Это просто) Смотри, простые вещества (состоящие только из атомов одного элемента) , типа N2, имеют нулевую валентность. Кислород, O, всегда имеет степень окисления -2. Например, N2O3. Степень окисления кислорода=-2.
Кислорода у нас три атома. 3*(-2)=-6. У всей молекулы в целом должна быть нулевая степень окисления (в твоем случае) . Атомов азота две штуки. На них должна приходиться степень окисления, противоположная степени окисления кислорода в целом, то есть +6. У нас два атома, значит, делим на два. Следовательно, валентность азота=+3.
Главное запомнить, что валентность кислорода почти всегда =-2, а водорода = +1. Сумма в целом на всю молекулу должна получиться равной 0(если у молекулы знаков плюс или минус нет, но у тебя другие примеры)
HNO3 – H=+1, O=-2, их три штуки, считаем: -2*3=-6. -6+1=-5. В целом должен быть 0. Значит, степень окисления N=5.
NH3 – 3 атома водорода, у каждого по +1, т. е. +3, значит у азота =-3.
Итак, NH3(-3), N2O3(+3), HNO3(+5),N2(0). Это степени окисления атомов азота. А у водорода и кислорода (+1) и (-2) соответственно.
аммиак
Степень окисления N в NH3 составляет -3 . Степень окисления H в NH3 составляет +1 .
| Элемент | Число окисления (среднее) | Атомы | Count | Электроотрицательность |
|---|---|---|---|---|
| N | -3 | -3 (×1) | 1 | 3.0 |
| H | +1 | +1 (×3) | 3 | 2.2 |
Введите химическую формулу (вводится с учетом регистра), чтобы рассчитать степень окисления элементов.
Инструкции
Enter the formula of a chemical compound to find the oxidation number of each element.
A net ionic charge can be specified at the end of the compound between { and }. For example: ZnCl4{2-} or NH2NH3{+}.
Enter just an element symbol to show the common and uncommon oxidation states of the element.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- Ca2Si
- C2H5NH2
- PO3{3-}
- Na2S2O4
- NaCN
- HgSO4
- C3H7OH
- Ca(ClO4)2
- C2H6S2
- KH2PO4
- H2CO
- TiO2
Это просто) Смотри, простые вещества (состоящие только из атомов одного элемента), типа N2, имеют нулевую валентность. Кислород, O, всегда имеет степень окисления – 2. Например, N2O3. Степень окисления кислорода=-2.
Кислорода у нас три атома. 3 * (-2) = – 6. У всей молекулы в целом должна быть нулевая степень окисления (в твоем случае). Атомов азота две штуки. На них должна приходиться степень окисления, противоположная степени окисления кислорода в целом, то есть + 6. У нас два атома, значит, делим на два. Следовательно, валентность азота=+3.
Главное запомнить, что валентность кислорода почти всегда = – 2, а водорода = + 1. Сумма в целом на всю молекулу должна получиться равной 0 (если у молекулы знаков плюс или минус нет, но у тебя другие примеры)
HNO3 – H=+1, O=-2, их три штуки, считаем: – 2*3=-6. – 6+1=-5. В целом должен быть 0. Значит, степень окисления N=5.
NH3 – 3 атома водорода, у каждого по + 1, т. е. + 3, значит у азота = – 3.
Итак, NH3 (-3), N2O3 (+3), HNO3 (+5), N2 (0). Это степени окисления атомов азота. А у водорода и кислорода (+1) и (-2) соответственно.
Окисление аммиака


3.9
Средняя оценка: 3.9
Всего получено оценок: 69.
3.9
Средняя оценка: 3.9
Всего получено оценок: 69.
Аммиак или нитрид водорода – активное соединение, вступающее в реакции с простыми и сложными веществами. В присутствии кислорода происходит окисление аммиака. В зависимости от условий протекания реакции аммиак может окислиться до оксида или азота.
Степень окисления
Степень окисления аммиака зависит от степени окисления элементов, входящих в его состав. На внешнем энергетическом уровне азота находится пять электронов. В составе аммиака атом азота проявляет валентность III. К трём валентным электронам присоединены атомы водорода. Следовательно, при синтезе аммиака произошло окисление азота водородом:
3H2 + N2 → 2NH3.
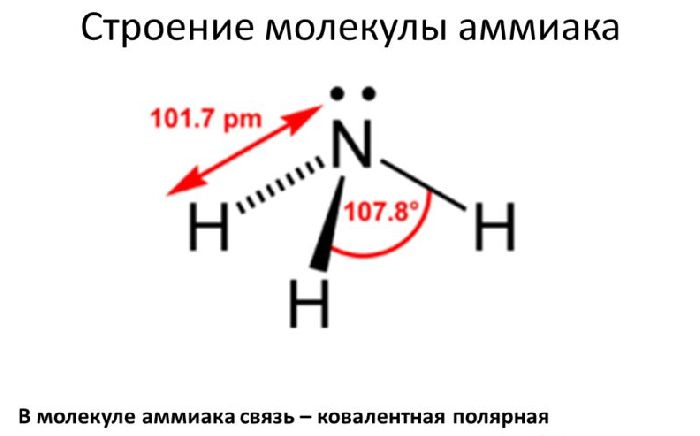
Поэтому азот имеет степень окисления -3, водород – +1.
Аммиак является восстановителем благодаря способности атома азота отдавать оставшиеся электроны и возможности атомов водорода легко отделяться.
Реакции с кислородом
За счёт оставшейся свободной пары электронов азот может окисляться водородом и кислородом. Аммиак легко притягивает катион водорода из воды или кислоты, образуя аммоний (NH4). Это производное аммиака, входящее в состав гидроксида и солей:
- NH3 + Н2О → NH4OH (гидроксид аммония);
- NH3 + HCl → NH4Cl (хлорид аммония);
- NH3 + HNO3 → NH4NO3 (нитрат аммония);
- 2NH4OH + H2SO4 → 2H2O + (NH4)2SO4 (сульфат аммония).

При взаимодействии с кислородом может образовываться свободный азот, оксид азота (II) или (I). Конечный продукт зависит от количества начальных веществ и условий проведения реакции. На воздухе аммиак не горит.
Если на четыре объёма аммиака взять пять объёмов кислорода, то получится оксид азота (II):
4NH3 + 5O2 → 4NO + 6H2O.
Реакция протекает в присутствии катализатора. Над нагретой до 800°С платиной быстро пропускают смесь аммиака с воздухом. Платиновый катализатор могут использовать по-другому. Из платины с примесью родия, рутения, палладия делают сетку, сквозь которую пропускают аммиак и кислород. Также реакция ускоряется в присутствии оксида хрома (III).

Азот можно получить при нагревании концентрированного раствора аммиака в отсутствии катализатора. Сначала раствор нагревают, а затем помещают в условия чистого кислорода (четыре объёма аммиака на три объёма кислорода). Аммиак горит жёлто-зелёным пламенем:
4NH3 + 3O2 → 2N2 + 6H2O.
При одинаковом объёме аммиака и кислорода образуется оксид азота (I):
2NH3 + 2O2 → N2O + 3H2O.
Реакцию окисления проводят для получения разбавленной азотной кислоты. Для этого сначала окисляют NH3 до NO. Затем получившийся газ окисляют до диоксида азота:
2NO + О2 → 2NO2.
Оксид азота (I) для получения кислоты окисляют и пропускают через воду:
4NO2 + О2 + 2Н2О → 4HNO3.
Окисление аммиака – экзотермическая реакция, сопровождающаяся выделением тепла.

Что мы узнали?
Аммиак является восстановителем и может окисляться водородом или кислородом. В результате взаимодействия с водородом образуется аммоний – NH4. Это соединение входит в состав солей и гидроксида аммиака. С кислородом аммиак реагирует по-разному, в зависимости от условий. В присутствии катализатора образуется оксид азота (II), при нагревании, но при разных объёмах начальных веществ образуются азот и оксид азота (I).
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 69.
А какая ваша оценка?
