Сегодня мы обозначим и постараемся объяснить все сведения необходимые для комфортного и непринуждённого расставления степеней окисления, небезусловную сущность которых мы раскрыли в предыдущем материале.
Итак, прежде всего необходимо понять, что степени окисления – это заряды, а следовательно значения, имеющиеся знак и размещаемые в верхнем правом углу от химического символа.
Заряды эти образуются в результате отдачи и взаимного принятия электронов. При этом в ходе отдачи электронов образуется положительно заряженная частица, а входе принятия – отрицательно заряженная частица.
Так как атомы, из представления о которых мы пока что исходим, электронейтральны, то отдача электронов приводит к преобладанию в частице положительно заряженного ядра, и образованию так называемого катиона, а принятие электронов – к преобладанию отрицательного заряда электронной оболочки и образованию аниона.
И на этом моменте мы подбираемся не только к ключевой, но и чрезвычайно логичной мысли, согласно которой число отданных электронов равно числу принятых электронов, а значит, суммарный положительный заряд по модулю должен быть равен суммарному отрицательному заряду, то есть:
суммарная степень окисления в химической формуле вещества всегда равна нулю!
И вот теперь-то мы готовы ввести правила расстановки степеней окисления:
Правило №1: у простых веществ степень окисления всегда равна нулю.
Напомню, простые вещества – вещества, состоящие из атомов одного химического элемента.
Но прежде чем обозначить следующее правило, необходимо пояснить, что каждое последующее правило не отменяет предыдущее.
Правило №2: у фтора (F) в составе всех сложных веществ степень окисления всегда равна -1.
Для того, чтобы понять это правило, бросим взгляд в ряд электроотрицательности неметаллов:
Фтор (F) – самый электроотрицательный неметалл (напомню, что электроотрицательность – способность атомов химических элементов оттягивать на себя электронную плотность), это значит, что, будучи в составе любого вещества, фтор (F) по теории степеней окисления всегда принимает электроны, а так как фтор (F) – элемент главной подгруппы 7-й группы, то нуждается он только в одном электроне, необходимом ему для достижения электронной конфигурации инертного благородного газа.
Итого по фтору:
Правило №3. У кислорода (O) в составе всех сложных соединений степень окисления равна -2.
Исключения: пероксиды и фторид кислорода.
Дело в том, что в перекисях присутствует ковалентная неполярная химическая связь между атомами кислорода, а фтор – единственный более электроотрицательный атом, чем кислород.
Правило №4: у водорода (H) степень окисления всегда +1
Исключение: гидриды металлов.
Водород, согласно приведённому выше ряду электроотрицательности неметаллов, обладает среди перечисленных в нём наименьшим значением электроотрицательности, что означает, что по отношению к ним он будет донором электронной плотности. Однако водород (H) остаётся неметаллом и будет проявлять свои неметаллические свойства, то есть способность принимать электроны, а точнее один электрон, в солеподобных бинарных соединениях с металлами – так называемыми гидридами.
Правило №5 – у металлов всегда положительные степени окисления.
Это и понятно, если учесть, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны. Но не стоит забывать, что у простых веществ степень окисления всё-таки 0
Правило №6:
у металлов главной подгруппы первой группы IA (Li, Na, K и т.д.) в составе всех сложных соединений степень окисления всегда +1
у Me главной подгруппы второй группы IIА (Mg, Ca, Sr, Ba) – всегда +2
IIIA (Al) – всегда +3
Итоговая таблица:
На этом хотелось бы и закончить, но мы ещё ничего не сказали о расчёте степени окисления центрального атома, когда это необходимо. Рассмотрим пример дихромата калия:
-согласно правилам, у калия +1, у кислорода -2.
– “атомов” кислорода (O) семь, у каждого степень окисления -2. Это означает, что каждый “атом” кислорода (O) принимает два электрона. В сумме семь “атомов” кислорода (O) приняли 14 электронов.
– откуда “атомы” кислорода (O) приняли 14 электронов? Степень окисления калия (K) +1. Это означает, что “атом” калия(K) отдал 1 электрон. Атомов калия (K) два, каждый отдал 1 электрон. В сумме атомы калия (K) отдали 2 электрона.
– значит, оставшиеся 12 электронов были получены атомами кислорода (O) от двух атомов хрома (Cr). То есть, каждый атом хрома (Cr) отдал 6 электронов. Таким образом, степень окисления хрома +6.
Рассмотрим ещё несколько неочевидных примеров.
1) Единственное правило, которое мы можем применить к данному примеру, – это правило, согласно которому у железа (Fe), как у металла, в данном случае положительная степень окисления, то есть железо отдаёт электроны. Значит, у хлора (Cl) – отрицательная, то есть хлор (Cl) принимает электроны.
2) Смотрим, сколько хлор (Cl) будет принимать электронов, видим, что хлор (Cl) – элемент главной подгруппы 7-й группы, значит хлор (Cl) принимает 1 электрон.
3) Атомов хлора (Cl) в составе рассматриваемого соединения три, значит в сумме они принимают 3 электрона.
4) Откуда они принимают эти три электрона – от одного атома железа (Fe), значит у железа (Fe) степень окисления +3.
А что если рассмотреть пример, к которому мы не сможем применить ни одно из известных правил? Например, сероуглерод.
1) В данном случае смотрим в ряд электроотрицательности неметаллов, выясняем, какой из атомов более электроотрицательный, – он и будет принимать электроны.
2) Сера (S) обладает большей электроотрицательностью. При этом сера (S) – элемент главной подгруппы 6-й группы, значит, атому серы (S) до электронной конфигурации инертного благородного газа не хватает 2-х электронов, то есть сера (S), будет принимать 2 электрона, приобретая степень окисления -2.
3) Атомов серы (S) два, каждый принимает 2 электрона, в сумме они принимают 4 электрона. От кого они принимают 4 электрона? От одного атома углерода (C), значит у углерода (C) степень окисления +4.
Есть примеры веществ, в формулах которых невозможно без предварительных знаний правильно расставить степени окисления. К таковым, например относятся карбид кальция и пирит, формулы и степени окисления в составе которых я обозначу как данность.
И вот теперь у меня всё! Спасибо всем, кто дошёл до конца. Пока.
Загрузить PDF
Загрузить PDF
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления — это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
-
1
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
-
2
Определите, состоит ли рассматриваемое вещество из ионов. Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl– равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
-
3
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3.[1]
Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl– имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
-
4
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси — это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O2-2). К примеру, в составе молекулы H2O2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.
-
5
Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H2O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
-
6
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность — иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
-
7
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки — если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Реклама
-
1
Найдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления. Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
- Например, в соединении Na2SO4 неизвестен заряд атома серы (S) — мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
-
2
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na2SO4, пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
-
3
Умножьте количество атомов на их степень окисления. Теперь, когда нам известны степени окисления всех атомов за исключением одного, необходимо учесть, что атомов некоторых элементов может быть несколько. Умножьте число атомов каждого элемента (оно указано в химической формуле соединения в виде подстрочного числа, следующего за символом элемента) на его степень окисления.
- В Na2SO4 мы имеем 2 атома Na и 4 атома O. Таким образом, умножая 2 × +1, получаем степень окисления всех атомов Na (2), а умножая 4 × -2 — степень окисления атомов O (-8).
-
4
Сложите предыдущие результаты. Суммируя результаты умножения, получаем степень окисления соединения без учета вклада искомого атома.
- В нашем примере для Na2SO4 мы складываем 2 и -8 и получаем -6.
-
5
Найдите неизвестную степень окисления из заряда соединения. Теперь у вас есть все данные для простого расчета искомой степени окисления. Запишите уравнение, в левой части которого будет сумма числа, полученного на предыдущем шаге вычислений, и неизвестной степени окисления, а в правой — общий заряд соединения. Иными словами, (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения).
- В нашем случае Na2SO4 решение выглядит следующим образом:
- (Сумма известных степеней окисления) + (искомая степень окисления) = (заряд соединения)
- -6 + S = 0
- S = 0 + 6
- S = 6. В Na2SO4 сера имеет степень окисления 6.
Реклама
- В нашем случае Na2SO4 решение выглядит следующим образом:
Советы
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.
- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Реклама
Что вам понадобится
- Периодическая таблица элементов
- Доступ в интернет или справочники по химии
- Лист бумаги, ручка или карандаш
- Калькулятор
Об этой статье
Эту страницу просматривали 644 517 раз.
Была ли эта статья полезной?
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют химическую связь, электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ—, его «партнер» — частичный положительный заряд δ+. Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной. Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например, в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например, для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N2H4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например: Ca2+, CO3 2-.
Для нахождения степеней окисления используют следующие правила:
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами (солеобразные гидриды — NaH, CaH2 и др.) равна -1; в соединениях с неметаллами (летучие водородные соединения) +1;
- Степень окисления кислорода равна -2. Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1, и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1.
Выше перечислены ситуации, когда степень окисления мы считаем постоянной. У всех остальных химических элементов степень окисления — переменная, и зависит от порядка и типа атомов в соединении.
Примеры:
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х, степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe3O4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO2)2. При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe2O3.
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н2О2, и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H2SO5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H2SO3(O2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O2)2 или CrO5, и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO2) и солеобразные озониды KO3. В этом случае уместнее говорить о молекулярном ионе O2 с зарядом -1 и и O3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Полезные советы:
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.
Тренировочный тест по теме «Степени окисления и валентность» 10 вопросов, при каждом прохождении новые.
187
Создан на
07 января, 2022 От Admin
Тренировочный тест “Степени окисления”
1 / 10
1) Li 2) Si 3) S 4) Al 5) F
Из приведённого списка выберите два элемента, которые в соединениях могут проявлять степень окисления +4.
Запишите в поле ответа номера выбранных элементов в порядке возрастания.
2 / 10
1) Na 2) P 3) Br 4) Mn 5) Cl
Из числа указанных в ряду элементов выберите два элемента, проявляющих во всех соединениях только положительную степень окисления.
3 / 10
1) O 2) Cu 3) Al 4) Cl 5) Na
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления, равную -1.
4 / 10
1) P 2) Cl 3) B 4) Ca 5) He
Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +5.
5 / 10
1) N 2) С 3) B 4) Na 5) Al
Из числа указанных в ряду элементов выберите два элемента, степень окисления которых в оксидах может принимать значение +1.
6 / 10
1) C 2) Mg 3) Mn 4) P 5) Cl
Из числа указанных в ряду элементов выберите два элемента, которые в высших оксидах проявляют одинаковую степень окисления.
7 / 10
1) Li 2) N 3) F 4) Cr 5) Ar
Из числа указанных в ряду элементов выберите два элемента, которые в соединениях проявляют степень окисления +3.
8 / 10
1) Al 2) Se 3) Cr 4) As 5) O
Из числа указанных в ряду элементов выберите два элемента, которые в составе образованных ими анионов с общей формулой ЭOx2– могут иметь одинаковую степень окисления.
9 / 10
1) Ga 2) Cr 3) O 4) Br 5) Mn
Из числа указанных в ряду элементов выберите два элемента, которые проявляют степень окисления –1.
10 / 10
1) Na 2) S 3) F 4) V 5) Si
Из числа указанных в ряду элементов выберите два элемента, которые в образованных ими анионах с общей формулой ЭOx2− могут иметь одинаковую степень окисления.
Ваша оценка
The average score is 57%
Таблица окисления химических элементов

4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.
Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.
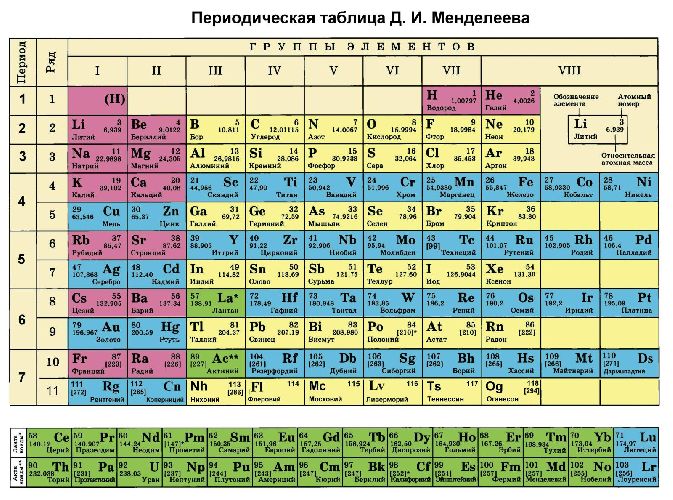
Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.
Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Паша Кривов
4/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 552.
А какая ваша оценка?