Напишу негласные правила:
1) Во всех молекулах должен соблюдаться принцип электронейтральности.
Что это значит? – АЛгебраическая сумма зарядов должна равняться нулю в молекуле.
2) Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для простых веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
- Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
3) Начинать рекомендуется с атомов с постоянной или “распространенной” степенью окисления.
Такими атомами являтся:
Однако будь-те внимательны, у атомов водорода и кислорода есть исключения: для H – металгидриды, там водород H- (-1). И различные соединения килосрода: пероксиды, надперкосиды и другие:
4) Часто у металлов могут быть две распространенные ст. ок. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3.
Так , например FeCl2 и FeCl3 . В данном случаи начинаем смотреть на атом(ион) хлора. В данных случаях он будет в ст. ок. (-1), хотя сам атом обладает возможность формировать вещества со ст. ок. (0, +7, +6, +5, +4, +3, +1 ).
Однако согласно правилу (№1) невозможно будет образовать такую молекулу, учитывая что ст. ок. железа в данных веществах будет либо +3 либо +2. Поэтому, выбираем ст. ок. атома хлора (-1).
Таким образом: Fe (+2) Cl2 (-) и Fe (+3) Cl3 (-).
В более сложных соединениях, включается математика и решение уравнений с одним неизвестным.
К примеру
Na2SO4.
Ст. ок. атомов Натрия и Кислорода известны: Na (+1), O(-2).
Учитывая индексы атомов, составляем уравнение:
(+1)*2 + x + (-2)*4 = 0
x = 6
17,1 K
Комментировать ответ…Комментировать…
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
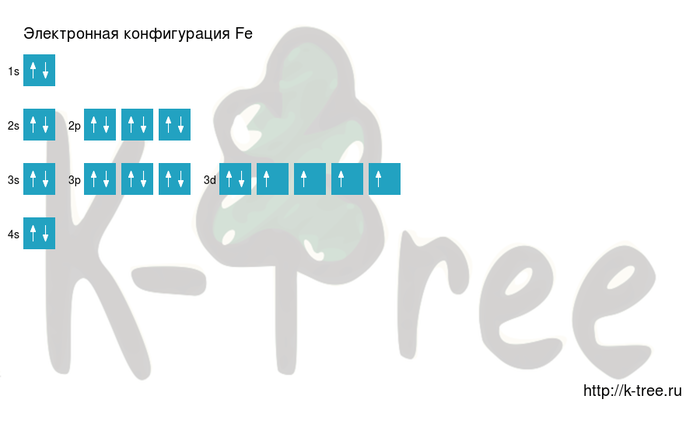
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Андрей Давыдов
Знаток
(491)
13 лет назад
По второй части соединения) ) вот например
FeCl3, Cl имеет заряд -1, следовательно Cl3 имеет заряд -3, а Fe +3
Fe(OH)2, OH-группа имеет заряд -1, (OH)2 имеет заряд -2, а Fe +2
образуется всегда то соединение, на образование которого уходит меньше энергии, чем на другие возможные!!! !
то есть всегда происходит наиболее энергетически выгодный процесс!!!
Александр Давиденко
Гуру
(4356)
13 лет назад
Все более сложно. Железо может иметь степень окисления +2 и +3. В зависимости от того каким реагентом на металлическое железо Fe (в вашем случае) подействовать степень окисления будет или 2 или 3. Это в общем случае зависит от окислительных свойств действующего реагента. чем сильнее окислительные свойства тем в более высокую степень окисления переводится железо, т. е. в +3
Сегодня мы обозначим и постараемся объяснить все сведения необходимые для комфортного и непринуждённого расставления степеней окисления, небезусловную сущность которых мы раскрыли в предыдущем материале.
Итак, прежде всего необходимо понять, что степени окисления – это заряды, а следовательно значения, имеющиеся знак и размещаемые в верхнем правом углу от химического символа.
Заряды эти образуются в результате отдачи и взаимного принятия электронов. При этом в ходе отдачи электронов образуется положительно заряженная частица, а входе принятия – отрицательно заряженная частица.
Так как атомы, из представления о которых мы пока что исходим, электронейтральны, то отдача электронов приводит к преобладанию в частице положительно заряженного ядра, и образованию так называемого катиона, а принятие электронов – к преобладанию отрицательного заряда электронной оболочки и образованию аниона.
И на этом моменте мы подбираемся не только к ключевой, но и чрезвычайно логичной мысли, согласно которой число отданных электронов равно числу принятых электронов, а значит, суммарный положительный заряд по модулю должен быть равен суммарному отрицательному заряду, то есть:
суммарная степень окисления в химической формуле вещества всегда равна нулю!
И вот теперь-то мы готовы ввести правила расстановки степеней окисления:
Правило №1: у простых веществ степень окисления всегда равна нулю.
Напомню, простые вещества – вещества, состоящие из атомов одного химического элемента.
Но прежде чем обозначить следующее правило, необходимо пояснить, что каждое последующее правило не отменяет предыдущее.
Правило №2: у фтора (F) в составе всех сложных веществ степень окисления всегда равна -1.
Для того, чтобы понять это правило, бросим взгляд в ряд электроотрицательности неметаллов:
Фтор (F) – самый электроотрицательный неметалл (напомню, что электроотрицательность – способность атомов химических элементов оттягивать на себя электронную плотность), это значит, что, будучи в составе любого вещества, фтор (F) по теории степеней окисления всегда принимает электроны, а так как фтор (F) – элемент главной подгруппы 7-й группы, то нуждается он только в одном электроне, необходимом ему для достижения электронной конфигурации инертного благородного газа.
Итого по фтору:
Правило №3. У кислорода (O) в составе всех сложных соединений степень окисления равна -2.
Исключения: пероксиды и фторид кислорода.
Дело в том, что в перекисях присутствует ковалентная неполярная химическая связь между атомами кислорода, а фтор – единственный более электроотрицательный атом, чем кислород.
Правило №4: у водорода (H) степень окисления всегда +1
Исключение: гидриды металлов.
Водород, согласно приведённому выше ряду электроотрицательности неметаллов, обладает среди перечисленных в нём наименьшим значением электроотрицательности, что означает, что по отношению к ним он будет донором электронной плотности. Однако водород (H) остаётся неметаллом и будет проявлять свои неметаллические свойства, то есть способность принимать электроны, а точнее один электрон, в солеподобных бинарных соединениях с металлами – так называемыми гидридами.
Правило №5 – у металлов всегда положительные степени окисления.
Это и понятно, если учесть, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны. Но не стоит забывать, что у простых веществ степень окисления всё-таки 0
Правило №6:
у металлов главной подгруппы первой группы IA (Li, Na, K и т.д.) в составе всех сложных соединений степень окисления всегда +1
у Me главной подгруппы второй группы IIА (Mg, Ca, Sr, Ba) – всегда +2
IIIA (Al) – всегда +3
Итоговая таблица:
На этом хотелось бы и закончить, но мы ещё ничего не сказали о расчёте степени окисления центрального атома, когда это необходимо. Рассмотрим пример дихромата калия:
-согласно правилам, у калия +1, у кислорода -2.
– “атомов” кислорода (O) семь, у каждого степень окисления -2. Это означает, что каждый “атом” кислорода (O) принимает два электрона. В сумме семь “атомов” кислорода (O) приняли 14 электронов.
– откуда “атомы” кислорода (O) приняли 14 электронов? Степень окисления калия (K) +1. Это означает, что “атом” калия(K) отдал 1 электрон. Атомов калия (K) два, каждый отдал 1 электрон. В сумме атомы калия (K) отдали 2 электрона.
– значит, оставшиеся 12 электронов были получены атомами кислорода (O) от двух атомов хрома (Cr). То есть, каждый атом хрома (Cr) отдал 6 электронов. Таким образом, степень окисления хрома +6.
Рассмотрим ещё несколько неочевидных примеров.
1) Единственное правило, которое мы можем применить к данному примеру, – это правило, согласно которому у железа (Fe), как у металла, в данном случае положительная степень окисления, то есть железо отдаёт электроны. Значит, у хлора (Cl) – отрицательная, то есть хлор (Cl) принимает электроны.
2) Смотрим, сколько хлор (Cl) будет принимать электронов, видим, что хлор (Cl) – элемент главной подгруппы 7-й группы, значит хлор (Cl) принимает 1 электрон.
3) Атомов хлора (Cl) в составе рассматриваемого соединения три, значит в сумме они принимают 3 электрона.
4) Откуда они принимают эти три электрона – от одного атома железа (Fe), значит у железа (Fe) степень окисления +3.
А что если рассмотреть пример, к которому мы не сможем применить ни одно из известных правил? Например, сероуглерод.
1) В данном случае смотрим в ряд электроотрицательности неметаллов, выясняем, какой из атомов более электроотрицательный, – он и будет принимать электроны.
2) Сера (S) обладает большей электроотрицательностью. При этом сера (S) – элемент главной подгруппы 6-й группы, значит, атому серы (S) до электронной конфигурации инертного благородного газа не хватает 2-х электронов, то есть сера (S), будет принимать 2 электрона, приобретая степень окисления -2.
3) Атомов серы (S) два, каждый принимает 2 электрона, в сумме они принимают 4 электрона. От кого они принимают 4 электрона? От одного атома углерода (C), значит у углерода (C) степень окисления +4.
Есть примеры веществ, в формулах которых невозможно без предварительных знаний правильно расставить степени окисления. К таковым, например относятся карбид кальция и пирит, формулы и степени окисления в составе которых я обозначу как данность.
И вот теперь у меня всё! Спасибо всем, кто дошёл до конца. Пока.
