Смещение химического равновесия
Основная
статья: Принцип
Ле Шателье — Брауна
Положение
химического равновесия зависит от
следующих параметров
реакции: температуры, давления и концентрации.
Влияние, которое оказывают эти факторы
на химическую реакцию, подчиняются
закономерности, которая была высказана
в общем виде в 1885 году французским
ученым Ле-Шателье.
Факторы,
влияющие на химическое равновесие:
1)
температура
При
увеличении температуры химическое
равновесие смещается в сторону
эндотермической (поглощение) реакции,
а при понижении в сторону экзотермической
(выделение) реакции.
CaCO3=CaO+CO2 -Q
t↑ →, t↓ ←
N2+3H2↔2NH3 +Q
t↑ ←, t↓ →
2)
давление
При
увеличении давления химическое равновесие
смещается в сторону меньшего объёма
веществ, а при понижении в сторону
большего объёма. Этот принцип действует
только на газы, т.е. если в реакции
участвуют твердые вещества, то они в
расчет не берутся.
CaCO3=CaO+CO2 P↑
←, P↓ →
1моль=1моль+1моль
3)
концентрация исходных веществ и продуктов
реакции
При
увеличении концентрации одного из
исходных веществ химическое равновесие
смещается в сторону продуктов реакции,
а при повышении концентрации продуктов
реакции-в сторону исходных веществ.
S2+2O2=2SO2 [S],[O]↑
→, [SO2]↑
←
Катализаторы
не влияют на смещение химического
равновесия!



-
Основные
количественные характеристики
химического равновесия: константа
химического равновесия, степень
превращения, степень диссоциации,
равновесный выход. Поясните смысл этих
величин на примере конкретных химических
реакций.
В химической
термодинамикезакон действующих
масс связывает между собой равновесные
активности исходных веществ и продуктов
реакции, согласно соотношению:
![]() где
где
![]() — активностьвеществ.
— активностьвеществ.
Вместо активности могут быть
использованыконцентрация(для
реакции в идеальном растворе),парциальные
давления(реакция в смеси идеальных
газов), фугитивность (реакция в смеси
реальных газов);
![]() — стехиометрический
— стехиометрический
коэффициент(для исходных веществ
принимается отрицательным, для продуктов —
положительным);
![]() —
—
константа химического
равновесия. Индекс «a» здесь означает
использование величиныактивностив
формуле.
Эффективность
проведенной реакции оценивают обычно,
рассчитывая выход продукта реакции
(параграф 5.11). Вместе с тем, оценить
эффективность реакции можно также,
определив, какая часть наиболее важного
(обычно наиболее дорогого) вещества
превратилась в целевой продукт реакции,
например, какая часть SO2 превратилась
в SO3 при
производстве серной кислоты, то есть
найти степень
превращенияисходного
вещества.
Пусть
краткая схема протекающей реакции
А ![]() В
В
Тогда
степень превращения вещества А в вещество
В (![]() А)
А)
определяется следующим уравнением
где nпрореаг(А)
– количество вещества реагента А,
прореагировавшего с образованием
продукта В,
а nисходн(А)
– исходное количество вещества реагента
А.![]()
Естественно,
что степень превращения может быть
выражена не только через количество
вещества, но и через любые пропорциональные
ему величины: число молекул (формульных
единиц), массу, объем.
Если
реагент А взят в недостатке и потерями
продукта В можно пренебречь, то степень
превращения реагента А обычно равна
выходу продукта В
![]() В =
В = ![]() А
А
Исключение
– реакции, в которых исходное вещество
заведомо расходуется на образование
нескольких продуктов. Так, например, в
реакции
Cl2 +
2KOH = KCl + KClO + H2O
хлор
(реагент) в равной степени превращается
в хлорид калия и гипохлорит калия. В
этой реакции даже при 100 %-ном выходе
KClO степень превращения в него хлора
равна 50 %.
Известная
вам величина – степень протолиза
(параграф 12.4) – частный случай степени
превращения:
![]()
В
рамках ТЭД аналогичные величины
называются степенью
диссоциации кислоты
или основания (обозначатся также, как
степень протолиза). Степень диссоциации
связана с константой диссоциации в
соответствии с законом разбавления
Оствальда.
В
рамках той же теории равновесие гидролиза
характеризуется степенью
гидролиза (h),
при этом используются следующие
выражения, связывающие ее с исходной
концентрацией вещества (с)
и константами диссоциации образующихся
при гидролизе слабых кислот (KHA)
и слабых оснований (KMOH):
![]()
Первое
выражение справедливо для гидролиза
соли слабой кислоты, второе – соли
слабого основания, а третье – соли
слабой кислоты и слабого основания. Все
эти выражения можно использовать только
для разбавленных растворов при степени
гидролиза не более 0,05 (5 %).
Обычно
равновесный выход определяют по известной
константе равновесия, с которой он
связан в каждом конкретном случае
определенным соотношением.
Выход
продукта можно изменить, сместив
равновесие реакции в обратимых процессах,
воздействием таких факторов, как
температура, давление, концентрация.
В
соответствии с принципом Ле Шателье
равновесная степень превращения
увеличивается с повышением давления в
ходе простых реакций, а др. случае объем
реакционной смеси не меняется и выход
продукта не зависит от давления.
Влияние
температуры на равновесный выход, так
же как и на константу равновесия,
определяется знаком теплового эффекта
реакции.
Для
более полной оценки обратимых процессов
используют так называемый выход от
теоретического (выход от равновесного),
равный отношению действительно
полученного продукта со к количеству,
которое получилось бы в состоянии
равновесия.
-
Степень
диссоциации вещества в реакциях
термического разложения (термической
диссоциации). Влияние давления и
температуры на степень диссоциации.
Можно ли изменением этих параметров
увеличить степень диссоциации
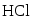 на
на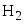 и
и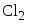
ТЕРМИЧЕСКАЯ
ДИССОЦИАЦИЯ химическая
реакция
обратимого разложения вещества,
вызываемая повышением темп-ры.
При
Т. д. из одного вещества образуется
несколько (2H2H+ ОСаО + СО) или одно более
простое
(N2NO2Cl).
Равновесие
Т. д. устанавливается по действующих
масс закону. Оно
может
быть охарактеризовано или константой
равновесия, или степенью диссоциации
(отношением
числа распавшихся молекул к общему
числу молекул). В
большинстве
случаев Т. д. сопровождается поглощением
теплоты (приращение
энтальпии
ДН>0);
поэтому в соответствии с Ле Шателье
-Брауна принципом
нагревание
усиливает её, степень смещения Т. д. с
температурой определяется
абсолютным
значением ДН. Давление препятствует Т.
д. тем сильнее, чем большим
изменением
(возрастанием) числа молей (Ди) газообразных
веществ
сопровождается
процесс; при Дn = 0 (напр., в реакции 2Н1<-±Н2
+ 1)
степень
диссоциации от давления не зависит.
Если твёрдые вещества не
образуют
твёрдых растворов и не находятся в
высокодисперсном состоянии,
то
давление Т. д. однозначно определяется
темп-рой. Для осуществления Т.
д.
твёрдых веществ (окислов, кристаллогидратов
и пр.)
важно
знать
темп-ру,
при к-рой давление диссоциации становится
равным внешнему (в частности,
атмосферному)
давлению. Так как выделяющийся газ может
преодолеть
давление
окружающей среды, то по достижении этой
темп-ры процесс разложения
сразу
усиливается.
Зависимость
степени диссоциации от температуры:
степень диссоциации возрастает при
повышении температуры (повышение
температуры приводит к увеличению
кинетической энергии растворённых
частиц, что способствует распаду молекул
на ионы)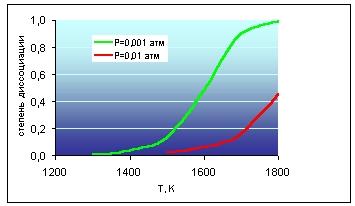
-
Степень
превращения исходных веществ и
равновесный выход продукта. Способы
их расчета при заданной температуре.
Какие данные необходимы для этого?
Дайте схему расчета любой из этих
количественных характеристик химического
равновесия на произвольном примере.
Степень
превращения – количество прореагировавшего
реагента, отнесенное к его исходному
количеству.
Для
простейшей реакции ![]()
![]() ,[1]
,[1]
где ![]() –
–
концентрация на входе в реактор или в
начале периодического процесса,
![]() –
–
концентрация на выходе из реактора или
текущий момент периодического
процесса.
Для
произвольной реакции, например,
![]() ,
,
в
соответствии с определением расчетная
формула такая же:
![]()
![]() .
.
Если
в реакции несколько реагентов, то степень
превращения можно считать по каждому
из них, например, для реакции
![]()
![]() Зависимость
Зависимость
степени превращения от времени реакции
определяется изменением концентрации
реагента от времени. В начальный момент
времени, когда ничего не превратилось,
степень превращения равна нулю. Затем,
по мере превращения реагента, степень
превращения растет. Для необратимой
реакции, когда ничто не мешает реагенту
израсходоваться полностью, ее значение
стремится (рис.1) к единице
(100%).
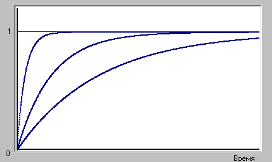 Рис.1
Рис.1
Чем
больше скорость расходования реагента,
определяемая значением константы
скорости, тем быстрее растет степень
превращения, что представлено на
рисунке.
Если
реакция обратимая ![]() ,
,
то при стремлении реакции к равновесию
степень превращения стремится к
равновесному значению, величина которого
зависит от соотношения констант скоростей
прямой и обратной реакции (от константы
равновесия) (рис.2).
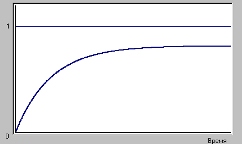 Рис.2
Рис.2
Выход
целевого продукта
Выход
продукта – количество реально полученного
целевого продукта, отнесенное к количеству
этого продукта, которое получилось бы,
если бы весь реагент перешел в этот
продукт (к максимально возможному
количеству получившегося продукта).
Или
(через реагент): количество реагента,
реально перешедшего в целевой продукт,
отнесенное к исходному количеству
реагента.
Для
простейшей реакции ![]() выход
выход ![]() ,
,
а имея в виду, что для этой реакции ![]() ,
, ![]() ,
,
т.е. для простейшей реакции выход и
степень превращения – это одна и та же
величина. Если превращение проходит с
изменением количества веществ,
например, ![]() ,
,
то в соответствии с определением
стехиометрический коэффициент должен
войти в расчетное выражение. В соответствии
с первым определением воображаемое
количество продукта, получившегося из
всего исходного количества реагента,
будет для этой реакции в два раза меньше,
чем исходное количество реагента,
т.е. ![]() ,
,
и расчетная формула ![]() .
.
В соответствии со вторым определением
количество реагента, реально перешедшее
в целевой продукт будет в два раза
больше, чем образовалось этого продукта,
т.е. ![]() ,
,
тогда расчетная формула ![]() .
.
Естественно, что оба выражения
одинаковы.
Для
более сложной реакции расчетные формулы
записываются точно так же в соответствии
с определением, но в этом случае выход
уже не равен степени превращения.
Например, для реакции[2] ![]() ,
, ![]() .
.
Если
в реакции несколько реагентов, выход
может быть рассчитан по каждому из них,
если к тому же несколько целевых
продуктов, то выход можно считать на
любой целевой продукт по любому
реагенту.
Как
видно из структуры расчетной формулы
(в знаменателе находится постоянная
величина), зависимость выхода от времени
реакции определяется зависимостью от
времени концентрации целевого продукта.
Так, например, для реакции ![]() эта
эта
зависимость выглядит как на
рис.3.
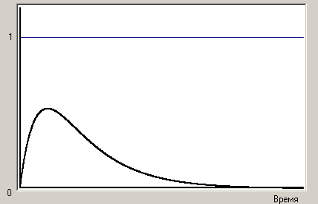 Рис.3
Рис.3
-
Степень
превращения как количественная
характеристика химического равновесия.
Как повлияют повышение общего давления
и температуры на степень превращения
реагента … в газофазной реакции: (дано
уравнение)?
Приведите обоснование ответа и
соответствующие математические
выражения.
-
Равновесный
выход химической реакции. Выразите в
общем виде константу равновесия
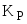 для реакции (дано
для реакции (дано
уравнение газофазной реакции)
через равновесное число молей компонента
… (х), и общее давление в системе р,
если для проведения реакции исходные
вещества взяты в стехиометрических
количествах. -
Вывод
и анализ уравнения изотермы химической
реакции. Химическое сродство. Стандартное
химическое сродство. -
Закон
действующих масс и его термодинамическое
обоснование. Термодинамическая и
эмпирическая константы химического
равновесия. Способы выражения эмпирической
константы химического равновесия. -
Константа
химического равновесия. Влияние общего
давления и примеси инертного газа на
равновесный выход продуктов реакции. -
Способы
выражения константы химического
равновесия:
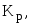 Кс
Кс
и Кх.
Связь между эмпирическими константами
равновесия. -
Влияние
температуры на химическое равновесие.
Вывод и анализ уравнения изобары
Вант-Гоффа. -
Константа
химического равновесия, ее зависимость
от температуры. Расчет тепловых эффектов
химических реакций по данным о химическом
равновесии. -
Влияние
давления и температуры на константу
химического равновесия и смещение
химического равновесия. Проиллюстрируйте
на примере произвольно выбранной
газофазной реакции.
12
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
13.02.20156.13 Mб8pod_red_muhlenova_i_p_tehnologija_katalizator.doc
- #
- #
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2Ag2O = 4Ag + O2
2HgO = 2Hg + O2
4CrO3 = 2Cr2O3 + O2
2Mn2O7 = 4MnO2 + 3O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
2Cr(OH)3 = Cr2O3 + 3H2O
Mn(OH)2 = MnO + H2O
Fe(OH)2 = FeO + H2O
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например, кремниевая кислота:
H2SiO3 = H2O + SiO2
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
H2SO3 = H2O + SO2↑
H2CO3 = H2O + CO2↑
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
K2CO3 + H2O + CO2 = 2KHCO3
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
2HNO2 = H2O + NO2↑ + NO↑
При нагревании выше 100оС продукты распада несколько отличаются:
3HNO2 = H2O + HNO3↑ + 2NO↑
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
4HNO3 = 2H2O + 4NO2 + O2
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 оС разлагается:
NH4Cl → NH3 + HCl
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например, разложение нитрата калия:
2KNO3 → 2KNO2 + O2
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 оС:
Ca(NO3)2 → Ca(NO2)2 + O2
Mg(NO3)2 → Mg(NO2)2 + O2
Ba(NO3)2 → Ba(NO2)2 + O2
Sr(NO3)2 → Sr(NO2)2 + O2
При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
2Ca(NO3)2 → 2CaО + 4NO2 + O2
2Mg(NO3)2 → 2MgО + 4NO2 + O2
2Sr(NO3)2 → 2SrО + 4NO2 + O2
2Ba(NO3)2 → 2BaО + 4NO2 + O2
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2Cu(NO3)2 → 2CuО + 4NO2 + O2
2Pb(NO3)2 → 2PbО + 4NO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
4LiNO3 → 2Li2O + 4NO2 + O2
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
2AgNO3 → 2Ag + 2NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
NH4NO3 → N2O + 2H2O
При более высокой температуре образуются азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
2Na2HPO4 → H2O + Na4P2O7
2K2HPO4 → H2O + K4P2O7
2CaHPO4 → H2O + Ca2P2O7
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4l → NH3 + Hl
NH4H2PO4 → NH3 + H3PO4
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O

Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
KClO4 → KCl + 2O2
Вопрос по химии. Что такое степень разложения в-ва и как ее рассчитать? Массу пр. разделить на массу теор.?
Без Имени
Профи
(622),
закрыт
12 лет назад
Лучший ответ
Антон Дятлов
Гений
(83315)
13 лет назад
Степень разложения вещества – это масса разложившейся части вещества, отнесенная к общей массе вещества.
Остальные ответы
Похожие вопросы

Разложение веществ
Материал по химии
- Реакции разложения солей
- Разложение нитратов
- Особые реакции разложения нитратов
- Разложение солей аммония
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение гидросульфитов
- Разложение сульфитов
- Разложение сульфатов
- Уравнения реакций разложения комплексных солей
- Реакция разложения дихромата калия и перманганата калия
- Разложение бертолетовой соли
- Разложение гидроксидов
- Разложение органических веществ
- Разложение кислот
Реакции разложения солей
Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
- 4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
- 4Cr(NO3)2 → 2Cr2O3 + 8NO2↑ + O2↑
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
- Mn(NO3)2 → MnO2 + 2NO2↑
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O3 + NO2 + O2
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- LiNO3
- Cu(NO3)2
- RbNO2
- Zn(NO3)2
- Hg(NO3)2
- Al(NO2)3
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O + NO2 + O2
- Me2O3 + NO2 + O2
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
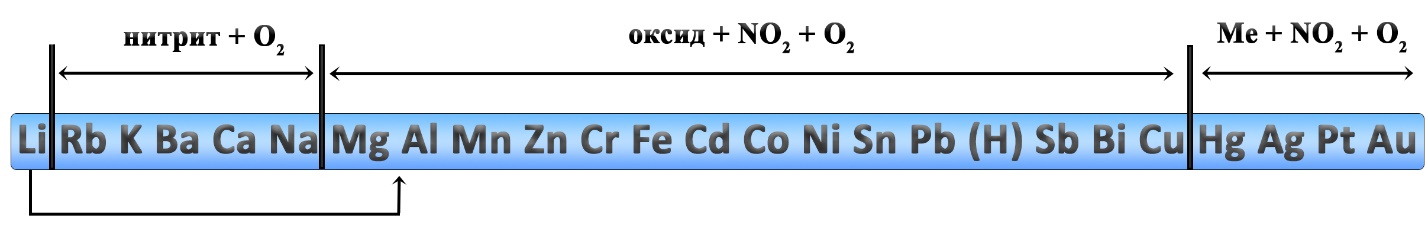
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
- NH4NO3 → 2H2O + N2O ‒ разложение нитрата аммония
- NH4NO2 → 2H2O + N2 ‒ разложение нитрита аммония
Задание по образцу ФИПИ:
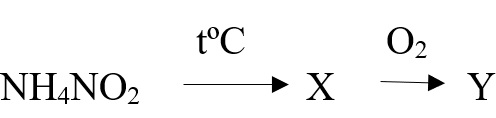
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
- NH3
- NO
- NH4NO3
- N2
- N2O
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
- (NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O↑ ‒ разложение дихромата аммония
- 2NH4MnO4 → N2↑ + 2MnO2 + 4H2O↑ ‒ разложение перманганата аммония
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
- N2 + Cr2O3 + H2O
- NH3 + Cl2 + H2
- N2 + H2O
- NO2 + Cr2O3 + H2O
- NH3 + HCl
- N2O + H2O
Разложение карбонатов
Реакции разложения карбонатов также происходит при нагревании. Карбонаты щелочных металлов (IА-группа), кроме карбоната лития, не разлагаются. Большинство других карбонатов разлагаются до оксидов, карбонат серебра и карбонат ртути разлагаются с выделением свободного металла.
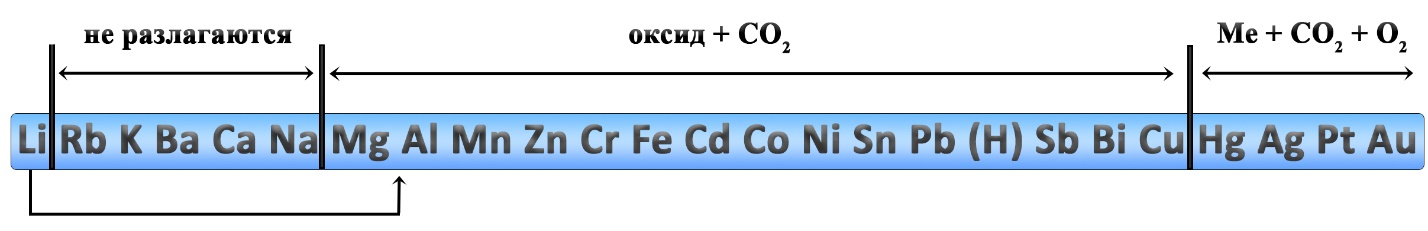
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
- Na2CO2
- MgCO3
- CaCO3
- K2CO3
- Cs2CO3
- CuCO3
При разложении каких карбонатов образуется оксид металла?
- Na2CO3
- HgCO3
- Li2CO3
- CaCO3
- Ag2CO3
- FeCO3
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
- 2KHCO3 → K2CO3 + CO2↑ + H2O↑
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
- Ba(HCO3)2 → BaCO3 + CO2↑ + H2O↑ ‒ нагревание
- BaCO3 → BaO + CO2↑ ‒ при продолжении нагревания
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
- 2KHSO3 → K2SO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита калия
- Ba(HSO3)2 → BaSO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита бария
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
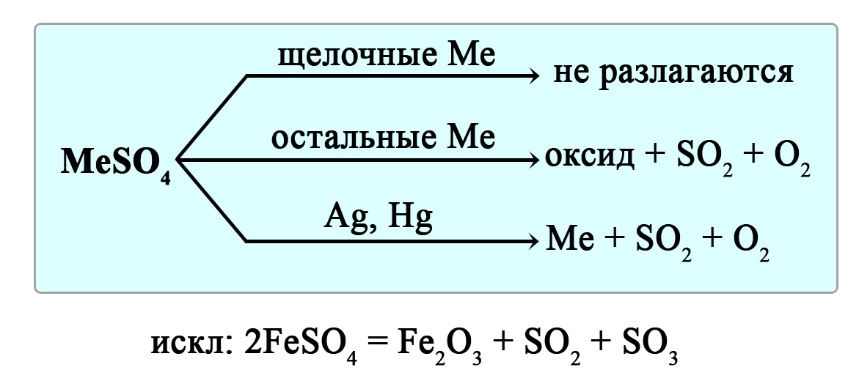
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
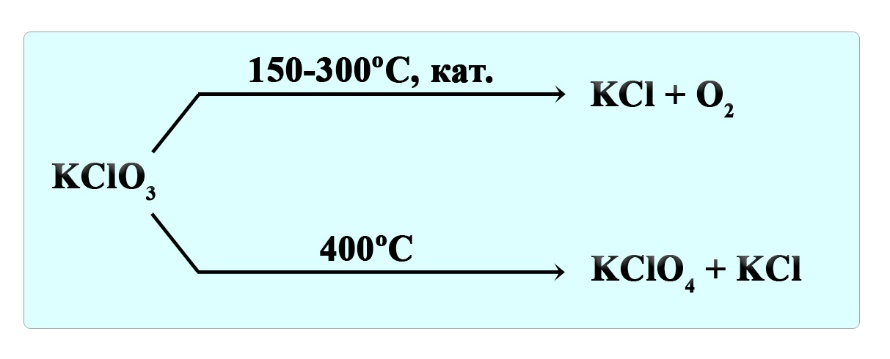
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2↑
Сходным образом разлагается перхлорат калия:
- KClO4 → KCl + 2O2↑
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
- 4KClO3 → 3KClO4 + KCl
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
-
KClO3 (400 градусов)
KClO4 + KCl
-
-
-
-
-
(NH4)2Cr2O7
N2 + Cr2O3 + H2O
-
-
-
K2Cr2O7
K2CrO4 + Cr2O3 + O2
-
Разложение гидроксидов
Еще одна популярная тема в разложении веществ – термическое разложение гидроксидов. Большинство нерастворимых гидроксидов неустойчивы, разлагаются на оксид и воду. При этом степень окисления металла не меняется. Растворимые гидроксиды (щелочи) не разлагаются, за исключением неустойчивого гидроксида аммония (который не является щелочью).
- 2Al(OH)3 → Al2O3 + 3H2O ‒ разложение гидроксида алюминия
- Zn(OH)2 → ZnO + H2O ‒ разложение гидроксида цинка
- Cu(OH)2 → CuO + H2O ‒ разложение гидроксида меди II
- 2Fe(OH)3 → Fe2O3 + 3H2O ‒ разложение гидроксида железа III
- NH4OH → NH3↑ + H2O или NH3·H2O → NH3↑ + H2O ‒ разложение гидроксида аммония
Разложение органических веществ
Сходным образом происходит и разложение органических веществ – гидроксидов метиламмония, диметиламмония, триметиламмония и некоторых других.
- [CH3-NH3]OH → CH3-NH2↑ + H2O ‒ разложение гидроксида метиламмония
- [(CH3)2-NH2]OH → (CH3)2-NH↑ + H2O ‒ разложение гидроксида диметиламмония
- [(CH3)3-NH]OH → (CH3)3-N↑ + H2O ‒ разложение гидроксида триметиламмония
Разложение кислот
Неустойчивыми кислотами являются угольная, сернистая кислота и азотистая кислота, они разлагаются даже при небольшом нагревании:
- H2CO3 → CO2↑ + H2O ‒ разложение угольной кислоты
- H2SO3 → SO2↑ + H2O ‒ разложение сернистой кислоты
- 2HNO2 → NO↑ + NO2↑ + H2O ‒ разложение азотистой кислоты без нагревания
- 3HNO2 → HNO3 + 2NO↑ + H2O – разложение азотистой кислоты при нагревании
Разложение остальных кислот требует нагревания:
- 4HNO3 → 4NO2 + O2↑ + 2H2O ‒ разложение азотной кислоты
- H2SiO3 → SiO2 + H2O – разложение кремниевой кислоты
Реакции разложения
1) термическое разложение нерастворимых оснований (а также LiOH и Ca(OH)2):
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O
2CuOH → Cu2O + H2O;
2) термическое разложение нерастворимых карбонатов:
CaCO3 → CaO + CO2
FeCO3 → FeO + CO2
MgCO3 → MgO + CO2 ;
;
3) термическое разложение гидрокарбонатов:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
+ H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
+ H2O
2NaHCO3 → Na2CO3 + CO2 + H2O;
+ H2O;
4) термическое разложение некоторых кислот:
H2CO3 → CO2 + H2O
+ H2O
H2SO3 → SO2 + H2O
+ H2O
H2SiO3 → SiO2 + H2O
4HNO3 → 4NO2 + O2
+ O2 + 2H2O
+ 2H2O
5) термическое разложение нитратов:
Если металл, входящий в состав соли, может быть окислен (выделяющимися газами), то при разложении образуется оксид с более высокой степенью окисления металла:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
+ O2 (t)
(t)
Mn(NO3)2 → MnO2 + 2NO2 (t)
(t)
6) термическое разложение солей аммония:
NH4Cl → NH3 + HCl
+ HCl
(NH4)3PO4 → H3PO4 + 3NH3
(NH4)2CO3 → 2NH3 + CO2
+ CO2 + H2O
+ H2O
NH4HCO3 → NH3 + CO2
+ CO2 + H2O
+ H2O
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
+ Cr2O3 + 4H2O
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O
+ H2O
NH4NO2 → N2 + H2O
+ H2O
7) другие примеры термического разложения, протекающего с изменением степени окисления элементов:
2H2O2 → 2H2O + O2
2KMnO4 → K2MnO4 + MnO2 + O2
2HgO → 2Hg + O2
2Ag2O → 4Ag + O2
4CuO → 2Cu2O + O2 (t=1100ºC)
(t=1100ºC)
8) термическое разложение солей кислот хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
(t, kt = MnO2)
9) термическое разложение гидроксокомплексов:
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
Na[Al(OH)4] → NaAlO2 + 2H2O (t)