Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
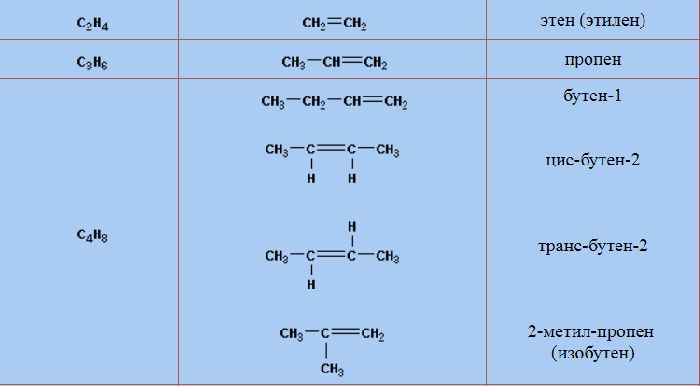
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
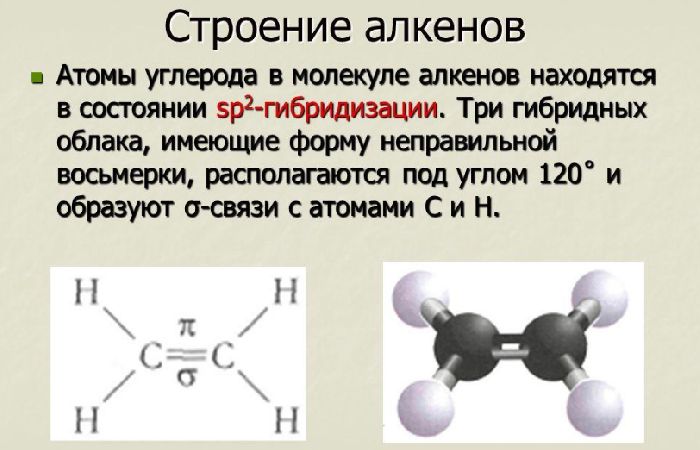
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

|
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название 2-метилпропен.
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH2=CH- | винил |
| CH2=CH-CH2— | аллил |
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Получение алкенов
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт.
4. Дегидратация спиртов
При нагревании спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
Например, при дегидратации этанола при высокой температуре образуется этилен.
Дегидратация более сложных молекул также протекает по правилу Зайцева.
Например, при дегидратации бутанола-2 преимущественно образуется бутен-2.
5. Дегалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов.
Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Например, 1,2-дихлорпропан реагирует с цинком с образованием пропилена
6. Гидрирование алкинов
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
7. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
План урока:
Что такое алкены?
Элементарный состав алкенов и их номенклатура
Физические свойства алкенов
Химические свойства алкенов
Применение алкенов
Что такое алкены?
Алкенами называются углеводороды, в которых есть одна двойная связь. На 1 уроке органической химии рассказывалось, что появление в составе молекулы кратных связей влияет на их химические свойства, о чем будет рассмотрено ниже.
Элементарный состав алкенов и их номенклатура
Для всех молекул алкенов ученые представили формулу, которая связывает соотношение водорода и углерода в молекуле. Общая формула алкенов выглядит так: СnH2n.
Теперь разберемся, как воспользоваться формулой на некоторых примерах.
Число атомов углерода в молекуле задается произвольно, начиная от 2 (т.к. двойная связь может образовываться только между двумя атомами углерода). Для примера мы примем, что число атомов углерода (т.е. n)равно 2.
Подставим это значение в формулу и запишем:
C2H2*2 = C2H4.
Мы получили, что алкен, имеющий в своем составе 2 атома углерода, имеет формулу C2H4.
Теперь представим, что в молекуле алкена не 2, а 3 или 5, или даже 10 атомов углерода.
Запишем формулы этих веществ:
C3H2*3 = C3H6
C5H2*5 = C5H10
C10H2*10 = C10H20
Вот мы получили некоторые формулы веществ, теперь нужно разобраться, а как их можно назвать?
Номенклатура алкенов
Вспомним, что номенклатура – это правило, по которому составляются названия органических веществ. Строение углеродного скелета позволяет разделить алкены на 2 типа, в которых он имеет вид:
- цепочки, т.е. имеет линейное строение (рисунок 1 а);
- цепочки, у которой есть заместители, т.е. имеет разветвленное строение (рисунок 1 б).
Рисунок 1. Виды алкенов.
Номенклатура линейных алкенов
Если вспомним 2 урок по органической химии, в котором рассказывалось про номенклатуру радикалов и алканов, то вспомним, что есть зависимость между числом углеродных атомов в цепочке молекулы и корнем названия. Точно такая же зависимость характерна для алкенов и других органических соединений, и корень названия алкена указывается в зависимости от числа атомов углерода в его цепочке. Для полного названия необходимо добавить суффикс, который у алкенов –ен, что и указано в таблице ниже.
Стоит знать, что алкены линейного строения образуют гомологический ряд алкенов.
Таблица 1. Название алкенов линейного строения.
Для этена было принято еще одно собственное название – этилен.
Чтобы описание алкена было более точно, то необходимо изобразить его структурную формулу и посмотреть, рядом с каким атомом углерода стоит кратная связь. После этого указать его номер через дефис в конце названия.
Но стоит помнить, что нумерация атомов углерода начинается с того конца, к которому кратная связь ближе.
Например, назовем гексен, в котором кратная связь находится в разных частях углеродного скелета.
Номенклатура алкенов с заместителями
Чтобы назвать алкен с заместителями, следует пользоваться алгоритмом:
- Пронумеровать самую длинную углеродную цепь, начиная с того конца, к которому ближе двойная связь.
- В приставке названия указать номер атома углерода, у которого стоит заместитель, и назвать его в соответствии с таблицей радикалов.
- Если у разных атомов углерода стоит один и тот же заместитель, то сначала перечисляются номера атомов, у которых он стоит, а затем через дефис указать общее количество и название.
- В соответствии с длиной цепочки углеродного скелета, выбрать корень названия из таблицы 1.
- Добавить суффикс –ен и через дефис указать, у какого атома углерода стоит кратная связь.
Дадим название веществу, которое имеет структурную формулу, представленную ниже.
Название вещества: 5,5-диметил-2-этил-6-бромгептен-2
Строение алкенов
Два атома углерода в молекуле алкена имеют гибридизацию sp2. Это значит, что гибридизованы его s и только 2 p орбитали, при этом одна p орбиталь имеет свою прежнюю гантелевидную форму. Между sp2-гибридизованными атомами получается двойная связь: одна образуется при перекрывании гибридных орбиталей (рисунок 2 а), а вторая – при перекрывании p-орбиталей (рисунок 2 б).
Рисунок 2. – Образование двойной связи.
Изомерия алкенов
Вспомним, что изомерами называются вещества, у которых одинаковый элементарный состав, но разное структурное строение.
На примере пентена-2 рассмотрим, какие виды изомерии встречаются у алкенов.
- Структурная изомерия. Например, пентен-2 и 2-метилбутен-2 имеют одинаковый элементный состав, но разную длину углеродной цепи и количество заместителей.
- Положение кратной связи. Например, пентен-2 и пентен-1.
- Межклассовая. Циклопентан и пентен-2 относятся к разным классам углеводородов, хоть и имеют одинаковый элементный состав.
- Геометрическая. По отношению к кратной связи заместители могут располагаться либо по одну сторону (цис-изомерия), либо по разные (транс-изомерия).
Все виды изомерии алкенов показаны на рисунке 3.
Рисунок 3. – Виды изомерии алкенов на примере пентена-2.
Физические свойства алкенов
Как и алканы, физические свойства алкенов зависят от количества атомов углерода в его цепочке.
Агрегатные состояния алкенов
Алкены, имеющие в своем составе от 2 до 4 атомов углерода – газы, с 5 до 17 – жидкости, а с 18 – твердые вещества, что показано на рисунке 5.
Рисунок 4. – Газообразный, жидкий и твердый алкены.
Источник
Температура кипения и некоторые другие физические свойства алкенов
Помимо количества атомов углерода в молекуле, на физические свойства алкенов влияет и строение его молекул. Например, чем выше разветвленность, тем выше температура плавления и кипения, а также плотность. Например, в таблице 2 2-метилпропен и бутен-1 имеют одинаковый состав, но при этом разные структурные формулы и разные показатели температур кипения и плавления.
Таблица 2. – Температуры кипения и плавления алкенов
Следует отметить, что алкены хорошо растворимы в органических растворителях, однако плохо растворимы в воде.
В обычных условиях алкены с водой не взаимодействуют (для этого необходимо использовать катализаторы и повышенную температуру), поэтому газообразные алкены водой не поглощаются. Например, если этилен попадет в воду, то он пузырьками выйдет из нее.
Жидкие алкены образуют систему с границей раздела фаз, например, как представлено на рисунке 5.
Рисунок 5. – Несмешивающиеся жидкости.
Твердые алкены ведут себя аналогично камню в воде, т.е. не растворяются.
Способы получения алкенов
Алкены добываются из недр земли или с помощью химических реакций. Первый способ не так распространен в промышленности, ввиду хорошей реакционной способности алкенов, из-за чего они довольно быстро превращаются в другие соединения.
Алкены – востребованные в химическом синтезе реагенты, поэтому были найдены способы их синтеза при помощи химических реакций, которые описаны ниже.
Ниже рассмотрим способы получения алкенов с записью уравнения в общем виде (т.е. используя для обозначения некоторой части углеродной цепи некий радикал R-), а так же с конкретной подставкой метил радикала (CН3-).
Помимо этого, в общем виде химических формул будут встречаться заместители-галогены, которые будут обозначены в общем случае как –Hal. При конкретном примере в качестве галогена будет выступать –Cl.
Итак, химические способы получения алкенов:
- Дегидрирование алканов.Алканы при высокой температуре на катализаторе из оксида хрома претерпевают необратимые изменения и становятся алкенами.
- Термический крекинг алканов.
Крекинг – это химическая реакция, при которой углеводороды с длинной углеродной цепочкой превращаются в соединения с углеродными цепочками меньшей длины. Под термическим крекингом нужно понимать, что такой процесс разложения проводят при повышенной температуре (от 800 до 1000 °С).
- Дегалогенирование. Дегалогенирование – один из видов реакций разложения, при протекании которой от молекулы алкилгалогенида отщепляются атомы галогена. Для проведения такой реакции необходимо использовать дигалогеналкан, у которого атомы галогена находятся у соседних атомов углерода. В присутствии цинка в качестве катализатора и при повышенной температуре от дигалогеналкана отрываются атомы галогена, и между соседними атомами углерода образуется двойная связь. В качестве побочного продукта выделяется соль цинка.
- Дегидрогалогенирование. Дегидрогалогенирование – реакция разложения, в результате которой отщепляется молекула галогенводорода (вспомним, что галогенводороды – это HCl, HBr, HIи HF). Реагентом в такой реакции является алкилгалогенид, от которого при высокой температуре отщепляется галогенводород, а он сам становится алкеном. Выделяющейся в качестве побочного продукта галогенводород взаимодействует с раствором щелочи, т.е. нейтрализуется.
- Дегидратация спиртов в присутствии серной кислоты. Дегидратация – реакция разложения, при которой от органической молекулы отщепляется молекула воды. Чаще всего для такой реакции в качестве реагента используется спирт. Двойная связь образуется, когда от одного атома углерода «отрывается» OH-группа, а от соседнего – атом водорода.Чтобы реакция прошла, необходимо использовать концентрированную серную кислоту в качестве катализатора и нагреть.
- Дегидратация спиртов в присутствии оксида алюминия. Оксид алюминия – вещество, которое чувствительно к влаге, и активно взаимодействует даже с небольшим количеством воды, образуя гидроксид алюминия. Эту способность оксида алюминия используют для того, чтобы сместить равновесие реакции в сторону продуктов, путем уменьшения концентрации одного из них (воды).
- Гидрирование алкинов. При взаимодействии алкина с водородом в присутствии палладия и солей свинца образуется алкен.
Химические свойства алкенов
Наличие кратной связи в молекуле алкена делает их более реакционноспособными, если сравнивать с алканами. Другими словами, алкенам характерен более широкий набор химических реакций, и помимо реакций горения и разложения, они вступают в реакции присоединения и полимеризации. Реакции присоединения – один из характерных химических свойств алкенов.
Реакции замещения, как правило, для алкенов не характерны, т.к. в основном все реакции идут таким образом, чтобы разрушилась кратная связь.
Уравнения химических свойств алкенов будут представлены ниже
Реакции присоединения алкенов
Именно этот тип реакций наиболее часто встречается в практике синтеза органических соединений из алкенов.
Реакцию присоединения можно представить как взаимодействие алкена с веществом А-Б.
- Гидрирование. На платиновом катализаторе, под воздействием высокой температуры, алкен взаимодействует с водородом, в результате чего образуется алкан. Атомы водорода встают по обе стороны кратной связи.
- Галогенирование(качественная реакция с бромом). Вспомним, что бром – жидкость коричневого цвета. При пропускании через раствор брома в воде газообразного алкена образуется дигалогеналкан: атомы брома присоединяются к соседним атомам углерода, а жидкость меняет свой цвет. Эта реакция является качественной для алкенов (т.е. при анализе веществ с ее помощью можно определить, является ли исследуемое вещество алкеном или нет). Аналогично идет присоединение и других галогенов (хлора и иода).
На рисунке 6 наглядно видно, что представляет собой качественная реакция. В 2 пробирки, заполненные одинаковыми реагентами (в данном случае бромом), добавляют алкен(слева) и алкан (справа). После прохождения реакции видно, что в левой пробирке реакция прошла (раствор обесцветился), а в правой нет (бром просто частично растворился в алкане).
Рисунок 6. – Качественная реакция на алкен – взаимодействие с бромной водой.
- Гидрогалогенирование. Правило Марковникова. При взаимодействии алкена с галогенводородом, присоединение к кратной связи идет по правилу: водород присоединяется к тому атому углерода, у которого содержится большее число атомов водорода (т.е. к более гидрированному). Соответственно, атом галогена присоединяется к соседнему атому углерода. На примере ниже видно, что у углерода справа 2 атома водорода, а слева – 1. Значит, в соответствии с правилом, водород присоединится к тому атому углерода, у которого водорода 2, т.е. к стоящему справа.
Последний атом водорода можно не указывать при записи структурной формулы, включив его в общее количество водородов при углероде, т.е. записав:
При использовании специальных катализаторов может происходить присоединение и против правила Марковникова (т.е. когда атом водорода присоединится к менее гидрированному атому углерода), но в школьном курсе такие реакции не рассматриваются.
- Гидратация. Гидратация – реакция присоединения молекулы воды. При взаимодействии с водой в присутствии кислот, алкен превращается в спирт. Правило Марковникова также характерно для данной реакции: водород присоединяется к более гидрированному атому углерода.
Реакции окисления
Под воздействием различных окислителей алкены превращаются в определенные соединения, которые широко используются в дальнейшем органическом синтезе.
В качестве окислителей используются перманганат или дихромат калия. В общем случае, над стрелкой реакции окислитель обозначается как [O].
- Окисление в присутствии перманганата калия (качественная реакция). Водный раствор перманганата калия имеет розовый цвет, но при пропускании через него газообразного алкена, он обесцвечивается. В результате реакции на месте кратной связи образуются гидроксильные группы и такие соединения называются гликолями.
- Окисление алкенов до альдегидов. При взаимодействии с окислителем в кислой среде алкен превращается в альдегид, в качестве побочных продуктов выделяются углекислый газ и вода.
Реакции полимеризации и горения алкенов
Полимеризация – реакция, в результате которой из многих одинаковых молекул с низкой молекулярной массой образуются молекулы с большой молекулярной массой. Продукты реакций полимеризации называют полимерами. Они состоят из цепочки повторяющихся между собой «звеньев». Звенья имеют вид соединения, из которого был получен полимер.
Например, если полимеризовался этилен, то в результате реакции полимеризации образуется полиэтилен.
Как и многие органические соединения, при реакции горения алкенов образуются углекислый газ и вода.Общая формула горения алкенов выглядит так:
Например, при сгорании этилена, реакция горения будет выглядеть следующим образом:
Применение алкенов
Алкены используют в химической промышленности в качестве реагента для получения пластмасс, спиртов, альдегидов и др. соединений, про которые будет рассказано на последующих уроках.
Также алкены используют в сельском хозяйстве в качестве веществ, которые помогают овощам быстрее созреть.
Некоторые алкены используют при сварке металлических изделий, что изображено на рисунке 7.
Рисунок 7. – Газовая сварка с использованием этилена.
Запрос «Алкен» перенаправляется сюда; см. также другие значения.
Пространственная структура этилена.
Алке́ны (этиле́новые углеводоро́ды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации и имеют валентный угол 120°.
Простейшим алкеном является этилен (C2H4).
По номенклатуре IUPAC, названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой после соответствующего атома углерода. Например: CH2=CH-CH2-CH3 (Бутен-1)
Углеводородные радикалы, образованные от алкенов, имеют суффикс «-ени́л».
Тривиальные названия: CH2=CH— «вини́л», CH2=CH—CH2— «алли́л».
Гомологический ряд и изомерия[править | править код]
Алкены, число атомов углерода в которых больше двух, (то есть кроме этилена) имеют свои изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая. Например, единственным изомером пропилена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутилена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропилен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров возрастает в геометрической прогрессии.

Гомологический ряд алкенов:
| Этен (этилен) | C2H4 |
| Пропен (пропилен) | C3H6 |
| Бутен (бутилен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен[en] | C7H14 |
| Октен | C8H16 |
| нонен[en] | C9H18 |
| децен | C10H20 |
Алкены могут существовать в виде пространственных или геометрических изомеров.
Различают:
- цис- изомеры: заместители расположены по одну сторону от двойной связи;
- транс- изомеры: заместители расположены по разные стороны от двойной связи.
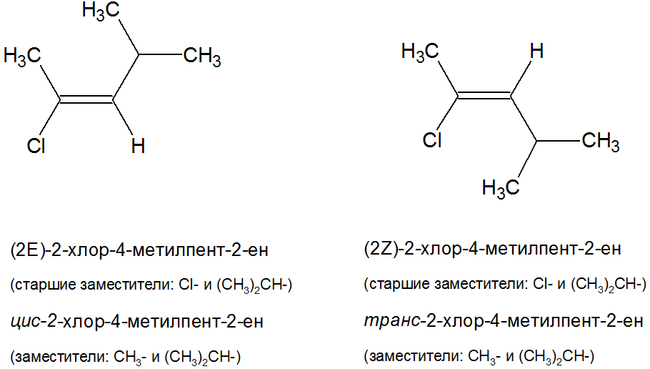
IUPAC рекомендует называть геометрические изомеры по следующей номенклатуре:
- Z- изомеры: старшие заместители у углеродных атомов двойной связи находятся по одну сторону относительно двойной связи;
- E- изомеры: старшие заместители у углеродных атомов двойной связи находятся по разные стороны относительно двойной связи.
Электронное строение двойной связи[править | править код]
В соответствии с теорией гибридизации двойная связь образуется за счёт перекрывания вдоль линии связи С-С sp2-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания углеродных p-орбиталей (π-связь).
Схема образования связей в молекуле этилена
В состоянии sp2-гибридизации электронное состояние атома углерода можно представить следующим образом:

Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120 °. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С.
Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p-орбиталей углерода формирует две молекулярные π-орбитали этилена[1]:
Формирование π-орбиталей этилена
Первый потенциал ионизации этилена составляет 10,51 эВ[2], что позволяет электрону относительно легко уходить (электрофильное взаимодействие) с высшей занятой молекулярной орбитали (ВЗМО).
В то же время, низшая связывающая молекулярная орбиталь (НСМО) этилена имеет достаточно низкую энергию: −1,6—1,8 эВ, что объясняет относительную лёгкость присоединения электрона с образованием аниона[2] (нуклеофильное взаимодействие).
Добавление метильного заместителя снижает потенциал ионизации π-электронов примерно на 0,6—0,8 эВ и повышает энергию НСМО на 0,2 эВ, а ВЗМО на 0,7 эВ[2].
История открытия[править | править код]
Впервые этилен был получен в 1669 году немецким химиком и врачом И. И. Бехером действием серной кислоты на этиловый спирт. Учёный установил, что его «воздух» более химически активен, чем метан, однако идентифицировать полученный газ он не смог и названия ему не присвоил[3].
Вторично и тем же способом «воздух Бехера» был получен и описан голландскими химиками Я.Р. Дейманом[en], Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795 году. Они назвали его «маслородным газом» так как при взаимодействии с хлором, он образовывал маслянистую жидкость — дихлорэтан (об этом стало известно позднее). По-французски «маслородный» — oléfiant. Французский химик Антуан Фуркруа ввёл этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало общим для всего класса олефинов (или, по современной номенклатуре, алкенов)[4].
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из «маслородного» газа и воды. Этот же газ он обнаружил и в хлористом этиле[5]. В 1828 году Ж. Дюма и П. Буллей предположили, что этилен представляет собой основание, способное давать соли подобно аммиаку. Якоб Берцелиус принял эту идею, назвав соединение «этерином» и обозначив буквой E[6].
Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его настоящую формулу. В 1848 году Кольбе писал формулу этилена как С4Н4, этого же мнения придерживался и Либих. Ж. Дюма правильно определил состав вещества, но его структура по-прежнему была описана неверно: С2НН3[5].
В 1862 году немецкий химик-органик Э. Эрленмейер предположил наличие в молекуле этилена двойной связи, а в 1870 году известный российский учёный А. М. Бутлеров признал эту точку зрения правильной, подтвердив её природу экспериментально[7].
Нахождение в природе и физиологическая роль алкенов[править | править код]
В природе ациклические алкены практически не встречаются[8]. Простейший представитель этого класса органических соединений — этилен (C2H4) — является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов — мускалур (цис– трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).

Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей[9].
Отдельные представители:
- Этилен — вызывает наркоз, обладает раздражающим и мутагенным действием.
- Пропилен — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие, а его межклассовый изомер- циклопропан также используется в качестве наркоза.
- Бутен-2 — вызывает наркоз, обладает раздражающим действием[9].
Физические свойства[править | править код]
- Температуры плавления и кипения алкенов (упрощённо) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гептадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
| Физические свойства алкенов[10] | |||||
|---|---|---|---|---|---|
| № | Название | Формула | Т плавления, ° C | Т кипения, ° C | Плотность, d20 4 |
| 1 | Этилен | С2H4 | −169,1 | −103,7 | 0,5700* |
| 2 | Пропилен | C3H6 | −187,6 | −47,7 | 0,5193* |
| 3 | Бутен-1 | C4H8 | −185,3 | −6,3 | 0,5951* |
| 4 | цис-Бутен-2 | CH3-CH=CH-CH3 | −138,9 | 3,7 | 0,6213 |
| 5 | транс-Бутен-2 | CH3-CH=CH-CH3 | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Метилпропен-1 | CH3-C(CH3)=CH2 | −140,4 | −7,0 | 0,5942* |
| 7 | Пентен-1 | CH2=CH-CH2-CH2-CH3 | −165,2 | 30,1 | 0,6405 |
| 8 | Гексен-1 | CH2=CH-CH2-CH2-CH2-CH3 | −139,8 | 63,5 | 0,6730 |
| 9 | Гептен-1[en] | С7H14 | −119,0 | 93,6 | 0,6970 |
| 10 | Октен-1 | С8H16 | −101,7 | 121,3 | 0,7140 |
| … | Гептадецен[en][11] | С17H34 | 4,1 | 284,4 | 0,7811 |
* Значения измерены при температуре кипения.
Химические свойства[править | править код]
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи.
Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются с сильными восстановителями или водородом под действием катализаторов, а также способны к радикальному замещению.
Реакции электрофильного присоединения[править | править код]
В данных реакциях атакующей частицей является электрофил.
Галогенирование[править | править код]
Галогенирование алкенов, проходящее в отсутствие инициаторов радикальных реакций — типичная реакция электрофильного присоединения. Она проводится в среде неполярных инертных растворителей (например: CCl4):

Реакция галогенирования стереоспецифична —- присоединение происходит с противоположных сторон относительно плоскости молекулы алкена[1]
Механизм реакций подобного типа в общем виде:

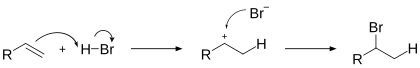
Гидрогалогенирование[править | править код]
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:

Однако в присутствии перекисей присоединение происходит преимущественно против этого правила (эффект Хараша)[1]:

Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму и присоединение радикала Br. идёт по стерически наиболее доступному концевому атому углерода двойной связи:

Гидроборирование[en][править | править код]
Присоединение гидридов бора к алкенам и последующее их расщепление в щелочной среде, открытое Г. Брауном в 1958 году, является столь важной реакцией, что за её обнаружение и изучение в 1979 году учёный был удостоен Нобелевской премии по химии[12].
Присоединение происходит многоступенчато с образованием промежуточного циклического активированного комплекса, причём присоединение бора происходит против правила Марковникова — к наиболее гидрогенизированному атому углерода:
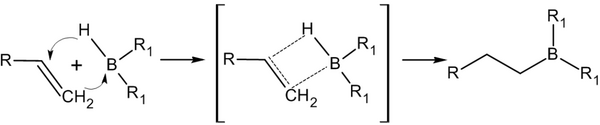
В синтезе обычно используется не сам диборан, а его донорно-акцепторный комплекс с простым эфиром:

Алкилбораны легко расщепляются. Так под действием пероксида водорода в щелочной среде образуются спирты:
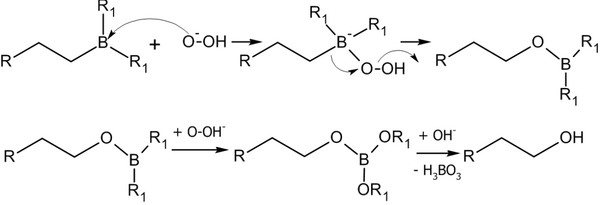
Реакция гидроборирования является реакцией син-присоединения — её результатом становятся цис-аддукты.
Гидратация[править | править код]
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты[13]:

Реакция протекает по правилу Марковникова.
Алкилирование[править | править код]
Присоединение алканов к алкенам в присутствии кислотного катализатора (HF или H2SO4) при низких температурах приводит к образованию углеводорода с большей молекулярной массой и часто используется в промышленности[14]:

Данная реакция также может протекать по свободнорадикальному механизму в отсутствие катализатора при высокой температуре (500 °C) и давлении (15-30 МПа)[13].
Прочие реакции электрофильного присоединения[править | править код]
Для алкенов также характерны следующие реакции электрофильного присоединения[13]:
- Присоединение спирта с образованием простого эфира:

- Получение спиртов по реакции оксимеркурирования-демеркурирования:


- Присоединение хлорноватистой кислоты с образованием хлоргидринов:

- Присоединение хлорангидридов с дальнейшим получением ненасыщенных кетонов (реакция Кондакова, катализатор ZnCl2[15]):

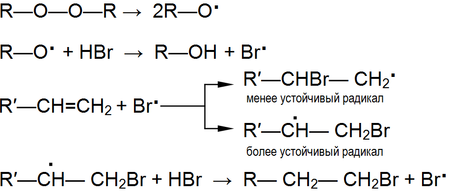
Реакции радикального присоединения[править | править код]
В условиях, способствующих гомолитическому разрыву связи, (высокая температура, облучение, наличие свободных радикалов и пр.) присоединение к алкенам происходит по радикальному механизму[16].



и т. п.
Механизм реакции:
Реакции присоединения карбенов[править | править код]
Карбены CR2: — высокореакционные короткоживущие частицы, которые способны легко присоединяться к двойной связи алкенов[17]. В результате реакции присоединения карбена образуются производные циклопропана:
Карбены в более характерном для них синглетном состоянии, вступая в реакцию, дают стереоспецифичные продукты син-присоединения[13].
Помимо собственно карбена, в подобные реакции могут вступать и его производные[13]:

Часто реакции присоединения карбенов происходят без прямых доказательств их свободного присутствия, то есть происходит перенос карбена. Для этого случая, а также если генерация свободного карбена ставится под сомнение, пользуются термином карбеноид[18].
В лабораторной практике часто пользуются реакцией Симмонса — Смита[en][19]:

Подробнее о методах получения карбенов см. статью Карбены.
Гидрирование (реакция Сабатье — Сандеран)[править | править код]

Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора.
Гетерогенными катализаторами гидрирования служат платина, палладий, никель
[20].
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами (например: катализатор Уилкинсона ((C6H5)3P)3Rh Cl)[20].
В качестве реагентов гидрирования могут выступать диимид[en] (NH=NH), диборан (B2H6) и др[21].
Реакции радикального замещения[править | править код]
При высоких температурах (более 400 °C) реакции радикального присоединения, носящие обратимый характер, подавляются.
В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи:

Реакция носит радикальный характер и протекает аналогично хлорированию алканов.
Аллильное бромирование обычно проводят N-бромсукцинимидом (реакция Воля — Циглера)[22] в присутствии перекиси бензоила в среде тетрахлорметана или в бинарной смеси диметилсульфоксида и воды[20]:

Окисление[править | править код]
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
Окисление неорганическими окислителями[править | править код]
- В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп[23]:

На первом этапе происходит присоединение оксида осмия к алкену, затем под действием восстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге).
Аналогично реакция идёт в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера)[23]:

- При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
![{mathsf {R!!-!!CH!!=!!CH!!-!!R+[O]}}rightarrow {mathsf {2R!!-!!COOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5848e6203a9341c8ca9a8d6a7251d29c949dfdf5)
![{mathsf {R!!-!!CH!!=!!C(R)(R')+[O]}}rightarrow {mathsf {R!!-!!COOH+R!!-!!C(O)!!-!!R'}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea6c33e33f2be61289db42c78b1747f6409c7d50)
- Некоторые окислители, например нитрат (III) таллия, окисляют алкены с перегруппировкой по следующей схеме[23]:
![{mathsf {R!!-!!C(R)!!=!!CH!!-!!R+[O]}}rightarrow {mathsf {R!!-!!C(O)!!-!!CH(R)R}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea802883018bd47662e62ca08a22b0db107be036)
Окисление в присутствии солей палладия[править | править код]
В присутствии солей палладия этилен окисляется до ацетальдегида[1]:

Реакция идёт в кислой среде и является промышленным способом получения ацетальдегида.
Аналогично образуется ацетон из пропена.
Эпоксидирование[править | править код]
При действии на алкены пероксикарбоновых кислот образуются эпоксиды (реакция Прилежаева)[24]:

Реакция эпоксидирования используется для промышленного получения этиленоксида. Окислителем выступает кислород воздуха; процесс идёт на серебряном катализаторе при 200—250 °C под давлением.
Озонолиз[править | править код]
Озонолиз алкенов обычно проводят при низких температурах (от −80 до −30 °C) в инертном растворителе (гексан, тетрахлорметан, хлороформ, этилацетат и пр.). Непосредственные продукты озонолиза не выделяют, а подвергают дальнейшему гидролизу, окислению или восстановлению[23].
- Озонолиз[en] в мягких условиях: алкен окисляется до альдегидов (в случае монозамещённых вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена).
На первой стадии происходит присоединение озона с образованием озонида. Далее под действием восстановителя (например: Zn + CH3COOH) озонид разлагается:
Если взять более сильный восстановитель, скажем — алюмогидрид лития, продуктом реакции будут спирты.
- Озонолиз[en] в жёстких условиях — алкен окисляется до кислоты:

В данном случае разложение озонида происходит под действием окислителей (пероксид водорода, оксид серебра, пероксикислоты и пр.[23]).
Реакция карбонилирования[править | править код]
Алкены в присутствии катализатора, высокой температуры и давления присоединяют CO и H2 с образованием альдегидов[25]:

Аналогично протекает реакция CO и H2O с образованием карбоновых кислот[25] :

Если вместо воды использовать спирт, конечным продуктом реакции будет сложный эфир[25] :

Реакции полимеризации[править | править код]
Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионному механизму.
По первому методу получают полиэтилен высокого давления:
![{mathsf {n CH_{2}!!=!!CH_{2}}}rightarrow {mathsf {-[-!CH_{2}!!-!!CH_{2}!-]_{n}-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e97cdfc9a0a959098c6ee2d45a5bc394ba41aa9)
Катализатором реакции выступают пероксиды.
Второй метод предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений (катализаторы Циглера-Натта, анионная полимеризация). Преимуществом метода является возможность получения стереоселективных полимеров.
Реакции свободнорадикального присоединения
Метатезис алкенов[править | править код]
Впервые данный тип реакций был обнаружен в середине прошлого века при изучении полимеризации этилена, а в затем был использован в 1966 году для промышленного синтеза бутена-2.
В 1967 году Н. Кальдерон, Х. Ю Чен и К. В. Скотт описали метатезис алкенов (в российской литературе часто употребляется термин реакция дисмутации алкенов, иначе говоря — реакцию обмена атомами при сохранении общей структуры алкена и его двойной связи) в условиях катализа хлоридом вольфрама (VI):

Реакция оказалась настолько важной в области практической препаративной химии, что исследовательская группа Роберта Граббса, разработавшая новый класс катализаторов (алкилиденовые комплексы рутения) метатезиса олефинов, получила в 2005 году Нобелевскую премию в области химии[26]. Эту премию также получили француз Ив Шовен в 1971 году, предложивший карбеновую теорию механизма реакции метатезиса[27], и американец Ричард Шрок, создавший в 1990 году первый металлорганический катализатор метатезиса алкенов[28].
В 2008 году польские химики продемонстрировали реакцию метатезиса в водном растворе с использованием коммерчески доступного рутениевого катализатора[29].
Технологические аспекты метатезиса алкенов рассмотрены в статье: Метатезис олефинов: современный путь к полипропилену.
Методы получения алкенов[править | править код]
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
В лабораторной практике обычно применяют метод дегидратации спиртов в присутствии сильных минеральных кислот[1], дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных; синтезы Гофмана, Чугаева, Виттига и Коупа[30].
Подробнее — см. соответствующие разделы ниже.
Дегидрирование алканов[править | править код]
Это один из промышленных способов получения алкенов[31][32]. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы[33]. Для получения транс-алкенов используют MOH/EtOH, для цис-производных NaNH2/NH3


Дегидрогалогенирование и дегалогенирование алканов[править | править код]
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка[34]:

Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей[35]:

При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
Дегидратация спиртов[править | править код]
Дегидратацию спиртов ведут при повышенной температуре бани в присутствии сильных минеральных кислот[34]:


В современной практике алкены из вторичных и третичных спиртов также получают с использованием дегидратирующего реагента — реагента Бёрджесса[19]:

Гидрирование алкинов[править | править код]
Частичное гидрирование алкинов требует специальных условий и наличие катализатора (например, дезактивированного палладия — катализатора Линдлара)[34]:



Реакция Виттига[править | править код]
Реакция Виттига — стереоселективный синтез алкенов взаимодействием карбонильных соединений и алкилиденфосфоранов (илидов фосфониевых солей)[36]:
![{mathsf {(C_{6}H_{5})_{3}P+CH_{3}Br}}rightarrow {mathsf {[(C_{6}H_{5})_{3}P!!-!!CH_{3}]Br}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73a40add539caa3e89155b37347220e6410e653c)
![{mathsf {[(C_{6}H_{5})_{3}P!!-!!CH_{3}]Br+C_{6}H_{5}Li}}rightarrow {mathsf {(C_{6}H_{5})_{3}P!!-!!CH_{2}!!:+}}{mathsf {C_{6}H_{6}+LiBr}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce8a7eb853879473cc1c355a6a154aaf1711f5ad)

Для превращения солей фосфония в илиды используются бутиллитий, гидрид, амид или алкоголят натрия, а также некоторые другие сильные основания.
В реакцию могут вступать самые различные карбонильные соединения, среди которых ароматические и алифатические альдегиды и кетоны, в том числе содержащие двойные и тройные связи и различные функциональные группы.
В лабораторной практике часто используют более современную модификацию (1959 год) реакции Виттига — реакцию Хорнера-Уодсворта-Эммонса[37]:
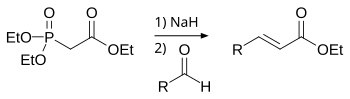
Преимущество использования фосфонатов заключается в том, что образующиеся в ходе реакции фосфаты легко отмываются водой. Кроме того, реакция позволяет избирать оптическое направление элиминирования, получая на выходе транс– (термодинамический контроль) или цис-изомеры (кинетический контроль)[19].
Реакция Кнёвенагеля[править | править код]
Реакция Кнёвенагеля — конденсация альдегидов или кетонов с соединениями, содержащими активную CH2-группу[19]:

Реакция имеет очень широкий диапазон применения, при этом помимо эфиров малоновой кислоты, в реакцию могут вступать и другие соединения, например: CH3CN, CH3NO2, LiCH2COOC2H5 и пр.[13].
Реакция Чугаева[править | править код]
Реакция Чугаева — взаимодействие спиртов с CS2 и NaOH с последующим метилированием и дальнейшим пиролизом образовавшихся S-метилксантогенатов[38]:


Реакция Гофмана[править | править код]
Исчерпывающее метилирование по Гофману — разложение четвертичных аммониевых оснований на алкен, третичный амин и воду[39]:

На первой стадии реакции действием метилиодида амин превращают в четвертичный аммонийиодид, который далее переводят в гидроксид действием оксида серебра, наконец, последний этап — разложение — ведут при 100—200 °C, часто при пониженном давлении[40].
Элиминирование по Гофману приводит к образованию наименее замещённых алкенов (против правила Зайцева).
Метод используется, в основном, для получения некоторых циклических алкенов и в химии алкалоидов[40].
Реакция Коупа[править | править код]
Реакция Коупа[en] — разложение N-окисей третичных аминов[40]:

Прочие методы синтеза[править | править код]
Реакция Бурда[править | править код]
Реакция Бурда — элиминирование брома и этоксигруппы из бромалкилэтиловых эфиров под действием цинковой пыли[41]:

Синтез из тозилгидразонов[править | править код]
Алкены можно получить разложением тозилгидразонов под действием оснований (Реакция Бэмфорда — Стивенса[en] и Реакция Шапиро[en])[42]:

Реакция Бэмфорда — Стивенса и Реакция Шапиро протекают по одинаковому механизму.
В первом случае используются натрий, метилат натрия, гидриды лития или натрия, амид натрия и т. п. Во втором: аллкиллитий и реактивы Гриньяра.
В реакция Бэмфорда — Стивенса образуются более замещённые, а в реакция Шапиро — наименее замещённые алкены[43].
Реакция Перкина[править | править код]
Реакция Перкина — взаимодействие ароматических альдегидов с ангидридами карбоновых кислот в присутствии катализаторов основного характера (щелочных солей карбоновых кислот, третичных аминов и т. п.)[44]:

Последующим декарбоксилированием образующейся кислоты можно получить соответствующий алкен.
Синтез Кори — Винтера[править | править код]

Олефинирование Жюлиа — Лижо[править | править код]
Идентификация алкенов[править | править код]
Химические методы идентификации алкенов[править | править код]
Часто для идентификации алкенов используют реакцию Вагнера: обесцвечивание раствора перманганата калия в слабощелочной среде (окисление алкенов до гликолей).
Другой вариант — обесцвечивание раствора брома в четыреххлористом углероде при отсутствии выделения бромоводорода (реакция присоединения)[45].
Эти химические методы является очень общими, не селективными и не могут гарантированно определить алкены.
Для подтверждения наличия двойной связи в соединении используют методы спектроскопии.
Масс-спектрометрические методы анализа алкенов[править | править код]
Масс-спектры алкенов по сравнению с алканами содержат более интенсивные M+ пики[46].
Существует эффективный экспресс-метод масс-спектрометрического исследования строения алкенов, заключающийся в изучении масс-спектров соответствующих алканов, образующихся при проведении газофазного гидрирования алкенов в токе водорода (кат. Pt, Pd) в микрореакторе, расположенном между газовым хроматографом и масс-спектрометром[47].
УФ-спектроскопические методы анализа алкенов[править | править код]
Алкены с изолированными двойными связями имеют интенсивную (ε от 6500 до 12000) широкую полосу поглощения, обусловленную переходом π→π, в области 165—200 нм. Наличие алкильных заместителей смещает эту полосу в длинноволновую область[48].
ИК-спектроскопические методы анализа алкенов[править | править код]
ИК-спектры алкенов имеют представленные в таблице характеристические полосы, вызванные валентными колебаниями связи С=С и C-H[49]:
| Типы колебаний и групп | Диапазон, см−1 | Примечание |
|---|---|---|
|
Валентные колебания связей C−H |
||
| R2C=CH2 | 3095-3075 | Могут наблюдаться мультиплеты |
| R2C=CHR | 3045-3010 | Дифференциация цис- и транс- изомеров невозможна |
|
Деформационные колебания связей C−H |
||
| RCH=CH2 | 990, 910 | |
| R,RC=CH2 | около 890 | |
| R,RC=CHR | 840-790 | |
| транс—RCH=CHR | около 950 | |
| цис−RCH=CHR | 730-665 | |
|
Валентные колебания связей C=С |
||
| транс−RCH=CHR | около 1675 | Полосы умеренной и высокой интенсивности, пригодные для идентификации ациклических и ненапряжённых систем |
| цис−RCH=CHR | около 1660 | |
| RCH=CR1R2 | около 1670 | |
| R2C=CH2 | около 1650 | |
| RCH=CH2 | около 1640 | |
| C=C−C=C | 1645-1600 | Положение полосы, более интенсивной чем у алкенов, зависит от геометрии сопряжённой системы |
| C=C−C=O | 1660-1580 | |
| C=C−(C=C)n | 1650-1580 | Полосы имеют мультиплетную структуру, а при больших n сливаются в одну широкую полосу |
| ArC=C | около 1630 | Положение полосы зависит от положения и природы заместителей |
ЯМР-спектроскопические методы анализа алкенов[править | править код]
ЯМР-спектроскопические методы анализа алкенов позволяют идентифицировать сигналы атомов водорода алкенов, тем самым получив важную информацию о структуре углеводородов. Эти сигналы лежат в диапазоне 4-8 м.д. Существует эмпирическая зависимость, позволяющая достаточно точно вычислить сдвиги протонов алкенов[50]:
δC=C-H = 5,25 + Zгем + Zцис + Zтранс
где Z-аддитивные параметры экранирования соответствующих заместителей.
Значения Z для отдельных заместителей представлены в таблице[50]:
| Заместитель | Zгем | Zцис | Zтранс |
|---|---|---|---|
| H | 0,00 | 0,00 | 0,00 |
| Алкил | 0,45 | -0,22 | -0,28 |
| Алкил (цикл.)* | 0,69 | -0,25 | -0,28 |
| CH2Ar | 1,05 | -0,29 | -0,32 |
| CH2X (X:F, Cl, Br) | 0,70 | 0,11 | -0,04 |
| CH2OH | 0,64 | -0,01 | -0,02 |
| CH2NH2 | 0,58 | -0,10 | -0,08 |
| C=C (изолир.) | 1,00 | -0,09 | -0,23 |
| C=C (сопряж.) | 1,24 | 0,02 | -0,05 |
| Ar | 1,38 | 0,36 | -0,07 |
| Cl | 1,08 | 0,18 | 0,13 |
| Br | 1,07 | 0,45 | 0,55 |
| OR | 1,22 | -1,07 | -1,21 |
| OC(O)R | 2,11 | -0,35 | -0,64 |
| CHO | 1,02 | 0,95 | 1,17 |
| COOH | 0,97 | 1,41 | 0,71 |
| COOR | 0,80 | 1,18 | 0,55 |
* — Двойная связь и алкил входят в цикл
Применение алкенов[править | править код]
Алкены являются важнейшим химическим сырьём.
Промышленное использование этилена[править | править код]
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты[34]. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн тонн в год[51] (по данным на 2005 год: 107 млн тонн[52]).
Промышленное использование пропилена[править | править код]
Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объёма[53]). Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид[34].
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год[53]. По прогнозам специалистов, потребность в пропилене в ближайшем будущем будет существенно превышать объёмы его производства, причём, ожидается, что к 2010 году объём его мирового выпуска достигнет 90 млн тонн[54].
Промышленное использование прочих алкенов[править | править код]
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона и пр[55].
Изобутилен — сырьё для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10−С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
См. также[править | править код]
- Диены
- Алканы
- Алкины
- Функциональные группы
- Крекинг
- Пиролиз
Дополнительные внешние источники[править | править код]
Общие лекции по химии алкенов[править | править код]
- Иллюстративные материалы лекций по органической химии профессора Ненайденко В. Г., лекция № 7 (Алкены. Строение, получение, реакционная способность.)
- Иллюстративные материалы лекций по органической химии профессора Ненайденко В. Г., лекция № 8 (Алкены. Реакционная способность.)
- Иллюстративные материалы лекций по органической химии профессора Ненайденко В. Г., лекция № 9 (Алкены. Реакционная способность.)
- Курц А. Л., Ливанцов М. В., Ливанцова Л. И. Алкены (Часть I). Химический факультет МГУ, 1998 год.
- Курц А. Л., Ливанцов М. В., Ливанцова Л. И. Алкены (Часть II). Химический факультет МГУ, 1999 год.
Учебная литература[править | править код]
- Нейланд О. Я. Глава II. Алкены // Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990. — С. 102—130. — ISBN 5-06-001471-1.
- Робертс Дж., Касерио М. Глава 6. Алкены. Структура, спектры и стереоизомерия. Глава 7. Алкены. Реакции двойных углерод-углеродных связей // Основы органической химии / Под редакцией академика Несмеянова А.Н.. — 2-е, дополненное. — М.: Мир, 1978. — Т. 1. — С. 171—235.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. В 4 частях. — 3-е издание. — М.: Бином. Лаборатория знаний, 2007. — Т. 1. — 568 с. — ISBN 978-5-94774-613-6.
- Травень В. Ф. Глава 5. Алкены // Органическая химия: Учебник для вузов: В 2 т / В. Ф. Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 1. — С. 237—305. — ISBN 5-94628-171-2.
Механизмы реакций с участием алкенов[править | править код]
- Марч Дж. Глава 15. Реакции присоединения к кратным связям углерод-углерод. Глава 16. Реакции присоединения к кратным связям углерод-гетероатом. // Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах / Пер. с англ., под редакцией И. П. Белецкой. — М.: Мир, 1988. — Т. 3. — С. 132—430.
- Сайкс П. Механизмы реакций в органической химии / Пер. с англ.,под редакцией В. Ф. Травеня. — 4-е изд. — М.: Химия, 1991. — 448 с. — ISBN 5-7245-0191-0.
Использование алкенов в промышленности[править | править код]
- Этиленовое производство в СНГ: реакторы и катализаторы
- Полиолефины: новые технологии и рынок
Примечания[править | править код]
- ↑ 1 2 3 4 5
Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т / В.Ф.Травень. — М.: ИКЦ «Академкнига», 2004. — Т. 1. — 727 с. — ISBN 5-94628-171-2. - ↑ 1 2 3 Мазалов Л.Н. Электронно-структурные факторы в экстракции. Журнал структурной химии. ИНХ СО РАН (17 октября 2002). Дата обращения: 24 июля 2009. Архивировано из оригинала 20 сентября 2008 года.
- ↑ Случайные открытия. Этилен. Занимательная химия. Дата обращения: 22 июля 2009. Архивировано 19 мая 2007 года.
- ↑ Открытие этилена (pdf). Открытия в органической химии и биохимии. Единая коллекция цифровых образовательных ресурсов. Дата обращения: 22 июля 2009.
- ↑ 1 2
Меншуткин Н. Очеркъ развитія химическихъ воззрҌній. — С-Петербургъ: Тип. В.Демакова, 1888. — С. 252—264. - ↑
Фигуровский Н.А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. — М.: Просвещение, 1979. — С. 102. - ↑
Соловьев Ю. И. История химии: Развитие химии с древнейших времен до конца XIX в. Пособие для учителей. — 2-е изд., перераб. — М.: Просвещение, 1983. — С. 208. - ↑ В природе существует большое количество соединений с двойными связями, например терпены или каротиноиды, однако их относят к отдельным классам соединений и в настоящей статье они не рассматриваются.
- ↑ 1 2 Вредные вещества. Непредельные углеводороды этиленового ряда (алкены). Новый справочник химика и технолога. Chemanalytica.com. Дата обращения: 22 июля 2009.
- ↑ Непредельные, или ненасыщенные, углеводороды ряда этилена (алкены). Органическая химия. Chemistry.narod.ru. Дата обращения: 22 июля 2009. Архивировано 28 мая 2013 года.
- ↑ Свойства органических соединений. Справочник. / Под. ред. А. А. Потехина. Л. Химия. — 1984. — 520 с.
- ↑ The Nobel Prize in Chemistry 1979 (англ.). Nobel Prize in Chemistry. The Official Web Site of the Nobel Foundation. Дата обращения: 25 июля 2009. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 5 6
Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 3. — 459 с. - ↑ Робертс Дж., Касерио М. Основы органической химии = Basic principles of organic chemistry / Под редакцией академика Несмеянова А.Н.. — 2-е, дополненное. — М.: Мир, 1978. — Т. 1. — С. 227—228.
- ↑ Кондакова реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 2. — С. 887—888.
- ↑ Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 2. — 504 с.
- ↑ Курц А Л., Ливанцов М.В., Ливанцова Л.И. Карбены и карбеноиды (раздел 4.7.). Алкены (часть II). Химический факультет МГУ. Дата обращения: 22 июля 2009.
- ↑ Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 1. — С. 253.
- ↑ 1 2 3 4 Ли Дж. Именные реакции. Механизмы органических реакций = Name reactions / Пер. с англ. В.М.Демьянович. — М.: БИНОМ. Лаборатория знаний, 2006. — 456 с. — ISBN 5-94774-368-X.
- ↑ 1 2 3 Курц А Л., Ливанцов М.В., Ливанцова Л.И. Химические свойства алкенов (раздел 4.). Алкены (часть II). Химический факультет МГУ. Дата обращения: 22 июля 2009.
- ↑ Макквиллин Ф. Дж. Гомогенное гидрирование в органической химии = Homogeneous hydrogenation in organic chemistry / Пер. с англ. Н.М.Лойма. — М.: Химия, 1980. — 160 с.
- ↑ Воля-Циглера реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 824—825.
- ↑ 1 2 3 4 5 Хейнс А. Методы окисления органических соединений: Алканы, алкены, алкины и арены = Methods for the oxidation of organic compounds: Alkanes, Alkenes, Alkynes and Arenes / Перевод с англ., под редакцией И.П. Белецкой. — М.: Мир, 1988. — 400 с. — ISBN 5-03-000149-2.
- ↑ Прилежаева реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 4. — С. 169.
- ↑ 1 2 3
Фальбе Ю. Синтез на основе окиси углерода / Пер. с нем. — Л., 1971. - ↑ The Nobel Prize in Chemistry 2005 (англ.). Nobel Prize in Chemistry. The Official Web Site of the Nobel Foundation. Дата обращения: 22 июля 2009. Архивировано 22 августа 2011 года.
- ↑ Механизм реакции метатезиса (jpg). Сайт журнала “Наука и жизнь”. Дата обращения: 22 июля 2009. (недоступная ссылка)
- ↑ Нобелевскую премию по химии присудили Иву Шавену, Роберту Груббсу и Ричарду Шроку. Новости. Lenta.ru (5 октября 2005). Дата обращения: 22 июля 2009.
- ↑ Метатезис в водной среде. Новости химической науки. Портал Chemport.ru (9 февраля 2008). Дата обращения: 22 июля 2009.
- ↑
Олефины // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 3. — С. 737—740. - ↑ Дегидрирование алканов (раздел 2.5.3.). Интерактивный мультимедиа учебник “Органическая химия”. Самарский ГУ, Кафедра органической, биорганической и медицинской химии. Дата обращения: 22 июля 2009. Архивировано из оригинала 28 октября 2011 года.
- ↑ Алкены и алкадиены из алканов. Нефтехимия. Chemistry.narod.ru. Дата обращения: 22 июля 2009. Архивировано из оригинала 16 октября 2009 года.
- ↑ Катализаторы дегидрирования // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 2. — С. 670—671.
- ↑ 1 2 3 4 5
Нейланд О. Я. Органическая химия: Учеб. для хим. вузов. — М.: «Высшая школа», 1990. — 750 с. — ISBN 5-06-001471-1. - ↑
Матьё Ж., Панико Р., Вейль-Рейналь Ж. Изменение и введение функций в органическом синтезе = L’amenagement fonctionnel en synthese organique / Перевод с французского С.С. Юфита. — М.: «Мир», 1980. — С. 169. - ↑
Керри Ф, Сандберг Р. Книга первая. Структура и механизмы // Углубленный курс органической химии / Пер. с англ., под редакцией проф. В.М.Потапова. — М.: Химия, 1981. — С. 54—59. - ↑ Хорнера реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 5. — С. 606—607.
- ↑ Реакция Чугаева. Именные органические реакции. Иркутский государственный университет. Химический факультет. Дата обращения: 22 июля 2009. Архивировано из оригинала 19 апреля 2011 года.
- ↑ Аммониевые соединения // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 278—280.
- ↑ 1 2 3 Марч Дж. Органическая химия. Реакции, механизмы и структура. Углубленный курс для университетов и химических вузов: в 4-х томах = Advanced organic chemistry. Reactions, Mechanisms and Structure / Пер. с англ., под редакцией И.П.Белецкой. — М.: Мир, 1988. — Т. 4. — С. 49—53.
- ↑ Реакция Бурда. Именные органические реакции. Иркутский государственный университет. Химический факультет. Дата обращения: 22 июля 2009. Архивировано из оригинала 10 апреля 2013 года.
- ↑ Бэмфорда-Стивенса реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 658.
- ↑ Дядченко В.П., Андресюк А.Н, Белоглазкина Е.К., Брусова Г.П. Использование защитных групп в синтезе. Планирование многостадийных синтезов. Химический факультет МГУ (2003). Дата обращения: 25 июля 2009.
- ↑ Перкина реакция // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 3. — С. 965—966.
- ↑ Шрайнер Р., Фьюзон Р., Кёртин Д., Моррилл Т. Идентификация органических соединений. Химический каталог. Дата обращения: 22 июля 2009.
- ↑ Вульфсон Н.С., Заикин В.Г., Микая А.И. Масс-спектрометрия органических соединений. — Химия. — М., 1986. — С. 31.
- ↑
Микая А.И., Сметанин В.И., Заикин В.Г. // Серия химическая : Сб. — Известия АН СССР, 1982. — С. 2214. - ↑
Казицына Л.А., Куплетская Н.Б. Применение УФ-, ИК- и ЯМР-спектроскопии в органической химии. — М.: Высшая школа, 1971. — С. 66—67. - ↑
Браун Д., Флойд А., Сейнзбери М. Спектроскопия органических веществ = Organic Spectroscopy / Пер. с англ. А. А. Кирюшкина. — М.: Мир, 1992. — С. 50. — ISBN 5-03-002111-6. - ↑ 1 2
Ионин Б.И., Ершов Б.А., Кольцов А.И. ЯМР-спектроскопия в органической химии / Под ред. Ершова Б.А.. — 2-е изд., перераб. — Л.: Химия, 1983. — С. 157—158. - ↑ Прогноз рынка этилена. Конъюнктура. Товары и рынки. Российский Центр внешней торговли. Дата обращения: 22 июля 2009.
- ↑ Этилен, этен. Статьи о газах. Компания “НИИ КМ”. Дата обращения: 22 июля 2009.
- ↑ 1 2 Мировой рынок пропилена. Ssa.ru. Дата обращения: 22 июля 2009.
- ↑ Метатезис олефинов: современный путь к полипропилену. Аналитический портал химической промышленности: Новые химические технологии. Дата обращения: 22 июля 2009.
- ↑ Бутены // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 638—640.
Алкены

4.5
Средняя оценка: 4.5
Всего получено оценок: 1617.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1617.
Ациклические непредельные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейший алкен – этилен (C2H4), образующий гомологический ряд.
Описание
Алкены – класс веществ органической химии. Второе название класса – олефины. Общая формула алкенов – CnH2n.
Алкены обязательно содержат одну двойную связь, которая может располагаться в любом месте молекулы. Атомы, связанные двойной связью, находятся в состоянии sp2-гибридизации, т.е. в соединении атомов участвуют одна s- и две р-орбитали. При этом одна р-орбиталь остаётся свободной.
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Номенклатура
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменён на «-ен». Названия и формулы веществ приведены в таблице алкенов.
|
Название |
Формула |
|
Этен (этилен) |
C2H4 |
|
Пропен (пропилен) |
C3H6 |
|
Бутен (бутилен) |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
|
Гептен |
C7H14 |
|
Октен |
C8H16 |
|
Нонен |
C9H18 |
|
Децен |
C10H20 |
Название может содержать две цифры. В начале названия цифра указывает на расположение заместителей (в формуле записывается в скобках). Вторая цифра, стоящая в конце названия, указывает положение двойной связи. Нумерация атомов начинается с конца, к которому ближе расположена двойная связь. Например, название «5-метилгексен-2» указывает, что к пятому атому гексена присоединён метил, а двойная связь находится между вторым и третьим атомом.
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Получение
Алкены в отличие от алканов практически не встречаются в природе. Небольшое количество этилена содержат растения. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют промышленным и лабораторным путём. В промышленности применяется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
- дегидратация спиртов в присутствии сильных кислот;
- дегидрогалогенирование – отщепление галогенводорода при нагревании;
- дегалогенирование дигалогеналканов – отщепление галогенов в присутствии цинка;
- синтез Гофмана – разложение аммониевых оснований;
- реакция Чугаева – взаимодействие спиртов с сероуглеродом и гидроксидом натрия;
- метод Виттига – взаимодействие карбонильных соединений и алкилиденфосфоранов;
- метод Коупа – разложение N-окисей третичных аминов.
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Химические свойства
Алкены – активные вещества. Они реагируют:
- с водородом:
CH3-СН2-СН=СН2 + Н2 → CH3-CH2-СН2-СН3;
- с галогенами:
СН2=СН2 + Cl2 → Cl-CH2-CH2-Cl;
- с галогеноводородами:
СН2=СН2 + HCl → CH3-CH2-Cl;
- с водой:
СН2=СН2 + H2O → CH3-CH2OH;
- с кислородом:
СН2=СН2 + 3O2 → 2CO2↑ + 2H2O.
Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Что мы узнали?
Из темы урока узнали, что такое алкены. Это класс органических веществ, содержащий одну двойную связь между атомами углерода. Названия алкенов образуются путём присоединения суффикса «-ен». В зависимости от количества атомов углерода алкены могут находиться в газообразном, жидком или твёрдом состоянии. Алкены получают искусственными путями, т.к. в природе вещества практически не встречаются. Это активные соединения, вступающие в реакции с неорганическими веществами.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Кирилл Климов
7/10
-
Ольга Данилова
9/10
-
Дмитрий Туманов
10/10
-
Александра Патрикеева
10/10
-
Софья Кузнецова
10/10
-
Юлия Самольская
9/10
-
Елизавета Малахова
10/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1617.
А какая ваша оценка?
Дисциплина: Химия
Курс 1 Специальности: Технология продукции общественного питания
Лекция №___
Тема: Этиленовые углеводороды. Алкены.
План:
-
Понятие «Алкены»
-
Электронное и пространственное строение молекулы этена
-
Гомологический ряд алкенов
-
Номенклатура и изомерия алкенов
-
Физические свойства алкенов
-
Химические свойства алкенов
-
Получение и применение алкенов
Углеводороды, содержащие в углеродной цепи одну или несколько кратных (двойных или тройных) углерод-углеродных связей, называют непредельными. Термин «непредельный» означает, что атомы углерода не до предела насыщены атомами водорода и, как следствие, склонны к реакциям присоединения с образованием соединений предельного ряда.
Aлкенами (олефиновыми, этиленовыми) называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углерод-углеродную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Электронное и пространственное строение молекулы этилена.
В молекуле этилена атомы углерода имеют иной тип гибридизации по сравнению с метаном. Гибридизации подвержены одна s – и две р – орбитали; третья р – орбиталь остается без изменения. Такое состояние атома углерода называют sр2 – гибридизацией (рис. 3.1).
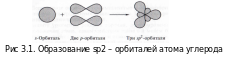
В результате у атома углерода имеются четыре орбитали: три гибридные sр2 – орбитали и одна негибридизованная р – орбиталь. На каждой из них находится по одному неспаренному электрону, за счет которых углерод образует четыре ковалентные связи. В результате взаимного отталкивания электронов орбитали стремятся расположиться в пространстве на максимальном удалении. Такое удаление орбиталей друг от друга достигается в том случае, если оси sр2-орбиталейлежат в одной плоскости под углом 1200, а ось р-орбитали будет перпендикулярна этой плоскости (рис.3.2).
Каждый атом углерода в молекуле этилена за счет перекрывания Sp2-оpбиталей образует три -связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей р-орбиталей двух атомов происходит их боковое перекрывание с образованием второй углерод-углеродной связи π-типа (рис. 3.3).
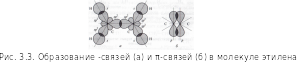
π –Связь является менее прочной и более доступной для атаки реагентов по сравнению с -связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет и ее пространственное строение (рис. 3.4). Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости π-связи. Все валентные углы 0. Длина двойной связи значительно меньше длины одинарной и составляет 0,134нм. Свободное вращение атомов углерода относительно связи С=С невозможно.

Гомологический ряд и изомерия алкенов. Этилен является первым представителем гомологического ряда этиленовых (олефиновых) углеводородов, или алкенов. Как и в случае алканов, два ближайших гомолога отличаются по составу на гомологическую разность – СН2 –.
Общая формула углеводородов гомологического ряда алкенов СnН2n. В табл. 3.1 приведены структурные формулы и названия первых четырех гомологов ряда алкенов.
Таблица 3.1
Названия и структурные формулы первых четырех гомологов ряда алкенов
|
Молекулярная формула |
Структурная формула |
Номенклатура |
|
|
рациональная |
международная |
||
|
С2Н4 |
СН2=СН2 |
Этилен |
Этен |
|
СЗН6 |
CH2=CH – СН3 |
Пропилен |
Пропен |
|
С4Н8 |
CH2=CH – СН2 – СН3 |
Бутилен |
Бутен-1 |
|
СН2=С – СНЗ |
Изобутилен |
Изобутен (2-метилпропен) |
|
|
| |
|||
|
СНЗ |
Для алкенов характерны три типа изомерии: изомерия углеродного скелета, изомерия положения двойной связи и геометрическая изомерия.
Изомерия начинается с углеводорода состава С4Н8 – бутена. При расположении двойной связи между первым и вторым углеродными атомами возможны два структурных изомера: бутен-l и 2-метилпропен. Для углеводородов, в молекулах которых двойная связь расположена в середине цепи, существуют два геометрических изомера: цис-бутен-2 и транс-бутен-2. Они отличаются взаимным расположением атомов водорода относительно линии двойной связи:
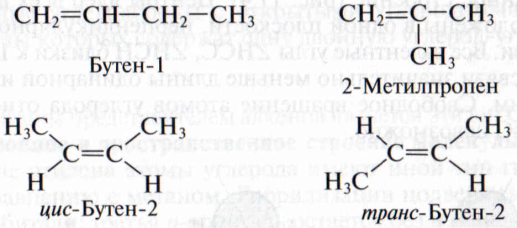
Поскольку поворот молекулы относительно двойной связи в алкенах невозможен, цuс-бутен-2 и транс-бутен-2 являются разными веществами.
Не любой алкен имеет геометрические изомеры. для этого необходимо, чтобы каждый из двух атомов углерода в состоянии sр-гибридизации имел по два разных заместителя. Например, 3-этилгексен-3 пространственных изомеров не имеет (третий углеродный атом связан с двумя одинаковыми группами), а 3-метилгексен-3 имеет. Изображение начинают с атомов углерода, связанных двойной связью, затем указывают четыре заместителя:
Следует иметь в виду, что в алкенах все атомы углерода, не связанные двойной связью, находятся в состоянии sрЗ-гибридизации.
Номенклатура алкенов. Названия алкенов строят в соответствии с правилами международной номенклатуры. Самая длинная цепь д о л ж н а с о д е р ж а т ь д в о й н у ю с в я з ь; цепь нумеруют с того конца, к которому ближе двойная связь. При расположении кратной связи в центре цепи нумерацию ведут от атома углерода, к которому ближе разветвление. Основой названия является наименование алкана с тем же числом углеродных атомов, при этом суффикс «-ан-» меняют на «-ен-». Положение и названия заместителей указывают перед основой названия, а положение двойной связи в цепи – после. Если необходимо указать тип пространственноro изомера, перед названием добавляют «цис-» или «транс-».
Приведенные правила иллюстрируют следующие примеры:

Простейшие алкены наряду с названиями согласно международной номенклатуре: этен, пропен и бутен – называют исторически сложившимися (тривиальными) названиями: этилен, пропилен, бутилен соответственно.
При отщеплении одного атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnH2n-1, простейшие из которых: винил СН2=СН – и аллил СН2 = СН – СН2
Физические свойства. При обычных условиях алкены состава С2Н4, С3Н6, С4Н8 являются газообразными веществами без цвета и запаха; углеводороды СnH2n, где n = 5 – 15 – бесцветные жидкости; при n 16 – твердые вещества. Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси.
3.2. Получение и химические свойства алкенов
В отличие от предельных углеводородов алкены встречаются в природе нечасто. Промышленные способы получения этиленовых углеводородов основаны на превращении алканов (природных источников углеводородов, главным образом нефти и природного газа) в алкены. Все лабораторные способы получения основаны на реакциях отщепления, или элиминирования. При этом от двух соседних атомов углерода отщепляются два атома или группы, и между атомами углерода возникает π-связь.
Промышленные способы получения алкенов. Основными промышленными способами получения алкенов являются крекинг и дегидрирование алканов.
1. Крекинг алканов. Главным промышленным способом получения алкенов является крекинг алканов, входящих в состав нефти и попутного нефтяного газа:
В зависимости от условий про ведения процесса различают термический и каталитический крекинг. С целью получения алкенов используют, как правило, крекинг термический, протекающий при температуре 400 – 7000С.
2. Дегидрирование алканов. Этот процесс рассматривался в подразд.2.2 как химическое свойство предельных углеводородов:
Лабораторные способы получения алкенов. В лаборатории для получения алкенов используют реакции дегидратации спиртов и дегидрогалогенирования производных предельных углеводородов.
1. Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 1800С происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода:
Реакция дегидратации – это реакция, в результате которой от молекулы органического вещества отщепляется молекула воды
2. Дегидрогалогенирование галогеналканов. Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на бром- и хлорпроизводные алканов, например:
Реакция дегидрогалогенирования – это реакция, в результате которой от молекулы органического вещества отщепляется молекула галогеноводорода.
Обратите внимание на тот факт, что во всех реакциях элиминирования углеродный скелет молекулы н е и з м е н я е т с я, происходит лишь образование кратной связи между двумя атомами углерода.
Химические свойства алкенов. По химическим свойствам алкены коренным образом отличаются от алканов. Наличие в молекуле двойной углерод-углеродной связи обусловливает характерные свойства олефинов: реакции присоединения, окисления, полимеризации.
Реакции присоединения. π-Связь в молекулах алкенов значительно менее прочная, чем
-связь. Она относительно легко разрывается, за счет освободившихся валентностей атомы углерода способны присоединять различные реагенты: водород, галогены, галогеноводороды, воду.
1. Г и д р и ро в а н и е а л к е н о в. Происходит при повышенных значениях температуры и давления в присутствии металлических катализаторов. Наиболее распространенным катализатором процессов гидрирования (равно как и обратного процесса – дегидрирования) является никель
Присоединение водорода по кратным углерод-углеродным связям называют реакцией гидрирования
2. Г а л о г е н и р о в а н и е а л к е н о в. Алкены легко присоединяют молекулы хлора и брома с разрывом двойной связи и образованием дигалогенопроизводных:
Присоединение галогенов по кратным углерод-углеродным связям называют реакцией галогенирования.
Если газообразный этилен пропускать через раствор брома в воде то желтая окраска бромной воды постепенно исчезает. Обесцвечивание бромной воды является качественной реакцией на непредельные соединения, в том числе на алкены.
3. Г и д р о г а л о г е н и р о в а н и е а л к е н о в. При взаимодействии алкенов с хлороводородом или бромоводородом образуются галогеналканы:
Присоединение галогеноводородов по кратным углерод-углеродным связям называют реакцией гидрогалогенирования.
При присоединении галогеноводородов к гомологам этилена строение образующегося продукта в ряде случаев определяется правилом Марковникова:
При присоединении молекул типа их НХ (Х= ОН, галогены и т.п.) к алкенам водород преимущественно присоединяется к наиболее гидрогенизированиому атому углерода двойной связи
Наиболее гидрогенизированный – это тот атом углерода двойной связи, который содержит большее число атомов водорода. Например, при взаимодействии пропена с бромоводородом образуется 2-бромпропан:
Правило Марковникова отражает распределение электронной плотности в молекулах алкенов. π-Связь в молекулах этиленовых углеводородов очень чувствительна к влиянию заместителей sр2-гибридных атомов углерода. Если заместитель при двойной связи обладает электронодонорным эффектом (например, алкильный радикал), т. е. подает на связанный с ним атом электронную пару, то электронная плотность двойной связи в ответ смещается к наиболее гидрогенизированному атому углерода.
Так, алкены с несимметричным расположением двойной связи имеют следующее распределение электронной плотности:
Молекула бромоводорода также полярная, причем атом водорода как менее электроотрицательного, чем бром, элемента обладает частичным положительным зарядом:
По законам электростатического взаимодействия атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
4. Г и д р а т а ц и я а л к е н о в. При взаимодействии алкенов с водой в присутствии серной или фосфорной кислот образуются спирты. Кислота в данном случае выполняет роль катализатора. Строение образующегося спирта также определяется правилом Марковникова:
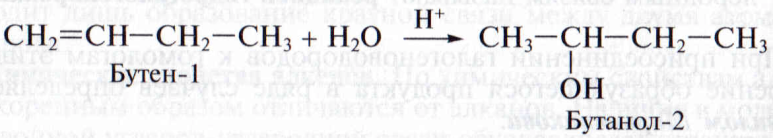
Присоединение воды по кратным углерод-углеродным связям называют реакцией гидратации.
Реакции окисления.
1. Г о р е н и е. Как и любые другие углеводороды, алкены горят с образованием углекислого газа и воды:
С2Н4 + 3О2 2СО2 + 2Н2О
За счет большей массовой доли углерода в алкенах по сравнению с алканами пламя этиленовых углеводородов имеет красноватый оттенок, оно более светящееся.
2. О к и с л е н и е п е р м а н г а н а т о м к а л и я. Пропускание газообразного алкена через водный раствор перманганата калия при комнатной температуре приводит к обесцвечиванию раствора:
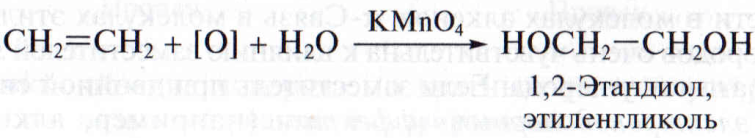
В результате реакции двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе. Соединения такого класса называют гликолями. Эта реакция также является качественной на двойную углерод-углеродную связь.
Реакция полимеризации. При повышенных значениях температуры и давления в присутствии катализаторов двойные связи молекул алкенов разрываются и атомы углерода соединяются друг с другом с образованием длинных цепочек:
Контрольные вопросы:
-
Какие углеводороды называют непредельными? Охарактеризуйте класс органических соединений алкены. Относятся ли этиленовые углеводороды к непредельным соединениям?
-
Какие типы изомерии характерны для алкенов? Приведите примеры изомеров различного типа и назовите эти вещества.
-
Напишите структурные формулы следующих углеводородов: а) 2-метилбутен-2; б) 2-метилпропен; в) 2,3-диметилгексен-3; г) 2,5,5 -триметилгексен-2; д) цис-4-метилпентен-2.
Какие из них имеют геометрические изомеры? Напишите их структурные формулы и назовите.
-
10л паров этиленового углеводорода при нормальных условиях имеют массу 18,75г. Определите его формулу и плотность по воздуху.
-
Напишите реакции получения следующих алкенов: а) бутена-2; б) 3-метилпентена-1; в) 2-метилбутена-2 – дегидратацией и дегидрогалогенированием соответствующих исходных соединений.
-
Сформулируйте правило Марковникова. Приведите примеры реакций гидрогалогенирования и реакций гидратации, иллюстрирующие это правило.
-
С помощью каких реакций можно отличить алкены от алканов? Напишите уравнения этих реакций для пропена.
-
Какова структурная формула этиленового углеводорода, если 11,2г его при взаимодействии с избытком HBr превращаются в 27,4г бромалкана с положением галогена у третичного атома углерода?
-
Сколько граммов 1,2-дихлорэтана можно получить взаимодействием этилена с хлором, полученным при действии 200г хлороводородной кислоты с массовой долей НСl 36,5% на избыток оксида марганца(IV)?
Используемая литература:
-
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
-
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
3