Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 1 февраля 2022 года; проверки требуют 9 правок.
| Сульфат натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
сульфат натрия, натрий сернокислый |
| Традиционные названия | глауберова соль, тенардит |
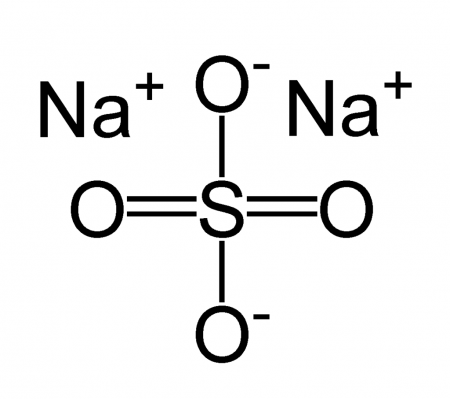
| Хим. формула | Na2SO4 |
| Рац. формула | Na2SO4 |
| Физические свойства | |
| Состояние | белые гигроскопичные кристаллы |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 883 °C |
| Энтальпия | |
| • образования | −1387,9 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Классификация | |
| Рег. номер CAS | 7757-82-6 |
| PubChem | 24436 |
| Рег. номер EINECS | 231-820-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[Na+].[Na+] |
| InChI |
InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 PMZURENOXWZQFD-UHFFFAOYSA-L |
| Кодекс Алиментариус | E514(i) и E514 |
| RTECS | WE1650000 |
| ChEBI | 32149 |
| ChemSpider | 22844 |
| Безопасность | |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты. Это бесцветные кристаллы, хорошо растворяющиеся в воде, образует кристаллогидраты, самый известный из них — декагидрат, получивший традиционное название — «глауберова соль». Обладает низкой токсичностью. Не путать с питьевой содой — гидрокарбонатом натрия, кислой натриевой солью угольной кислоты.
Свойства[править | править код]
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе[править | править код]
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
- 2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение[править | править код]
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Применение[править | править код]
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тысяч тонн сульфата натрия.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении целлюлозы сульфатным методом, а также в текстильной, кожевенной промышленности и в цветной металлургии.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешевизна и легкость фильтрации.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Водные растворы сульфата натрия используются для лечения отравления растворимыми солями бария.
Зарегистрирован в качестве пищевой добавки E514.
Регулятор кислотности, используется как буферная добавка поддерживающая pH на определённом уровне[1].
Физиологическое действие и указания по технике безопасности[править | править код]
Сульфат натрия Na2SO4 пожаро- и взрывобезопасен. По степени воздействия на организм человека натрий сернокислый относится к IV классу опасности (малоопасные вещества) согласно ГОСТ 12.1.007-76. По токсикологии NFPA 704 сульфату натрия присвоена низшая токсичность.
См. также[править | править код]
- Глауберова соль
Примечания[править | править код]
- ↑ Сульфаты натрия. Дата обращения: 2 февраля 2019. Архивировано 2 февраля 2019 года.
Литература[править | править код]
- Реми Г. Курс неорганической химии. Т.2. — М., 1966
Ссылки[править | править код]
Средняя соль серной кислоты H2SO4 и гидроксида натрия NaOH.
Химическая формула
Na2SO4
Получение
Природные источники
Сульфат натрия встречается в виде минерала тенардита, а кристаллогидрат Na2SO4.10H2O – в виде мирабилита или глауберовой соли.
Лабораторные методы получения
Сульфат натрия получают взаимодействием серной кислоты с гидроксидом или карбонатом натрия:
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
H2SO4 + Na2CO3 =Na2SO4 + H2O + CO2↑.
Получение сульфата натрия в промышленности
В промышленности сульфат натрия получали из хлорида натрия и серной кислоты:
H2SO4 + 2NaCl =Na2SO4 + 2HCl↑,
но сейчас это не имеет смысла – достаточно природных источников.
Свойства сульфата натрия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см3 |
| Температура плавления | 883°С |
| Cтандартная мольная энтальпия образования при 298К ΔH°298, кДж/моль | −1387,9 (т)2 |
| Стандартная мольная энтропия при 298 К S°298, Дж/(моль•К) | 149,58 (т) |
| Стандартная мольная теплоемкость при 298 К Cp298, Дж/(моль•К) | 127,3 |
| Растворимость в воде, г/100 г | при 0°С — 4,5 при 20°С — 19,2 при 32,4°С — 49,8 при 100°С — 42,3 |
Химические свойства
При растворении в воде сульфат натрия диссоциирует на ионы:
Na2SO4↔ 2Na++ SO42-.
Раствор имеет нейтральную реакцию.
При взаимодействии с кислотами образует кислые соли:
Na2SO4 + HСl = NaHSO4 + NaCl.
Вступает в реакции обмена с образованием нерастворимых сульфатов:
Na2SO4 + CaCl2 = 2NaCl + CaSO4↓,
Na2SO4 + SrCl2 = 2NaCl + SrSO4↓,
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓.
Применение
Сульфат натрия используют как компонент шихты в производстве стекла; используется при сульфатной варке целлюлозы, при крашении хлопчато-бумажных тканей.
Применяется он также и в химической промышленности как сырье для получения силикатов Na, Na2S, H2SO4, (NH4)2SO4, соды и др.
В медицине сульфат натрия изредка применяют как слабительное.
В пищевой промышленности он известен как пищевая добавка Е514. Сульфат натрия используют в качестве регулятора кислотности.
Относится к малоопасным веществам (4 класс опасности), но при передозировке в пищевых продуктов приводит к расстройствам пищеварения.
Пример решения задачи с сульфатом натрия
Назовите 5 способов получения сульфата натрия.
Решение
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
H2SO4 + Na2CO3 =Na2SO4 + H2O + CO2↑;
SO3 + Na2O = Na2SO4;
NaHSO4 + NaOH = Na2S04 + H20;
H2SO4 + 2NaHCO3 =Na2SO4 + 2H2O + 2CO2↑.
Тест по теме «Сульфат натрия»
Физические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + H2O
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
Na2S + 2O2 = Na2SO4
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Na2S + 4H2O2 = Na2SO4 + 4H2O
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат натрия образует сульфат бария и хлорид натрия:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами:
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
Na2SO4 + 2F2 = 2NaF + SO2F2 + O2
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
Na2SO4 + 4H2 = Na2S + 4H2O
2. Сульфат натрия вступает в реакцию со многими сложными веществами:
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Na2SO4 + H2SO4 = 2NaHSO4
2.3. Сульфат натрия реагирует с оксидом серы (VI). Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
Na2SO4 + SO3 = Na2S2O7
2.4. Сульфат натрия взаимодействует с хлоридом бария. При этом образуются хлорид натрия и сульфат бария:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Как получить сульфат натрия
Сульфат натрия (другое название – натрий сернокислый) имеет химическую формулу Na2SO4. Представляет собою бесцветное кристаллическое вещество. Широко распространен в природе, главным образом, в виде «глауберовой соли» – кристаллогидрата, в котором одна молекула натрия сернокислого удерживает десять молекул воды. Пожаро- и взрывобезопасен. Как получают сульфат натрия?

Инструкция
Поскольку сульфат натрия – это соль, образованная сильным основанием NaOH и сильной кислотой H2SO4, ее раствор имеет показатель рН, близкий к нейтральному. То есть индикаторы типа лакмуса и фенолфталеина в растворе этой соли не меняют цвет.
Основное количество этого вещества добывается открытым способом, в местах, где имеются большие залежи глауберовой соли и других подобных минералов.
Также существует промышленный способ – взаимодействие серной кислоты с хлоридом натрия при высоких температурах (порядка 550 градусов). Реакция идет следующим образом:
2NaCl + H2SO4 = Na2SO4 + 2HCl
Натрий сернокислый также может быть получен при переработке т.н. «фосфогипса» – отходов производства фосфорных удобрений, содержащих сульфат кальция – CaSO4.
В лабораторных условиях, можно получить сульфат натрия, воздействуя серной кислотой на соду кальцинированную (натрий углекислый). Реакция идет до конца, поскольку в результате образуется слабая угольная кислота, которая сразу же разлагается на воду и углекислый газ:
H2SO4 + Na2CO3 = Na2SO4 + H2CO3
H2CO3 = H2O + CO2
Можно получить сульфат натрия также с помощью реакции нейтрализации (взаимодействием едкого натра с серной кислотой):
2NaOH + H2SO4 = Na2SO4 + 2H2O
Полезный совет
Сульфат натрия используется во многих отраслях промышленности. Главным образом, при производстве моющих средств (как один из компонентов), а также при производстве стекла. Натрий сернокислый также находит применение в целлюлозно-бумажной промышленности, при производстве текстиля, обработке кожи и т.д. В лабораторном деле сульфат натрия широко используется для осушения органических растворителей. Может применяться также в пищевой промышленности, как добавка, код по международной номенклатуре – Е514. До сих пор находит ограниченное применение в медицине и ветеринарии.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
| Сульфат натрия | |
|---|---|
 |
|
| Систематическое наименование |
сульфат натрия, натрий сернокислый |
| Хим. формула | Na2SO4 |
| Состояние | белые гигроскопичные кристаллы |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Т. плав. | 883 °C |
| Энтальпия образования | −1387,9 кДж/моль |
| Растворимость в воде | 19,2 (20 °C), 42,3 (100 °C) |
| ГОСТ | ГОСТ 4166-76 ГОСТ 21458-75 ГОСТ 6318-77 |
| Рег. номер CAS | 7757-82-6 |
| PubChem | 24436 |
| Рег. номер EINECS | 231-820-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[Na+].[Na+] |
| InChI |
1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 PMZURENOXWZQFD-UHFFFAOYSA-L |
| Кодекс Алиментариус | E514(i) |
| RTECS | WE1650000 |
| ChEBI | 32149 |
| ChemSpider | 22844 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Свойства
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
Нахождение в природе
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
- 2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Получение
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
- 2NaCl + H2SO4 ⟶ Na2SO4 + 2HCl
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
Сульфат натрия в биг-бэгах
Применение
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тыс. тонн сульфата натрия.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении целлюлозы сульфатным методом, а также в текстильной, кожевенной промышленности и в цветной металлургии.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Зарегистрирован в качестве пищевой добавки E514.
Регулятор кислотности, используется как буферная добавка поддерживающая pH на определенном уровне.