Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45o к соответствующим осям.

- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
![]()
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
![]()
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
![]()
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
![]()
![]()
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
Ответ: Электронная конфигурация 2s22p5. Главное квантовое число для всех электронов равно 2. Для s электронов l = 0, для р-электронов l = 1.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 |
0 |
0 | — 1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | — 1 | +1/2 |
| 6 | 2 | 1 | 1 | — 1/2 |
| 7 | 2 | 1 | 0 |
— 1/2 |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
II
4.
Отказ от классического представления
об атомах произошел в 1897 г., когда Дж.
Томсоном
был открыт электрон
– отрицательно заряженная частица,
входящая в состав всех атомов.
Поскольку электрон имеет отрицательный
заряд, а атом в целом электронейтрален,
было сделано предположение, что в нем
должна быть ещё и положительная частица.
С помощью Опыта
Э. Резерфорда,
было открыто атомное
ядро – положительно заряженная
микрочастица, которая намного меньше
атома, но в ней почти полностью
сосредоточена его масса.
в
1900
году М. Планкпредположил, что излучение
энергии (Е) в этом случае происходит не
непрерывно, а определенными порциями
– квантами.
Математически представил это в виде
уравнения (уравнение Планка):
E
= h∙,
(1.1)
где
– частота света, h
– универсальная постоянная (постоянная
Планка), характеризующая меру дискретной
порции энергии, которой обмениваются
вещество и излучение.
Так,
в 1905
г. А. Эйнштейн ввел понятие кванта света
и использовал его для объяснения
фотоэффекта. При этом было доказано,
что свет обладает одновременно и
корпускулярными, и волновыми свойствами.
Так появилось понятие
о корпускулярно-волновом дуализме,
позже распространенном на весь микромир.
Это был революционный шаг – признать,
что свет распространяется как волна,
но излучает и поглощает как частица.
В
1913 г. Н. Бор применил идею кванта для
решения вопроса о строении атома,
уточнив планетарную модель атома
Резерфорда. Бор показал, что система
атома существует на основе электромагнитных
сил,
а не гравитационных, как считал Резерфорд.
Также в
каждом атоме существует несколько
стационарных орбит электронов, двигаясь
по которым, они не излучают энергии.
Лишь при переходе электрона из одного
стационарного состояния в другое атом
излучает или поглощает энергию.
электрон,
тоже обладает волновой природой.
Поэтому электрон – не шарик, не точка,
он обладает внутренней структурой,
которая до сих пор не известна. В
действительности электроны как бы
«размазаны» по атому, образуя электронное
облако.
Следующий
шаг в создании новой теории был сделан
Луи
де Бройлем, выдвинувшим в 1924 г. гипотезу
о волновых свойствах материи.
Он довел идею кванта до логического
конца и утверждал, что волновые свойства
присущи не только квантам света и
электронам, но и протонам, атомам,
молекулам и даже макроскопическим
телам. Длина волны определяется формулой
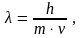
(1.2)
где
– частота света, h
– универсальная постоянная (постоянная
Планка), характеризующая меру дискретной
порции энергии, которой обмениваются
вещество и излучение,
– длина волны света, m
– масса вещества.
5.
Для
характеристики состоянияэлектрона
была предложена комплексная
волновая функция.
Зная её можно вычислить вероятность
обнаружения определенного значения
не только координаты, но и любой другой
физической величины. Эволюция состояния
системы определяется именно с помощью
уравнения Шрёдингера.
2
+ 2m0/ħ2
∙ (E
– U)
∙
= 0 или Ĥ
= Е
, (1.3)
где
– комплексная волновая функция, Ĥ –
квантово-механический оператор полной
энергии Гамильтона, который учитывает
движение электрона в пространстве, Е
– энергия электрона в атоме.
Для
того, чтобы определить энергетическое
состояние электрона в атоме решают
уравнение Шрёдингера, которое кроме
массы электрона, его заряда энергии
кинетического движения входит некоторая
функция
(пси), которая характеризует волновые
свойства электрона. Математическое
решение этого уравнения, представлено
в виде функции, зависящей от 4 квантовых
чисел, которые и характеризуют положение
электрона в около ядерном пространстве.
n
– главное квантовое число,
оно показывает энергию электрона,
находящегося на данном энергетическом
уровне. Принимает значения 1, 2, 3, 4…7.
Чем ближе к ядру уровень, тем меньше
энергия уровня.
l
– орбитальное квантовое число.
Оно показывает форму электронного
облака. Принимает значения от 0 до n
– 1.
Если
l=0,
то это s
облачко, оно имеет форму сферы;
если
l=1,
то это р облачко, оно имеет форму гантели;
если
l=2,
то это d
облачко, оно имеет форму сдвоенной
гантели;
если
l=3,
то это fоблачко,
оно имеет форму сложного лепестка.
В
нормальном состоянии у электрона нет
других форм облаков.
ml
– магнитное квантовое число,
показывает ориентацию электронных
облаков около ядерного пространства.
Принимают значения от – l,
…0… + l.
Если
l=0,
то ml
= 0;
еслиl=1,
то ml
= −1, 0, 1;
еслиl=2,
то ml
= −2, −1, 0, 1, 2;
еслиl=3,
то ml
= −3, −2, −1, 0, 1, 2, 3.
ms
– спиновое квантовое число,
характеризует собственный момент
движения электрона. Принимает значения:
+ ½ и − ½.
7.Типы атомных орбиталей.
Для
элементов 1-го периода (Н, He) характерна
одна АО – 1s. (1 клеточка)
Р(
3 клеточки) у d(
5 клеточек)
В
элементах 2-го периода электроны занимают
пять АО на двух энергетических уровнях:
первый уровень 1s; второй уровень – 2s,
2px, 2py, 2pz. (цифры обозначают номер
энергетического уровня, буквы – форму
орбитали).
Состояние
электрона в атоме полностью описывают
квантовые числа.
8. Распределение электронов в атоме
От
распределения электронов в атоме
зависят химические свойства элементов.
По электронным формулам можно определить
свойства элемента. Распределяются
электроны в атоме согласно четырем
принципам:
∙ принцип
наименьшей энергии;
∙ правило
Клечковского;
∙ принцип
Паули;
∙ правило
Гунда.
Принцип
наименьшей энергии. Любая
система, в том числе и микрочастицы, в
том числе и электроны, стремятся занять
положение, более энергетически выгодное,
т.е. с наименьшей энергией. Сначала
заполняется 1-й энергетический уровень,
затем 2-й энергетический уровень и т.д.
9.
Последовательность заполнения
электронами орбиталей
осуществляется в соответствии с
принципом минимальной энергии, согласно
которому электроны заполняют орбитали
в порядке повышения уровня энергии
орбиталей. Очередность орбиталей по
энергии определяется правилом
Клечковского: увеличение энергии и
соответственно заполнение орбиталей
происходит в порядке возрастания суммы
(n+l), а при равной сумме (n+l) – в порядке
возрастания n.
10.
Правило Клечковского. Увеличение
энергии и соответственно заполнение
орбиталей происходит в порядке
возрастания суммы квантовых чисел n
+ l,
а при равной сумме n
+ l
в порядке возрастания числа n.
Соответственно этому правилу подоболочки
выстраиваются в следующий ряд:
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
5p
6s
5d …
11.
Принцип Паули гласит,
что в атоме не может быть двух одинаковых
электронов, со всеми одинаковыми
четырьмя квантовыми числами, хотя бы
одним квантовым числом они должны
отличаться.
Правило
Гунда. Электроны
на эквивалентных орбиталях располагаются
так, чтобы суммарный спин их был
максимальный.Орбиталь обозначаем ,
а спин электрона:
(+1/2), (-1/2).
Количество
электронов на данном уровне можно
определить по формуле 2 n2,
но эта формула справедлива только до
4-го энергетического уровня, на остальных
уровнях больше 32 ē быть не может.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Квантовые числа электронов
Существует четыре квантовых числа электронов и о каждом из них – по порядку.
Главное квантовое число N характеризует энергетический уровень, другими словами это размер энергетического уровня,
чем больше число N – тем больше радиус, на котором находятся электроны.
Орбитальное квантовое число L обозначает форму той области, в которой может находится электрон, число L имеет
значения s (L=0),p (L=1), d (L=2),f (L=3) и также называется энергетической оболочкой или энергетическим подуровнем.
На каждой орбитали находится «2·L + 1» орбиталей, магнитное квантовое число Ml
обозначает орбиталь, на котором находится электрон. Ml может принимать значения ±L.
И последнее квантовое число – спин, он принимает два значения: +½ и -½, обозначающий соответственно
прямое и обратное вращение электрона.
Квантовые числа элемента, или квантовые числа электрона – это четыре квантовых числа, характеризующих состояние
внешнего электрона в атоме, ниже дана таблица квантовых чисел электронов любого атома:
1
H
водород
1s 1
N = 1 L = 0 Ml = 0 Ms = +½
2
He
гелий
1s 2
N = 1 L = 0 Ml = 0 Ms = -½
3
Li
литий
2s 1
N = 2 L = 0 Ml = 0 Ms = +½
4
Be
бериллий
2s 2
N = 2 L = 0 Ml = 0 Ms = -½
5
B
бор
2p 1
N = 2 L = 1 Ml = -1 Ms = +½
6
C
углерод
2p 2
N = 2 L = 1 Ml = 0 Ms = +½
7
N
азот
2p 3
N = 2 L = 1 Ml = 1 Ms = +½
8
O
кислород
2p 4
N = 2 L = 1 Ml = -1 Ms = -½
9
F
фтор
2p 5
N = 2 L = 1 Ml = 0 Ms = -½
10
Ne
неон
2p 6
N = 2 L = 1 Ml = 1 Ms = -½
11
Na
натрий
3s 1
N = 3 L = 0 Ml = 0 Ms = +½
12
Mg
магний
3s 2
N = 3 L = 0 Ml = 0 Ms = -½
13
Al
алюминий
3p 1
N = 3 L = 1 Ml = -1 Ms = +½
14
Si
кремний
3p 2
N = 3 L = 1 Ml = 0 Ms = +½
15
P
фосфор
3p 3
N = 3 L = 1 Ml = 1 Ms = +½
16
S
сера
3p 4
N = 3 L = 1 Ml = -1 Ms = -½
17
Cl
хлор
3p 5
N = 3 L = 1 Ml = 0 Ms = -½
18
Ar
аргон
3p 6
N = 3 L = 1 Ml = 1 Ms = -½
19
K
калий
4s 1
N = 4 L = 0 Ml = 0 Ms = +½
20
Ca
кальций
4s 2
N = 4 L = 0 Ml = 0 Ms = -½
21
Sc
скандий
3d 1
N = 3 L = 2 Ml = -2 Ms = +½
22
Ti
титан
3d 2
N = 3 L = 2 Ml = -1 Ms = +½
23
Vd
ванадий
3d 3
N = 3 L = 2 Ml = 0 Ms = +½
24
Cr
хром
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
25
Mn
марганец
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
26
Fe
железо
3d 6
N = 3 L = 2 Ml = -2 Ms = -½
27
Co
кобальт
3d 7
N = 3 L = 2 Ml = -1 Ms = -½
28
Ni
никель
3d 8
N = 3 L = 2 Ml = 0 Ms = -½
29
Cu
медь
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
30
Zn
цинк
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
31
Ga
галлий
4p 1
N = 4 L = 1 Ml = -1 Ms = +½
32
Ge
германий
4p 2
N = 4 L = 1 Ml = 0 Ms = +½
33
As
мышьяк
4p 3
N = 4 L = 1 Ml = 1 Ms = +½
34
Se
селен
4p 4
N = 4 L = 1 Ml = -1 Ms = -½
35
Br
бром
4p 5
N = 4 L = 1 Ml = 0 Ms = -½
36
Kr
криптон
4p 6
N = 4 L = 1 Ml = 1 Ms = -½
37
Rb
рубидий
5s 1
N = 5 L = 0 Ml = 0 Ms = +½
38
Sr
стронций
5s 2
N = 5 L = 0 Ml = 0 Ms = -½
39
Y
иттрий
4d 1
N = 4 L = 2 Ml = -2 Ms = +½
40
Zr
цирконий
4d 2
N = 4 L = 2 Ml = -1 Ms = +½
41
Nb
ниобий
4d 4
N = 4 L = 2 Ml = 1 Ms = +½
42
Mo
молибден
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
43
Tc
технеций
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
44
Ru
рутений
4d 7
N = 4 L = 2 Ml = -1 Ms = -½
45
Rh
родий
4d 8
N = 4 L = 2 Ml = 0 Ms = -½
46
Pd
палладий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
47
Ag
серебро
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
48
Cd
кадмий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
49
In
индий
5p 1
N = 5 L = 1 Ml = -1 Ms = +½
50
Sn
олово
5p 2
N = 5 L = 1 Ml = 0 Ms = +½
51
Sb
сурьма
5p 3
N = 5 L = 1 Ml = 1 Ms = +½
52
Te
теллур
5p 4
N = 5 L = 1 Ml = -1 Ms = -½
53
I
йод
5p 5
N = 5 L = 1 Ml = 0 Ms = -½
54
Xe
ксенон
5p 6
N = 5 L = 1 Ml = 1 Ms = -½
55
Cs
цезий
6s 1
N = 6 L = 0 Ml = 0 Ms = +½
56
Ba
барий
6s 2
N = 6 L = 0 Ml = 0 Ms = -½
57
La
лантан
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
58
Ce
церий
4f 2
N = 4 L = 3 Ml = -2 Ms = +½
59
Pr
празеодим
4f 3
N = 4 L = 3 Ml = -1 Ms = +½
60
Nd
неодим
4f 4
N = 4 L = 3 Ml = 0 Ms = +½
61
Pm
прометий
4f 5
N = 4 L = 3 Ml = 1 Ms = +½
62
Sm
самарий
4f 6
N = 4 L = 3 Ml = 2 Ms = +½
63
Eu
европий
4f 7
N = 4 L = 3 Ml = 3 Ms = +½
64
Gd
гадолиний
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
65
Tb
тербий
4f 9
N = 4 L = 3 Ml = -2 Ms = -½
66
Dy
диспрозий
4f 10
N = 4 L = 3 Ml = -1 Ms = -½
67
Ho
гольмий
4f 11
N = 4 L = 3 Ml = 0 Ms = -½
68
Er
эрбий
4f 12
N = 4 L = 3 Ml = 1 Ms = -½
69
Tm
тулий
4f 13
N = 4 L = 3 Ml = 2 Ms = -½
70
Yb
иттербий
4f 14
N = 4 L = 3 Ml = 3 Ms = -½
71
Lu
лютеций
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
72
Hf
гафний
5d 2
N = 5 L = 2 Ml = -1 Ms = +½
73
Ta
тантал
5d 3
N = 5 L = 2 Ml = 0 Ms = +½
74
W
вольфрам
5d 4
N = 5 L = 2 Ml = 1 Ms = +½
75
Re
рений
5d 5
N = 5 L = 2 Ml = 2 Ms = +½
76
Os
осмий
5d 6
N = 5 L = 2 Ml = -2 Ms = -½
77
Ir
иридий
5d 7
N = 5 L = 2 Ml = -1 Ms = -½
78
Pt
платина
5d 9
N = 5 L = 2 Ml = 1 Ms = -½
79
Au
золото
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
80
Hg
ртуть
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
81
Tl
таллий
6p 1
N = 6 L = 1 Ml = -1 Ms = +½
82
Pb
свинец
6p 2
N = 6 L = 1 Ml = 0 Ms = +½
83
Bi
висмут
6p 3
N = 6 L = 1 Ml = 1 Ms = +½
84
Po
полоний
6p 4
N = 6 L = 1 Ml = -1 Ms = -½
85
At
астат
6p 5
N = 6 L = 1 Ml = 0 Ms = -½
86
Rn
радон
6p 6
N = 6 L = 1 Ml = 1 Ms = -½
87
Fr
франций
7s 1
N = 7 L = 0 Ml = 0 Ms = +½
88
Ra
радий
7s 2
N = 7 L = 0 Ml = 0 Ms = -½
89
Ac
актиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
90
Th
торий
7d 2
N = 7 L = 2 Ml = -1 Ms = +½
91
Pa
протактиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
92
U
уран
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
93
Np
нептуний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
94
Pu
плутоний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
95
Am
америций
5f 7
N = 5 L = 3 Ml = 3 Ms = +½
96
Cm
кюрий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
97
Bk
берклий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
98
Cf
калифорний
5f 10
N = 5 L = 3 Ml = -1 Ms = -½
99
Es
эйнштейний
5f 11
N = 5 L = 3 Ml = 0 Ms = -½
100
Fm
фермий
5f 12
N = 5 L = 3 Ml = 1 Ms = -½
101
Md
менделеевий
5f 13
N = 5 L = 3 Ml = 2 Ms = -½
102
No
нобелий
5f 14
N = 5 L = 3 Ml = 3 Ms = -½
103
Lr
лоуренсий
6d 1
N = 6 L = 2 Ml = -2 Ms = +½
104
Rf
резерфордий
6d 2
N = 6 L = 2 Ml = -1 Ms = +½
105
Db
дубний
6d 3
N = 6 L = 2 Ml = 0 Ms = +½
106
Sg
сиборгий
6d 4
N = 6 L = 2 Ml = 1 Ms = +½
107
Bh
борий
6d 5
N = 6 L = 2 Ml = 2 Ms = +½
108
Hs
хассий
6d 6
N = 6 L = 2 Ml = -2 Ms = -½
109
Mt
мейтнерий
6d 7
N = 6 L = 2 Ml = -1 Ms = -½
110
Ds
дармштадтий
6d 8
N = 6 L = 2 Ml = 0 Ms = -½
111
Rg
рентгений
6d 9
N = 6 L = 2 Ml = 1 Ms = -½
112
Cn
коперниций
6d 10
N = 6 L = 2 Ml = 2 Ms = -½
113
Nh
нихоний
7p 1
N = 7 L = 1 Ml = -1 Ms = +½
114
Fl
флеровий
7p 2
N = 7 L = 1 Ml = 0 Ms = +½
115
Mc
московий
7p 3
N = 7 L = 1 Ml = 1 Ms = +½
116
Lv
ливерморий
7p 4
N = 7 L = 1 Ml = -1 Ms = -½
117
Ts
теннесcин
7p 5
N = 7 L = 1 Ml = 0 Ms = -½
118
Og
оганесон
7p 6
N = 7 L = 1 Ml = 1 Ms = -½
Электронная конфигурация атомов химических элементов
Согласно атомной модели Нильса Бора, протоны и нейтроны атома находятся в ядре, а электроны – вокруг него. Хотя мы не можем знать, где именно находится электрон, есть области, где он, скорее всего, может быть обнаружен, – атомные орбитали. И как мы можем определить эти орбитали? Очень просто, используя квантовые числа.

Содержание
- 1 Какие квантовые числа?
- 2 Как получаются квантовые числа
- 2.1 Электронная конфигурация
- 2.2 Исключения в электронной конфигурации
- 2.3 Как получить квантовые числа
- 3 Упражнения и примеры
Какие квантовые числа?
Есть 4 квантовых числа. Три из них дают нам информацию о том, где находится электрон определенного атома, то есть они дают нам информацию об орбитали. С другой стороны, четвертое квантовое число говорит нам не о том, где находится электрон, а о том, как это сделать. Вы все еще не очень понимаете это? Действуй!
- Главное квантовое число (п). Это последний энергетический уровень, который необходимо заполнить, и он указывает размер орбитали и, следовательно, расстояние между ядром и электроном. Почему? Очень просто. Чем больше орбиталь, тем дальше электрон может быть от ядра атома.
- Азимутальное или вторичное квантовое число (л). Укажите форму орбиты.
- Магнитное квантовое число (м). Указывает ориентацию орбиты.
- Спиновое квантовое число (s). Скажите, в какую сторону вращается электрон.
Легко, правда? Пойдем с важным!
Как получаются квантовые числа
Чтобы получить квантовые числа, вам просто нужно выполнить 2 простых шага:
- Напишите электронную конфигурацию.
- Получите квантовые числа от дифференциального электрона (последнего, заполняющего орбиталь).
Электронная конфигурация
Начнем с шага 1, запишем электронную конфигурацию. Как? Есть два способа сделать это, давайте перейдем к делу!
Диаграмма Меллера
Этот метод указывает порядок заполнения орбиталей с помощью следующего рисунка:

Эта диаграмма подчиняется принципу Ауфбау, который утверждает, что орбитали заполняются в порядке возрастания энергии, то есть орбиталь с наименьшей энергией заполняется раньше.
Чтобы узнать, какая орбиталь имеет больше энергии, выполняется операция n + l. Если эта операция для двух разных атомов приводит к одному и тому же числу, тот, у которого номер n больше, будет иметь больше энергии. Другими словами, в случае ничьей первым заполняется тот, у кого наименьший номер n. Посмотрим на это на примере:
4р: п + 4 -> 1 + 5 = XNUMX
5с: n + l -> 5 + 0 = 5
Поскольку в правиле n + l есть ничья, оно заполняет 4p раньше, потому что его номер n меньше.
Модель ядра
Чтобы получить электронную конфигурацию, соответствующую этой модели, вы должны очень хорошо знать таблицу Менделеева. Если у нас есть атомный номер и положение элемента в таблице, это совсем несложно!

Этот метод считается упрощенным, поскольку он позволяет не записывать полную электронную конфигурацию. Таким образом, мы можем записать название благородного газа выше в скобках, а затем путь от этого благородного газа до рассматриваемого элемента. Посмотрим на пример:Таким образом, мы запишем траекторию с учетом номера периода (строки периодической таблицы) и «зоны» и, как только электронная конфигурация будет написана, мы извлечем квантовые числа.
Люминофор (P) будет записан из предыдущего благородного газа, то есть неона:
P -> [Ne] 3 с23p3
Конечно, с этим методом нужно быть осторожным, так как зоны d и f – особые зоны. Во время путешествия в зону d мы будем ставить не номер периода (строки), а номер периода минус один. То же самое и с областью F, мы будем ставить не номер периода, а номер периода минус два. Вы поймете это лучше на нескольких примерах:
Nb -> [Kr] 5s14d4
Хотя это период 5, когда мы находимся в зоне d, мы вычитаем 1.
Nd -> [Xe] 6s24f14
Хотя это период 6, когда мы находимся в зоне f, мы вычитаем 2.
Исключения в электронной конфигурации
Электронная конфигурация имеет несколько особенностей, которые, если вы не знаете о них, могут привести к большим головным фидерам. Но не паникуйте! Мы вам расскажем!
Зона F
Зона F появляется в нижней части таблицы Менделеева, но на самом деле она «встроена» в промежуток, который мы видим белым, то есть между первым и вторым элементами двух последних строк зоны D.

Ты видишь это? По этой причине иногда, когда нам нужно записать электронную конфигурацию элемента в зоне F, например, Nd, нам придется поместить электрон в зону D соответствующего уровня относительно того элемента в зоне D, который является перед входом в зону F.
Ce -> [Xe] 6s25d14f1
Группа 6 и Группа 11
Переходные металлы группы 6 и группы 11 имеют 4 и 9 электронов на последних оболочках соответственно. Следовательно, чтобы быть более стабильным элементом, s-орбиталь возбуждается и теряет электрон, который переходит на следующую орбиталь, d. Таким образом, на s-орбитали останется электрон; и d с 5, если это элемент группы 6, или с 10, если это элемент группы 11.
Вот пример:
Ag -> [Kr] 5s24d9
По-видимому, это была бы электронная конфигурация серебра (Ag). Однако потеря электрона с s-орбитали выглядит так:
Ag -> [Kr] 5s14d10
Однако есть исключения из этого правила, такие как вольфрам (группа 6), у которого остается 2 электрона на s-орбитали и 4 электрона на d-орбитали.
Но не волнуйтесь! Наиболее типичные из них (Cr, Cu, Ag и Au) подчиняются этому правилу.
Ты понял? Хорошо. Это все, что вам нужно знать об электронной конфигурации. Пойдем за квантовыми числами!
Как получить квантовые числа
Чтобы получить квантовые числа, мы должны знать, сколько электронов помещается на каждой орбитальной оболочке, принимая во внимание, что 2 электрона помещаются на орбитали.
- Слой s. У него только одна орбиталь, поэтому он может удерживать 2 электрона.

- Слой p. У него 3 орбитали, поэтому есть место для 6 электронов.

- Слой d. У него 5 орбиталей, поэтому он может удерживать 10 электронов.

- Слой f. У него 7 орбиталей, то есть он может удерживать 14 электронов.

Теперь, когда вы понимаете, что на каждой орбитали есть 2 электрона, вы должны знать правило Хунда. Это правило гласит, что при заполнении орбиталей одного и того же подуровня или оболочки, например, p-оболочки, электроны заполняют орбиталь в одном направлении (положительном), а затем в другом (отрицательном). Хотите увидеть это на примере?
Если у нас есть 2p4, то есть 2p-орбиталь с 4 электронами, не будет заполняться следующим образом:

Он будет заливаться так:

Вы это понимаете? Отлично, посмотрим, как считать числа:
- Квантовое число n. Это число совпадает с номером последнего уровня электронной конфигурации. Например, если электронная конфигурация заканчивается через 4 с2, главное квантовое число будет 4.
- Квантовое число l. Это число зависит от последнего залитого слоя.
- Слой s -> l = 0
- Слой p -> l = 1
- Слой d -> l = 2
- Слой f -> l = 3
- Квантовое число m. Число m может быть любым значением от -l до + l, поэтому оно будет зависеть от подуровня, на котором находится дифференциальный электрон, то есть от того, является ли он s, p, d или f. Как вычислить это число немного сложнее, давайте посмотрим на это на паре рисунков:
- Слой s -> Как мы видели, l имеет значение 0, поэтому m может иметь значение только 0.
- Слой p -> l стоит 1, поэтому m может быть -1, 0 или 1.

- Слой d -> l равно 2, поэтому m может быть -2, -1, 0, 1 и 2.

- Слой f -> l стоит 3, поэтому m может быть -3, -2, -1, 0, 1, 2 и 3.

Вы уже знаете, как заполняются орбитали, поэтому квантовое число m будет иметь значение дыры, в которой находится последний нарисованный электрон. Вы помните этот пример раньше ?:

В этом случае m будет -1, так как в p-оболочке (3 орбитали), если есть 4 электрона, последний, который заполнится, будет отрицательным по отношению к первой орбитали.
- Квантовое число s. Квантовое число s может иметь значение только ½ и –½. Если последний нарисованный электрон положительный, то есть стрелка вверх, s будет ½. С другой стороны, если последний электрон, заполнивший орбиталь, отрицателен, то есть со стрелкой, направленной вниз, s будет -½.
Упражнения и примеры
Да, мы уже знаем, что все это много информации, но вы поймете это лучше на некоторых примерах. Вот так!
Пример 1
Селен (Se) -> Атомный номер: 34
- Записываем электронную конфигурацию. Мы записываем электронную конфигурацию согласно диаграмме Меллера, учитывая, что s, p, d и f орбитали имеют 2, 6, 10 и 14 электронов соответственно. Мы записываем конфигурацию, добавляя количество электронов, которое записывается в виде экспоненты.
1s22s22p63s23p64s23d104p4
Поскольку орбиталь 4p не заполняется, поскольку сумма электронов составит 36, мы не ставим 4p6но 4p4.
- Вынимаем квантовые числа. Для этого мы смотрим на валентный или дифференциальный электрон, то есть последний электрон, заполнивший орбиталь. В этом случае мы будем смотреть на 4p4.
- Главное квантовое число. Последний уровень энергии, который нужно заполнить, был 4.
п = 4
- Вторичное квантовое число. Последним заполняемым энергетическим подуровнем была p-орбиталь.
l = 1
- Магнитное квантовое число. Если мы рисуем электроны, последняя заполнится первой орбиталью p-оболочки.

м = -1
- Спиновое квантовое число. Последний электрон, занявший p-орбиталь, имеет стрелку вниз.
s = -½
Пример 2
Золото (Au) -> [Xe] 6s14f145d10
- Главное квантовое число -> N = 5
- Вторичное квантовое число -> l = 2
- Магнитное квантовое число -> м = 2
- Квантовое число спина -> s = -½
И это все! Теперь ваша очередь, не могли бы вы выполнить конфигурацию электронов и получить квантовые числа следующих элементов?:
Cr(24), Rb(37), Br(35), Lu(71), Au(79)
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 4
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22,/2005; 1, 2/2006
Строение электронной оболочки
атома
План
 1.
1.
Квантовые числа (главное, побочное, магнитное,
спиновое).
2. Закономерности заполнения электронной
оболочки атома: принцип Паули, принцип
наименьшей энергии, правило Клечковского,
правило Гунда.
3. Определения понятий: «электронная оболочка»,
«электронное облако», «энергетический уровень»,
«энергетический подуровень», «электронный
слой».
Атом состоит из ядра и электронной оболочки. Электронная
оболочка атома – это совокупность всех
электронов в данном атоме. От строения
электронной оболочки атома напрямую зависят
химические свойства данного химического
элемента. Согласно квантовой теории каждый
электрон в атоме занимает определенную орбиталь
и образует электронное облако, которое
является совокупностью различных положений
быстро движущегося электрона.
 Для
Для
характеристики орбиталей и электронов
используют квантовые числа.
Главное квантовое число n характеризует
энергию и размеры орбитали и электронного
облака, принимает значения целых чисел – от 1 до
бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали,
имеющие одинаковые значения n, близки между
собой по энергии и по размерам, они образуют один
энергетический уровень.
Энергетический уровень – это совокупность
орбиталей, имеющих одинаковое значение главного
квантового числа. Энергетические уровни
обозначают либо цифрами, либо большими буквами
латинского алфавита (1 – K, 2 – L, 3 – M, 4
– N, 5 – O, 6 – P, 7 – Q). С увеличением
порядкового номера энергия орбиталей
увеличивается.
Электронный слой – это совокупность
электронов, находящихся на одном энергетическом
уровне.
На одном энергетическом уровне могут
находиться электронные облака, имеющие
различные геометрические формы.
Побочное (орбитальное) квантовое число l характеризует
формы орбиталей и облаков, принимает значения
целых чисел от 0 до n – 1.
| Энергетический уровень |
Значения главного квантового числа n |
Значения побочного квантового числа l |
| K | 1 | 0 (s) |
| L | 2 | 0, 1 (s, p) |
| M | 3 | 0, 1, 2 (s, p, d) |
| N | 4 | 0, 1, 2, 3 (s, p, d, f) |
Орбитали, для которых l = 0, имеют
форму сферы и называются s–орбиталями. Они
содержатся на всех энергетических уровнях,
причем на К-уровне есть только s-орбиталь.
Орбитали, для которых l = 1, имеют форму
вытянутой восьмерки и называются р–орбиталями.
Они содержатся на всех энергетических уровнях,
кроме первого (К).
Орбитали, для которых l = 2, называются d–орбиталями.
Их заполнение электронами начинается с третьего
энергетического уровня.
Заполнение f–орбиталей, для которых l
= 3, начинается с четвертого энергетического
уровня.
Энергия орбиталей, находящихся на одном
энергетическом уровне, но имеющих разную форму,
неодинакова: Es < Ep < Ed
< Ef, поэтому на одном уровне выделяют
разные энергетические подуровни.
Энергетический подуровень – это
совокупность орбиталей, которые находятся на
одном энергетическом уровне и имеют одинаковую
форму. Орбитали одного подуровня имеют
одинаковые значения главного и побочного
квантовых чисел, но отличаются направлением
(ориентацией) в пространстве.
Магнитное квантовое число ml
характеризует ориентацию орбиталей (электронных
облаков) в пространстве и принимает значения
целых чисел от –l через 0 до +l. Число
значений ml определяет число орбиталей на
подуровне, например:
s-подуровень: l = 0, ml = 0 – одна
орбиталь;p-подуровень: l = 1, ml = –1, 0, +1 –
три орбитали;d-подуровень: l = 2, ml = –2, –1, 0, +1,
+2 – пять орбиталей.
Таким образом, число орбиталей на подуровне
равно 2l + 1. Общее число орбиталей на одном
энергетическом уровне – n2. Общее число
электронов на одном энергетическом уровне – 2n2.
Графически любая орбиталь изображается в виде
клетки (квантовой ячейки).
Итак, каждая орбиталь и электрон, находящийся
на этой орбитали, характеризуются тремя
квантовыми числами: главным, побочным и
магнитным. Электрон характеризуется еще одним
квантовым числом – спином.
Спиновое квантовое число ms, спин (от
англ. spin – кружение, вращение) –
характеризует вращение электрона вокруг своей
оси и принимает только два значения: +1/2 и –1/2.
Электрон со спином +1/2 условно изображают так: ![]() ; со спином –1/2:
; со спином –1/2: ![]() .
.
Заполнение электронной оболочки атома
подчиняется следующим законам.
П р и н ц и п П а у л и. В атоме не может быть двух
электронов с одинаковым набором всех четырех
квантовых чисел.
П р и н ц и п н а и м е н ь ш е й э н е р г и и.
Основное (устойчивое) состояние атома
характеризуется минимальной энергией. Поэтому
электроны заполняют орбитали в порядке
увеличения их энергии.
П р а в и л о К л е ч к о в с к о г о. Электроны
заполняют энергетические подуровни в порядке
увеличения их энергии. Этот порядок определяется
значением суммы главного и побочного квантовых
чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s,
3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p,
7s, 5f, 6d.
П р а в и л о Г у н д а. На одном подуровне
электроны располагаются так, чтобы абсолютное
значение суммы спиновых квантовых чисел
(суммарного спина) было максимальным. Это
соответствует устойчивому состоянию атома.
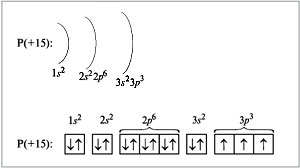
Например, электронные формулы магния, железа и
теллура имеют вид:
Mg(+12) 1s22s22p63s2;
Fe(+26) 1s22s22p63s23p64s23d6;
Te(+52) 1s22s22p63s23p64s23d104p65s24d105p4.
Исключения в четвертом периоде составляют
атомы хрома и меди, в которых происходит проскок
(переход) одного электрона с 4s-подуровня на 3d-подуровень,
что объясняется большой устойчивостью
образующихся при этом электронных конфигураций 3d5
и 3d10. Таким образом, электронные
формулы атомов хрома и меди имеют вид:
Cr(+24) 1s22s22p63s23p64s13d5;
Cu(+29) 1s22s22p63s23p64s13d10.
Для характеристики электронного строения
атома можно использовать схемы электронного
строения, электронные и электронно-графические
формулы, например:
Тест по теме «Строение
электронной оболочки атома»
(Возможно несколько правильных
ответов)
 1.
1.
Элемент, невозбужденный атом которого не
содержит неспаренных электронов, это:
а) магний; б) углерод; в) сера; г) цинк.
2. Электронная конфигурация иона Cl+ в
основном электронном состоянии (этот ион
образуется при действии ультрафиолетового
излучения на сильно нагретый хлор) имеет вид:
а) [Ne] 3s23p5; б) [Ne] 3s13p6;
в) [Ne] 3s23p4; г) [Ne] 3s23p6.
3. Элементу 2-го периода для завершения
внешнего уровня не хватает трех электронов. Этот
элемент:
а) бор; б) углерод; в) азот; г) фосфор.
4. Формула высшего оксида некоторого
элемента – ЭО3. Какую конфигурацию
валентных электронов может иметь этот элемент в
основном состоянии?
а) 4d6; б) 2s22p4; в) 3s23p4;
г) 3s13d5.
5. Чему равно орбитальное квантовое число 3р-электрона?
а) 1; б) 3; в) 0; г) +1/2.
6. Число неспаренных электронов в атоме
хрома в невозбужденном состоянии равно:
а) 1; б) 4; в) 5; г) 6.
7. Электронную конфигурацию внешнего
электронного слоя 3s23p6 имеют
соответственно атом и ионы:
а) Ar, Cl–, S2–; б) Kr, K+, Ca2+;
в) Ne, Cl–, Ca2+; г) Ar, Cl–, Ca2+.
8. Число d-электронов у атома серы в
максимально возбужденном состоянии равно:
а) 1; б) 2; в) 4; г) 6.
9. Распределение электронов в нормальном
состоянии в атоме хрома по энергетическим
уровням соответствует ряду цифр:
а) 2, 8, 12, 2; б) 2, 8, 8, 6;
в) 2, 8, 13, 1; г) 2, 8, 14, 0.
10. Ионы Ag+ и Cs+ имеют
соответственно следующие электронные формулы
внешнего и предвнешнего энергетических уровней:
а) …4d105s0 и …5p66s1;
б) …4d95s1 и …5p66s0;
в) …4d105s0 и …5p66s0;
г) …4d105s0 и …5p56s1.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а, г | в | в | в | а | г | а, г | б | в | в |
Задачи на определение
формулы вещества по продуктам сгорания
 1.
1.
При полном сгорании 0,88 г вещества образовалось
0,51 г углекислого газа и 1,49 г сернистого газа.
Определить простейшую формулу вещества.
Ответ. CS2.
2. Установить истинную формулу
органического вещества, если известно, что при
сжигании 4,6 г этого вещества было получено 8,8 г
углекислого газа и 5,4 г воды. Плотность паров
этого вещества по водороду равна 23.
Решение
В исходном веществе присутствуют элементы С, Н
и, возможно, О. Схема реакции:
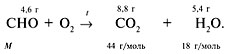
![]() (СО2)
(СО2)
= m(CO2)/M(CO2) = 8,8/44 = 0,2 моль,
![]() (С) =
(С) = ![]() (СО2) = 0,2 моль,
(СО2) = 0,2 моль,
m(С) = ![]() (C)•Ar(C)
(C)•Ar(C)
= 0,2•12 = 2,4 г.
![]() (Н2О)
(Н2О)
= m(H2O)/M(H2O) = 5,4/18 = 0,3 моль,
![]() (Н) = 2
(Н) = 2![]() (Н2О) = 0,6 моль,
(Н2О) = 0,6 моль,
m(Н) = ![]() (H)•Ar(H)
(H)•Ar(H)
= 0,6•1 = 0,6 г.
m(С) + m(Н) = 2,4 + 0,6 = 3 г – это меньше массы
исходного вещества. Следовательно, в исходном
веществе содержится кислород.
m(О) = 4,6 – 3 = 1,6 г,
![]() (О) = m(О)/Ar(О)
(О) = m(О)/Ar(О)
= 1,6/16 = 0,1 моль.
![]() (С) :
(С) : ![]() (Н) :
(Н) : ![]() (О) = 0,2 : 0,6 : 0,1 = 2 : 6 : 1.
(О) = 0,2 : 0,6 : 0,1 = 2 : 6 : 1.
Простейшая формула – С2Н6О (М = 46
г/моль).
Найдем молярную массу вещества, зная его
относительную плотность по водороду:
М(в-ва) = ![]() •М(H2) = 23•2 = 46 г/моль.
•М(H2) = 23•2 = 46 г/моль.
Отсюда истинная формула – С2Н6О.
Ответ. С2Н6О.
3. При полном сгорании 12,3 г органического
вещества образовалось 26,4 г углекислого газа, 4,5 г
воды и выделилось 1,4 г азота. Определить
молекулярную формулу вещества, если его молярная
масса в 3,844 раза больше молярной массы кислорода.
Ответ. C6H5NO2.
4. При сгорании 20 мл горючего газа СхНy
расходуется 50 мл кислорода, а получается 40 мл
углекислого газа и 20 мл водяных паров. Определить
формулу газа.
Решение
Составим схему реакции:
![]()
По третьему следствию из закона Авогадро
объемы газов, участвующих в реакции, соотносятся
между собой как простые целые числа,
пропорциональные их объемам. Исходная схема
реакции принимает вид:
2СxНy + 5О2 ![]() 4СО2 + 2Н2О (г.).
4СО2 + 2Н2О (г.).
Отсюда находим индексы х и у: х = у
= 2.
Заданный горючий газ – С2Н2.
Ответ. C2H2.
5. При сжигании 5,4 г неизвестного вещества в
кислороде образовалось 2,8 г азота, 8,8 г
углекислого газа и 1,8 г воды. Установить формулу
вещества, если известно, что оно легче воздуха.
Ответ. HCN.
6. При сжигании 3,4 г неизвестного вещества в
кислороде образовалось 2,8 г азота и 5,4 г воды.
Установить формулу вещества, если известно, что
оно легче воздуха.
Ответ. NH3.
7. При сжигании 1,7 г неизвестного вещества в
кислороде образовалось 3,2 г сернистого газа и 0,9 г
воды. Установить формулу вещества, если известно,
что оно легче аргона.
Ответ. H2S.
8. Образец вещества массой 2,96 г в реакции с
избытком бария при комнатной температуре дает 489
мл водорода (Т = 298 К, давление нормальное). При
сжигании 55,5 мг того же вещества получили 99 мг
углекислого газа и 40,5 мг воды. При полном
испарении образца этого вещества массой 1,85 г его
пары занимают объем 0,97 л при 473 К и 101,3 кПа.
Определить вещество, привести структурные
формулы двух его изомеров, отвечающих условиям
задачи.
Ответ. С3Н6О2,
изомеры – СН3СН2СООН
и СН3С(О)СН2ОН.
9. При сгорании 2,3 г вещества образовалось 4,4
г углекислого газа и 2,7 г воды. Плотность паров
этого вещества по воздуху равна 1,59. Определить
молекулярную формулу вещества.
Ответ. С2Н6О.
10. Определить молекулярную формулу
вещества, если известно, что 1,3 г его при сгорании
образует 2,24 л углекислого газа и 0,9 г паров воды.
Масса 1 мл этого вещества при н. у. равна 0,00116 г.
Ответ. C2H2.
11. При сжигании 1 моль простого вещества
образовалось 1,344 м3 (н.у.) газа, который в 11
раз тяжелее гелия. Установить формулу сжигаемого
вещества.
Ответ. С60.
12. При сжигании 112 мл газа было получено 448 мл
углекислого газа (н.у.) и 0,45 г воды. Плотность газа
по водороду составляет 29. Найти молекулярную
формулу газа.
Ответ. С4Н10.
13. При полном сгорании 3,1 г органического
вещества образовалось 8,8 г углекислого газа, 2,1 г
воды и 0,47 г азота. Найти молекулярную формулу
вещества, если масса 1 л паров его при н. у.
составляет 4,15 г.
Ответ. C6H7N.
14. При сгорании 1,44 г органического вещества
образовалось 1,792 л углекислого газа и 1,44 г воды.
Установите формулу вещества, если его
относительная плотность по воздуху составляет
2,483.
Ответ. С4Н8О.
15. При полном окислении 1,51 г гуанина
образуется 1,12 л углекислого газа, 0,45 г воды и 0,56 л
азота. Вывести молекулярную формулу гуанина.
Ответ. C5H5N5O.
16. При полном окислении органического
вещества массой 0,81 г образуется 0,336 л углекислого
газа, 0,53 г карбоната натрия и 0,18 г воды.
Установить молекулярную формулу вещества.
Ответ. C4H4O4Na2.
17. При полном окислении 2,8 г органического
вещества образовалось 4,48 л углекислого газа и 3,6
г воды. Относительная плотность вещества по
воздуху 1,931. Установить молекулярную формулу
данного вещества. Какой объем 20%-го раствора
гидроксида натрия (![]() = 1,219 г/мл) необходим для поглощения
= 1,219 г/мл) необходим для поглощения
выделившегося при сгорании углекислого газа?
Какова массовая доля карбоната натрия в
полученном растворе?
Ответ. С4Н8; 65,6 мл; 23,9%.
18. При полном окислении 2,24 г органического
вещества образуется 1,792 л углекислого газа, 0,72 г
воды и 0,448 л азота. Вывести молекулярную формулу
вещества.
Ответ. C4H4N2O2.
19. При полном окислении органического
вещества массой 2,48 г образуется 2,016 л углекислого
газа, 1,06 г карбоната натрия и 1,62 г воды.
Установить молекулярную формулу вещества.
Ответ. C5H9O2Na.
