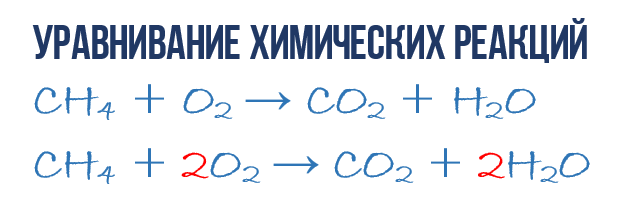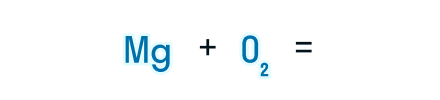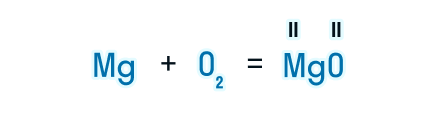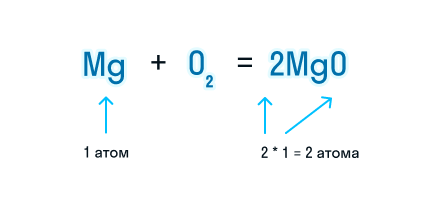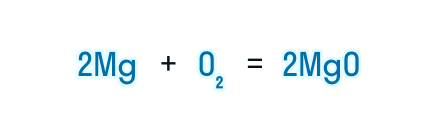Химическая реакция. Химическое уравнение
Химическими реакциями называют явления, при которых одни вещества превращаются в другие.
Химическим уравнением называют условную запись химической реакции с помощью формул веществ и коэффициентов.
Признаками химических реакций являются:
- выделение газа
- выпадение или исчезновение осадка
- изменение цвета
- изменение запаха
- выделение тепла и света
Давайте порассуждаем вместе
1. Сумма коэффициентов в уравнении реакции между оксидом магния и оксидом азота (V) равна
Ответ: Составим уравнение реакции MgO + N2O5 = Mg(NO3)2 Сумма коэффициентов в уравнении равна 1 + 1 + 1 = 3
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
Ответ: 3Na2O + P2O5 = 2Na3PO4 сумма коэффициентов равна 3+1+2 = 6
3. Сумма коэффициентов в уравнении реакции между магнием и оксидом углерода (IV)
Ответ: 2Mg + CO2 = 2MgO + C сумма коэффициентов равна 2 + 1 + 2 + 1 = 6
4. Сумма коэффициентов в левой части уравнения реакции между оксидом железа (II) и алюминием
Ответ: 3FeO + 2Al = Al2O3 + 3Fe сумма коэффициентов в левой части равна 3 + 2 = 5
5. Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
Ответ: 2KMnO4 = K2MnO4 + MnO2 + O2 сумма коэффициентов в правой части равна 1+ 1 + 1 = 3
6. Сумма коэффициентов в правой части уравнения реакции между оксидом железа (III) и водородом
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O сумма коэффициентов в правой части равна 2 + 3 = 5
7. К физическим явлениям относится процесс
2) плавление свинца
3) скисание молока
4) разложение малахита
Ответ: к физическим явлениям относится процесс плавления свинца, т.к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
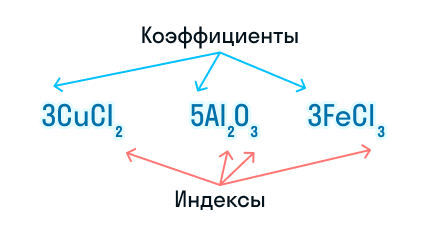
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
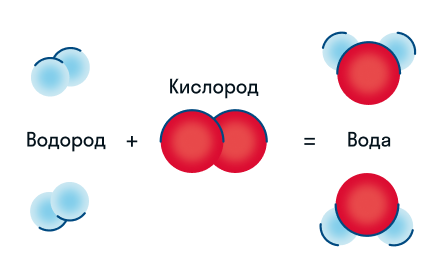
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
источники:
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/
Химическая реакция. Химическое уравнение
Химическими реакциями называют явления, при которых одни вещества превращаются в другие.
Химическим уравнением называют условную запись химической реакции с помощью формул веществ и коэффициентов.
Признаками химических реакций являются:
- выделение газа
- выпадение или исчезновение осадка
- изменение цвета
- изменение запаха
- выделение тепла и света
Давайте порассуждаем вместе
1. Сумма коэффициентов в уравнении реакции между оксидом магния и оксидом азота (V) равна
Ответ: Составим уравнение реакции MgO + N2O5 = Mg(NO3)2 Сумма коэффициентов в уравнении равна 1 + 1 + 1 = 3
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
Ответ: 3Na2O + P2O5 = 2Na3PO4 сумма коэффициентов равна 3+1+2 = 6
3. Сумма коэффициентов в уравнении реакции между магнием и оксидом углерода (IV)
Ответ: 2Mg + CO2 = 2MgO + C сумма коэффициентов равна 2 + 1 + 2 + 1 = 6
4. Сумма коэффициентов в левой части уравнения реакции между оксидом железа (II) и алюминием
Ответ: 3FeO + 2Al = Al2O3 + 3Fe сумма коэффициентов в левой части равна 3 + 2 = 5
5. Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
Ответ: 2KMnO4 = K2MnO4 + MnO2 + O2 сумма коэффициентов в правой части равна 1+ 1 + 1 = 3
6. Сумма коэффициентов в правой части уравнения реакции между оксидом железа (III) и водородом
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O сумма коэффициентов в правой части равна 2 + 3 = 5
7. К физическим явлениям относится процесс
2) плавление свинца
3) скисание молока
4) разложение малахита
Ответ: к физическим явлениям относится процесс плавления свинца, т.к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
[spoiler title=”источники:”]
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
[/spoiler]
Как вычислить сумму коэффициентов химической реакции?
Дмитрий
Знаток
(297),
закрыт
14 лет назад
Например: Fe+KOH+KNO3
Ольга
Мыслитель
(9653)
14 лет назад
1. Запишем реакцию полностью
Fe + KOH + KNO3 = K2FeO4 + KNO2 + H2O
2. Расставляем коэффициенты. для этого ищем элементы, у которых изменилась степень окисления. Это Fe и N.
Fe(0) -6e = Fe (+6) |1
N( +5) + 2e= N (+3) |3
Fe+2KOH+3KNO3 = K2FeO4 + 3KNO2 + H2O
3. Ищем сумму коэффициентов: 1+2+3+1+3+1 = 11.
Ответ: Сумма коэффициентов в уравнении равна 11.
Коэффициент – число, стоящее перед формулой вещества, показывающее сколько молекул данного вещества участвует в реакции
Например, найти сумму коэффициентов в реакции
Перед формулой алюминия стоит коэффициент 4
Перед формулой кислорода стоит коэффициент 3
Перед формулой оксида алюминия стоит коэффициент 2
Сумма коэффициентов: 4+3+2=9
Еще пример: найти сумму коэффициентов в реакции
Перед формулой оксида серы (IV) стоит коэффициент 2
Перед формулой кислорода стоит коэффициент 1 (если перед формулой вещества не стоит числа, то там 1)
Перед формулой оксида серы (VI) стоит коэффициент 2
Сумма коэффициентов: 2+1+2=5
Химическая реакция. Химическое уравнение
Химическими реакциями называют явления, при которых одни вещества превращаются в другие.
Химическим уравнением называют условную запись химической реакции с помощью формул веществ и коэффициентов.
Признаками химических реакций являются:
- выделение газа
- выпадение или исчезновение осадка
- изменение цвета
- изменение запаха
- выделение тепла и света
Давайте порассуждаем вместе
1. Сумма коэффициентов в уравнении реакции между оксидом магния и оксидом азота (V) равна
1) 5
2) 2
3) 3
4) 4
Ответ: Составим уравнение реакции MgO + N2O5 = Mg(NO3)2 Сумма коэффициентов в уравнении равна 1 + 1 + 1 = 3
2. Сумма коэффициентов в уравнении реакции между оксидом фосфора (V) и оксидом натрия
3. Сумма коэффициентов в уравнении реакции между магнием и оксидом углерода (IV)
1) 4
2) 5
3) 6
4) 2
Ответ: 2Mg + CO2 = 2MgO + C сумма коэффициентов равна 2 + 1 + 2 + 1 = 6
4. Сумма коэффициентов в левой части уравнения реакции между оксидом железа (II) и алюминием
1) 5
2) 4
3) 3
4) 2
Ответ: 3FeO + 2Al = Al2O3 + 3Fe сумма коэффициентов в левой части равна 3 + 2 = 5
5. Сумма коэффициентов в правой части уравнения реакции термического разложения перманганата калия
1) 5
2) 2
3) 3
4) 4
Ответ: 2KMnO4 = K2MnO4 + MnO2 + O2сумма коэффициентов в правой части равна 1+ 1 + 1 = 3
6. Сумма коэффициентов в правой части уравнения реакции между оксидом железа (III) и водородом
1) 8
2) 3
3) 6
4) 5
Ответ: Fe2O3 + 3H2 = 2Fe + 3H2O сумма коэффициентов в правой части равна 2 + 3 = 5
7. К физическим явлениям относится процесс
1) горение свечи
2) плавление свинца
3) скисание молока
4) разложение малахита
Ответ: к физическим явлениям относится процесс плавления свинца, т.к. при физических явлениях изменяется агрегатное состояние, а само вещество не меняется.
Коэффициенты и как правильно их расставлять в химической формуле
Химическое уравнение – отражение взаимодействия соединений формулами. Согласно закону сохранения массы в обеих сторонах уравнения должно быть равное количество атомов. Этот закон соблюдается с помощью расстановки коэффициентов.
Алгоритм расстановки коэффициентов
- Подсчет количества атомов в обеих частях уравнения.
- Нахождение наименьшего общего кратного у элементов, количество которых в обеих частях уравнения отличается.
- Разделение наименьшего общего кратного на индексы атомов.
- Расстановка полученных коэффициентов.
- Пересчет количества атомов.
Примеры расстановки коэффициентов в уравнениях
В реакции участвуют углерод С, водород Н и кислород О. При подсчете атомов можно получить следующие результаты:
- один атом углерода слева и один справа;
- четыре водорода слева и два справа;
- два кислорода слева и три справа.
Количество атомов углерода совпадает, поэтому соединения углерода не нуждаются в коэффициентах.
Чтобы поставить коэффициент перед водородом, необходимо найти наименьшее общее кратное – 2. Поэтому вода Н2О нуждается в коэффициенте 2.
Стоит обратить внимание на то, что из-за постановки коэффициента перед водой количество кислорода увеличивается. В данном варианте уравнения слева находится два кислорода, а справа – четыре. Перед кислородом нужен коэффициент 2.
Как расставить коэффициенты в окислительно-восстановительных реакциях (ОВР)
1. В уравнении нужно найти восстановитель и окислитель. Для этого следует расставить степени окисления у каждого атома.
H + Cl — +K + Mn +7 O -2 4=Mn +2 Cl — 2+K + Cl — +Cl 0 2+H + 2O -2
Теперь можно определить восстановитель и окислитель.
Mn +7 +5ē→Mn +2 (окислитель)
2Cl — -2ē→Cl 0 2 (восстановитель)
2. Затем необходимо найти наименьшее общее кратное принятых и отданных электронов. В данной реакции оно равно 10. Таким образом, у соединений марганца должен стоять коэффициент 2, а коэффициент 5 должен стоять только у газа хлора в правой части уравнения. Перед соляной кислотой в левой части уравнения коэффициент ставить рано, т. к. водород не изменил степень окисления.
3. Необходимо уравнять металлы. Слева два атома калия, а справа один, поэтому перед хлоридом калия необходимо поставить коэффициент 2.
4. Нужно уравнять количество хлора. Справа 16 атомов хлора, а слева только один. Перед соляной кислотой ставят коэффициент 16.
5. Затем необходимо посчитать количество водорода. Слева 16 атомов водорода, а справа 2, поэтому перед водой нужен коэффициент 8.
6. В обеих частях уравнения по 8 атомов кислорода.
Как расставить коэффициенты в окислительно-восстановительных реакциях с органическими веществами
Чтобы расставить степени окисления в органическом соединении, необходимо расписать полную формулу вещества.
Каждый атом углерода связан с тремя атомами водорода и одним углерода. Водород в данном соединении играет роль восстановителя, поэтому отдает электроны. Таким образом, атом углерода получает три электрона и принимает степень окисления -3.
С -3 -7ē→С +4 (восстановитель, окисление)
2О 0 +4ē→О -2 2 (окислитель, восстановление)
Исходя из метода электронного баланса, в уравнении стоят следующие коэффициенты.
Химические уравнения
При составлении химических уравнений используют математические знаки «+», «−», «=», а также числа — они выступают в качестве коэффициентов и индексов.
Коэффициенты показывают число частиц (атомов или молекул), а индексы — число атомов, которые входят в состав молекулы.
Химическую реакцию можно изобразить в виде схемы:
На схеме протекание реакции представлено нагляднее, но сложные химические процессы изобразить таким способом сложно. Поэтому их записывают в виде химического уравнения.
Вещества, которые вступают в реакцию, называют исходными веществами, или реагентами. Вещества, которые образуются в результате, называют продуктами реакции.
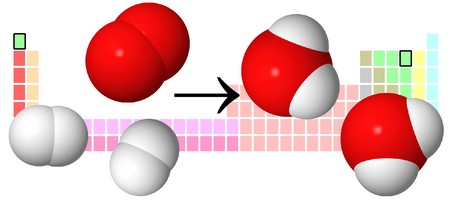
Давайте разберем этот пример химического уравнения. Здесь видно, что из двух молекул водорода и одной молекулы кислорода образуются две молекулы воды. Реагенты в данном случае — водород и кислород, продукт реакции — вода.
Новые вещества образуются вследствие перегруппировки исходных атомов. В результате химической реакции атомы химических элементов никуда не исчезают и не возникают новые, их число остается неизменным — это следует из закона сохранения массы веществ.
Закон сохранения массы веществ лежит в основе химии и используется при составлении уравнений химических реакций.
Алгоритм составления уравнения химической реакции
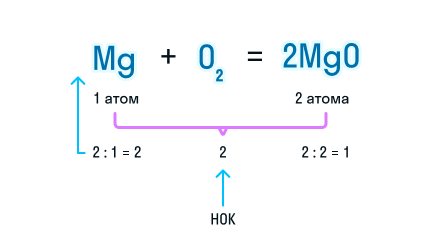
Рассмотрим, как составлять уравнения химических реакций, на примере взаимодействия магния и кислорода с образованием оксида магния.
Записываем химические формулы исходных веществ в левой части уравнения. Напоминаем: молекулы H2, N2, O2, F2, Cl2, Br2, I2 двухатомны. Между исходными веществами ставим «+», а затем знак «=».
После знака равенства записываем химическую формулу продукта. Химическую формулу необходимо составить с учетом валентностей химических элементов.
Согласно закону сохранения массы веществ, число атомов каждого химического элемента до и после реакции должно быть одинаковым. Давайте посмотрим, как расставлять коэффициенты в химических уравнениях, чтобы закон выполнялся.
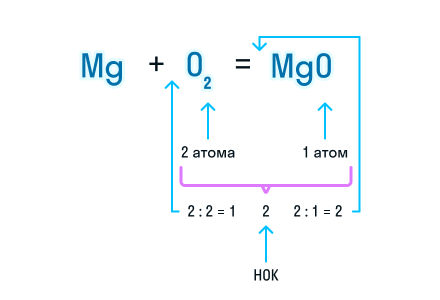
Из составленной химической реакции видно, что количество атомов магния слева и справа от знака равенства одинаково, но атомов кислорода слева два, а справа один.
Чтобы уравнять число атомов в химическом уравнении, находим наименьшее общее кратное (НОК), в нашем случае — 2. А затем делим НОК на количество атомов кислорода в реагентах и полученное число записываем в виде коэффициента.
Проверим количество атомов магния до и после знака «=». Если перед химической формулой уже стоит коэффициент, то для подсчета количества атомов необходимо умножить коэффициент на индекс, который относится к этому химическому элементу.
Чтобы уравнять количество атомов магния в химической реакции, посчитаем НОК и разделим его на количество атомов с каждой стороны от знака «=». Результат деления и будет являться коэффициентом (повторяем расстановку коэффициентов в химическом уравнении из 3-го пункта).
Получаем уравнение химической реакции, в котором в исходных веществах и продуктах реакции по 2 атома магния и кислорода.
Сумма коэффициентов в этом химическом уравнении равна 5 (2 + 1 + 2 = 5).
Коэффициенты, которые стоят в химическом уравнении перед веществами, указывают на мольное соотношение исходных веществ и продуктов реакции, по которому и производятся расчеты.
Типы химических реакций
Химические реакции можно классифицировать по различным признакам:
По числу и составу исходных веществ и продуктов реакции.
По изменению степени окисления.
По тепловому эффекту.
По агрегатному состоянию.
По наличию или отсутствию катализатора.
По числу и составу исходных веществ и продуктов реакции
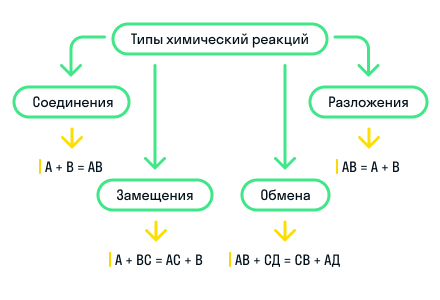
По этому признаку выделяют 4 типа реакций: реакции соединения, реакции разложения, реакции замещения и реакции обмена.
Реакции соединения — это реакции, в результате которых из нескольких более простых веществ образуется одно более сложное.
Например, простые вещества барий и кислород взаимодействуют с образованием сложного вещества оксида бария:
Также к реакциям соединения относится взаимодействие оксида натрия с водой с образованием более сложного вещества гидроксида натрия. Оно более сложное, так как состоит уже из трех атомов химических элементов, в отличие от веществ-реагентов, которые состоят из двух атомов:
Реакции разложения — это реакции, в результате которых из одного более сложного вещества образуется несколько более простых веществ. Является процессом, обратным реакции соединения.
Пример такой реакции — разложение нитрата серебра на несколько более простых веществ: серебро, оксид азота (IV) и кислород.
Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного химического элемента в сложном веществе. Также возможно замещение функциональных групп в сложном веществе.
Например, замещение атомов водорода в молекуле соляной кислоты на атомы цинка:
Реакции обмена — это реакции между двумя сложными веществами, в результате которых вещества обмениваются своими составными частями.
Для наглядности показали все типы химических реакций по этому признаку на схеме:
По изменению степени окисления
По этому признаку выделяют два вида реакций:
реакции, протекающие без изменения степени окисления;
окислительно-восстановительные реакции (ОВР) — реакции, протекающие с изменением степени окисления нескольких элементов.
В ОВР всегда участвуют вещество-окислитель и вещество-восстановитель. Другие исходные вещества, принимающие участие в реакции, выступают в качестве среды, в которой протекает эта реакция.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции принимает электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции отдает электроны, тем самым повышая свою степень окисления.
Из определений можно сделать вывод, что в ходе реакции протекает два процесса: принятие электронов (восстановление) и отдача электронов (окисление). Протекают они одновременно.
По тепловому эффекту
По тепловому эффекту реакции делятся на эндотермические и экзотермические.
Эндотермические реакции протекают с поглощением теплоты (−Q). Буквой Q обозначается количество теплоты.
К таким реакциям относятся практически все реакции разложения. Пример:
Экзотермические реакции протекают с выделением теплоты (+Q).
К таким реакциям относятся практически все реакции соединения. Пример:
По агрегатному состоянию исходных веществ
По этому признаку все реакции разделяют на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе.
К гомогенным реакциям относятся те, исходные вещества которых находятся либо в жидком агрегатном состоянии, либо в газообразном. Например, взаимодействие двух газообразных веществ — водорода и хлора:
Агрегатное состояние указывается в правом нижнем углу: «г» — газообразное, «ж» — жидкое, «тв» — твердое.
Гетерогенные реакции протекают на границе раздела фаз.
Как правило, такие реакции протекают между веществами, которые находятся в разных агрегатных состояниях:
Также к гетерогенным относятся реакции между двумя несмешивающимися жидкостями. Собрали несколько примеров гетерогенных реакций:
Между какими веществами протекает
Между жидкостью и твердым веществом
Сода и уксусная кислота
Между твердым веществом и газом
Между жидким веществом и газом
Между двумя несмешивающимися жидкостями
По наличию или отсутствию катализатора
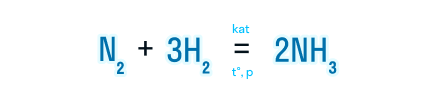
По этому признаку выделяют реакции каталитические и некаталитические.
Каталитические реакции — реакции, протекающие с участием катализатора
Катализатор — вещество, которое ускоряет реакцию, участвует в ней, но остается неизменным после окончания этой реакции.
Наличие катализатора указывается над знаком равенства как kat или формула конкретного вещества, выступающего в роли катализатора.
Некаталитические реакции — реакции, протекающие без участия катализатора.
По обратимости
Различают обратимые и необратимые реакции.
Обратимые реакции — реакции, протекающие в двух противоположных направлениях.
При составлении уравнений обратимых реакций вместо знака равенства используют знак «⇄».
К обратимым реакциям относят реакции ионного обмена, диссоциации электролитов и многие другие:
Необратимые реакции — реакции, которые протекают только в одном направлении.
Чтобы научиться составлять уравнения химических реакций, нужно только одно — практика. Много практики школьники получают на онлайн-курсах по химии в Skysmart. Интересные задания на интерактивной платформе, примеры из жизни и опытные преподаватели обязательно приведут к желаемому результату — и просто помогут полюбить химию.