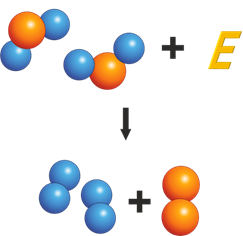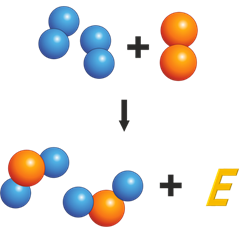Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 августа 2016 года; проверки требуют 24 правки.
Теплота́ сгора́ния — количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества. Измеряется в джоулях или калориях. Теплота сгорания, отнесённая к единице массы или объёма топлива, называется удельной теплотой сгорания. В системе СИ: Дж/кг. Также довольно часто используются внесистемные единицы измерения: кДж/кг, МДж/кг и ккал/кг.
Для её измерения пользуются методами калориметрии. Теплота сгорания определяется химическим составом горючего вещества. Содержащиеся в горючем веществе химические элементы обозначаются принятыми символами С, Н, О, N, S, а зола и вода — символами А и W соответственно.
Виды теплоты сгорания[править | править код]
Теплота сгорания может быть отнесена к рабочей массе горючего вещества 


Различают высшую (

Под высшей теплотой сгорания понимают то количество теплоты, которое выделяется при полном сгорании вещества, включая теплоту конденсации водяных паров при охлаждении продуктов сгорания.
где k — коэффициент, равный 25 кДж/кг (6 ккал/кг); W — количество воды в горючем веществе, % (по массе); Н — количество водорода в горючем веществе, % (по массе).
Расчёт теплоты сгорания[править | править код]
Таким образом, высшая теплота сгорания — это количество теплоты, выделившейся при полном сгорании единицы массы или объема (для газа) горючего вещества и охлаждении продуктов сгорания до температуры точки росы. В теплотехнических расчетах высшая теплота сгорания принимается как 100 %. Скрытая теплота сгорания газа — это теплота, которая выделяется при конденсации водяных паров, содержащихся в продуктах сгорания. Теоретически она может достигать 11 %.
На практике не удается охладить продукты сгорания до полной конденсации, и потому введено понятие низшей теплоты сгорания (QHp), которую получают, вычитая из высшей теплоты сгорания теплоту парообразования водяных паров как содержащихся в веществе, так и образовавшихся при его сжигании. На парообразование 1 кг водяных паров расходуется 2514 кДж/кг (600 ккал/кг). Низшая теплота сгорания для жидкого и твердого вещества определяется по формулам (кДж/кг или ккал/кг):

или

2514 — теплота парообразования при температуре 0 °C и атмосферном давлении, кДж/кг;

9 — коэффициент, показывающий, что при сгорании 1 кг водорода в соединении с кислородом образуется 9 кг воды.
Теплота сгорания является наиболее важной характеристикой топлива, так как определяет количество тепла, получаемого при сжигании 1 кг твердого или жидкого топлива или 1 м³ газообразного топлива в кДж/кг (ккал/кг). 1 ккал = 4,1868 или 4,19 кДж.
Низшая теплота сгорания определяется экспериментально для каждого вещества и является справочной величиной. Также её можно определить для твердых и жидких материалов, при известном элементарном составе, расчётным способом в соответствии с формулой Д. И. Менделеева, кДж/кг или ккал/кг:

или






Для сравнительных расчётов используется так называемое условное топливо, имеющее удельную теплоту сгорания, равную 29308 кДж/кг (7000 ккал/кг).
В России тепловые расчёты (например, расчёт тепловой нагрузки для определения категории помещения по взрывопожарной и пожарной опасности[1]) обычно ведут по низшей теплоте сгорания; в США, Великобритании, Франции — по высшей. В Великобритании и США до внедрения метрической системы мер удельная теплота сгорания измерялась в британских тепловых единицах (BTU) на фунт (lb) (1Btu/lb = 2,326 кДж/кг).
| Вещества и материалы | Низшая теплота сгорания при постоянном давлении  , МДж/кг , МДж/кг
|
|---|---|
| Бензин | 41,87[2] |
| Керосин | 42,9—43,12[3] |
| Бумага(книги, журналы) | 13,4[4] |
| Древесина (бруски W = 14%) | 13,8[4] |
| Каучук натуральный | 44,73—44,8[4] |
| Линолеум поливинилхлоридный | 14,31[4] |
| Резина | 33,52 |
| Волокно штапельное | 13,8 |
| Полиэтилен | 47,14[4] |
| Полистирол | 39[4] |
| Хлопок разрыхленный | 15,7[4] |
Самые высокие значения теплоты сгорания природных газов из различных источников[править | править код]
Данные получены Международным энергетическим агентством[5].
- Алжир: 42 000 кДж/м³
- Бангладеш: 36 000 кДж/м³
- Белоруссия: 33 000 кДж/м³
- Великобритания: 39 710 кДж/м³
- Вьетнам: 45 520 кДж/м³
- Канада: 38 200 кДж/м³
- Индонезия: 40 600 кДж/м³
- Нидерланды: 33 320 кДж/м³
- Норвегия: 39 877 кДж/м³
- Россия: 38 231 кДж/м³
- Саудовская Аравия: 38 000 кДж/м³
- США: 38 416 кДж/м³
- Узбекистан: 37 889 кДж/м³
Необходимое количество электроэнергии для работы лампочки мощностью 100 Вт в течение 1 года[править | править код]
Количество топлива, необходимого для получения указанной ниже электроэнергии, рассчитано при 100 % эффективности преобразования тепловой энергии в электрическую. Так как большинство электрогенерирующих установок и распределительных систем достигают эффективности (КПД) порядка 30—35 %, фактическое количество топлива, используемого для питания лампочки мощностью 100 Вт, будет приблизительно в три раза больше указанного количества.
- 228,5 кг древесины (при 20 % влажности)
- 88,5 кг угля (антрацит малозольный)
- 72,1 кг керосина
- 79,2 м³ природного газа (используя усредненную величину 40000 кДж/м³)
- 63 кг метана
- 26 кг водорода
- 0,04 г урана (здесь имеется в виду энергия, выделяющаяся при цепной ядерной реакции)
- 1,75*10−5 г антивещества (здесь имеется в виду энергия, выделяющаяся при аннигиляции).
Примечания[править | править код]
- ↑ НПБ 105-03
- ↑ Теплота сгорания Автоматические системы пожаротушения, установки пожаротушения, проект сигнализации, обслуживание сигнализации, оросители: спринклеры и дренчеры, монтаж пожарной сигнализации, пожарная экспертиза, огнезащитная краска, покрытия и составы, обработка огнезащитная, огнезащита конструкций, металлоконструкций, системы пожарной безопасности, пожарные категории, план эвакуации, охранно пожарная сигнализация, противопожарные ворота, двери металлические, системы пожарной сигнализации, автоматическое пожаротушение, противопожарная защита, монтаж ОПС. stopfire.ru. Дата обращения: 19 октября 2017. Архивировано 20 октября 2017 года.
- ↑ ГОСТ 10227-86. Топлива для реактивных двигателей. Топлива для реактивных двигателей. www.nge.ru. Дата обращения: 19 октября 2017. Архивировано 20 октября 2017 года.
- ↑ 1 2 3 4 5 6 7 ООО “Аудит пожарной безопасности”. pozharaudit.ru. Дата обращения: 19 октября 2017. Архивировано из оригинала 31 октября 2017 года.
- ↑ Key World Energy Statistics (2005), page 59. Дата обращения: 14 ноября 2010. Архивировано из оригинала 5 декабря 2010 года.
Литература[править | править код]
- Физический энциклопедический словарь
- Большая Советская энциклопедия
- Пособие по применению НПБ 105-95 «Определение категорий помещений и зданий по взрывопожарной и пожарной опасности»
См. также[править | править код]
- Внутренняя энергия
- Горение
- Пожар
- Экзотермическая реакция
- Удельная теплота сгорания
Задачи на сгорание топлива с решениями
Формулы, используемые на уроках «Задачи на сгорание топлива».
Название величины |
Обозначение |
Единица измерения |
Формула |
Масса |
m |
кг |
m = Q / q |
Удельная теплота сгорания |
q |
Дж/кг |
q = Q / m |
Количество теплоты |
Q |
Дж |
Q = q•m |
1 кДж = 103 Дж; 1 МДж = 106 Дж; 1т= 1000 кг; 1г = 0,001 кг
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
Сколько энергии выделится при сгорании 30 кг каменного угля?
Задача № 2.
Определите массу сгоревшего древесного угля, если при его сгорании выделилось 5,1 • 108 Дж энергии.
Задача № 3.
Какова удельная теплота сгорания торфа, если при сгорании 15 кг торфа выделяется 2,1 • 108 Дж энергии?
Задача № 4.
Сколько теплоты выделится при полном сгорании сухих березовых дров объемом 5 м3?
Задача № 5.
Какое количество теплоты выделится при полном сгорании пороха массой 25 г; торфа массой 0,5 т; каменного угля массой 1,5 т?
Задача № 6.
Сколько теплоты выделится при полном сгорании керосина объемом 0,25м3; спирта объемом 0,00005 м3; бензина объемом 25 л; нефти объемом 250 л?
Задача № 7.
Смешали бензин объемом 1,5 л и спирт объемом 0,5 л. Какое количество теплоты выделится при полном сгорании этого топлива?
Задача № 8.
В топке котла парового двигателя сожгли торф массой 20 т. Какой массой каменного угля можно было бы заменить сгоревший торф? (Удельную теплоту сгорания торфа принять равной 1,5 • 107 Дж/кг.)
Задача № 9.
Сколько спирта надо сжечь, чтобы изменить температуру воды массой 2 кг от 14 до 50 °С, если вся теплота, выделенная при горении спирта, пойдет на нагревание воды?
Задача № 10.
На сколько изменится температура воды, масса которой 22 кг, если ей передать всю энергию, выделившуюся при сгорании керосина, масса которого равна 10 г?
Задача № 11.
ЕГЭ
На спиртовке нагрели воду массой m = 400 г. Температура её повысилась от t1 = 16 °С до t2 = 71 °С. При этом сожгли mс = 10 г спирта. Найти коэффициент полезного действия (КПД) установки. Удельная теплота сгорания спирта q = 2,7 • 107 Дж/кг.
Краткая теория для решения Задачи на сгорание топлива.
Это конспект по теме «Задачи на сгорание топлива». Выберите дальнейшие действия:
- Перейти к теме: ЗАДАЧИ на плавление и отвердевание
- Посмотреть конспект по теме Тепловые машины. Удельная теплота сгорания топлива
- Вернуться к списку конспектов по Физике.
- Проверить свои знания по Физике.
Энергия, которую тело получает или отдает при теплопередаче, называется количеством теплоты. Мы проделали не один опыт, рассмотрели как при теплообмене одни тела отдают энергию, а другие получают. Во многих опытах мы использовали горелку, чтобы сообщить телу какое-то количество теплоты. А как рассчитать это количество теплоты?
С давних времен, чтобы получить энергию, люди используют топливо. Сейчас топливо является источником энергии в промышленности, сельском хозяйстве, на транспорте и, конечно, в повседневном быту. Это нефть, природный газ, торф, уголь, дрова и др.
В данном уроке мы рассмотрим, за счет чего выделяется энергия при сгорании топлива и как ее рассчитать. Также вы узнаете новое определение (удельная теплота сгорания) и научитесь им пользоваться.
Сгорание топлива и энергия
Для начала давайте вспомним строение молекулы воды (рисунок 1). Она состоит из одного атома кислорода и двух атомов водорода.
Между атомами действуют силы притяжения. Если мы захотим разделить атомы, составляющие молекулы, придется преодолеть эти силы. В таком случае будет совершена работа, и затрачена некоторая энергия. При соединение атомов, наоборот, энергия будет выделяться.
Выделение энергии при соединении атомов — явление, на котором основано использование топлива.
В любом топливе содержатся атомы углерода. В процессе горения они соединяются с двумя атомами кислорода (рисунок 2).
В результате:
- Образуется молекула углекислого газа (оксида углерода)
- Выделяется энергия
Удельная теплота сгорания
При сгорании разных видов топлива одинаковой массы выделяется разное количество теплоты. Для того чтобы характеризовать каждый вид топлива используют такую величину, как удельная теплота сгорания. При проектировании двигателей эта величина помогает рассчитать, какое количество теплоты может выделить сжигаемое топливо.
Удельная теплота сгорания топлива — это физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой $1 space кг$.
- Обозначается буквой $q$
- Единица измерения — $1 frac{Дж}{кг}$
Величину удельной теплоты сгорания устанавливают на опыте. Мы будем использовать уже готовые результаты таких исследований, представленные в таблице 1.
| Вещество | $q, space frac{Дж}{кг}$ | Вещество | $q, space frac{Дж}{кг}$ |
| Порох | $0.38 cdot 10^7$ | Древесный уголь | $3.4 cdot 10^7$ |
| Дрова сухие | $1.0 cdot 10^7$ | Природный газ | $4.4 cdot 10^7$ |
| Торф | $1.4 cdot 10^7$ | Нефть | $4.4 cdot 10^7$ |
| Каменный уголь | $2.7 cdot 10^7$ | Бензин | $4.6 cdot 10^7$ |
| Спирт | $2.7 cdot 10^7$ | Керосин | $4.6 cdot 10^7$ |
| Антрацит | $3.0 cdot 10^7$ | Водород | $12 cdot 10^7$ |
Возьмем табличное значение удельной теплоты сгорания нефти — $4.4 cdot 10^7 frac{Дж}{кг}$. Эта величина говорит нам о том, что при полном сгорании нефти массой $1 space кг$ выделяется $4.4 cdot 10^7 frac{Дж}{кг}$ энергии.
Формула для расчета количества теплоты, выделяемого при сгорании топлива
Для расчета полного количества теплоты, выделяемого при полном сгорании топлива некоторой массы, используют формулу:
$Q = qm$,
где $Q$ — выделяемое количество теплоты,
$q$ -удельная теплота сгорания топлива,
$m$ — масса сгораемого топлива.
Упражнения
Упражнение №1
Какое количество теплоты выделится при полном сгорании керосина объемом $2 space л$ и плотностью $800 frac{кг}{м^3}$?
Дано:
$V = 2 space л$
$rho = 800 frac{кг}{м^3}$
$q = 4.6 cdot 10^7 frac{Дж}{кг}$
СИ:
$2 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты:
$Q = qm$.
Массу выразим через объем и плотность: $m = rho V$.
Рассчитаем количество теплоты:
$Q = qrho V = 4.6 cdot 10^7 frac{Дж}{кг} cdot 800 frac{кг}{м^3} cdot 2 cdot 10^{-3} space м^3 = 7360 cdot 10^4 space Дж = 73.6 cdot 10^6 space Дж = 73.6 space МДж$.
Ответ: $Q = 73.6 space МДж$.
Упражнение №2
Вычислите массу сухих дров, если при их полном сгорании выделилось $70 000 space кДж$ энергии.
Дано:
$Q = 70 000 space кДж$
$q = 1.0 cdot 10^7 frac{Дж}{кг}$
СИ:
$7 cdot 10^7 space Дж$
$m — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Из формулы $Q = qm$ выразим массу дров $m$:
$m = frac{Q}{q}$.
Рассчитаем:
$m = frac{7 cdot 10^7 space Дж}{1.0 cdot 10^7 frac{Дж}{кг}} = 7 space кг$.
Ответ: $m = 7 space кг$.
На прошлом уроке мы с вами научились рассчитывать количество теплоты полученное или переданное телами при их непосредственном контакте или в результате конвекции. Однако вы уже знаете, что существует и ещё один вид теплопередачи — это излучение.
Все вы не раз зажигали дома газовую плиту, чтобы разогреть еду. Или разжигали в походе костёр, чтобы приготовить на нём пищу и согреться прохладным вечером.
И вам известно, что одним из источников энергии, которая используется в промышленности и сельском хозяйстве, на транспорте и в быту, является топливо. Это, например, природный газ, дрова, торф, уголь, нефть и т. д. При их сгорании происходит выделение необходимой для нужд человека энергии.
Горение — это химическая реакция, во время которой происходит окисление, сопровождаемое выделением теплоты.
Выясним за счёт чего при горении выделяется энергия. Вы уже знаете, что молекула любого вещества является достаточно устойчивой конструкцией. И чтобы её разрушить необходимо затратить энергию.
Но при образовании молекулы из атомов энергия наоборот выделяется.
Так, например, атомы углерода, содержащиеся в топливе, при горении соединяются с двумя атомами кислорода. В результате такого слияния образуется молекула углекислого газа и выделяется энергия.
Различные вещества при горении выделяют разное количество теплоты.
Поэтому энергию, выделяющуюся при сгорании различного вида топлива, принято характеризовать величиной, называемой удельной теплотой сгорания топлива.
Удельной теплотой сгорания топлива называется физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании одного килограмма топлива.
Обозначается она буквой «q».
Единица её измерения: Дж/кг .
Значение удельной теплоты сгорания топлива определяют экспериментально, с помощью довольно сложных приборов, а потом заносят в таблицу:
Числовое значение удельной теплоты сгорания показывает, какое количество теплоты выделяется при сгорании 1 кг топлива.
Например, из таблицы видно, что при сгорании 1 кг газообразного водорода выделяется 120 000 000 Дж теплоты.
А при сгорании 1 кг пороха — всего 3 800 000 Дж теплоты.
Очевидно, что если сгорает не 1 кг пороха, а, например, 5 кг, то при его полном сгорании выделиться в 5 раз больше теплоты, то есть 19 000 000 Дж.
Поэтому в общем случае количество теплоты, выделяющееся при полном сгорании топлива, равно произведению удельной теплоты его сгорания и массы:
Q = qm
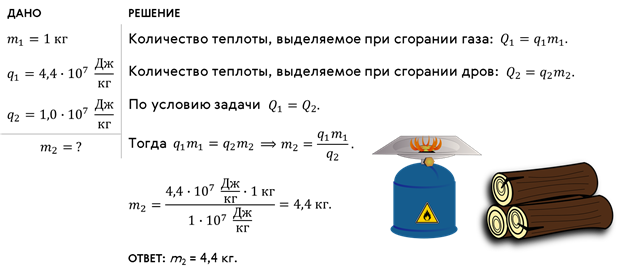
Задача 1. Сколько сухих дров нужно сжечь, чтобы получить такое же количество теплоты, которое выделяется при сгорании 1 кг природного газа?
Задача 2. Определите массу спирта, которую нужно сжечь для того, чтобы нагреть 3 л воды на 50 оС. Считать, что вся теплота, выделяемая при сгорании спирта, идёт на нагревание воды.
Задача 3. Определите массу бурого угля, который надо сжечь, чтобы нагреть воду массой 20 кг от 20 оС до 100 оC. Считать, что на нагревание воды идет 20% теплоты от сгорания топлива.
Домашнее задание
Стр. 30 — 31 читать, упражнение 8 выполнить в тетради
Приручив огонь, человек получил большое количество благ. Благодаря огню мы готовим пищу и обогреваем дома. Человеческая цивилизация начала развиваться — возникла металлургия и энергетика. Появились полезные инструменты, механизмы и изобретения.
Процесс горения топлива подарил нам возможность передвигаться на автомобилях и мотоциклах, летать на самолетах, запускать ракеты в космос и путешествовать по морю на кораблях.
До сих пор горение – это основной источник получения энергии во всем мире. В 2010 году сотрудники международного энергетического агентства IEA подсчитали, что 90 процентов всей энергии человечество получает, сжигая различное топливо.
Во время горения происходят химические превращения одних веществ в другие вещества. Такие превращения называют химическими реакциями.
Два вида химических реакций и энергия
Благодаря химическим реакциям в природе появилось множество различных веществ.
Примечание: Химики сложные вещества, состоящие из атомов различных хим. элементов, называют химическими соединениями.
Химические реакции – это процессы перегруппировки атомов:
- имеющиеся молекулы разъединяются на отдельные атомы;
- из этих атомов образуются новые молекулы.
При этом происходит поглощение, или выделение энергии.
Повышая температуру, мы ускоряем химические реакции
Скорость молекул зависит от температуры. Чем быстрее молекулы двигаются, тем чаще они будут сталкиваться. А когда количество столкновений увеличивается, то химические реакции протекают быстрее. Поэтому температура вещества влияет на химические реакции.
Рис. 1. Все химические реакции можно разделить на поглощающие тепловую энергию – эндотермические и, выделяющие энергию — экзотермические
Во время протекания одних химических реакций тепловая энергия поглощается. Такие реакции называются эндотермическими (рис. 1).
Примерами эндотермических процессов могут служить процесс плавления или процесс парообразования.
А во время протекания других реакций, энергия, наоборот – выделяется. Такие химические реакции называют экзотермическими.
Среди экзотермических процессов можно отметить, например, конденсацию или кристаллизацию.
Примечание: Слова «эндотермический» и «экзотермический» пришли к нам из древнегреческого языка. По-гречески «Эндо» – внутри, «Экзо» – наружу, а «Термо» – тепло.
Что такое горение
В процессе горения температура резко повышается и выделяется большое количество тепловой энергии (теплоты). Поэтому, горение – это экзотермический процесс.
В топливе содержатся атомы химического элемента, который называется углеродом. При горении топлива каждый атом углерода объединяется в двумя атомами кислорода и выделяется энергия.
Когда горит какое-либо вещество, мы видим пламя (рис. 2).
Пламя – это поток раскаленных газов, часть пространства, в которой топливо и кислород превращаются в продукты сгорания.
Рис. 2. Горение – это химическая реакция окисления топлива с образованием продуктов горения, пламенем выделением теплоты
Горение – процесс сложный, потому, что во время его протекания происходит цепочка химических превращений. В основном – это реакции окисления между сгорающим топливом и кислородом;
Примечание: В окружающем воздухе содержится кислород. Кислород – это сильный окислитель.
Что нужно, чтобы горение возникло
Только лишь наличия топлива и кислорода в окружающем воздухе недостаточно, чтобы это топливо загорелось. Мы должны сначала нагреть топливо до температуры, при которой произойдет его возгорание. Для предварительного нагрева мы используем источник зажигания. Например, спички, зажигалку и т. п.
Примечание: Чтобы горение возникло, нужно сначала нагреть топливо до температуры, при которой произойдет возгорание.
Например, самостоятельно может загореться бумага, наргетая до 233 градусов Цельсия или дерево, нагретое до 300 градусов Цельсия.
Поэтому, бездумно нагревать горючие вещества опасно. Так как нагретое горючее вещество способно самостоятельно загореться, иногда со взрывом.
Температура самовоспламенения некоторых веществ
- бумага: 233 (C);
- дерево: 300 (C);
- бензин: 250 — 300 (C);
- спирт этиловый: 400 (C);
Температура горения некоторых веществ
- сухие дрова: от 800 до 1000 (C);
- пламя спички: от 750 до 1400 (C);
- уголь в печи или котле: от 1000 до 2300 градусов Цельсия (зависит от подачи воздуха);
- бензин: 1300 — 1400 (C);
Температура частей пламени различается
Раскаленные до высокой температуры газы, выделяющиеся при сгорании топлива, светятся. Они образуют светлый ореол около горящего топлива. Этот ореол называют пламенем. Пламя можно условно разделить на слои. Температура таких слоев пламени различается. Чем ярче пламя, чем ближе его цвет к белому цвету, тем выше его температура.
Рис. 3. Раскаленные газы, выделяющиеся при горении, светятся и, образуют пламя, которое по степени нагревания можно разделить на слои
Что такое удельная теплота сгорания
Мы уже знаем, что при горении выделяется теплота (тепловая энергия).
Количество теплоты, которое мы получим при сгорании, будет отличаться для разных видов топлива. Одно топливо будет выделять больше энергии, другое – меньше.
Чтобы сравнивать горючие вещества между собой, удобно сжигать 1 килограмм топлива и измерять выделяемое количество теплоты.
Примечание: Не путайте теплоту и температуру. Теплота – это тепловая энергия. Любую энергию измеряют в Джоулях. А температуру измеряют в градусах.
Тепловая энергия, которая выделяется при полном сгорании 1 кг топлива, называется удельной теплотой сгорания. Ее обозначают маленькой латинской буквой q.
(large q left( frac{text{Дж}}{text{кг}}right)) – удельная теплота сгорания.
Примечание: Удельная теплота сгорания — это тепловая энергия, которая выделяется при полном сгорании 1 кг. топлива. Ранее мы уже сталкивались с удельными величинами (ссылка).
Удельную теплоту сгорания некоторых веществ можно найти в справочнике физики.
Как связаны количество теплоты и удельная теплота сгорания — формула
Мы можем посчитать количество теплоты, выделенной при сгорании, когда нам известны:
- удельная теплота сгорания топлива и
- количество килограммов вещества.
Для расчетов используем формулу:
[large boxed{ Q = q cdot m }]
(large Q left( text{Дж} right) ) – количество теплоты, т. е. общая тепловая энергия;
(large q left( frac{text{Дж}}{text{кг}} right) ) – удельная теплота сгорания;
(large m left( text{кг} right) ) – масса вещества;
Примечание: Если умножить удельную теплоту сгорания (large q ) на количество килограммов m сгоревшего вещества, то можно вычислить общее количество теплоты (large Q ), выделившейся при сгорании топлива.
Недостатки использования горения
На нашей планете из-за широкого использования горения возникают негативные последствия:
- истощаются полезные ископаемые – нефть, уголь, горючие сланцы, газ,
- загрязняется окружающая среда — большинство продуктов горения токсичны,
- ухудшается экология,
- проявляется глобальное потепление.
Из-за глобального потепления температура на планете поднялась на несколько градусов, начали таять многовековые льды на северном и южном полюсах, изменяется климат.
Выводы
- Повышая температуру, мы ускоряем химические реакции.
- Чтобы процесс горения начался, мы предварительно нагреваем топливо источником зажигания. Как только топливо достигнет критической температуры, оно загорится.
- Горение – это экзотермический процесс, потому, что во время горения выделяется большое количество тепловой энергии.
- Пламя – это поток раскаленных газов. Температура слоев пламени различается. Чем ярче пламя, чем ближе его цвет к белому цвету, тем выше его температура.
- Одни виды топлива при горении выделяют больше теплоты, другие — меньше. Чтобы сравнить горючие вещества между собой, нужно сжечь по-отдельности 1 килограмм каждого топлива и измерить количества выделенной ими теплоты.
- Удельная теплота сгорания — это теплота, выделяемая при полном сгорании 1 кг топлива.
- Зная удельную теплоту сгорания топлива и количество килограммов сгоревшего вещества, можно посчитать количество теплоты, выделенной при сгорании. Для этого нужно умножить удельную теплоту сгорания q на количество килограммов m сгоревшего вещества.
- Что происходит во время горения:
- высокая температура действует на горючие вещества (топливо);
- эти вещества взаимодействуют с кислородом и превращаются в продукты горения;
- выделяется большое количество тепловой энергии,
- резко повышается температура,
- возникает пламя и излучается свет.