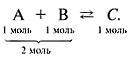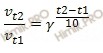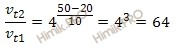Температурный коэффициент скорости реакции
Возрастание
скорости реакции с ростом температуры
принято характеризовать температурным
коэффициентом скорости реакции , числом,
показывающим, во сколько раз возрастает
скорость данной реакции при повышении
температуры системы на 10°С. Температурный
коэффициент различных реакций различен.
При обычных температурах его значение
для большинства реакций находится в
пределах от 2… 4.
Температурный
коэффициент определяют в соответствии
с так называемым «правилом Вант-Гоффа»,
которое математически выражается
уравнением
v2/v1
=
(T2
–
T1)/10,
где
v1
и v2
–
скорости реакции при температурах Т1
и Т2;
температурный коэффициент реакции.
Так,
например, если
= 2, то при Т2
–
Т1
= 50°С v2/v1
= 25
= 32, т.е. реакция ускорилась в 32 раза,
причем это ускорение никак не зависит
от абсолютных величин Т1
и Т2,
а только от их разности.
Энергия
активации,
разность между значениями средней
энергии частиц (молекул, радикалов,
ионов и др.), вступающих в элементарный
акт химической реакции, и средней энергии
всех частиц, находящихся в реагирующей
системе. Для различных химических
реакций Э. а. изменяется в широких
пределах — от нескольких до ~ 10 дж./
моль. Для
одной и той же химической реакции
значение Э. а. зависит от вида функций
распределения молекул по энергиям их
поступательного движения и внутренним
степеням свободы (электронным,
колебательным, вращательным). Как
статистическую величину Э. а. следует
отличать от пороговой энергии, или
энергетического барьера, — минимальной
энергии, которой должна обладать одна
пара сталкивающихся частиц для протекания
данной элементарной реакции.
Аррениуса
уравнение,
температурная зависимость константы
скорости
к элементарной
хим. реакции:
где
A-предэкспоненциальныи множитель
(размерность совпадает с размерностью
к), Еа
-энергия
активации, обычно принимающая положит.
значения, Т-абс. температура, k-постоянная
Больцмана. Принято приводить Еа
в расчете не
на одну молекулу.
а на число частиц NA
= 6,02*1023
(постоянная Авогадро) и выражать в
кДж/моль; в этих случаях в уравнении
Аррениуса величину k
заменяют
газовой
постоянной
R. График
зависимости 1nк от 1/kT
(аррениусов
график) – прямая линия, отрицательный
наклон которой определяется энергией
активации
Еа
и
характеризует положит. температурную
зависимость к.
22
Скорость
химической реакции —
изменение количества одного из реагирующих
веществ за единицу времени в единице
реакционного пространства. Является
ключевым понятием химической
кинетики.
Скорость химической реакции —
величина всегда положительная, поэтому,
если она определяется по исходному
веществу (концентрация
которого убывает в процессе реакции),
то полученное значение домножается на
−1.
Например
для реакции:
выражение
для скорости будет выглядеть так:
.
Скорость
химической реакции в каждый момент
времени пропорциональна концентрациям
реагентов, возведенным в некоторые
степени.
Для
элементарных
реакций
показатель степени при значении
концентрации каждого вещества часто
равен его стехиометрическому коэффициенту,
для сложных реакций это правило не
соблюдается. Кроме концентрации на
скорость химической реакции оказывают
влияние следующие факторы:
-
природа
реагирующих веществ, -
наличие
катализатора, -
температура
(правило
Вант-Гоффа), -
давление,
-
площадь
поверхности реагирующих веществ.
Если
мы рассмотрим самую простую химическую
реакцию A + B → C, то мы заметим, что
мгновенная
скорость химической реакции величина
непостоянная.
Катализа́тор —
химическое
вещество,
ускоряющее
реакцию,
но не входящее в состав продуктов
реакции[1].
Количество катализатора, в отличие от
других реагентов, после реакции не
изменяется. Важно понимать, что катализатор
участвует в реакции. Обеспечивая более
быстрый путь для реакции, катализатор
реагирует с исходным веществом,
получившееся промежуточное соединение
подвергается превращениям и в конце
расщепляется на продукт и катализатор.
Затем катализатор снова реагирует с
исходным веществом, и этот каталитический
цикл многократно (до миллиона
раз)[источник?]
повторяется.
Катализаторы
подразделяются на гомогенные
и гетерогенные.
Гомогенный катализатор находится в
одной фазе
с реагирующими веществами, гетерогенный —
образует самостоятельную фазу, отделённую
границей раздела от фазы, в которой
находятся реагирующие вещества [1].
Типичными гомогенными катализаторами
являются кислоты и основания. В качестве
гетерогенных катализаторов применяются
металлы, их оксиды и сульфиды.
Реакции
одного и того же типа могут протекать
как с гомогенными, так и с гетерогенными
катализаторами. Так, наряду с растворами
кислот применяются имеющие кислотные
свойства твёрдые Al2O3,
TiO2,
ThO2,
алюмосиликаты, цеолиты. Гетерогенные
катализаторы с основными свойствами:
CaO, BaO, MgO [1].
Гетерогенные
катализаторы имеют, как правило, сильно
развитую поверхность, для чего их
распределяют на инертном носителе
(силикагель,
оксид
алюминия,
активированный
уголь
и др.).
Для
каждого типа реакций эффективны только
определённые катализаторы. Кроме уже
упомянутых кислотно-основных,
существуют катализаторы
окисления-восстановления;
для них характерно присутствие переходного
металла
или его соединения (Со+3,
V2O5+MoO3).
В этом случае катализ осуществляется
путём изменения степени окисления
переходного металла.
Много
реакций осуществлено при помощи
катализаторов, которые действуют через
координацию
реагентов у атома или иона переходного
металла (Ti,
Rh,
Ni).
Такой катализ называется координационным.
Если
катализатор обладает хиральными
свойствами, то из оптически неактивного
субстрата получается оптически активный
продукт.
В
современной науке и технике часто
применяют системы
из нескольких катализаторов,
каждый из которых ускоряет разные стадии
реакции [2][3].
Катализатор также может увеличивать
скорость одной из стадий каталитического
цикла, осуществляемого другим
катализатором. Здесь имеет место «катализ
катализа», или катализ
второго уровня
(Имянитов).
В
биохимических реакциях роль катализаторов
играют ферменты.
Катализаторы
следует отличать от инициаторов.
Например, перекиси
распадаются на свободные
радикалы,
которые могут инициировать радикальные
цепные
реакции.
Инициаторы расходуются в процессе
реакции, поэтому их нельзя считать
катализаторами.
Ингибиторы
иногда ошибочно считают отрицательными
катализаторами. Но ингибиторы, например,
цепных радикальных реакций, реагируют
со свободными радикалами и, в отличие
от катализаторов, не сохраняются. Другие
ингибиторы (каталитические яды)
связываются с катализатором и его
дезактивируют, здесь имеет место
подавление катализа, а не отрицательный
катализ. Отрицательный катализ в принципе
невозможен: он обеспечивал бы для реакции
более медленный путь, но реакция,
естественно, пойдёт по более быстрому,
в данном случае, не катализированному,
пути.
23
Диспе́рсная
систе́ма —
это образования
из двух или более числа
фаз (тел),
которые совершенно или практически не
смешиваются и не реагируют друг с другом
химически. Первое из веществ (дисперсная
фаза)
мелко распределено во втором (дисперсионная
среда).
Если фаз несколько, их можно отделить
друг от друга физическим способом
(центрифугировать, сепарировать и т. д.).
Обычно
дисперсные системы — это коллоидные
растворы,
золи.
К дисперсным системам относят также
случай твёрдой дисперсной среды, в
которой находится дисперсная фаза.
Наиболее
общая классификация дисперсных систем
основана на различии в агрегатном
состоянии дисперсионной
среды и дисперсной фазы. Сочетания трех
видов агрегатного состояния позволяют
выделить девять видов дисперсных систем.
Для краткости записи их принято обозначать
дробью, числитель которой указывает на
дисперсную фазу, а знаменатель на
дисперсионную среду, например для
системы «газ в жидкости» принято
обозначение Г/Ж.
-
Дисперсная
фазаДисперсионная
средаНазвание
и примерГазообразная
Газообразная
Дисперсная
система не образуетсяЖидкая
Газообразная
Аэрозоли:
туманы,
облакаТвёрдая
Газообразная
Аэрозоли
(пыли, дымы), порошкиГазообразная
Жидкая
Газовые
эмульсии и пеныЖидкая
Жидкая
Эмульсии:
нефть,
крем,
молокоТвёрдая
Жидкая
Суспензии
и золи: пульпа, ил,
взвесь,
пастаГазообразная
Твёрдая
Пористые
телаЖидкая
Твёрдая
Капиллярные
системы: жидкость в пористых телах,
грунт,
почваТвёрдая
Твёрдая
Твёрдые
гетерогенные системы: сплавы,
бетон,
ситаллы,
композиционные
материалы
Коллоидные
растворы. Коллоидное состояние характерно
для многих веществ, если их частицы
имеют размер от 1 до 500 нм. Легко показать,
что суммарная поверхность этих частиц
огромна. Если предположить, что частицы
имеют форму шара с диаметром 10 нм, то
при общем объеме этих частиц
1
см3
они будут иметь
площадь
поверхности порядка 10 м2. Как указывалось
ранее поверхностный слой характеризуется
поверхностной энергией и способностью
адсорбировать те или иные частицы, в
том числе ионы
из
раствора. Характерной особенностью
коллоидных частиц является наличие на
их поверхности заряда, обусловленного
избирательной адсорбцией ионов.
Коллоидная частица имеет сложное
строение. Она включает в себя ядро,
адсорбированные ионы, противоины и
растворитель. Существуют лиофильные
(гид.
роф
ильные) коллоиды, в которых растворитель
взаимодейстиует с ядрами частиц,
илнофобные (гидрофобные) коллоиды, в
которых растворитель не взаимодействует
с ядрами
частиц.
Растворитель входит в состав гидрофобных
частиц лишь как сольватная оболочка
адсорбированных ионов или при наличии
стабилизаторов (ПАВ), имеющих лиофобную
и лиофильные части.
Приведем
несколько примеров коллоидных частиц:
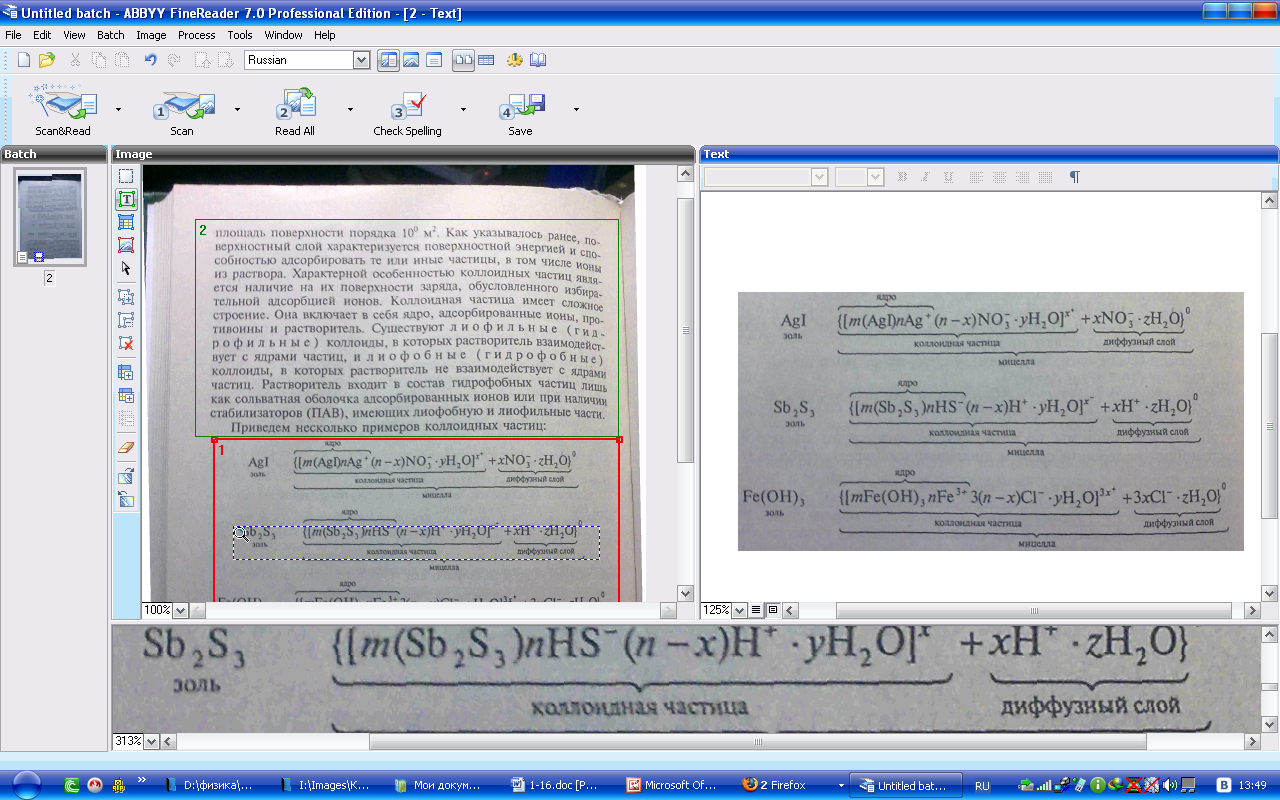
Как.
видно, ядро состоит из электронейтрального
агрегата частиц с адсорбированными
ионами элементов, входящих в состав
ядра (в данных примерах ионами Аg+,
НS-,
Fе3+).
Коллоидная час-шца кроме ядра имеет
противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы
с растворителем образуют адсорбированный
слой. Суммарно заряд частицы равен
разности зарядов адсороированных
ионов и противоионов. Вокруг частиц
находится д и ф ф у з н ы й с л о и и о
н о в, заряд которых равен иряду коллоидной
частицы. Коллоидная частица и диффузный
слои образуют электронейтральную
мицеллу
Мицеллы (уменьшительное
от лат. mica —
частица, крупинка) — частицы в
коллоидных
системах,
состоят из нерастворимого в данной
среде ядра очень малого размера,
окруженного стабилизирующей оболочкой
адсорбированных
ионов
и молекул
растворителя.
Например, мицелла сульфида
мышьяка
имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний
размер мицелл от 10−5
до 10−7см.
Коагуляция
– разделение коллоидного раствора на
две фазы – растворитель и студнеобразную
массу, или загустевание раствора в
результате укрупнения частиц растворенного
вещества
Пептизация
— процесс перехода коллоидного осадка
или геля в коллоидный раствор под
действием жидкости или добавленных к
ней веществ, хорошо адсорбирующихся
осадком или гелем, называемых в этом
случае пептизаторами (например, пептизация
жиров под действием желчи).
Пептизация
— разъединение агрегатов частиц гелей
(студней) или рыхлых осадков под влиянием
определенных веществ — пептизаторов
после коагуляции коллоидных растворов.
В результате пептизации осадок (или
гель) переходит во взвешенное состояние.
24
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Растворимость,
способность вещества образовывать с
другим веществом (или веществами)
гомогенные смеси с дисперсным
распределением компонентов (см. Растворы).
Обычно растворителем
считают вещество, которое в чистом виде
существует в том же агрегатном состоянии,
что и образовавшийся раствор. Если до
растворения
оба вещества находились в одном и том
же агрегатном состоянии, растворителем
считается вещество, присутствующее в
смеси в существенно большем кол-ве.
Растворимость
определяется физическим и химическим
сродством молекул
растворителя и растворяемого вещества,
соотношением энергий взаимодействием
однородных и разнородных компонентов
раствора. Как правило, хорошо растворимы
друг в друге подобные по физ. и хим.
свойствам вещества (эмпирич. правило
“подобное растворяется в подобном”).
В частности, вещества, состоящие из
полярных
молекул,
и вещества с ионным типом связи хорошо
раств. в полярных растворителях (воде,
этаноле,
жидком аммиаке), а неполярные вещества
хорошо раств. в неполярных растворителях
(бензоле, сероуглероде).
Согласно
теории, предложенной Дж. Гильдебрандом
(1935), взаимная растворимость неэлектролитов
возрастает с уменьшением разности их
параметров растворимости
d=(Е/V)1/2,
где Е-теплота испарения,
V-полярный объем. Параметр растворимости
– одно из осн. понятий, определяющих
когезионные свойства веществ в конденсир.
состояниях; важная технол. характеристика
полимеров
и растворителей, лакокрасочных
материалов
и т.п. (см. Когезия). Р. мн. электролитов
возрастает пропорционально кубу
диэлектрич. проницаемости растворителя.
Обычно более растворимы электролиты
с большей склонностью к сольватации
растворителем; образование кристаллогидратов
обычно увеличивает растворимость солей.
Растворимость
данного вещества зависит от температуры
и давления
соответствует общему принципу смещения
равновесий (см. Ле Шателье-Брауна
принцип). Концентрация
насыщенного раствора при данных условиях
численно определяет Р. вещества в данном
растворителе и также наз. растворимостью.
Пересыщенные растворы содержат большее
кол-во растворенного вещества, чем это
соответствует его растворимости,
существование пересыщенных растворов
обусловлено кинетич. затруднениями
кристаллизации
(см. Зарождение новой фазы). Для
характеристики растворимости
малорастворимых веществ используют
произведение
активностей
ПА (для растворов, близких по своим
свойствам к идеальному – произведение
растворимости ПР).
Способы
выражения концентрации растворов.
1)
Массовая доля раствора ω (х). Выражается
отношением массы растворенного вещества
m(х) к массе раствора.
Является
величиной безразмерной или выражается
в процентах:
Например,
15%-ный раствор: массовая доля ω (х) = 0,15
2)
Молярная концентрация раствора С(х).
Выражается отношением количества
растворенного вещества n(x) к объему
раствора, выраженному в литрах.
Т.к.
количество вещества n(x) выражается
отношением массы вещества m(x) к его
молярной массе M(x), то молярную концентрацию
раствора удобно выразить как
25
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
01.05.2015354.02 Кб230725259_F7873_baranenko_a_v_holodilnye_mashiny.pdf
- #
- #
- #
- #
01.05.20156.82 Mб301.doc
- #
- #
- #
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
477
Создан на
11 января, 2022 От Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к уменьшению скорости реакции натрия с хлором.
1) понижение температуры
2) повышение давления в системе
3) добавление хлорида натрия
4) увеличение концентрации хлора
5) понижение давления в системе
2 / 10
Из предложенного списка воздействий выберите те, которые приводят к увеличению скорости химической реакции магния с раствором серной кислоты.
1) повышение температуры
2) понижение давления в системе
3) увеличение давления в системе
4) добавление магния
5) увеличение концентрации кислоты
3 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления не приводит к увеличению скорости реакции.
1) 2P + 5Cl2(г) = 2PCl5
2) Fe + CuSO4(р-р) = FeSO4 + Cu
3) Ca + 2H2О(ж) = Ca(OH)2 + H2
4) Fe2О3 + H2(г) = 2FeO + H2О
5) 2KOH(р-р) + H2SO4(р-р) = K2SO4 + 2H2О
4 / 10
Из предложенного перечня выберите два вещества, взаимодействие которых будет протекать с наибольшей скоростью при равных условиях.
1) железо
2) цинк
3) магний
4) уксусная кислота
5) соляная кислота
Запишите в поле ответа номера выбранных веществ.
5 / 10
Из предложенного перечня выберите все факторы, которые приводят к уменьшению скорости химической реакции метана с кислородом.
1) уменьшение концентрации кислорода
2) уменьшение концентрации углекислого газа
3) уменьшение концентрации метана
4) понижение давления в системе
5) понижение температуры
6 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции железа с жидким бромом.
1) повышение давления в системе
2) понижение давления в системе
3) использование ингибитора
4) увеличение степени измельчения железа
5) повышение температуры
Запишите в поле ответа номера выбранных факторов.
7 / 10
Из предложенного перечня выберите все факторы, влияющие на скорость химической реакции кальция с соляной кислотой.
1) измельчение кусочка металла
2) повышение давления в системе
3) увеличение концентрации кислоты
4) разбавление кислоты
5) уменьшение температуры
8 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости химической реакции, схема которой
FeO(тв.) + CO(г)→ Fe(тв.) + CO2(г)
1) повышение давления
2) измельчение железа
3) понижение температуры
4) увеличение концентрации CO
5) увеличение концентрации CO2
Запишите в поле ответа номера выбранных внешних воздействий.
9 / 10
Из предложенного перечня выберите все реакции, которые при тех же условиях протекают с большей скоростью, чем взаимодействие натрия с этанолом.
1) взаимодействие лития с пропанолом-1
2) взаимодействие калия с этанолом
3) взаимодействие натрия с бутанолом-1
4) взаимодействие лития с этанолом
5) взаимодействие натрия с водой
10 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости химической реакции, уравнение которой
Zn(тв.) + 2НCl(р-р) = ZnCl2(р-р) + H2(г)
1) увеличение давления
2) увеличение концентрации ионов цинка
3) уменьшение температуры
4) увеличение концентрации кислоты
5) измельчение цинка
Запишите в поле ответа номера выбранных внешних воздействий.
Ваша оценка
The average score is 38%
Скорость химической реакции – основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
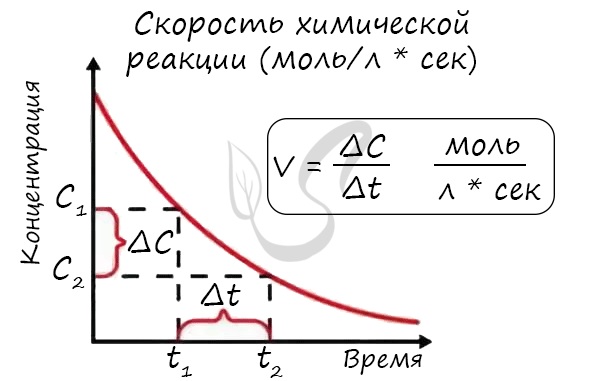
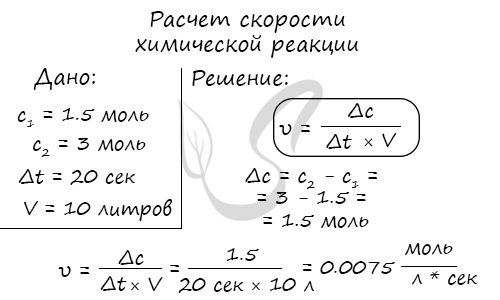
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции – 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо – железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос “какой из металлов Fe или Ca быстрее прореагирует с серой?” мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос “какой из металлов Li или K быстрее прореагирует с водой?” мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации “прямо пропорционально” скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении – понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости – k – в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени – a и b.
Записанное выше следствие закона действующих масс нужно не только “зазубрить”, но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: “Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!”
Очень часто в заданиях следующей темы – химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
Итак, влияние температуры на скорость реакции “прямо пропорционально”: чем выше температура, тем выше скорость реакции – чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая “пропорция”.
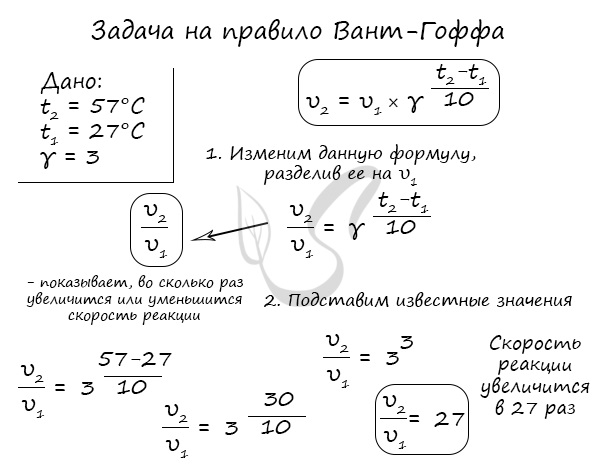
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
“При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза”

В формуле, написанной выше, используются следующие обозначение:
- υ1 – скорость реакции при температуре t1
- υ2 – скорость реакции при температуре t2
- γ – температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: “Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз”.

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) – вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов – белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
– каталитическими.

Ингибитор (лат. inhibere – задерживать) – вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
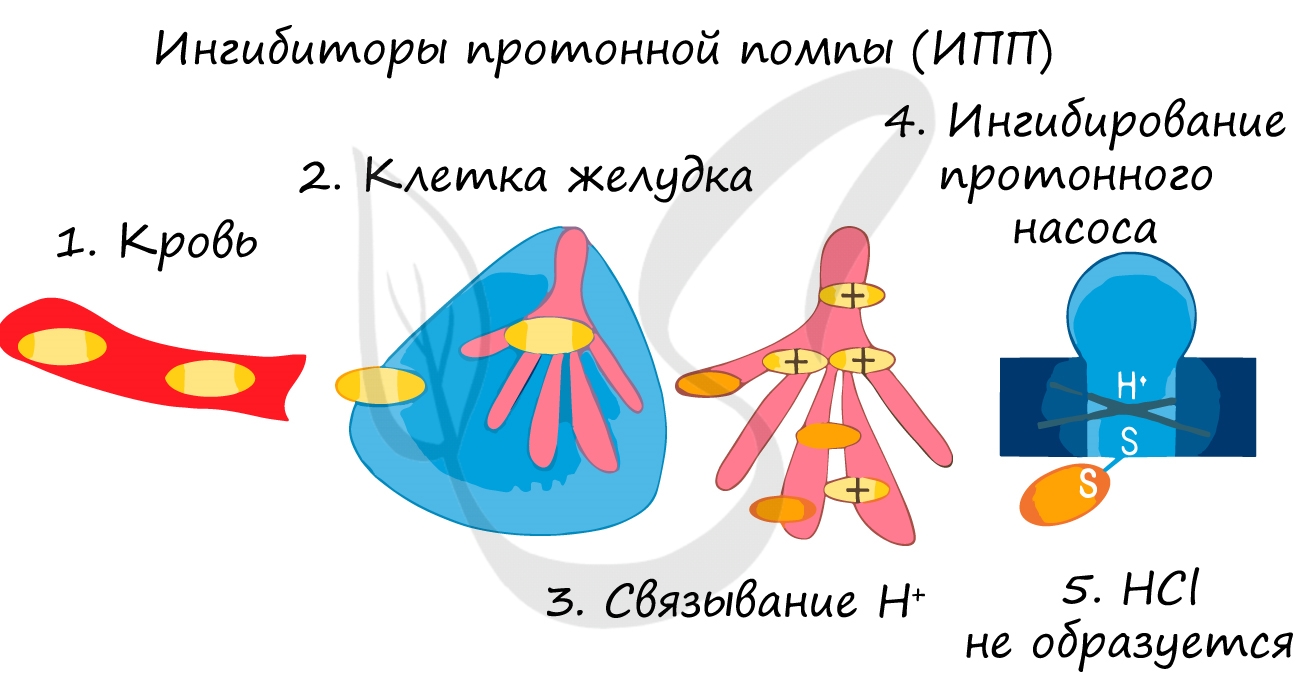
Так при лечении гастрита – воспаления желудка (греч. gaster – желудок) или язв часто назначаются ингибиторы протонной помпы – химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Учебно-методическое пособие
9 класс
Продолжение. См. 21, 22, 23/2003
2. Закономерности течения химических
реакций
2.1. Скорость химической реакции
Вычисление скорости химической реакции.
(Алгоритм 14.)
Задача. Вычислите среднюю скорость
химической реакции, если через 20 с от начала
реакции концентрация веществ составляла 0,05
моль/л, а через 40 с – 0,04 моль/л.
Зависимость скорости химической реакции
от концентрации реагентов.
(Алгоритм 15.)
Задача. Как изменится скорость
химической реакции
2СО + О2
2СО2,
если уменьшить объем газовой смеси в 2 раза?
Зависимость скорости реакции от температуры
(Алгоритм 16.)
Задача. Во сколько раз увеличится
скорость химической реакции при повышении
температуры от 300 до 350 °С, если температурный
коэффициент равен 2?
Задачи для
самоконтроля
1. Как изменится скорость реакции
2Fe + 3Cl2
2FeCl3,
если давление системы увеличить в 5 раз?
Ответ. Увеличится в 125 раз.
2. Скорость реакции при охлаждении от 80 до
60 °С уменьшилась в 4 раза. Найти температурный
коэффициент скорости реакции.Ответ. 2.
3. Реакция при 50 °С протекает за 2 мин 15 с. За
какое время закончится эта реакция
при t = 70 °C, если температурный коэффициент
равен 3?Ответ. 15 с.
2.2. Термохимические уравнения
В термохимических уравнениях в отличие от
химических указывается тепловой эффект
химической реакции и между левой и правой
частями уравнения принято ставить знак
равенства (=).
Тепловой эффект Q измеряется в килоджоулях
(кДж), в случае экзотермических реакций он
положителен, а в случае эндотермических реакций
отрицателен.
Энтальпия () –
величина, характеризующая внутреннюю энергию
вещества, обратная по знаку тепловому эффекту,
имеет размерность кДж на моль (кДж/моль).
Две возможные формы записи термохимического
уравнения:
2Н2 (г.) + О2 (г.) = 2Н2О (г.) +
483,6 кДж
или
Н2 (г.) + 1/2О2 (г.) = Н2О (г.),
= –241,8 кДж/моль.
Закон Гесса: тепловой эффект
реакции равен разности между суммой теплот
образования продуктов реакции и суммой теплот
образования исходных веществ:
При химической реакции теплота выделяется или
поглощается. Реакции, протекающие с выделением
теплоты, называются экзотермическими реакциями,
а сопровождающиеся поглощением теплоты –
эндотермическими.
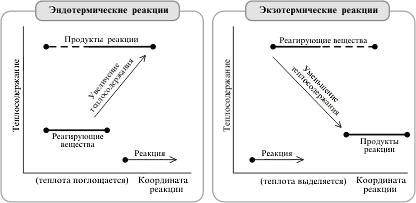 |
Эндотермические и экзотермические реакции |
Вычисление теплового эффекта реакции
по известному термохимическому уравнению.
(Алгоритм 17.)
Задача. По термохимическому уравнению
N2 (г.) + О2 (г.) = 2NО (г.) – 180,7 кДж
вычислите, сколько поглотится теплоты при
вступлении в реакцию 5,6 л азота (н. у.).
Составление термохимического уравнения.
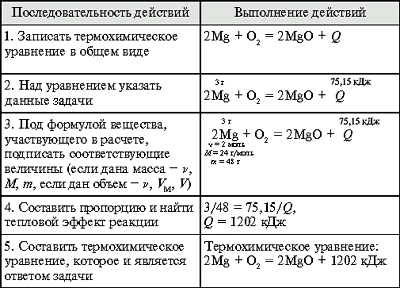
(Алгоритм 18.)
Задача. При сжигании 3 г магния
выделилось 75,15 кДж теплоты. Составьте
термохимическое уравнение реакции горения
магния.
Вычисление теплоты сгорания вещества.
(Алгоритм 19.)
Задача. По термохимическому уравнению
реакции
2СО (г.) + О2 (г.) = 2СО2 (г.) + 566,5
кДж
вычислите теплоту сгорания оксида углерода(II).
Вычисление теплоты образования вещества.
(Алгоритм 20.)
Задача. При сжигании 93 г белого
фосфора выделилось 2322 кДж теплоты. Рассчитайте
теплоту образования оксида фосфора(V).
Вычисление теплового эффекта реакции по
закону Гесса.
(Алгоритм 21.)
Задача. Вычислите тепловой эффект
реакции
Fe2O3 + 2Al Al2O3 + 2Fe,
если теплота образования оксида железа(III)
составляет +821,5 кДж/моль, а теплота образования
оксида алюминия +1675,7 кДж/моль (теплота
образования простого вещества равна нулю).
Задания для
самоконтроля
1. Составьте термохимическое уравнение реакции
разложения карбоната кальция, если при
разложении 40 г карбоната кальция поглощается 70,8
кДж теплоты.Ответ. CaCO3 = CaO + CO2
– 177 кДж/моль.
2. Сколько теплоты выделится при полном
сгорании 1 м3 смеси, состоящей из 30% (по
объему) этилена и 70% ацетилена, если при сгорании 1
моль этих веществ выделяется соответственно 1400 и
1305 кДж?Ответ. 59 531 кДж.
3. Вычислите теплоту сгорания ацетилена С2Н2,
если теплота образования углекислого газа 393,5
кДж/моль, водяного пара – 242 кДж/моль, ацетилена –
226,8 кДж/моль.Ответ. 1604,4 кДж.
2.3. Химическое равновесие
Принцип Ле Шателье: если на
систему, находящуюся в равновесии, производится
внешнее воздействие (изменяется температура,
давление или концентрация), то равновесие
смещается в том направлении, которое ослабляет
это воздействие.
Влияние температуры
а) А + В С + Q.
При экзотермической реакции увеличение
температуры приводит к тому, что скорость
обратной реакции обр
становится больше скорости прямой реакции пр, т. е.
обр >
пр.
б) А + В С – Q.
При эндотермической реакции увеличение
температуры приводит к тому, что обр <
пр.
Влияние давления (для газов)
Увеличение давления приводит к смещению
равновесия в сторону реакции, ведущей к
образованию меньшего числа молекул.
Увеличение давления
пр >
обр.
Влияние концентрации реагентов
а) Увеличение концентрации исходных веществ
приводит к росту скорости прямой реакции: пр >
обр.
б) Увеличение концентрации продуктов реакции
пр <
обр.
Влияние катализатора
Катализатор не смещает химическое равновесие,
а только ускоряет его достижение.
Константа равновесия К для реакции аА + bВ
cC + dD
равна:
где [A], [B], [С], [D] – равновесные концентрации
веществ в моль/л;
а, b, c, d – стехиометрические коэффициенты в
уравнении реакции.
Равновесная концентрация: сравн = сисх
– спрореагир.
Исходная концентрация: сисх = сравн + спрореагир.
Использование принципа Ле Шателье.
(Алгоритм 22.)
Задание. При определенных условиях
реакция хлороводорода с кислородом является
обратимой:
4НСl (г.) + O2 (г.) 2Сl2 (г.) + Н2O (г.),
= –116,4 кДж.
Какое влияние на равновесное состояние системы
окажут:
а) увеличение давления;
б) повышение температуры;
в) увеличение концентрации кислорода;
г) введение катализатора?
Вычисление константы равновесия реакции.
(Алгоритм 23.)
Задача. Вычислите константу
равновесия для реакции
СО2 + Н2 СО + Н2О,
если равновесная концентрация углекислого
газа равна 0,02 моль/л, водорода – 0,005 моль/л, а
угарного газа и воды – по 0,01 моль/л.
Вычисление исходных концентраций веществ.
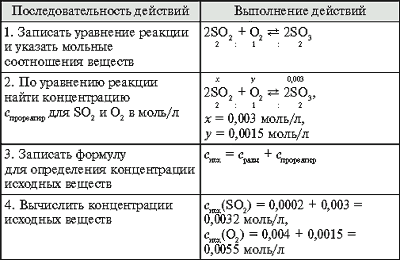
(Алгоритм 24.)
Задача. Обратимая реакция выражается
уравнением
2SO2 + O2 2SO3.
Известны равновесные концентрации: для оксида
серы(IV) – 0,0002 моль/л, для кислорода – 0,004 моль/л,
для оксида серы(VI) – 0,003 моль/л. Найдите исходные
концентрации кислорода и сернистого газа.
Задания для
самоконтроля
1. Уравнение реакции
Н2 + I2
2HI.
Даны равновесные концентрации: водорода – 0,004
моль/л, йода – 0,25 моль/л, йодоводорода – 0,08 моль/л.
Вычислить исходные концентрации водорода и йода
и константу равновесия.Ответ. [H2] = 0,044 моль/л,
[I2] = 0,29 моль/л,
К = 6,4.2. Как изменится давление к моменту наступления
равновесия в реакцииN2 + 3Н2
2NН3,
протекающей в закрытом сосуде при постоянной
температуре, если начальные концентрации азота и
водорода равны соответственно 2 и 6 моль/л и если
равновесие наступает тогда, когда прореагирует
10% первоначального количества азота?Ответ. Уменьшится в 1,05 раза.
3. В какую сторону сместится равновесие реакций:
2H2S
2Н2 + 2S – Q,
N2O4
2NO2 – Q,
CO + H2O (г.)
СО2 + Н2 + Q,
а) при понижении температуры;
б) при повышении давления?Ответ. Смещение равновесия в реакциях:
а) при понижении температуры:
2Н2S2Н2
+ 2S – Q – влево,
N2O4
2NO2 – Q – влево,
CO + H2O (г.)
СО2 + Н2 + Q – вправо;б) при повышении давления:
2Н2S2Н2
+ 2S – Q – не сместится,
N2O4
2NO2 – Q – влево,
CO + H2O (г.)
СО2 + Н2 + Q – не сместится.
И.М.ХАРЧЕВА,
М.А.АХМЕТОВА
Температурный коэффициент некоторой химической реакции равен 4. Как изменится скорость этой химической реакции при нагревании реакционной смеси от 20 до 50 градусов?
Решение задачи
Зависимость скорости химической реакции от температуры определяет правило Вант-Гоффа, которым мы воспользуемся при решении задачи.
Правило Вант-Гоффа: скорость большинства химических реакций при повышении температуры на каждые 10 возрастает в 2-4 раза.
Математически правило Вант-Гоффа выражается формулой:
где:
– температурный коэффициент;
– скорость химической реакции при температурах
, соответственно.
Учитывая то, что по условию задачи температурный коэффициент равен 4, а температура повысилась на 30 градусов, вычислим, как изменилась скорость химической реакции:
Таким образом, скорость химической реакции увеличилась в 64 раза.
Ответ: скорость химической реакции увеличилась в 64 раза.