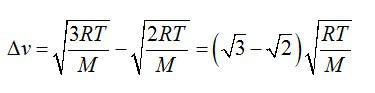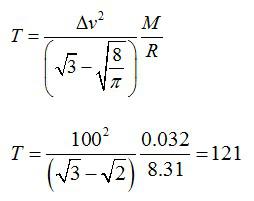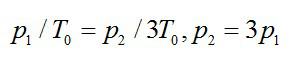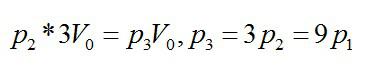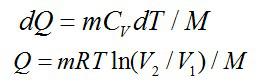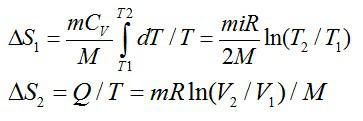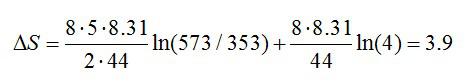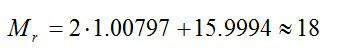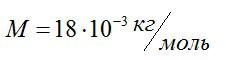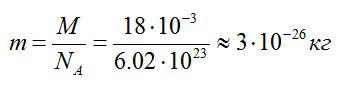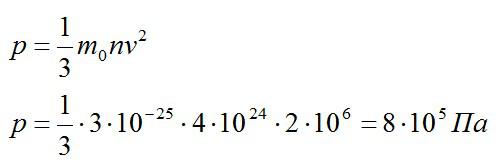Температура газа с учетом среднеквадратичной скорости и молярной массы Калькулятор
| Search | ||
| Дом | Химия ↺ | |
| Химия | Кинетическая теория газов ↺ | |
| Кинетическая теория газов | Температура газа ↺ |
|
✖Среднеквадратичная скорость представляет собой значение квадратного корня из суммы квадратов значений скорости укладки, деленное на количество значений.ⓘ Среднеквадратичная скорость [CRMS] |
+10% -10% |
||
|
✖Молярная масса – это масса данного вещества, деленная на количество вещества.ⓘ Молярная масса [Mmolar] |
+10% -10% |
|
✖Температура газа является мерой тепла или холода газа.ⓘ Температура газа с учетом среднеквадратичной скорости и молярной массы [Tg] |
⎘ копия |
Температура газа с учетом среднеквадратичной скорости и молярной массы Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Среднеквадратичная скорость: 10 метр в секунду –> 10 метр в секунду Конверсия не требуется
Молярная масса: 44.01 Грамм на моль –> 0.04401 Килограмм на моль (Проверьте преобразование здесь)
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
0.176439544847679 Кельвин –> Конверсия не требуется
12 Температура газа Калькуляторы
Температура газа с учетом среднеквадратичной скорости и молярной массы формула
Температура газа = ((Среднеквадратичная скорость)^2)*Молярная масса/(3*[R])
Tg = ((CRMS)^2)*Mmolar/(3*[R])
Каковы постулаты кинетической теории газов?
1) Фактический объем молекул газа незначителен по сравнению с общим объемом газа. 2) отсутствие силы притяжения между молекулами газа. 3) Частицы газа находятся в постоянном беспорядочном движении. 4) Частицы газа сталкиваются друг с другом и со стенками емкости. 5) Столкновения абсолютно эластичны. 6) Различные частицы газа имеют разную скорость. 7) Средняя кинетическая энергия молекулы газа прямо пропорциональна абсолютной температуре.
|
0 / 0 / 0 Регистрация: 25.10.2015 Сообщений: 22 |
|
|
1 |
|
Средняя квадратичная скорость13.01.2016, 16:35. Показов 3110. Ответов 8
Молекулы углекислого газа имеют среднюю квадратичную скорость 400 м/с. Какова будет величина этой скорости после изобарического сжатия газа, при котором объем его уменьшится в два раза? Определить температуру газа до и после сжатия
0 |
|
4174 / 2817 / 707 Регистрация: 16.09.2012 Сообщений: 11,471 |
|
|
13.01.2016, 17:09 |
2 |
|
Предполагаю, что v=400*21/2 м/сек
0 |
|
0 / 0 / 0 Регистрация: 25.10.2015 Сообщений: 22 |
|
|
13.01.2016, 17:16 [ТС] |
3 |
|
Hant, Получается примерно так. Не понимаю откуда взялся корень и как дальше найти температуры
0 |
|
4174 / 2817 / 707 Регистрация: 16.09.2012 Сообщений: 11,471 |
|
|
13.01.2016, 17:22 |
4 |
|
и как дальше найти температуры Из формулы средней квадратичной скорости:
0 |
|
0 / 0 / 0 Регистрация: 25.10.2015 Сообщений: 22 |
|
|
13.01.2016, 17:27 [ТС] |
5 |
|
Предполагаю, что v=400*21/2 м/сек Спасибо. Еще вопрос почему тут корень? если v1=2v2
0 |
|
4174 / 2817 / 707 Регистрация: 16.09.2012 Сообщений: 11,471 |
|
|
13.01.2016, 17:34 |
6 |
|
Спасибо. Еще вопрос почему тут корень? Потому, что температура будет в два раза больше, а она находится под корнем.
0 |
|
761 / 662 / 195 Регистрация: 24.11.2015 Сообщений: 2,158 |
|
|
22.01.2016, 18:37 |
7 |
|
Надо 400/sqrt2 . Hant, что за дела? Если температура поднимается (а при сжатии она поднимается), то скорость увеличивается. Первый ответ правильный был.
0 |
|
372 / 342 / 42 Регистрация: 14.07.2015 Сообщений: 2,890 |
|
|
25.01.2016, 13:37 |
8 |
|
Если температура поднимается (а при сжатии она поднимается) А вот и нет. Газ сжимается, а давление остается постоянным. Это возможно если мы или газ выпускаем или остужаем его. Температура упадет в 2 раза. Скорость уменьшится в корень из двух раз.
1 |
|
761 / 662 / 195 Регистрация: 24.11.2015 Сообщений: 2,158 |
|
|
25.01.2016, 14:31 |
9 |
|
Газ сжимается, а давление остается постоянным
после изобарического сжатия газа, Sorry, невнимательно прочитал условие задачи
0 |
Представляем формулу основного уравнения молекулярно-кинетической теории (МКТ) газов:
(где n=NV – это концентрация частиц в газе, N – это число частиц, V – это объем газа, 〈E〉 – это средняя кинетическая энергия поступательного движения молекул газа, υkv – это средняя квадратичная скорость, m0 – это масса молекулы) связывает давление – макропараметр, достаточно просто измеряющийся с такими микропараметрами, как средняя энергия движения отдельной молекулы (или в другом выражении), как масса частицы и ее скорость. Но находя только лишь давление, нельзя установить кинетические энергии частиц отдельно от концентрации. Поэтому для нахождения в полном объеме микропараметров нужно знать еще какую-то физическую величину, связанную с кинетической энергией частиц, составляющих газ. За данную величину можно взять термодинамическую температуру.
Газовая температура
Для определения газовой температуры нужно вспомнить важное свойство, которое сообщает о том, что в условиях равновесия средняя кинетическая энергия молекул в смеси газов одинаковая для различных компонентов данной смеси. Из данного свойства следует то, что если 2 газа в различных сосудах находятся в тепловом равновесии, тогда средние кинетические энергии молекул данных газов одинаковые. Это свойство мы и будем использовать. К тому же в ходе экспериментов доказано, что для любых газов (при неограниченном числе), которые находятся в состоянии теплового равновесия, справедливо следующее выражение:
С учетом вышесказанного, используем (1) и (2) и получаем:
Из уравнения (3) следует, что величина θ, которой мы обозначили температуру, вычисляется в Дж, в чем измеряется также и кинетическая энергия. В лабораторных работах температура в системе измерения вычисляется в кельвинах. Поэтому введем коэффициент, который уберет данное противоречие. Он обозначается k, измеряется в ДжК и равняется 1,38·10-23. Данный коэффициент называется постоянной Больцмана. Таким образом:
θ=kT (4), где T – это термодинамическая температура в кельвинах.
Связь термодинамической температуры и средней кинетической энергией теплового движения молекул газа выражается формулой:
E=32kT (5).
Из уравнения (5) видно, что средняя кинетическая энергия теплового движения молекул прямо пропорциональна температуре газа. Температура является абсолютной величиной. Физический смысл температуры заключается в том, что она, с одной стороны, определяется средней кинетической энергией, которая приходится на 1 молекулу. А с другой стороны, температура – это характеристика системы в целом. Таким образом, уравнение (5) показывает связь параметров макромира с параметрами микромира.
Известно, что температура – это мера средней кинетической энергии молекул.
Можно установить температуру системы, а затем рассчитать энергию молекул.
Абсолютный ноль температур
В условиях термодинамического равновесия все составляющие системы характеризуются одинаковой температурой.
Температура, при которой средняя кинетическая энергия молекул равняется 0, давление идеального газа равняется 0, называется абсолютным нулем температур. Абсолютная температура никогда не является отрицательной.
Необходимо найти среднюю кинетическую энергию поступательного движения молекулы кислорода, если температура T=290 K. А также найти среднюю квадратичную скорость капельки воды диаметра d=10-7 м, взвешенной в воздухе.
Решение
Найдем среднюю кинетическую энергию движения молекулы кислорода по уравнению, связывающему энергию и температуру:
E=32kT (1.1).
Поскольку все величины заданы в системе измерения, проведем вычисления:
E=32·1,38·10-23·10-7=6·10-21 Дж.
Перейдем ко второй части задания. Положим, что капелька, взвешенная в воздухе, – это шар (рисунок 1). Значит, массу капельки можно рассчитать как:
m=ρ·V=ρ·πd36.
Рисунок 1
Найдем массу капельки воды. Согласно справочных материалов, плотность воды в нормальных условиях равняется ρ=1000 кгм3, тогда:
m=1000·3,14610-73=5,2·10-19 (кг).
Масса капельки чрезмерно маленькая, поэтому, сама капелька сравнима с молекулой газа, и тогда можно использовать при расчетах формулу средней квадратичной скорости капли:
E=mυkυ22 (1.2),
где 〈E〉 мы уже установили, а из (1.1) понятно, что энергия не зависит от разновидности газа, а зависит только лишь от температуры. Значит, мы можем применить полученную величину энергии. Найдем из (1.2) скорость:
υkυ=2Em=6·2Eπρd3=32kTπρd3 (1.3).
Рассчитаем:
υkυ=2·6·10-215,2·10-19=0,15 мс
Ответ: Средняя кинетическая энергия поступательного движения молекулы кислорода при заданной температуре равняется 6·10-21 Дж. Средняя квадратичная скорость капельки воды при заданных условиях равняется 0,15 м/с.
Средняя энергия поступательного движения молекул идеального газа равняется 〈E〉, а давление газа p. Необходимо найти концентрацию частиц газа.
Решение
В основу решения задачи положим уравнение состояния идеального газа:
p=nkT (2.1).
Прибавим к уравнению (2.1) уравнение связи средней энергии поступательного движения молекул и температуры системы:
E=32kT (2.2).
Из (2.1) выражаем необходимую концентрацию:
n=pkT 2.3.
Из (2.2) выражаем kT:
kT=23E (2.4).
Подставляем (2.4) в (2.3) и получаем:
n=3p2E
Ответ: Концентрацию частиц можно найти по формуле n=3p2E.






Чтобы получить решение, напишите мне в WhatsApp, оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным, не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу, я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Найти температуру, при которой средняя квадратичная скорость молекул азота больше их средней арифметической скорости на 50 м/с.
Решение.
Средняя квадратичная и средняя арифметическая скорости молекул газа вычисляются по формулам: , , где Дж/(моль∙К) – универсальная газовая постоянная; – температура газа; – молярная масса газа. Поскольку , то при одинаковой температуре средняя квадратичная скорость всегда больше наиболее вероятной скорости. Разность скоростей известна:
- При какой температуре T средняя квадратичная скорость мо¬лекул кислорода больше их наиболее вероятной скорости Vв на V = 100 м/с?
- При какой температуре T средняя квадратичная скорость молекул кислорода больше их наиболее вероятной скорости на V = 100 м/с? Молярная масса кислорода M = 3,2•10-2 кг/моль.
- Аргон нагревается в открытом сосуде при нормальном атмосферном давлении от 300 до 600 К. На сколько при этом изменяется число молекул в единице объёма газа?
- Определить температуру газа, при которой средняя квадратичная скорость молекул водорода больше их наиболее вероятной скорости наxa0 = 400 м/с. Найти среднюю арифметическую скорость молекул водорода при
Любишь теорию – люби и задачи решать. Во всяком случае, лучше полюбить, ведь заниматься этим все равно придется. Сегодня занимаемся решением задач по молекулярно-кинетической теории и радуемся.
Присоединяйтесь к нам в телеграм и будьте в курсе самых актуальных студенческих новостей.
А прежде чем приступать к решению задач, вспомните памятку по решению задач по физике и держите наготове основные формулы.
Задачи по молекулярно-кинетической теории
Задача №1. Средняя квадратичная скорость молекул и температура
Условие
При какой температуре средняя квадратичная скорость молекул кислорода больше их наиболее вероятной скорости на 100 м/с.
Решение
Находим разницу скоростей, используя формулы для средней квадратичной и наиболее вероятной скорости молекул:
Отсюда выражаем температуру:
Ответ: 121 К.
Задача №2. Изопроцессы
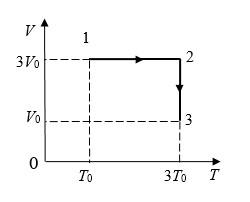
Условие
На диаграмме V – T изображены процессы перехода идеального газа постоянного количества из состояния 1 в состояние 3. Каким соотношением связаны конечное давление Р3 и начальное давление Р1?
Решение
При изохорном процессе:
Далее при изотермическом:
Ответ: Р3=9Р1
Задача №3. Приращение энтропии
Условие
Найти приращение энтропии при переходе массы m=8 г углекислого газа от объема V1=10 л при температуре t1=80° С к объему V2=40 л при температуре t2=300° С.
Решение
Рассмотрим процесс перехода между состояниями вначале по
изохоре, а затем по изотерме:
Соответствующие изменения при каждом процессе:
В сумме получаем общее изменение энтропии:
Ответ: 3,9 Дж/К.
Задача №4. Молярная масса
Условие
Каковы масса и молярная масса одной молекулы воды.
Решение
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Их относительные атомные массы берем в таблице Менделеева, а затем вычисляем относительную молярную массу молекулы:
Молярная масса воды:
Чтобы найти массу одной молекулы, разделим массу моля воды на количество молекул, содержащихся в нем (число Авогадро):
Ответ: 3*10^-26 кг.
Задача №5. Основное уравнение молекулярно-кинетической теории
Условие
Каково давление газа на стенки сосуда, если известны средний квадрат скорости его молекул (2*10^6 м2/с2), концентрация молекул (4*10^24 1/м^3) и масса одной молекулы (3*10^-25 кг).
Решение
Используем основное уравнение МКТ:
Ответ: 800 кПа.
Вопросы по молекулярно кинетической теории
Вопрос 1. Что такое основное уравнение МКТ?
Ответ. Основное уравнение МКТ – это уравнение, которое связывает макроскопические параметры системы (давление, объем, температура) с микроскопическими (масса молекул, скорость движения молекул)
Вопрос 2. Сформулируйте основные положения МКТ.
Ответ. Основные положения молекулярно-кинетической теории:
- Все вещества могут быть в жидком, твердом и газообразном состоянии. Вещество состоит из частиц (молекулы, атомы, ионы). Элементарные молекулы могут иметь сложное строение, то есть иметь в своем составе несколько атомов. Молекулы и атомы – электрически нейтральные частицы, которые в определенных условиях приобретают дополнительный электрический заряд и переходят в положительные или отрицательные ионы.
- Частицы вещества постоянно находятся в хаотическом движении.
- Силы, с которыми частицы взаимодействуют между собой, имеют электрическую природу. Гравитационным взаимодействием между частицами можно пренебречь.
Вопрос 3. Что такое 1 моль вещества?
Ответ. Это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода.
Вопрос 4. Каково экспериментальные подтверждение хаотического движения молекул?
Ответ. Броуновское движение – наиболее очевидное подтверждение второго положения МКТ.
Броуновское движение – это тепловое хаотическое движение микроскопических частиц, взвешенных в жидкости или газе.
Было открыто ботаником Робертом Броуном в 1827 году на примере пыльцы, но первые сведения об описании подобных явлений относятся к Древнему Риму.
Вопрос 5. Что происходит с кинетической энергией теплового движения молекул при спаде температуры.
Ответ. С ростом температуры кинетическая энергия теплового движения увеличивается, а при спаде температуры – наоборот, уменьшается.
В 19 веке существовала гипотеза тепловой смерти Вселенной, согласно которой в определенный момент, при достижении абсолютного нуля температуры, все процессы остановятся, и Вселенная придет в состояние термодинамического равновесия. В настоящее время эта теория опровергнута.
Нужна помощь в решении задач и других заданий по учебе? Профессиональный студенческий сервис и его лучшие специалисты всегда к вашим услугам и справятся с любой темой.