Физика, 10 класс
Урок №19. Температура. Энергия теплового движения молекул
На уроке рассматриваются понятия: температура и тепловое равновесие; шкалы Цельсия и Кельвина; абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества, зависимость давления от концентрации молекул и температуры.
Глоссарий по теме:
Макроскопические параметры – величины объём V, давление p и температура t, характеризующие состояние макроскопических тел без учёта их молекулярного строения.
Температура характеризует степень нагретости тела (холодное, тёплое, горячее).
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Тепловым равновесием называют – такое состояние тел, при котором температура во всех точках системы одинакова.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
Абсолютная температура Т прямо пропорциональна температуре Θ (тета), выражаемой в энергетических единицах (Дж).
Абсолютный нуль – предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или объём идеального газа стремится к нулю при неизменном давлении.
Абсолютный нуль – температура, при которой прекращается тепловое движение молекул.
Абсолютная шкала температур (Шкала Кельвина) – здесь нулевая температура соответствует абсолютному нулю, а каждая единица температуры равна градусу по шкале Цельсия.
Кельвин – единица абсолютной температуры в Международной системе измерений (СИ).
Постоянная Больцмана – коэффициент , связывает температуру Θ энергетических единицах (Дж) с абсолютной температурой Т (К).
, связывает температуру Θ энергетических единицах (Дж) с абсолютной температурой Т (К).
Абсолютная температура есть мера средней кинетической энергии молекул.
Давление газа прямо пропорционально концентрации его молекул и абсолютной температуре Т.
Закон Авогадро – в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул
Обязательная литература:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 195 – 203.
Дополнительная литература:
- Смородинский Я.А. Температура. – 3-е издание. – М.: Бюро Квантум, 2007. (Библиотечка «Квант». Вып. 103. Приложение к журналу «Квант» № 5/2007.) С. 5— 25.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. – С. 111-115.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. – С. 65 – 67.
- Орлов В.А., Сауров Ю.А. Практика решения физических задач. 10-11классы. – М.: Вентана-Граф, 2014. – С. 98-99.
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
Теоретический материал для самостоятельного изучения
Измеряя расположение звёзд на небе, расстояния на земле, время, люди знали, для чего они это делают и изобретали, телескопы, часы, прототипы современных линеек. О температуре такого же сказать было нельзя. О том, что такое тепловое равновесие и что означает степень нагрева тела (температура), существовали разные мнения. Но человек с незапамятных времен точно знал, что, когда два тела плотно соприкасаются, между ними устанавливается, выражаясь современным языком, тепловое равновесие.
Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходят в состояние теплового равновесия.
Тепловым равновесием называют такое состояние тел, при котором температура во всех точках системы одинакова.
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
К числу характеристик состояния макроскопических тел (твёрдых тел, жидкостей, газов) и процессов изменения их состояний, относят объём, давление и температуру. Эти величины описывают в целом тела, состоящие из большого числа молекул, а не отдельные молекулы. При этом микроскопические процессы внутри тела не прекращаются при тепловом равновесии: расположения молекул всё время меняются и меняются их скорости при столкновениях.
Величины объём, давление и температуру, характеризующие состояние макроскопических тел без учёта их молекулярного строения, называют макроскопическими параметрами.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Для точной характеристики нагретости тела, необходим прибор, способный измерить температуры тел и дать возможности их сравнения.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
В 1597 году Галилей создал термоскоп, в собственных сочинениях учёного нет описания этого прибора, но его ученики засвидетельствовали этот факт. Аппарат представлял собой устройство для поднятия воды при помощи нагревания.
Изобретение термометра, данные которого не зависели бы от перепадов атмосферного давления, произошли благодаря экспериментам физика Э. Торричелли, ученика Галилея.
Во всех приборах, изобретённых в XVIII веке, измерение температуры было относительно расширению столбика воды, спирта или ртути и произвольности выбора начала отсчёта, т.е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Необходимо было изобрести такую шкалу, чтобы избавиться от зависимости выбранного вещества, на основе которого формировалось градуирование.
Шкала, предложенная шведским учёным Андерсом Цельсием в 1742 г., точно устанавливала положение двух точек: 0 и 100 градусов. По шкале Цельсия температура обозначается буквой t, измеряется в градусах Цельсия (ºС).
На территории Англии и США используется шкала Фаренгейта. Такая шкала была предложена немецким учёным Даниелем Габриелем Фаренгейтом в 1724 г.: 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
Рене Антуан де Реомюр не одобрял применения ртути в термометрах вследствие малого коэффициента расширения ртути. В 1730 году изобрёл водно-спиртовой термометр и предложил шкалу от 0 до 80°.
Шкала Реомюра очень долго использовалась на родине учёного во Франции вплоть до настоящего времени.
Различные жидкости при нагревании расширяются не одинаково. Поэтому расстояния на шкале между нулевой отметкой 0 °C и 100 °C будут разными.
Однако существует способ создать тело, которое приближенно обладает нужными качествами. Это идеальный газ. Было замечено, что в отличие от жидкостей все разряжённые газы – водород, гелий, кислород – расширяются при нагревании одинаково и одинаково меняют своё давление при изменении температуры. Это свойство газов позволяет избавиться в термометрах от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчёта, то есть нулевой температуры.
При тепловом равновесии, если давление и объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура.
Практически такую проверку произвести непосредственно невозможно, но с помощью основного уравнения молекулярно-кинетической теории её можно выразить через макроскопические параметры:

 ;
;  ;
;  ;
;  ;
; 

Если кинетическая энергия действительно одинакова для всех газов в состоянии теплового равновесия, то и значение давления р должно быть тоже одинаково для всех газов при постоянном значении отношения объёма к числу молекул. Подтвердить или опровергнуть данное предположение может только опыт.

Возьмём несколько сосудов, заполненных различными газами, например, водородом, гелием и кислородом. Сосуды имеют определённые объёмы и снабжены манометрами, для измерения давления газов в сосудах. Массы газов известны, тем самым известно число молекул в каждом сосуде. Приведём газы в состояние теплового равновесия. Для этого поместим их в тающий лёд и подождём, пока не установится тепловое равновесие и давление газов перестанет меняться.
Здесь устанавливается тепловое равновесие и все газы имеют одинаковую температуру 0 °С. При этом показания манометра показывают разное давление р, объёмы сосудов V изначально были разными и число молекул N различно, так как газы, закаченные в баллоны разные. Найдём отношение для водорода всех параметров для одного моля вещества:

Такое значение отношения произведения давления газа на его объём к числу молекул получается для всех газов при температуре тающего льда. Обозначим это отношение через Θ0 (тета нулевое):

Таким образом, предположение, что средняя кинетическая энергия, а также давление р в состоянии теплового равновесия одинаковы для всех газов, если их объёмы и количества вещества одинаковы или если отношение

Если же сосуды с газами поместить в кипящую воду при нормальном атмосферном давлении, то согласно эксперименту, отношение макроскопических параметров будет также одинаковым для всех газов, но значение будет больше предыдущего

Отсюда следует, что величина Θ растёт с повышением температуры и не зависит от других параметром, кроме температуры. Этот опытный факт позволяет рассматривать величину Θ тета как естественную меру температуры и измерять в энергетических единицах — джоулях.
А теперь вместо энергетической температуры введём температуру, которая будет измеряться в градусах. Будем считать величину тета Θ прямо пропорциональной температуре Т, где k- коэффициент пропорциональности

Так как  , то тогда
, то тогда 
По этой формуле вводится температура, которая даже теоретически не может быть отрицательной, так как все величины левой части этого равенства больше или равны нулю. Следовательно, наименьшим значением этой температуры является нуль, при любом другом параметре p, V, N равным нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Тепловое движение молекул непрерывно и бесконечно, а при абсолютном нуле молекулы поступательно не двигаются. Следовательно, абсолютный нуль температур при наличии молекул вещества не может быть достигнут. Абсолютный нуль температур — это самая низкая температурная граница, верхней не существует, та «наибольшая или последняя степень холода», существование которой предсказывал М.В. Ломоносов.
В 1848 г. английскому физику Вильяму Томсону (лорд Кельвин) удалось построить абсолютную температурную шкалу (её в настоящее время называют шкалой Кельвина), которая имеет две основные точки 0 К (или абсолютный нуль) и 273К, точка в которой вода существует в трёх состояниях (в твёрдом, жидком и газообразном).
Абсолютная температурная шкала — шкала температур, в которой за начало отсчёта принят абсолютный нуль. Температура здесь обозначается буквой T и измеряется в кельвинах (К).
На шкале Цельсия, есть две основные точки: 0°С (точка, в которой тает лёд) и 100°С (кипение воды). Температура, которую определяют по шкале Цельсия, обозначается t. Шкала Цельсия имеет как положительные, так и отрицательные значения.
Из опыта мы определили значения величины Θ (тета) при 0 °С и 100 °С. Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле:



Отсюда можно вычислить коэффициент k, который связывает температуру в Θ энергетических единицах (Дж) с абсолютной температурой Т (К)
k = 1,38 • 10-23 Дж/К – постоянная Больцмана.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0°С:

 значение абсолютной температуры.
значение абсолютной температуры.
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:


Теперь выведем ещё одну зависимость температуры от средней кинетической энергии молекул. Из основного уравнения молекулярно-кинетической теории и уравнения для определения абсолютной температуры


Здесь видно, что левые части этих уравнений равны, значит правые равны тоже.

Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
Из выведенных формул мы можем получить выражение, которое показывает зависимость давления газа от концентрации молекул и температуры



Из этой зависимости вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный нам из курса химии.
Закон Авогадро: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Рассмотрим задачи тренировочного блока урока.
1. При температуре _______ (370C; 2830C; 270C) средняя кинетическая энергия поступательного движения молекул равна 6,21·10-21Дж.
Дано:

k = 1,38 • 10-23 Дж/К – постоянная Больцмана
t -?
Решение:
Запишем значение средней кинетической энергии хаотического поступательного движения молекул с зависимостью от абсолютной температуры:

Отсюда выразим Т:


Соотношение между абсолютной температурой и температурой в градусах Цельсия:

Подставим значение абсолютной температуры:

Правильный вариант ответа:
2. При температуре 290 К и давлении 0,8 МПа, средняя кинетическая энергия молекул равна __________ Дж, а концентрация составляет молекул ___________ м-3.
Дано:
Т = 290К
р = 0,8 МПа =0,8·106 Па
k = 1,38 • 10-23 Дж/К – постоянная Больцмана
Ек -? n – ?
Решение:
Значение средней кинетической энергии хаотического поступательного движения молекул:

Подставив значение абсолютной температуры, найдём ответ:

Определим концентрацию газа из соотношения:



Правильный вариант ответа: 6·10-21; 2·1026 м-3.
Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?

Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
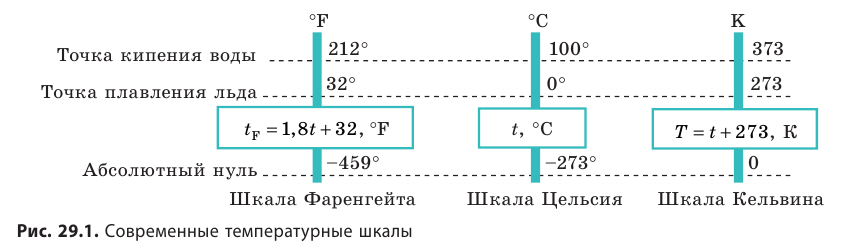
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 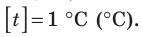 .
.

Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 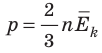 . По определению
. По определению 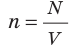 , поэтому
, поэтому 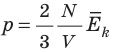 . После преобразований получим:
. После преобразований получим: 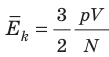 .
.
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 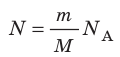 .
.
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
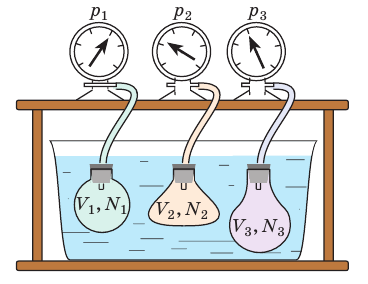
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 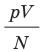 одинаково, а следовательно, одинаковыми являются и средние кинетические энергии молекул газов. (Отношение
одинаково, а следовательно, одинаковыми являются и средние кинетические энергии молекул газов. (Отношение 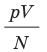 часто обозначают символом θ (тета).)
часто обозначают символом θ (тета).)
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 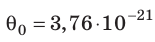 , Дж, то есть
, Дж, то есть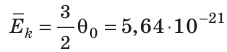 Дж; при температуре 100 °С (сосуды погрузили в кипящую воду)
Дж; при температуре 100 °С (сосуды погрузили в кипящую воду) 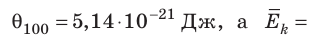
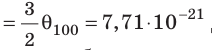 Дж. Так как в состоянии теплового равновесия значение θ для любых газов одинаково, то температуру можно измерять в джоулях.
Дж. Так как в состоянии теплового равновесия значение θ для любых газов одинаково, то температуру можно измерять в джоулях.
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
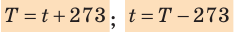
- температура по шкале Кельвина связана с величиной
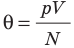 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 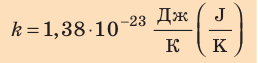
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
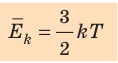 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (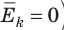 ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
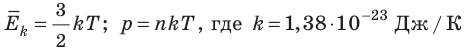 — постоянная Больцмана.
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
На протяжении школьного
курса физики, вы уже много раз слышали о том, что температура является мерой
средней кинетической энергии молекул. Но, как сказал Лев Ландау, «верховным
судьёй всякой физической теории является опыт». Поэтому, на сегодняшнем уроке мы
рассмотрим опыты, позволяющие нам дать определение температуре. Возьмем сосуд с
перегородкой и поместим в половинки сосуда два различных газа разной
температуры. Если перегородка сосуда проводит тепло, то через некоторое время
оба газа будут иметь одинаковую температуру.
Основываясь на нашем
начальном предположении о том, что температура является мерой средней
кинетической энергии молекул, мы попытаемся доказать, что средняя кинетическая
энергия молекул обладает таким же свойством, как и температура.
Как и было сказано в
предыдущих уроках, измерить кинетическую энергию отдельной молекулы крайне
сложно. Однако, мы можем выразить среднюю кинетическую энергию молекул газа
через макроскопические параметры. Воспользуемся основным уравнением
молекулярно-кинетической теории:
Заметим, что концентрация
молекул равна отношению числа молекул газа к его объёму:
Тогда
Итак, мы выразили среднюю
кинетическую энергию молекул через три величины, которые легко измеряются.
Объём можно задать, поместив газ в герметичный баллон, а давление измерим с
помощью манометра. Чтобы найти количество молекул, как вы знаете, нужно
количество вещества умножить на число Авогадро:
Вспомним теперь, что
количество вещества равно отношению массы к молярной массе:
Молярную массу, как вы
знаете, можно подсчитать, используя таблицу Менделеева.
Следовательно,
Для проведения опыта мы
можем использовать баллоны с водородом и кислородом, давление, объёмы и
количество молекул которых, различны.
Чтобы уравнять
температуру газов их необходимо привести в тепловое равновесие с одним и тем же
телом (как правило, используется тающий лед). Через некоторое время установится
тепловое равновесие, то есть температуры кислорода и водорода будут равны 0 оС.
Наша цель проверить — уравнялись ли при этом средние кинетические энергии
молекул газов, и если это так, то наше начальное предположение верно. Опыты и
сопутствующие расчеты говорят о том, что отношение произведения давления и
объёма к количеству молекул газа остается постоянным при постоянной температуре,
независимо от природы самого газа:
Это говорит нам о том,
что средняя кинетическая энергия молекул — это и есть температура.
Необходимо отметить, что
данное соотношение все же начинает зависеть от рода газа при очень большом
давлении, таком как несколько сотен атмосфер. Однако, мы с уверенностью можем
сказать, что до тех пор, пока газ может считаться идеальным, данное соотношение
строго определено.
Поскольку температура
фактически является мерой энергии, её иногда измеряют в энергетических единицах.
Но, дело в том, что в повседневной жизни подобные единицы измерения неудобны.
Например, если в баллоне объёмом 10 л находится 1 моль водорода при нормальном
давлении, то средняя кинетическая энергия его молекул будет равна 1,68 х 10−21
Дж. В связи с этим возникает вопрос: как перевести температуру из
энергетических единиц измерения в градусы, используемые в повседневной жизни?
Ведь, люди могут выбирать какую угодно температурную шкалу, но этот выбор не
может повлиять на кинетическую энергию молекул. Поэтому, вводится понятие абсолютной
температуры. Будем считать эту температуру прямо пропорциональной
температуре, выраженной в энергетических единицах:
В этой формуле мы
обозначили коэффициент пропорциональности буквой k.
Учитывая тот факт, что
такие величины, как объём, давление и число молекул, не могут быть
отрицательными, делаем вывод, что абсолютная температура тоже не может быть
отрицательной.
Как видно из формулы, абсолютный
ноль температуры — это такая температура, при которой давление газа равно нулю,
при постоянном объёме. Такое возможно только в случае, если молекулы газа
попросту остановились (это следует из основного уравнения
молекулярно-кинетической теории).
Абсолютную шкалу температур
предложил лорд Кельвин, в честь которого и названа единица измерения
температуры по абсолютной шкале. 1 К равен 1 оС, поэтому перевести
градусы Цельсия в кельвины довольно просто: нужно к температуре в градусах
Цельсия прибавить 273 градуса:
Таким образом, абсолютный
ноль температуры по шкале Цельсия равен −273 градуса. Необходимо
отметить, что абсолютный ноль недостижим.
Вернемся теперь к
уравнению, которое мы использовали в начале урока:
Также, мы выяснили, что
отношение произведения давления и объёма к числу молекул должно быть
пропорционально температуре:
Мы получили два
уравнения, левые части которых равны. Значит, должны быть равны и правые части:
Итак, мы вплотную подошли
к связи между средней кинетической энергией и температурой. Остается только
разобраться с коэффициентом пропорциональности.
Этот коэффициент получил
название постоянной Больцмана, в честь Людвига Больцмана.
Больцман был первым, кто
нашел соотношение между кинетической энергией и температурой. Постоянная
Больцмана определяет связь между температурой в энергетических единицах
измерения и температурой в кельвинах. Итак, средняя кинетическая энергия
молекул равна
Сегодня мы можем
повторить эксперимент, с помощью которого можно вычислить постоянную Больцмана.
Возьмем газ, который можно считать идеальным, и измерим среднюю кинетическую
энергию его молекул тем же способом, который мы использовали в начале урока —
то есть, выразив её через макроскопические параметры:
Проведем измерения для
двух случаев: в одном случае поместим сосуд в тающий лед, а во втором случае —
в кипящую воду.
Тогда, разность между
температурами в энергетических единицах измерения должна быть равна
произведению разности температуры в кельвинах и постоянной Больцмана:
Отсюда выразим постоянную
Больцмана:
Расчеты показывают, что
эта величина остается постоянной для любого газа, который можно считать
идеальным:
Несмотря на то, что
соотношение между температурой и кинетической энергией установлено для газов,
оно также выполняется для жидкостей и для твердых тел:
Данное соотношение не
выполняется только в том случае, если движение частиц не подчиняется законам
механики Ньютона. Это происходит при экстремальных условиях, например при
колоссальном давлении, огромной температуре или сильнейших электромагнитных
полях.
Пример решения задачи.
Задача. При
температуре 200 К средняя скорость молекул одного моля неизвестного газа равна
500 м/с. Считая этот газ идеальным, определите его молярную массу.
Абсолютная температура. Температура — мера средней кинетической энергии молекул
- Подробности
- Обновлено 04.10.2018 16:54
- Просмотров: 770
«Физика – 10 класс»
Абсолютная температура.
Вместо температуры Θ, выражаемой в энергетических единицах, введём температуру, выражаемую в привычных для нас градусах.
Будем считать величину Θ прямо пропорциональной температуре Т, измеряемой в градусах:
Θ = kТ, (9.12)
где k — коэффициент пропорциональности.
>Определяемая равенством (9.12) температура называется абсолютной.
Такое название, как мы сейчас увидим, имеет достаточные основания. Учитывая определение (9.12), получим

По этой формуле вводится температурная шкала (в градусах), не зависящая от вещества, используемого для измерения температуры.
Температура, определяемая формулой (9.13), очевидно, не может быть отрицательной, так как все величины, стоящие в левой части этой формулы, заведомо положительны. Следовательно, наименьшим возможным значением температуры Т является значение Т = 0, если давление р или объём V равны нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Это самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказывал Ломоносов.
Английский учёный У. Томсон (лорд Кельвин) (1824—1907) ввёл абсолютную шкалу температур. Нулевая температура по абсолютной шкале (её называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Единица абсолютной температуры в СИ называется кельвином (обозначается буквой К).
Постоянная Больцмана.
Определим коэффициент k в формуле (9.13) так, чтобы изменение температуры на один кельвин (1 К) было равно изменению температуры на один градус по шкале Цельсия (1 °С).
Мы знаем значения величины Θ при 0 °С и 100 °С (см. формулы (9.9) и (9.11)). Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле (9.12)
Θ100 – Θ0 = k(T2 -T1),
Θ100 – Θ0 = k • 100 K = (5,14 – 3,76) • 10-21 Дж.
Отсюда

Коэффициент
k = 1,38 • 10-23 Дж/К (9.14)
называется постоянной Больцмана в честь Л. Больцмана, одного из основателей молекулярно-кинетической теории газов.
Постоянная Больцмана связывает температуру Θ в энергетических единицах с температурой Т в кельвинах.

Это одна из наиболее важных постоянных в молекулярно-кинетической теории.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0 °С. Так как при 0 °С kT1 = 3,76 • 10-21 Дж, то

Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:
Т (К) = (f + 273) (°С). (9.15)
Изменение абсолютной температуры ΔТ равно изменению температуры по шкале Цельсия Δt: ΔТ(К) = Δt (°С).
На рисунке 9.5 для сравнения изображены абсолютная шкала и шкала Цельсия. Абсолютному нулю соответствует температура t = -273 °С.
В США используется шкала Фаренгейта. Точка замерзания воды по этой шкале 32 °F, а точка кипения 212 °Е Пересчёт температуры из шкалы Фаренгейта в шкалу Цельсия производится по формуле t(°C) = 5/9 (t(°F) – 32).
Отметим важнейший факт: абсолютный нуль температуры недостижим!
Температура — мера средней кинетической энергии молекул.
Из основного уравнения молекулярно-кинетической теории (9.8) и определения температуры (9.13) вытекает важнейшее следствие:
абсолютная температура есть мера средней кинетической энергии движения молекул.
Докажем это.
Из уравнений (9.7) и (9.13) следует, что  Отсюда вытекает связь между средней кинетической энергией поступательного движения молекулы и температурой:
Отсюда вытекает связь между средней кинетической энергией поступательного движения молекулы и температурой:

Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре.

Чем выше температура, тем быстрее движутся молекулы. Таким образом, выдвинутая ранее догадка о связи температуры со средней скоростью молекул получила надёжное обоснование. Соотношение (9.16) между температурой и средней кинетической энергией поступательного движения молекул установлено для идеальных газов.
Однако оно оказывается справедливым для любых веществ, у которых движение атомов или молекул подчиняется законам механики Ньютона. Оно верно для жидкостей, а также и для твёрдых тел, где атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решётки.
При приближении температуры к абсолютному нулю энергия теплового движения молекул приближается к нулю, т. е. прекращается поступательное тепловое движение молекул.
Зависимость давления газа от концентрации его молекул и температуры. Учитывая, что  из формулы (9.13) получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:
из формулы (9.13) получим выражение, показывающее зависимость давления газа от концентрации молекул и температуры:

Из формулы (9.17) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же.
Отсюда следует закон Авогадро, известный вам из курса химии.
Закон Авогадро:
В равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Источник: «Физика – 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления – Физика, учебник для 10 класса – Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике —
Основные положения молекулярно-кинетической теории. Размеры молекул —
Примеры решения задач по теме «Основные положения МКТ» —
Броуновское движение —
Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел —
Идеальный газ в МКТ. Среднее значение квадрата скорости молекул —
Основное уравнение молекулярно-кинетической теории газов —
Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» —
Температура и тепловое равновесие —
Определение температуры. Энергия теплового движения молекул —
Абсолютная температура. Температура — мера средней кинетической энергии молекул —
Измерение скоростей молекул газа —
Примеры решения задач по теме «Энергия теплового движения молекул» —
Уравнение состояния идеального газа —
Примеры решения задач по теме «Уравнение состояния идеального газа» —
Газовые законы —
Примеры решения задач по теме «Газовые законы» —
Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
Пояснительная
записка.
Температура –
фундаментальная физическая величина в курсе МКТ, Термодинамике.
Понятием температуры мы широко
пользуемся в жизни на бытовом уровне.
В младших классах (7 – 9 кл) это
понятие (степень нагретости тела) связывали со средней скоростью движения
молекул тела.
В 10 кл. усвоение физического
смысла этой величины встречает затруднения, так как просходят своеобразная «перезагрузка»
сознания , расширение и углубление понимания об окружающнм мире.
Ввиду важности данной темы,
провожу её изучение в виде лекции-беседы, с активным участием самих учеников в
обсуждении реализации поставленных задач. Ученики ведут план – конспект
основных положений, участвуя в обсуждении, учатся строить логические цепочки,
обобщать, делать выводы.
Данная тема позволяет наглядно
продемонстрировать научный метод изучения природы: проблема →гипотеза→проверка
на практике→новые знания→новая проблема…
На изучение данной темы
использую два урока.
Тема урока:
«Определение температуры. Измерение температуры»
Цель
урока:
1.
Ввести понятие «температура», раскрыть её физический смысл. 2.
Развитие познавательных интересов, метапредметных умений, логики мышления,
раскрытие методов изучения явлений
природы.
3. Воспитание убеждённости в познаваемости окружающего мира
Тип
урока:
Урок изучения нового материала.
Формы
урока:
Лекция – беседа
Инструментарий: Проектор,
презентация.
План урока:
1)
Организационная часть. Ученики,
участвуя в обсуждении проблем, делают в тетради краткий конспект лекции
2)
Постановка проблемы: Слово
«температура» возникло в те времена, когда люди считали, что в более нагретом
теле содержится большее количество особого вещества – теплорода, чем в менее
нагретом. По этой причине единицы измерения крепости
спиртных напитков и температуры называются одинаково – градусами.
При тепловом равновесии все газы
имеют одинаковую температуру. Чем выше температура газа неизменных массы и
объёма, тем давление газа больше. С
точки зрения МКТ какая величина должна соответствовать температуре?
3) Выдвигаем гипотезу: Предположим,
что эта величина – средняя энергия движения молекул ![]() .
.
![]()
→ ![]() или
или
![]() . Если при
. Если при
тепловом равновесии ![]() , то наше предположение будет верным.
, то наше предположение будет верным.
4) Проверка
гипотезы.
Проверка опытом: Три сосуда разного объёма
заполнены разными газами: О2 ; Н2 ; N2.
Массы газов различны. Зная массу газа m можно рассчитать число молекул газа N в
сосуде: ![]() NА. Сосуды снабжены манометрами для измерения давления
NА. Сосуды снабжены манометрами для измерения давления
газа внутри Опыт 1
. (См на экран)  Сосуды
Сосуды
помещали в ванну со льдом: при наступлении теплового равновесия измеряли p и
рассчитывали ![]() для
для
каждого газа. Оказалось,
что для всех газов ![]() = 3, 76 · 10– 21 Дж – одинаково.
= 3, 76 · 10– 21 Дж – одинаково.
Опыт 2. Сосуды помещали в ванну с кипящей водой при
нормальном атмосферном давлении: при наступлении теплового равновесия
измеряли p и рассчитывали ![]() для
для
каждого
газа.
Оказалось,
что для всех газов ![]() = 5,14 · 10– 21 Дж – одинаково.
= 5,14 · 10– 21 Дж – одинаково.
5) Вывод: наше предположение верно: С точки зрения МКТ температуре соответствует средняя
кинетическая энергия молекул! Температура
– мера средней кинетической энергии движения молекул.
Обозначим: ![]() =
=
3, 76 · 10– 21 Дж. =![]() 0 ;
0 ; ![]() =
=
5,14 · 10– 21 Дж. =![]()
![]() –
–
естественная мера температуры; ![]() =
=
Дж
6) Связь температуры, выраженной в Дж с
температурой, выраженной в градусах:
![]() , где
, где ![]() коэффициент пропорциональности, переводит температуру в Дж в
коэффициент пропорциональности, переводит температуру в Дж в
температуру в градусах. ![]() ? На
? На
основании формулы: ![]() =
=![]() устанавливается температурная шкала не зависящая от выбора
устанавливается температурная шкала не зависящая от выбора
вещества, используемого для измерения температуры: ![]() если
если ![]() при фиксированных N и V. Предельную температуру, при
при фиксированных N и V. Предельную температуру, при
которой давление идеального газа обращается в нуль при фиксированном объёме или
объём идеального газа стремится к нулю при неизменном давлении, называют
абсолютным нулём температуры. Английский
учёный У. Кельвин ввёл абсолютную шкалу температур (шкала Кельвина). В ней за 0
принят абсолютный нуль , а каждая единица температуры по этой шкале равна
градусу по шкале Цельсия. ![]() =
=
К
7)
Связь абсолютной шкалы и шкалы Цельсия

Т = t + 273
8) Постоянная Больцмана:
![]()
![]() →
→ ![]() 0 =
0 = ![]() 0) → (5,14
0) → (5,14
– 3, 76) ·10–
21 Дж =( 100-0) К → ![]() = 1,38·10– 23Дж/кг
= 1,38·10– 23Дж/кг ![]() 1,38·10–
1,38·10–
23 ![]() постоянная Больцмана
постоянная Больцмана
9) Температура – мера средней кинетической энергии
молекул.
 ;
;  →
→ ![]() или
или
![]()
![]() Средняя
Средняя
кинетическая энергия хаотичного поступательного движения молекул
газа прямо пропорциональна абсолютной температуре.
10) Зависимость давления от концентрации и абсолютной
температуры.
![]() ;
; ![]() →
→ ![]()
11) Рефлексия. Закрепление основных положений лекции
по конспекту.
12) Д/З: Конспект, § 67,68
10.12.2014г.
Учитель /Кухаренко/
![]()
