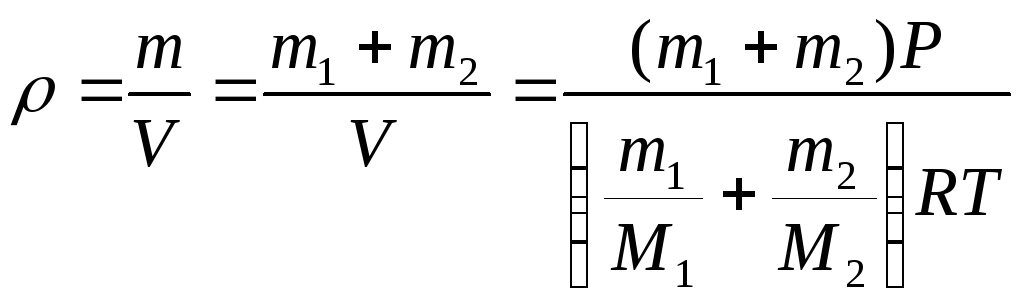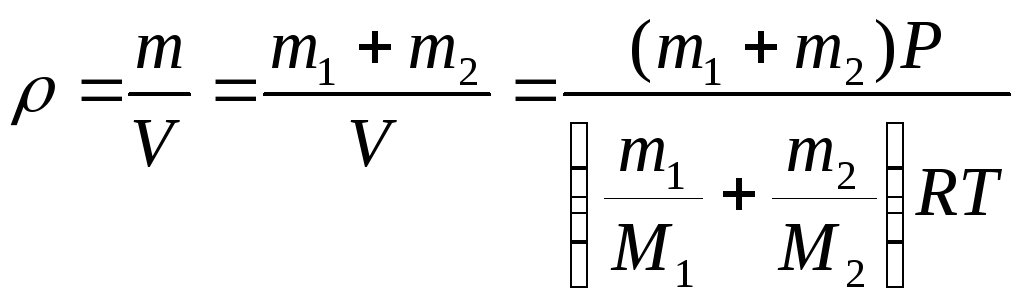План решения задач на газовые законы
-
Если
в задаче рассматривается одно состояние
газа и требуется найти какой-либо
параметр этого состояния, нужно
воспользоваться уравнением Менделеева
– Клапейрона. -
Если
значения давления и объема явно не
заданы, их нужно выразить через заданные
величины, подставить в записанное
уравнение и, решив его, найти неизвестный
параметр. -
В
том случае, когда в задаче рассматриваются
два различных состояния газа, нужно
установить, изменяется ли масса газа
при переходе из одного состояния в
другое. Если масса остается постоянной,
можно применить уравнение Клапейрона.
Если же при постоянной массе в данном
процессе не изменяется какой-либо из
параметров ( р,V или Т), применяются
уравнение соответствующего закона
(Гей-Люссака, Шарля или Бойля-Мариотта). -
Если
в двух состояниях масса газа разная,
то для каждого состояния записывают
уравнение Менделеева-Клапейрона. Затем
систему уравнений решают относительно
искомой величины.
Примеры решения задач
Пример 3.1. Определите
число молекул воды в бутылке вместимостью
0,33л. Молярная масса воды М=18∙10-3
кг/моль, плотность воды ρ=1г/см3.
Дано:
V=0,33л=0,33∙10-3
м3;
М=18∙10-3
кг/моль; ρ=1г/см3=
1∙103
кг/м3;
Найти:
N.
Решение:
Масса
воды, занимающей объём V,
m=ρV,
(1)
где
ρ – плотность воды.
Масса
молекулы
,
(2)
где
М – молярная масса; NA=6,02∙
1023моль-1
–
постоянная Авогадро.
Число
молекул в бутылке
(3)
Подставляя
в выражение (3) формулы (1) и (2), получим
искомое число молекул:
.
Ответ:
N=1,1∙1025.
Пример 3.1. Узкая
цилиндрическая трубка, закрытая с одного
конца, содержит воздух, отделённый от
наружного воздуха столбиком ртути.
Когда трубка обращена закрытым концом
кверху, воздух внутри неё занимает длину
ℓ, когда же трубка обращена кверху
открытым концом, то воздух внутри неё
занимает длину ℓ’ < ℓ. Длина ртутного
столбика h мм. Определить атмосферное
давление.
Дано:
ℓ; ℓ’ < ℓ; h.
Найти:
Р.
Решение:
В данном процессе
изменяются давление и объём воздуха, а
температура остаётся постоянной.
Следовательно, если начальные параметры
воздуха обозначить Р1
и V1,
а конечные как Р2
и V2 получаем
следующее соотношение:
Р1V1
= Р2V2
Когда
трубка обращена закрытым концом кверху,
воздух в ней находится под давлением
Р1=
Ратм
– h ( здесь и далее измеряем в мм.рт. ст.).
Если же трубку перевернуть, давление
воздуха в ней будет равно Р2
= Ратм
+ h .
Учитывая,
что V1 =
Sℓ1,
V2 =
Sℓ2,
где S – площадь сечения трубки, получаем:
(Ратм
– h) Sℓ =
(Ратм
+ h) Sℓ’,
Отсюда
находим атмосферное давление
Ответ.
Пример
3.2. В сосуде находится
смесь m = 7 г азота и m = 11г углекислого
газа при температуре Т = 290 К и давлении
Р = 1 атм. Найти плотность этой смеси,
считая газа идеальными.
Дано:
m1=7
г=7∙10-3кг;
m2=11
г=11∙10-3кг;
Т=290К; Р=1атм=105Па.
Найти:
ρ.
Решение:
Давление газов в сосуде
известно. Если через Р1
обозначить давление
азота, если бы углекислого газа не было,
а через Р2 давление
углекислого газа, если бы не было азота
(так называемые парциальными давления),
то давление смеси газов Р будет согласно
закону Дальтона Р =
Р1 +
Р2.
Учитывая, что температура каждого газа
Т запишем для азота и кислорода уравнение
Менделеева-Клапейрона:
Складывая
эти выражения, получаем:
Отсюда
находим объём, занимаемый смесью газов
Плотность
смеси газов вычисляется по формуле
Ответ:
Пример
3.3. Кислород массой
m=10г
находится под давлением 200кПа при
температуре 280К. В результате изобарного
расширения газ занял объём 9л. Определите:
1) объём газа V1
до расширения; 2) температуру газа T2
после расширения; 3) плотность газа ρ2
после расширения.
Дано:
M=32∙10-3кг/моль;
m=10г=10∙10-3кг;
р=200кПа=2∙105Па=const;
Т1=280К;
V2=9г=9∙10-3м3.
Найти:
1) V1;
2) Т2;
3) ρ2.
Решение:
Объём газа до расширения найдём, согласно
уравнению Клапейрона-Менделеева,
,
откуда
Записав уравнение Клапейрона-Менделеева
для конечного состояния газа:
,
найдём искомую температуру
Плотность газа после расширения газа
.
Ответ:
1) V1=3,64
л; 2) Т2=693
К; 3) ρ2=1,11
кг/м3.
Пример 3.3. В
цилиндре с площадью основания 100 см2
находится воздух. Поршень расположен
на высоте 50 см от дна цилиндра. На поршень
кладут груз массой 50 кг, при этом он
опускается на 10 см. Найти температуру
воздуха после опускания поршня, если
до его опускания давление было равно
101 кПа, а температура 12С.
Дано: S=100см2=1∙10-2м2;h1=50см=0,5
м;m=50кг; Δh=10см=0,1
мt;P1=101∙103Па; Т1=12С=285
К.
Найти:
Т2.
Решение:
Рассмотрим два состояния воздуха под
поршнем: до опускания поршня и после
его опускания. До опускания поршня
состояние воздуха характеризуется
параметрами Р1,
V1,
T1,
после опускания поршня – параметрами
Р2,
V2,
T2,
где V1=Sh1,
Р2=Р0+Р,
,
V2=Sh2,
или, поскольку h2=h1–
Δh,
V2=S(h1–
Δh).
Применим
к этим двум состояниям формулу Клапейрона:
,
откуда
(1)
Подставим
в формулу (1) выражения для Р1,
V1,
Р2
и V2:
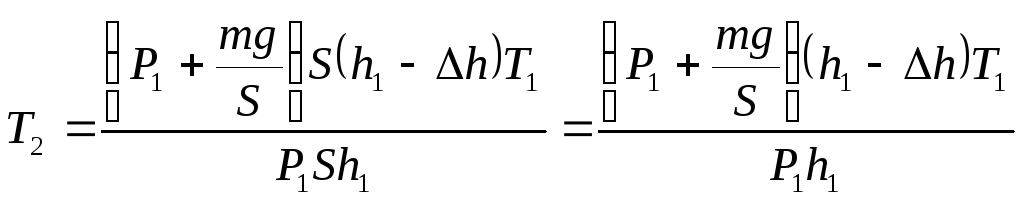
Ответ:
Т2=338К
Пример 3.3. Имеются
два сосуда с газом: один вместимостью
3 л, другой 4 л. В первом сосуде газ
находится под давлением 202 кПа, а во
втором 101 кПа. Под каким давлением будет
находиться газ, если эти cосуды соединить
между собой? Считать, что температура
в сосудах одинакова и постоянна.
Дано: V1=3л=3∙10–3м3;V2=4л=4∙10–3м3;Р1=202кПа=202∙103Па; Р2=101кПа=101∙103Па.
Найти:
Р.
Решение:
По закону Дальтона,
Р
= Р3
+ Р4 (1)
Так
как процесс изотермический, то парциальное
давление газа в каждом сосуде можно
найти по закону Бойля-Мариотта:
Р1V1
=
Р3V,
Р2V2
=
Р4V,
где
V=V1+V2.
Тогда парциальное давление газа в каждом
из сосудов после их соединения
,
, (2)
Подставляем
выражения (2) в (1):
Ответ:
Р=141 Па
Пример 3.3. В
баллоне содержатся сжатый газ при
температуре t1
= 27С
и давлении p1
= 4 МПа. Каково будет давление, если из
баллона выпустить
Δm
= 0,4m
массы газа, а температуру понизить до
t2
= 17С?
Дано: Т1=27С
=300 К;Р1=4МПа=4∙106
Па;Δm
= 0,4m;
Т2=17С
=290 К Найти:
Р.
Решение: Рассмотрим
два состояния газа: до разрежения и
после, когда осталось1-n массы m газа.
Параметры каждого из этих состояний
связаны уравнением Менделеева-Клапейрона:
,
где
Р1,
Т1,
Р2,
Т2
– соответственно давление и температура
газа до и после выпуска; m – масса газа;
М – молярная масса; V – объем.
Разделив
почленно первое равенство на второе,
получим:
,
oткуда
(1)
Ответ:
Р2
= 2,3106
Па = 2,3 МПа.
Пример
3.3. Найти максимально
возможную температуру идеального газа
в процессе P = P0
– αV2,
где P0,
α – положительные постоянные.
Дано:
P = P0
– αV2;
P0, α
– const
Найти:
Tmax.
Решение:
Для нахождения максимальной температуры
необходимо получить явную зависимость
последней от параметров и исследовать
эту зависимость на экстремум. Так как
газ является идеальным, выразим давление
из уравнения Менделеева-Клапейрона и
подставим его в уравнение процесса
Отсюда
выражаем температуру
Условие экстремума
,
которое сводится к выражению.
Решая
данное уравнение, получаем значение
объёма, при котором температура принимает
экстремальное значение
.
Исследуя знак второй производной, приходим к выводу, что при данном
значении объёма температура газа будет
идеальной. Подставляя выражение для
объёма в выражение для температуры при
данном процессе, получаем:
Ответ:
Пример
3.3. В сосуде
вместимостью V=5л
находится кислород массой m=15г.
определите: 1) концентрацию молекул
кислорода в сосуде; 2) число N
молекул газа в сосуде.
Дано:
V=5л=5∙10-3м3;
M=32∙10-3кг/моль;
m=15г=1,5∙10-2кг.
Найти:
1) n; 2) N.
Решение:
Записав
уравнение Клапейрона-Менделеева
(1)
И
уравнение состояния идеального газа
Р=nkT
(2)
И
поделив (1) на (2), найдём искомую концентрацию
молекул кислорода в сосуде
.
Концентрация
молекул
,
Откуда
искомое число молекул газа в сосуде
N=nV.
Ответ:
1)
n=5,64∙1025
м-3;
2) N=2,82∙1023.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как изменяется температура газа при расширении
Зависимость температуры газа от изменения объема объясняется, прежде всего, изначальным физическим смыслом самого понятия температуры, которое связано с интенсивностью движения частиц газа.

Из курса молекулярной физики известно, что температура тела, несмотря на то что она является макроскопической величиной, связана, в первую очередь, с внутренним строением тела. Как известно, частицы любого вещества находятся в постоянном движении. Вид данного движения зависит от агрегатного состояния вещества.
Если это твердое тело, то частицы колеблются в узлах кристаллической решетки, а если это газ, то частицы свободно перемещаются в объеме вещества, соударяясь друг с другом. Температура вещества пропорциональна интенсивности движения. С точки зрения физики, это означает, что температура прямо пропорциональна кинетической энергии частиц вещества, которая, в свою очередь, определяется величиной скорости движения частиц и их массой.
Чем больше температура тела, тем больше средняя кинетическая энергия частиц. Этот факт отражается в формуле для кинетической энергии идеального газа, равной произведению концентрации частиц, постоянной Больцмана и температуры.
Представьте себе внутреннее строение газа. Газ можно считать идеальным, что означает абсолютную упругость столкновений молекул друг с другом. Газ имеет определенную температуру, то есть определенную величину кинетической энергии частиц. Каждая частица ударяется не только с другой частицей, но и со стенкой сосуда, ограничивающего объем вещества.
Если объем газа увеличивается, то есть газ расширяется, то количество столкновений частиц со стенками сосуда и друг с другом уменьшается из-за увеличения свободного пробега каждой молекулы. Уменьшение количества столкновений ведет к спаду давления газа, однако общая средняя кинетическая энергия вещества не меняется, ибо процесс соударения частиц никак не влияет ее величину. Таким образом, при расширении идеального газа температура не изменяется. Данный процесс называется изотермическим, то есть процессом с постоянной температурой.
Обратите внимание, что данный эффект постоянства температуры при расширении газа основан на предположении его идеальности, а также на том, что при соударении частиц со стенками сосуда частицы не теряют энергию. Если же газ не идеальный, то при его расширении уменьшается количество столкновений, приводящих к потере энергии, спад температуры становится менее резким. Практически данная ситуации соответствует термостатированию вещества газа, при котором снижаются энергетические потери, вызывающие уменьшение температуры.
Видео по теме
Адиабатическое сжатие и расширение – два процесса, известные в термодинамике.
В этом процессе вещество расширяется без теплопередачи. Карно, Дизель, Отто – примеры адиабатического процесса.
Основные процессы выполняемой работы в термодинамике являются адиабатическими. один – обратимый адиабатический процесс, другой – необратимое адиабатическое расширение.
Необратимый адиабатический процесс происходит при свободном расширении газа.
Что такое адиабатическое расширение?
Адиабатический процесс в термодинамике используется в различных циклах.
Это расширение вещества в системе без тепломассообмена с окружающей средой.
Эта концепция хорошо изучена при изучении тепловой машины. адиабатическое расширение – это идеализированный процесс без передачи тепла.
На практике расширение вещества происходит в системе очень быстро. Этот процесс происходит быстро, поэтому теплообмен от системы к окружающей среде минимален. Тепловой поток через границу значительно меньше. Этот процесс считается адиабатическим расширением.
Формула адиабатического расширения
Есть много возможных условий для формулы адиабатического разложения.
Некоторые предположения сделаны для управления уравнением процесса адиабатического расширения.
Стена системы изоляционная.
Стенка системы (цилиндра) не имеет трения.
Если поршень перемещается вверх на расстояние dx из-за действия давления P
Работа, проделанная в системе, может быть представлена как,
dW = PA dx
Здесь A – площадь поперечного сечения над верхней частью поршня,
мы можем написать A dx = dV = Изменение объема
dW = PdV
Расширение вещества адиабатическое; состояние вещества изменилось с П1, В1, Т1 на П2, В2, Т2.
Состояние адиабатического процесса, ПВϒ = Константа = K
Общая работа над системой может быть представлена как,
Используйте P = K * V-ϒ
Процесс адиабатического расширения
Этот процесс возможен в двигателях, холодильных установках и системах кондиционирования воздуха.
Расширение газа происходит очень быстро, поэтому обмен теплом между системой и окружающей средой незначителен.
Есть два процесса адиабатическое сжатие и адиабатическое расширение. Оба процесса на практике осуществляются с минимальной теплопередачей на границе.
Принципиального процесса свободного адиабатического расширения несколько отличается от адиабатического расширения.
Предположим, мы заправляем газ в один ящик и присоединяем его к другому пустому ящику. У обоих ящиков одна и та же стенка. Допустим, мы протыкаем общую стену, газ из одного ящика начинает расширяться во втором ящике. Этот процесс расширения называется свободным расширением.
Этот процесс расширения вызван объемом, поэтому давление становится равным нулю. Работа не совершается из-за отсутствия давления. Если эта коробка или система теплоизолированный, этот процесс известен как свободное адиабатическое расширение.
Компания теплопередача Q = 0, проделанная работа W = 0
Степень адиабатического расширения
В термодинамических процессах есть две теплоемкости.
Отношение удельной теплоемкости при постоянном давлении к удельной теплоемкости при постоянном объеме известно как показатель адиабаты или отношение удельной теплоемкости.
Если Cp = значение удельной теплоемкости при постоянном давлении
Cv = значение удельной теплоемкости при постоянном объеме
ϒ = отношение двух удельной теплоемкости или показателя адиабаты
ϒ = Cp / Cv
Показатель адиабаты равен 1.7 для одноатомного идеального газа, такого как аргон, гелий.
Изменение температуры адиабатического расширения
Если система будет обмениваться теплом, это повлияет на температуру системы.
В этом процессе нет теплообмена, но работа, выполняемая при расширении, происходит из-за снижения температуры.
Внутренняя энергия процесса адиабатического расширения ниже, чем изотермического процесса. При незначительной работе теплообмена отсутствует.
Если процесс расширения свободный, температура остается постоянной. Энтропия системы имеет прямую зависимость от объема, если температура постоянна. Этот процесс необратим из-за возрастания энтропии.
Работа адиабатического расширения
Работа, выполняемая в процессе, является функцией теплопередачи и внутренней энергии.
В адиабатическом процессе теплоотдача равна нулю. Сделанная работа = изменение внутренней энергии.
Компания работа расширения адиабатического процесса приведен ниже,
Адиабатическое расширение газа
Свободное адиабатическое расширение вещества, такого как газ, – это простая для понимания концепция.
Газ расширяется в вакууме без внешнего давления. Работа в этом процессе равна нулю, потому что внешнее давление равно нулю. W = P * dV
Если газ, залитый из баллона, может свободно расширяться в пространстве, на газ не действует внешнее давление.
Проделанная работа = Давление * Изменение объема
давление = 0, поэтому работа, выполняемая в системе или от нее, равна нулю.
В адиабатическом процессе передача тепла невозможна,
Согласно Ist закон термодинамики,
ΔQ – ΔW = ΔU
Где ΔQ = ноль и ΔW = ноль
Таким образом, изменение в внутренняя энергия = ноль.
Адиабатическое расширение идеального газа
Поведение процесса меняется, если газ идеален.
Расширение идеального вещества, такого как идеальный газ, представляет собой процесс с постоянной температурой (изотермический процесс).
Обычно мы считаем изоэнтропический и адиабатический процессы одним и тем же, но они не одинаковы во всех случаях. Давайте рассмотрим пример расширения идеала газ.
Мы рассматриваем некоторые предположения для этого процесса,
- Цилиндр и поршень без трения
- Существует вакуум за пределами поршня и цилиндра.
- Поршень и цилиндр являются теплоизолированный
- Нет передачи тепла между системой и окружающей средой (адиабатический процесс)
Если заполненный газ расширяется за счет толкания поршня, газ расширяется за счет объема без какого-либо внешнего давления. Этот процесс является примером увеличения энтропии и необратимого процесса.
Адиабатическое необратимое расширение
При необратимом процессе начальная стадия не восстанавливается после завершения процесса.
Энтропия системы изменяется из-за трения. Этот процесс не такой медленный, как квазистатический.
Внешнее давление для идеального газа постоянно в процессе адиабатического расширения.
Компания адиабатическое необратимое расширение процесс изотермический.
Пример адиабатического расширения
Их многие процессы в технике считаются адиабатическим расширением.
- Выпуск воздуха из шины или контейнера
- Расширение газа в газе турбина адиабатически
- Расширение в паре сопло и турбина
- расширение внутри поршневого цилиндра с допущением
- Свободное адиабатическое расширение газа в баллоне
- Процесс расширения в тепловом двигателе с допущением
- Адиабатическое отопление и система охлаждения
- Устройство расширения