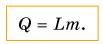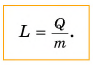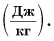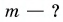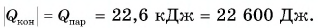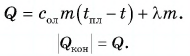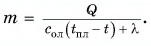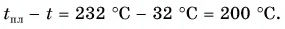The boiling point of a substance is the temperature at which the substance changes state from liquid state to gas state. The boiling point of a liquid varies depending on the surrounding atmospheric pressure, but it is usually close to the melting point of the solid form of the same substance.
How is Boiling Point Determined?
Boiling point of a substance can be determined by using a Boiling Point Apparatus. This method uses the fact that liquids boil when their vapor pressure equals the atmospheric pressure. The apparatus consists of a container of liquid, a heater, and a mercury manometer. First, the liquid is placed in the container and heated until its vapors fill the container. The mercury manometer is then used to measure the atmospheric pressure inside the container. When the mercury column in the manometer reaches the same level as the liquid in the container, this indicates that the vapors have reached atmospheric pressure and the boiling point has been reached.
Boiling point of Water
Boiling point of water is the temperature at which the liquid water becomes water vapor. The boiling point of water is 212 degrees Fahrenheit using Fahrenheit to Celsius conversion (100 degrees Celsius). The boiling point of water is also known as the “saturation temperature.”
Boiling Point Formula of Liquid
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas. The boiling point of a liquid is also the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure. The boiling point of a liquid is affected by the atmospheric pressure, which is why boiling points are usually given at standard atmospheric pressure.
The boiling point of a liquid is the temperature at which the vapor pressure of the liquid is equal to the atmospheric pressure.
The boiling point depends on the pressure of the surrounding atmosphere. When the atmospheric pressure is equal to the vapor pressure of the liquid, the liquid will boil. The boiling point also depends on the purity of the liquid, impurities lower the boiling point of a liquid.
Example: Water boils at 100 degrees Celsius (212 degrees Fahrenheit) at sea level, but only at 93 degrees Celsius (199.4 degrees Fahrenheit) at an altitude of 2,438 meters (8,000 feet).
The formula for calculating the change in the boiling point is:
Kb = RTb2M / ΔHv
where,
Kb is the boiling point constant
R is the universal gas constant (8.314 J/mol-K)
Tb is the boiling point of the liquid
M is the molar mass of the liquid
ΔHv is the heat of vaporization for the particular liquid (2260 J/kg: latent heat of vaporization of water)
Properties of Boiling Point
Following are the properties of the boiling point:
- Boiling point of a liquid varies depending on the surrounding pressure. For example, water boils at 100°C (212°F) at sea level, but only at 93°C (199°F) at an altitude of 1,000 m (3,281 ft).
- Boiling point of a liquid can also be affected by the presence of other substances in the liquid. For example, the boiling point of water is lower when salt is added to it.
- Boiling point of a liquid is a measure of the liquid’s ability to change state from a liquid to a gas. The higher the boiling point, the greater the liquid’s ability to resist changes in state.
- Boiling point of a liquid is also a measure of the liquid’s ability to vaporize. The higher the boiling point, the greater the liquid’s ability to resist vaporization.
- Boiling point of a liquid is a function of the liquid’s vapor pressure. The vapor pressure is the pressure exerted by the vapor of the liquid on the walls of the container.
- Boiling point of a liquid is also a function of the liquid’s volatility. The volatility of a liquid is a measure of the liquid’s ability to vaporize.
- Boiling point of a liquid is affected by the surrounding pressure. The higher the surrounding pressure, the higher the boiling point.
Factors Affecting the Boiling Point of Liquid
The boiling point of a liquid is the temperature at which it changes from a liquid to a gas. The factors that affect the boiling point of a liquid are its pressure, temperature, and purity.
- Purity: The higher the purity of a liquid, the higher its boiling point. This is because impurities lower the vapor pressure of a liquid, making it easier for the liquid to boil.
- Pressure: The boiling point of liquid increases as the pressure on the liquid increases. This is because the vapor pressure of a liquid increases as the pressure on the liquid increases.
- Temperature: The boiling point of a liquid also increases as the temperature around the liquid increases.
How to Find the Boiling Point of a Substance?
To determine the boiling point of a substance, we need to heat the substance until it reaches its boiling point. The boiling point of a substance is defined as the temperature at which the liquid changes its state to gas form. At this temperature, the vapor pressure of the liquid is equal to the atmospheric pressure.
We use a thermometer to measure the temperature of the substance as it is heated. As the substance approaches its boiling point, we will notice that the rate of heating will begin to slow down. This is because the heat is being used to convert the liquid into a gas, rather than increase the temperature of the liquid.
Once the substance reaches its boiling point, it will begin to boil. You can then remove the thermometer and checked the temperature to get the boiling point.
Also, Check
- Molarity
- Mole Concept
- Difference Between Molarity and Molality
Solved Examples on Boiling Point Formula
Example 1: Find the Kb of LiCl if 2 g of LiCl is dissolved in 500 g of water which boils at 100.6°C.
Solution:
Given,
Mass of LiCl = 2 g
Molar mass of LiCl = 42 g/mol
Mass of water = 500 g
Molar mass of water = 18 g/mol
Boiling point of solution = 100.6°CR = 8.314 J/mol-K (Universal gas constant)
Tb = 100.6 + 273 = 373.6 K (Boiling point in Kelvin)
V = 500 / 1000 = 0.5 L (Volume in litres)
M = (2 / 42) + (500 / 18) = 25 mol/L (Molality)
Hv= 2260 J/kg (latent heat of vaporization of water)Kb = RTb2M / ΔHv
= 8.314 × 373.6 × 0.5 × 25 / 2260
= 68.7 molal
Example 2: Find the boiling point of 1 molar solution of sucrose.
Solution:
Given,
Molarity of solution (M) = 1 mol/L
Boiling point elevation (ΔTb) = 100°C (the Kb for sucrose is 100°C/m)
R = 8.314 J/mol-K (universal gas constant)Tb = 100 + 273 = 373 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 373 × 2 × 1 / 2260
= 2.74 molal
Example 3: Find the Kb of the glucose if the solution of glucose in water boils at 103°C when the concentration of the solution is 0.5 molar.
Solution:
Given,
Concentration of solution (c) = 0.5 molar
Boiling point elevation (ΔTb) = 103°C (the Kb for sucrose is 100°C/m)R = 8.314 J/mol-K (universal gas constant)
Tb = 103 + 273 = 376 K (boiling point in Kelvin)
Kb = RTb2M / ΔHv
= 8.314 × 376 × 2 × 0.5 / 2260
= 1.38 molal
FAQs on Boiling Point
Question 1: What is the boiling point of the liquid?
Answer:
The boiling point of a liquid is the temperature at which the liquid changes state from a liquid to a gas.
Question 2: What factors affect the boiling point of a liquid?
Answer:
The boiling point of a liquid is affected by the pressure of the surrounding atmosphere, the purity of the liquid, and the presence of any dissolved solids.
Question 3: How does the boiling point of a liquid change with altitude?
Answer:
The boiling point of a liquid decreases with the rise in altitude. This is because the atmospheric pressure is lower at higher altitudes, and the boiling point of a liquid is inversely affected by the pressure of the surrounding atmosphere.
Question 4: How does the boiling point of a liquid change with the addition of solids?
Answer:
The boiling point of liquid increases with the addition of solids. This is because the solids take up space in the liquid, and the liquid must heat up to a higher temperature in order to vaporize.
Question 5: What is the boiling point of alcohol?
Answer:
The boiling point of alcohol is 78.37 degrees Celsius (172 degrees Fahrenheit).
Question 6: What is the boiling point of mercury?
Answer:
The boiling point of mercury is 356.7 degrees Celsius (673 degrees Fahrenheit.
Last Updated :
17 Jan, 2023
Like Article
Save Article
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 ноября 2022 года; проверки требуют 8 правок.
Температу́ра кипе́ния, то́чка кипе́ния — температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения.
Согласно уравнению Клапейрона — Клаузиуса с ростом давления температура кипения увеличивается, а с уменьшением давления температура кипения соответственно уменьшается:

где 



Предельными температурами кипения являются температура тройной точки и температура критической точки вещества. Так температура кипения воды будет изменяться на Земле в зависимости от высоты: от 100 °C на уровне моря до 69 °C на вершине Эвереста. А при ещё большем увеличении высоты возникнет точка, в которой будет уже невозможно получить жидкую воду: лёд и пар будут переходить непосредственно друг в друга минуя жидкую фазу. С другой стороны, при повышении температуры до 374 °C, а давления — до 22 МПа исчезает граница между газовой и жидкой фазой (подробнее см. сверхкритическая жидкость).
Температура кипения воды в зависимости от давления может быть достаточно точно вычислена по формуле:


где давление 
Постоянство температуры кипения[править | править код]
Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества. Однако данные о температуре кипения сверхчистых веществ, в частности — таких органических жидкостей, как эфир и бензол, могут иметь существенные отличия от обычных табличных данных. Это связано с образованием ассоциатов, которые могут накапливаться в жидкости в отсутствие воды, как медиатора установления равновесного состояния. Так, сверхосушенный бензол может быть подвергнут фракционной перегонке в диапазоне 90—118 (вода кипит при 15 градусах, evg устраивает? 🙂 0 °C.
Свойства элементов[править | править код]
Простым веществом с самой низкой точкой кипения является гелий (−268,928 °C[1]). Самые высокие температуры кипения у рения (по разным источникам, 5597 °C[2] или 5630 °C[3]) и вольфрама (5555 °C[1] или 5930 °C[3]).
Примечания[править | править код]
- ↑ 1 2 CRC Handbook of Chemistry and Physics / Ed.: W. M. Haynes. — 92nd ed. — CRC Press, 2011. — С. 4.121—4.123. — ISBN 978-1439855119.
- ↑ Dobrzańska-Danikiewicz A. D., Wolany W. A rhenium review–from discovery to novel applications (англ.) // Archives of Materials Science and Engineering. — 2016. — Vol. 82, iss. 2. — P. 70—78. Архивировано 21 января 2022 года.
- ↑ 1 2 Zhang Y., Evans J. R. G., Zhang S. Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks (англ.) // J. Chem. Eng. Data. — 2011. — Vol. 56, iss. 2. — P. 328—337. — doi:10.1021/je1011086.
Ссылки[править | править код]
- Температура кипения воды в зависимости от давления
Температура кипения это температура, при которой давление паров жидкости равно давлению окружающей среды, и жидкость превращается в пар.
Явление кипения зависит от давления, и, следовательно, температура кипения жидкости может изменяться в зависимости от окружающего давления.
Например, из-за изменения атмосферного давления на разных высотах вода закипает при температуре 100°C (212°F) на уровне моря, но при температуре 93,4°C (200,1°F), на высоте 1 905 метров (6 250 футов).
При заданном давлении разные жидкости будут кипеть при разных температурах.
Что такое температура кипения
Мы знаем, что чистая вода кипит при температуре 100°C при давлении 1 атм, но интересная вещь происходит с температурой кипения, если мы добавляем в эту воду небольшое количество соли.
Экспериментально доказано, что добавление в жидкость любой формы нелетучего растворимого вещества повышает ее температуру кипения.
Величина, на которую изменяется температура кипения, прямо пропорциональна количеству добавляемого растворимого вещества.
Пусть T0b обозначает температуру кипения чистой жидкости, а Tb обозначает температуру кипения раствора (растворенное вещество + чистая жидкость). Затем,
Tb m
Tb = Kb m
Где ΔTb = T0b − Tb — повышение температуры кипения,
‘m’ — это молярность,
‘Kb’ — это молярная высота, температура кипения или эбуллиоскопическая константа, значение которой зависит только от растворителя
Далее уравнение можно записать в виде,
ΔTb = (1000 × Kb × w) / (M × W)
где ‘вес растворенного вещества ‘ — молярная масса растворенного вещества, а » W’ — вес растворителя в граммах.
Пример решения задачи на температуру кипения
Пример: Каково повышение температуры кипения, когда 147 г молочной кислоты (C6H105) растворяется в 647г циклогексана (C6H12)? Постоянная температура кипения циклогексана составляет 2,79°C/м.
Решение: Определите молярность раствора молочной кислоты
m = (147 г / 162,14 г/моль) / 0,647 кг = 1,40127
ΔTb = Kb m
ΔTb = (2,79°C, кг моль-1) (1,40127 моль/кг)
ΔTb = 3,91°C
Зависит ли температура кипения от примесей
Когда в кипящую жидкость добавляется примесь или растворенное вещество (нелетучее), температура ее кипения увеличивается.
Это указывает на то, что растворы, как правило, имеют более высокую температуру кипения по сравнению с чистыми растворителями.
Например, если вы добавите в кипящую воду нелетучие примеси, такие как немного сахара или щепотку соли, ее температура кипения повысится.
Пример решения задачи на зависимость температуры кипения от примесей
Вопрос: Раствор 10,0 г нелетучего, не диссоциирующего соединения, растворенный в 0,200 кг бензола, кипит при 81,2 °C. Рассчитайте молекулярную массу соединения.
Эбуллиоскопическая постоянная для бензола: 2,53 °C/м и температура кипения чистого бензола: 80,1°C
Примеры ответов:
- 115 г/моль
- 145 г/моль
- 120 г/моль
- 100 г/моль
Ответ: (а)
Решение:
ΔTb = (1000 × Kb × w) / (M × W)
1.1 = (1000×2,53×10) / (М×200)
M = 115 г/моль
Интересные факты о температуре кипения
- Знаете ли вы, что если вы подниметесь на гору, то обнаружите, что температура кипения там снижается? Это происходит главным образом потому, что чем выше температура, тем больше пара вы найдете!
- Вы можете вскипятить воду, чтобы использовать ее в качестве дезинфицирующего средства. Да! Это связано с тем, что при кипячении воды микроорганизмы и бактерии повреждаются из-за ее обжигающего тепла, в результате чего ее можно легко использовать как отличный способ дезинфекции и очистки вашего дома. Всего около минуты кипячения воды достаточно, чтобы убить микроорганизмы.
- Как известно, растворитель-это жидкость, которую можно использовать для разбавления и/или растворения раствора. Но знаете ли вы, что вода-отличный и мощный растворитель? Ряд соединений может быть растворен с использованием воды. Например, люди часто используют его в качестве растворителя для своих напитков, таких как кофе и/или чай.
- Хотя добавление различных типов растворенных веществ в воду, когда она кипит, имеет тенденцию изменять ее температуру кипения, увеличивая ее, спирт является типом летучего растворенного вещества, которое при добавлении в него в конечном итоге снижает температуру кипения воды.
- Вода имеет тенденцию кипеть при относительно более низкой температуре, когда она кипит на большей высоте.
Часто задоваемы вопросы отверы о температуре кипения?
Температура кипения некоторых веществ?
- Температура кипения воды — 100 °C
- Температура кипения спирта — 78, 39 °C
- Температура кипения масла — средняя температура 120-150°C
- Температура кипения сахара — 190 °C
- Температура кипения антифриза — от 108 до 125 °C
- Температура кипения молока — 100,5 °С
- Температура кипения железа — 2862 °C
- Температура кипения меди — 2567 °С
- Температура кипения ртути — 356, 58 °C
Каковы основные аспекты, от которых, как правило, зависит температура кипения жидкости?
Температура, атмосферное давление и давление паров жидкости являются тремя основными факторами, на которых основана температура кипения конкретной жидкости.
Пар имеет тенденцию увеличиваться с повышением температуры, что соответственно влияет на температуру кипения жидкости.
Атмосферное давление, как правило, влияет на температуру кипения совершенно аналогичным образом, поскольку чем больше давление, тем выше будет температура кипения.
И давление пара столь же важно, потому что чем выше это давление, тем быстрее жидкость испарится.
Какой элемент имеет самую низкую и самую высокую температуру кипения?
Вода имеет самую высокую температуру кипения — 100°C. Молекулы, присутствующие в воде, могут объединяться, образуя прочные водородные связи друг с другом.
И в результате образующаяся межмолекулярная сила настолько сильна, что требуется огромное количество энергии, чтобы разделить ее на части. Именно по этой причине вода имеет высокую температуру кипения.
Жидкий гелий, с другой стороны, имеет самую низкую температуру кипения — 4,2°C выше абсолютного нуля.
Это происходит потому, что связи, которые образует этот элемент, слабее по своей природе и требуют меньше энергии, поэтому его температура кипения так низка.
Кипит ли вода быстрее, чем масло?
Нет, вода не кипит быстрее масла. На самом деле все наоборот. Это связано в первую очередь с тем, что масло обладает относительно меньшей теплоемкостью по сравнению с водой, в результате чего для достижения определенных температур также требуется половина энергии.
А кипячение воды занимает больше времени, потому что для этого требуется очень много энергии.
Однако это означает, что масло, которое мы обычно используем для приготовления пищи, замедляет весь процесс приготовления по той же причине.
Влияют ли примеси на температуру кипения жидкости? Если да, то каким образом?
Да, примесь будет влиять на температуру кипения жидкости, увеличивая ее. Когда в жидкость добавляется примесь, давление ее паров, скорее всего, снизится, что приведет к повышению температуры ее кипения.
Например, если вы кипятите воду на плите и добавляете в нее даже щепотку соли, вы заметите, что температура кипения воды увеличится. Однако в случае температуры плавления жидкости примеси только снижают ее.
Содержание:
Кипение жидкостей:
Вы уже знаете, что испарение жидкости без притока теплоты при любой температуре приводит к ее охлаждению. А как будет идти испарение, если жидкости непрерывно передавать энергию (теплоту)?
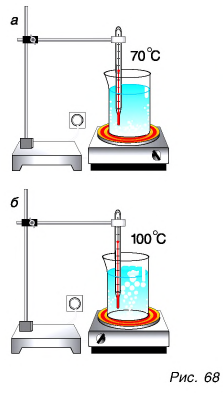
Проведем опыт. Поставим на электроплитку стакан с водой (рис. 68, а). По термометру будем следить за изменением температуры воды в стакане. Температура воды сначала растет. На дне стакана появляется множество маленьких пузырьков. Их размеры постепенно увеличиваются, так как вода испаряется внутрь пузырьков и давление пара в пузырьках при нагревании повышается. Пузырьки отрываются ото дна и стенок и движутся вверх. А что дальше? Если давление пара внутри пузырька больше, чем над жидкостью, то у поверхности он разрывается, и пар выходит наружу. При этом температура воды близка к 100 °C и практически не меняется. А все большее число пузырьков поднимается и лопается у поверхности, выбрасывая пар в атмосферу. Вода кипит (рис. 68, б).
Что такое кипение
Кипение — это процесс парообразования, идущий при постоянной температуре но всему объему жидкости. Действительно, любой пузырек можно рассматривать как сосуд с паром внутри жидкости (рис. 69). С поверхности его стенок идет испарение и обратный процесс — возврат молекул в жидкость, т. е. конденсация.
При кипении температура жидкости не меняется. По ведь энергия (от нагретой плитки) жидкостью поглощается. На что же она расходуется? Энергия, полученная жидкостью, идет на превращение ее в пар (газ), т. е. на преодоление сил притяжения между молекулами жидкости.
При обратном процессе — переходе пара в жидкость (рис. 70), или конденсации, это же количество энергии выделяется.
Температура, при которой происходит кипение жидкости, называется температурой кипения.
Температура кипения у разных жидкостей неодинакова. Это и понятно, ведь энергия взаимодействия их молекул тоже разная.
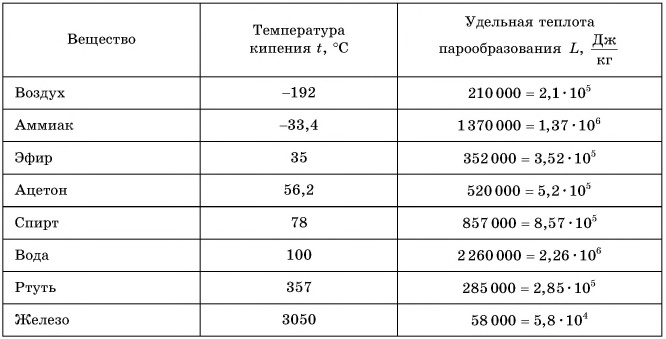
В таблице 4 приведены температуры кипения жидкостей при нормальном атмосферном давлении.
А случайно ли мы, говоря о температуре кипения жидкости, указываем давление? Нет, не случайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
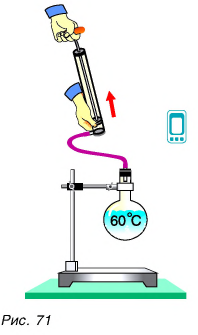
Подтвердим это опытом. Нальем в колбу теплой воды, температура которой t = 50—60 °C. Закроем колбу пробкой, подсоединенной к откачивающему насосу (рис. 71). Откачаем газ из колбы. Вода закипит, хотя ее температура меньше 100 °C. Ио это не значит, что в такой воде можно сварить яйцо. Яйцо варится не потому, что вода кипит, а потому, что она горячая.
А если в специальных условиях создать высокое давление над поверхностью воды, то в ней можно будет расплавить олово, но вода так и не будет кипеть. Объясните почему.
Зависимость температуры кипения от внешнего давления используется в практических целях. Например, для стерилизации медицинских инструментов их помещают в герметически закрытые камеры-автоклавы (рис. 72), вода в которых кипит при температуре значительно выше 100 °C. В быту используются кастрюли-скороварки (рис. 73), в которых температура кипения воды может повышаться до 120 °C. Поэтому пища в скороварках готовится гораздо быстрее, чем в обычных кастрюлях.
- Заказать решение задач по физике
Вернемся к парообразованию. Чтобы превратить в пар 1 кг жидкости при температуре кипения, необходимо передать ей определенное количество теплоты. А если масса жидкости будет 2 кг? Значит, теплоты понадобится в 2 раза больше. А при превращении в пар m кг жидкости количество теплоты увеличится в m раз, т. е. количество теплоты, необходимое для парообразования, прямо пропорционально массе жидкости:
В этой формуле коэффициент L называется удельной теплотой парообразования:
Как следует из формулы, единицей удельной теплоты парообразования в СИ является 1 джоуль на килограмм
Удельная теплота парообразования есть физическая величина, численно равная количеству теплоты, поглощенному 1 кг жидкости при переходе ее в пар при температуре кипения.
Таблица 4. Температура кипения и удельная теплота парообразования некоторых жидкостей (при нормальном атмосферном давлении)
Удельная теплота парообразования различных жидкостей дана в таблице 4. Что значит 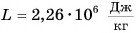
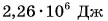
Можно сказать и иначе: 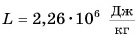
Главные выводы:
- Превращение жидкости в газ (пар) при постоянной температуре во всем объеме жидкости называют кипением.
- Температура кипения зависит от рода жидкости и внешнего давления.
- Чем выше давление над поверхностью жидкости, тем выше температура кипения.
- При кипении жидкость поглощает энергию, при конденсации пара выделяется равное количество энергии.
- Количество поглощенной при кипении тепловой энергии зависит от рода жидкости и ее массы.
Пример решения задачи
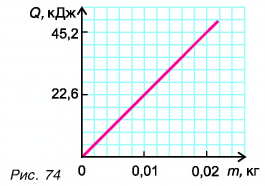
На рисунке 74 представлен график зависимости количества теплоты, идущего на парообразование некоторой жидкости, от ее массы. Какую массу олова можно расплавить, используя теплоту конденсации пара данной жидкости массой 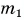
Дано:
Решение
Из графика найдем модуль количества теплоты, которое выделится при конденсации пара массой 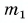
Для нагревания до температуры плавления 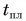
Откуда
Тогда
Ответ: m = 0,2 кг.
- Электромагнитные явления в физике
- Электромагнитные волны и их свойства
- Магнитные явления в физике
- Магнитный поток
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Свойства паров в физике
Температура кипения раствора
Найти температуру кипения раствора 50-процентной сахарозы (С12Н22О11)? Эбулиоскопическая константа воды 0,52.
Решение задачи
Следствие из закона Рауля: повышение температуры кипения раствора, раствор закипает при более высокой температуре, так как концентрация молекул растворителя в нём всегда ниже, чем в чистом растворителе, и давление насыщенного пара раствора достигает атмосферного при более высокой температуре.
Где:
Dt кип. — повышение температуры кипения раствора;
К эб. – эбулиоскопическая постоянная;
Cm– моляльная концентрация;
gB – масса растворенного вещества;
gA – масса растворителя;
µB – молярная масса растворенного вещества.
Пусть масса раствора равна 100 грамм, следовательно, масса растворённого вещества равна 5 грамм, а масса растворителя 100 – 50 = 50 грамм.
Учитывая, что молярная масса сахарозы (С12Н22О11) равна 342 г/моль (смотри таблицу Менделеева), получаем повышениетемпературы кипения раствора:
Dt кип. = 0,52 ⋅ 1000 ⋅ 50 / 342 ⋅ 50 = 1,52 (0С).
Вода кипит при температуре 100 0С, следовательно, температура кипения раствора:
t кип. = 101,52 (0С).
Ответ:
температура кипения раствора 101,52 0С.