Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 ноября 2022 года; проверки требуют 2 правки.

Температу́ра плавле́ния (обычно совпадает с температурой кристаллизации) — температура твёрдого кристаллического тела (вещества), при которой оно совершает переход в жидкое состояние. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать), и, пока оно не застынет полностью, его температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества. На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура отвердевания чистого вещества, например олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не изменяется и в точности совпадает с эталонной температурой, указанной в справочниках.
Смеси веществ не имеют температуры плавления/отвердевания вовсе и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определённой температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления. С ростом температуры вязкость таких веществ снижается, и материал становится более жидким.
Поскольку при плавлении объём тела изменяется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (101 325 Па, или 760 мм ртутного столба) называют точкой плавления.
| вещество | температура плавления (°C) |
|---|---|
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −219 |
| азот | −210,0 |
| метан | −182,5 |
| спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть[2] | −38,83 |
| водяной лёд[3] | 0 |
| бензол | +5,53 |
| цезий | +28,64 |
| галлий | +29,8 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1064 |
| медь | +1083,4 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| карбид вольфрама | +2870 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам[2] | +3414 |
| углерод (сублимация) | +3547 |
| карбид гафния | +3890 |
| карбид тантала-гафния[4] | +3990 |
| карбонитрид гафния[5] | +4200 |
Предсказание температуры плавления (критерий Линдемана)[править | править код]
Попытка предсказать точку плавления кристаллических материалов была предпринята в 1910 году Фредериком Линдеманом[en][6]. Идея заключалась в наблюдении того, что средняя амплитуда тепловых колебаний увеличивается с увеличением температуры. Плавление начинается тогда, когда амплитуда колебаний становится достаточно большой для того, чтобы соседние атомы начали частично занимать одно и то же пространство.
Критерий Линдемана утверждает, что плавление ожидается, когда среднеквадратическое значение амплитуды колебаний превышает пороговую величину.
Температура плавления кристаллов достаточно хорошо описывается формулой Линдемана[7]:
где 


Температура плавления — расчёт
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
Расчёт температуры плавления металлов[править | править код]
В 1999 году профессором Владимирского государственного университета И. В. Гаврилиным было получено новое выражение для расчёта температуры плавления:
где 


Впервые получено исключительно компактное выражение для расчёта температуры плавления металлов, связывающее эту температуру с известными физическими константами: скрытой теплотой плавления, числом Авогадро и константой Больцмана.
Формула выведена как одно из следствий новой теории плавления и кристаллизации, опубликованной в 2000 году[8]. Точность расчетов по формуле Гаврилина можно оценить по данным таблицы.
| Металл | Скрытая теплота плавления  , ккал*моль−1 , ккал*моль−1
|
Температура плавления  , K , K
|
|
|---|---|---|---|
| расчётная | экспериментальная | ||
Алюминий  |
2,58 | 876 | 933 |
Ванадий  |
5,51 | 1857 | 2180 |
Марганец  |
3,50 | 1179 | 1517 |
Железо  |
4,40 | 1428 | 1811 |
Никель  |
4,18 | 1406 | 1728 |
Медь  |
3,12 | 1051 | 1357 |
Цинк  |
1.73 | 583 | 692 |
Олово  |
1,72 | 529 | 505 |
Молибден  |
8.74 | 2945 | 2890 |
По этим данным, точность расчетов 
См. также[править | править код]
- Температура застывания
Примечания[править | править код]
- ↑ Дриц М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — 672 с.
- ↑ 1 2 Haynes, 2011, p. 4.122.
- ↑ Температура плавления очищенной воды была измерена как 0,002519 ± 0,000002 °C, см. Feistel, R.; Wagner, W. A New Equation of State for H2O Ice Ih (англ.) // J. Phys. Chem. Ref. Data (англ.) (рус. : journal. — 2006. — Vol. 35, no. 2. — P. 1021—1047. — doi:10.1063/1.2183324. — Bibcode: 2006JPCRD..35.1021F.
- ↑ Andrievskii R. A., Strel’nikova N. S., Poltoratskii N. I., Kharkhardin E. D., Smirnov V. S. Melting point in systems ZrC-HfC, TaC-ZrC, TaC-HfC // Soviet Powder Metallurgy and Metal Ceramics. — 1967. — Т. 6, вып. 1. — С. 65–67. — ISSN 0038-5735. — doi:10.1007/BF00773385.
- ↑ Создан самый тугоплавкий на сегодня материал. indicator.ru. Дата обращения: 9 августа 2020. Архивировано 13 августа 2020 года.
- ↑ Lindemann FA (англ.) (рус.. The calculation of molecular vibration frequencies (нем.) // Phys. Z. : magazin. — 1910. — Bd. 11. — S. 609—612.
- ↑ Жирифалько Л. Статистическая физика твердого тела. — М.: Мир, 1975. — С. 15.
- ↑ Гаврилин И. В. 3.7. Расчёт температуры плавления металлов // Плавление и кристаллизация металлов и сплавов. — Владимир: Изд. ВлГУ, 2000. — С. 72. — 200 экз. — ISBN 5-89368-175-4.
Литература[править | править код]
- Haynes, William M. CRC Handbook of Chemistry and Physics (неопр.). — 92nd. — CRC Press, 2011. — ISBN 1439855110.
# Определение температуры плавления
Основные
правила по технике безопасности для
данной работы
При
работе со спиртовкой нужно помнить:
-
зажигать
её можно только спичкой, а не от другой
спиртовки; -
диск
должен плотно прилегать к горлышку и
фитиль находиться в расправленном
виде; -
нельзя
переносить зажжённую спиртовку; -
тушить
фитиль спиртовки только колпачком.
Цель
работы
Определить
температуру плавления исследуемого
вещества и при сравнении её со справочными
данными сделать вывод о степени чистоты
изучаемого образца.
Основные
теоретические положения
Температура
плавления вещества – это температура,
при которой вещество из твердого
(кристаллического) состояния переходит
в жидкое. Началом плавления считается
момент размягчения вещества и образование
первой капли, а концом – образование
прозрачной жидкости.
Если вещество химически чистое, то его
температура плавления колеблется в
интервале 0,5-1,0°С. Четкая температура
плавления вещества является признаком
его чистоты, примеси обычно понижают
эту температуру или увеличивают интервал,
в котором плавится данное соединение.
Порядок
выполнения работы
Температуру плавления органического
кристаллического вещества определяют
в стеклянном капилляре. Для этого
вещество, тщательно измельченное в
фарфоровой ступке, помещают в запаянный
с одного конца стеклянный капилляр,
диаметром 0,8 – 1 мм. Для того чтобы
переместить вещество на дно капилляра
и плотно его утрамбовать, капилляр
с веществом бросают несколько раз
запаянным концом вниз через стеклянную
трубку длиной 40 – 50 см, поставленную
вертикально на стол. Высота столбика
вещества в капилляре, тщательно
уплотненного должна быть 3 – 5 мм.

-
термометр,
-
спиртовка,
-
капилляр,
-
глицерин
(дибутилфталат или силиконовое масло)
Капилляр с веществом помещают в
боковой отвод прибора, так чтобы он
касался шарика термометра.
Сначала нагревание ведут со скоростью
4 – 6 0С в минуту, а при температуре,
близкой к температуре плавления
(справочной) – со скоростью 1 – 20С
в минуту.
Отмечают температуру, при которой
появляется жидкая фаза (начало плавления)
и температуру, при которой исчезают
последние кристаллы вещества (конец
плавления). Результаты представляют в
виде интервала, например 135 -135,5°C. Данные
заносят в таблицу.
|
Название исследуемого вещества |
Температура начала плавления, |
Температура конца плавления, |
Температура плавления чистого вещества, 0С ( справочные |
Анализ результатов лабораторной
работы
Сделайте
вывод о степени чистоты исследуемого
органического вещества.
Контрольные
вопросы
-
Какие
физические константы характерны для
твердых органических веществ? -
Что такое
температура плавления? -
В каком
случае, температура плавления, полученная
в результате эксперимента, может
отличаться от справочных данных. -
О чём можно
судить по величине интервала: появление
первой капли – образование прозрачной
жидкости в капилляре. -
Почему
прибор для определения температуры
плавления заполняют глицерином, а,
например, не водой.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
«Плавление и кристаллизация.
Удельная теплота плавления»
Плавление
Плавление — это процесс превращения вещества из твёрдого состояния в жидкое.
Наблюдения показывают, что если измельчённый лёд, имеющий, например, температуру –10 °С, оставить в тёплой комнате, то его температура будет повышаться. При 0 °С лёд начнет таять, а температура при этом не будет изменяться до тех пор, пока весь лёд не превратится в жидкость. После этого температура образовавшейся изо льда воды будет повышаться.
Это означает, что кристаллические тела, к которым относится и лед, плавятся при определённой температуре, которую называют температурой плавления. Важно, что во время процесса плавления температура кристаллического вещества и образовавшейся в процессе его плавления жидкости остаётся неизменной.
В описанном выше опыте лёд получал некоторое количество теплоты, его внутренняя энергия увеличивалась за счёт увеличения средней кинетической энергии движения молекул. Затем лёд плавился, его температура при этом не менялась, хотя лёд получал некоторое количество теплоты. Следовательно, его внутренняя энергия увеличивалась, но не за счёт кинетической, а за счёт потенциальной энергии взаимодействия молекул. Получаемая извне энергия расходуется на разрушение кристаллической решетки. Подобным образом происходит плавление любого кристаллического тела.
Аморфные тела не имеют определённой температуры плавления. При повышении температуры они постепенно размягчаются, пока не превратятся в жидкость.
Кристаллизация
Кристаллизация — это процесс перехода вещества из жидкого состояния в твёрдое состояние. Охлаждаясь, жидкость будет отдавать некоторое количество теплоты окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счёт уменьшения средней кинетической энергии его молекул. При определённой температуре начнётся процесс кристаллизации, во время этого процесса температура вещества не будет изменяться, пока всё вещество не перейдет в твёрдое состояние. Этот переход сопровождается выделением определённого количества теплоты и соответственно уменьшением внутренней энергии вещества за счёт уменьшения потенциальной энергии взаимодействия его молекул.
Таким образом, переход вещества из жидкого состояния в твёрдое состояние происходит при определённой температуре, называемой температурой кристаллизации. Эта температура остаётся неизменной в течение всего процесса плавления. Она равна температуре плавления этого вещества.

На рисунке приведён график зависимости температуры твёрдого кристаллического вещества от времени в процессе его нагревания от комнатной температуры до температуры плавления, плавления, нагревания вещества в жидком состоянии, охлаждения жидкого вещества, кристаллизации и последующего охлаждения вещества в твёрдом состоянии.
Удельная теплота плавления
Различные кристаллические вещества имеют разное строение. Соответственно, для того, чтобы разрушить кристаллическую решётку твёрдого тела при температуре его плавления, необходимо ему сообщить разное количество теплоты.
Удельная теплота плавления — это количество теплоты, которое необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления. Опыт показывает, что удельная теплота плавления равна удельной теплоте кристаллизации.
Удельная теплота плавления обозначается буквой λ. Единица удельной теплоты плавления — [λ] = 1 Дж/кг.
Значения удельной теплоты плавления кристаллических веществ приведены в таблице. Удельная теплота плавления алюминия 3,9*105 Дж/кг. Это означает, что для плавления 1 кг алюминия при температуре плавления необходимо затратить количество теплоты 3,9*105 Дж. Этому же значению равно увеличение внутренней энергии 1 кг алюминия.
Чтобы вычислить количество теплоты Q, необходимое для плавления вещества массой m, взятого при температуре плавления, следует удельную теплоту плавления λ умножить на массу вещества: Q = λm.
Эта же формула используется при вычислении количества теплоты, выделяющегося при кристаллизации жидкости.

Конспект урока «Плавление и кристаллизация. Удельная теплота плавления».
Следующая тема: «Тепловые машины. ДВС. Удельная теплота сгорания топлива».
Плавление и кристаллизация:
При теплопередаче внутренняя энергия тела изменяется. Чаще всего это выражается в изменении его температуры. При этом агрегатное состояние вещества остается прежним. Однако существуют процессы, при которых внутренняя энергия вещества при получении теплоты увеличивается, а температура остается постоянной.
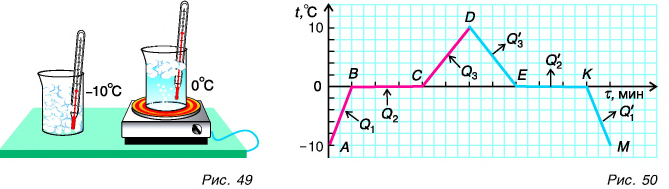
К таким процессам относятся плавление и кристаллизация (отвердевание). Изучим эти процессы с помощью опыта. В стакан поместим кусочки льда из морозильной камеры, охлажденные до температуры, например, -10 °C. Вставим в стакан термометр и начнем нагревать (рис. 49). Температура льда повышается. Он нагревается. Внутренняя энергия льда увеличивается за счет кинетической энергии его молекул. Изменение температуры вещества в стакане с течением времени будем изображать на графике (рис. 50). Участок АВ соответствует нагреванию льда от -10 °C до 0 °C. При дальнейшей передаче льду теплоты его температура остается постоянной, равной 0 °C (участок ВС). На что же уходит получаемая льдом теплота? Наблюдения показывают, что кристаллический лед превращается в воду.
Процесс перехода вещества из твердого состояния в жидкое называется плавлением.
Получаемая от плитки теплота по-прежнему превращается во внутреннюю энергию вещества, увеличивая ее. Это увеличение связано с изменением потенциальной энергии взаимодействия частиц при разрушении кристалла. Кинетическая же энергия не изменяется, так как температура постоянна. Аналогично идет процесс плавления других кристаллических веществ: железа, меди, стали и т. д.
Температура, при которой вещество переходит из твердого состояния в жидкое, т. е. плавится, называется температурой плавления.
Температура плавления у разных кристаллических веществ неодинакова (табл. 3). Она очень высокая у вольфрама и очень низкая у водорода.
Таблица 3. Температура плавления и удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)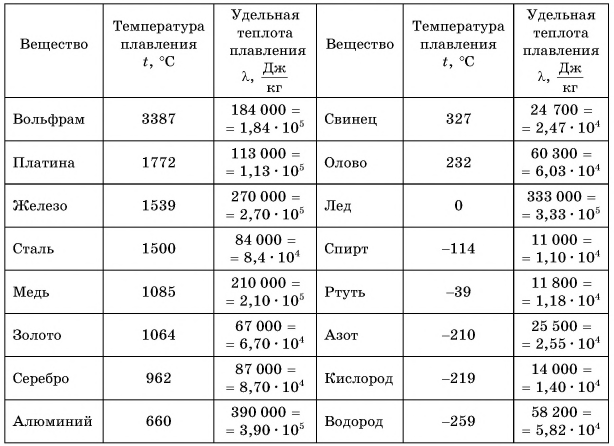
Продолжим опыт. Как только весь лед расплавится, температура воды в стакане начнет возрастать (участок CD, см. рис. 50). На всех рассмотренных участках теплота веществом (льдом, водой) поглощалась.
А теперь снимем стакан с плитки, поставим в морозильную камеру и будем периодически наблюдать за показаниями термометра и состоянием вещества. Вода сначала охлаждается до 0 °C (участок DE). Ее внутренняя энергия уменьшается, теплота 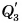 выделяется, причем
выделяется, причем 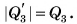 Затем идет процесс кристаллизации (участок ЕК), температура остается постоянной, ее значение равно 0 °C. Вода превращается в лед. Теплота
Затем идет процесс кристаллизации (участок ЕК), температура остается постоянной, ее значение равно 0 °C. Вода превращается в лед. Теплота 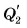 выделяется,
выделяется, 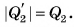 Участок КМ (см. рис. 50) соответствует охлаждению льда до температуры в камере.
Участок КМ (см. рис. 50) соответствует охлаждению льда до температуры в камере.
Процесс перехода вещества из жидкого состояния в твердое называется кристаллизацией.
Обратите внимание, что температура плавления и температура кристаллизации одинаковы. Например, если олово плавится при температуре 232 °C (см. табл. 3), то и отвердевать оно будет при температуре 232 °C.
Для любознательных:
В таблице 3 даны температуры плавления веществ при нормальном атмосферном давлении. И это не случайно. Для большинства веществ с увеличением давления температура плавления увеличивается. Но для льда — наоборот: при повышении давления лед может плавиться, например, при температуре -5 °C.

Понятия «температура плавления» и «температура кристаллизации» применимы не ко всем веществам. Согрев рукой кусок холодного твердого пластилина, мы ощутим постепенное уменьшение его твердости. Нагревая пластилин далее, можно перевести его в состояние вязкой жидкости. Но мы не обнаружим определенной температуры плавления. То же самое происходит при нагревании стекла: наблюдается непрерывное уменьшение его твердости (рис. 51) и увеличение текучести. Причина такого поведения указанных веществ (их называют аморфными) в отсутствии в их строении упорядоченного расположения частиц.
Понятия «температура плавления» и «температура кристаллизации» применимы лишь к веществам, имеющим кристаллическое строение.

Температуру плавления приходится учитывать при создании бытовой и промышленной техники. Спирали лампочек, нагревательных элементов (рис. 52) делают из тугоплавких материалов. В самолетостроении, в ракетной и космической промышленности используют материалы с высокой температурой плавления. Объясните причину этого.
Температуру плавления одних веществ можно изменить, смешивая их с другими. Так, добавляя поваренную соль ко льду, можно получить смесь с температурой плавления -21 °C. Это свойство активно используют дорожные службы, посыпая зимой улицы смесью песка и соли.
- Заказать решение задач по физике
Главные выводы:
- Для перехода кристаллического вещества из твердого состояния в жидкое его необходимо нагреть до температуры плавления.
- В процессах плавления и кристаллизации температура вещества не изменяется.
- Температуры плавления и кристаллизации для данного вещества одинаковы.
- При плавлении вещество поглощает энергию, при кристаллизации столько же энергии выделяется.
Удельная теплота плавления и кристаллизации
Как определить количество теплоты, которое должно поглотить твердое кристаллическое тело массой т, чтобы перейти в жидкое состояние, т. е. расплавиться? Еще раз обращаем ваше внимание на то, что температура во время плавления не изменяется (см. рис. 50, участок ВС), но теплота телу сообщается. Значит, она идет на разрушение кристаллической упорядоченной структуры вещества тела.
Физическая величина, численно равная количеству теплоты, которое необходимо передать твердому телу массой 1 кг при температуре плавления для перехода в жидкое состояние, называется удельной теплотой плавления.
Удельная теплота плавления обозначается греческой буквой 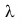 (ламбда).
(ламбда).
Чтобы расплавить твердое тело массой 2 кг, ему надо передать энергии (теплоты) Q в 2 раза больше. А если масса тела равна m? Очевидно, для перехода в жидкое состояние тело должно получить теплоты Q в m раз больше, т. е.
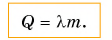
Из этой формулы следует, что удельная теплота плавления определяется как
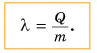
В СИ единицей удельной теплоты плавления является 1 джоуль на килограмм 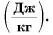
У различных веществ удельная теплота плавления 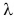 неодинакова. В таблице 3 приведены ее значения для разных веществ. Как следует из таблицы,
неодинакова. В таблице 3 приведены ее значения для разных веществ. Как следует из таблицы, 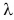 для ртути равна 11800 5
для ртути равна 11800 5 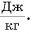 Это значит, что для перехода ртути массой m = 1 кг, имеющей температуру t = -39°С, из твердого состояния в жидкое ей надо передать Q = 11 800 Дж энергии. Больше всего теплоты для плавления массы m = 1 кг требуется льду —
Это значит, что для перехода ртути массой m = 1 кг, имеющей температуру t = -39°С, из твердого состояния в жидкое ей надо передать Q = 11 800 Дж энергии. Больше всего теплоты для плавления массы m = 1 кг требуется льду — 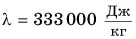 (рис. 54, а). Но при замерзании при температуре t = 0 °C столько же теплоты выделяет каждый килограмм воды (рис. 54, б).
(рис. 54, а). Но при замерзании при температуре t = 0 °C столько же теплоты выделяет каждый килограмм воды (рис. 54, б).
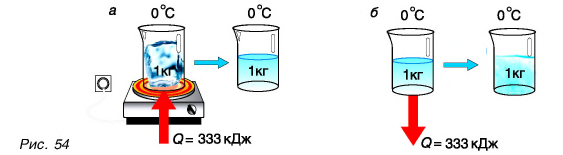
Большая удельная теплота плавления объясняет затяжное таяние льда озер, рек и других водоемов. А так как теплоту лед поглощает из окружающей среды, то погода в это время, как правило, прохладная. И наоборот, при замерзании озер, рек и других водоемов (рис. 55) выделяется большое количество энергии, что делает более теплой позднюю осеннюю погоду, а климат вблизи морей и океанов более умеренным.

Главные выводы:
- При переходе 1 кг вещества из твердого состояния в жидкое поглощается количество теплоты, численно равное удельной теплоте плавления, и ровно столько же теплоты выделяется при его переходе из жидкого состояния в твердое.
- Температуры плавления и кристаллизации для данного вещества одинаковы.
- Удельная теплота плавления у разных веществ различная.
Пример решения задачи
В горячую воду температурой 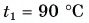 опустили кубик льда массой
опустили кубик льда массой 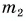 = 0,20 кг, имеющий температуру
= 0,20 кг, имеющий температуру 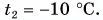 Окончательная температура воды стала t = 20 °C. Определите массу горячей воды. Потерями теплоты пренебречь.
Окончательная температура воды стала t = 20 °C. Определите массу горячей воды. Потерями теплоты пренебречь.
Дано:
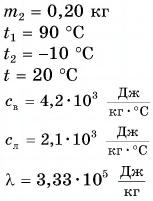
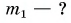
Решение:
Составим уравнение теплового баланса: 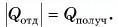 Отдавала теплоту горячая вода, охлаждаясь от температуры
Отдавала теплоту горячая вода, охлаждаясь от температуры 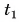 до температуры t:
до температуры t: 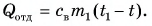 Лед получал теплоту, за счет которой он нагрелся от
Лед получал теплоту, за счет которой он нагрелся от 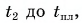 превратился в воду, затем полученная вода нагрелась от температуры
превратился в воду, затем полученная вода нагрелась от температуры 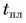 до температуры t:
до температуры t:
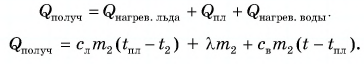
Тогда 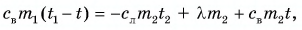
откуда 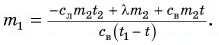
Ответ: 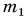 = 0,3 кг.
= 0,3 кг.
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Свойства паров в физике
- Кипение жидкостей в физике
- Инфракрасные излучения
- Количество теплоты в физике
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
Содержание:
- Плавление и кристаллизация
- Плавление, кристаллизация и температура плавления
- Удельная теплота плавления
- Изменение объема и плотности вещества при плавлении и отвердевании
- Зависимость температуры и теплоты плавления от давления. Точка плавления
- Уравнение теплового баланса при плавлении и кристаллизации
- Растворы и сплавы. Охлаждающие смеси
- Испарение твердых тел (сублимация)
- Диаграмма состоянии вещества. Тройная точка
Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением теплоты плавления и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температурной точке превращения — температура плавления.
Кристаллизация — образование кристаллов из паров, р ров, расплавов, из в ва в тв. состоянии (аморфном или другом кристаллическом), из электролитов в процессе электролиза (электрокристаллизация), а также при хим. реакциях.
На странице -> решение задач по физике собраны решения задач и заданий с решёнными примерами по всем темам физики.
Плавление и кристаллизация
Переход вещества из твёрдого состояние в жидкое называют плавлением.
Температуру, при которой вещество плавится, называют температурой плавления.
Кристаллизация — это процесс выстраивания атомов и молекул в жесткую кристаллическую решетку с хорошо определенной энергетически устойчивой структурой.
Плавление, кристаллизация и температура плавления
Переход вещества из твердого состояния в жидкое называется плавлением, а переход из жидкого состояния в твердое — отвердеванием или кристаллизацией.
При плавлении твердого вещества увеличиваются расстояния между частицами, образующими кристаллическую решетку, и происходит разрушение самой решетки. Это означает, что в процессе плавления увеличивается молекулярно-потенциальная энергия вещества. Таким образом, плавление вещества самопроизвольно происходить не может, так как на этот процесс необходимо затрачивать энергию.
При кристаллизации происходит сближение частиц, которые образуют решетку, а их потенциальная энергия уменьшается. Следовательно, кристаллизация может происходить только тогда, когда жидкость отдает свою энергию каким-либо внешним телам.
Итак, единица массы жидкого вещества обладает большей внутренней энергией, чем единица массы того же вещества в твердом состоянии, даже если их температура одинакова.
Область, в которой вещество однородно по всем физическим и химическим свойствам, называется фазой состояния этого вещества. Отметим, что твердая и жидкая фазы вещества при одинаковой температуре могут оставаться в равновесии сколь угодно долго, если твердая фаза не сможет получить энергию, а жидкая — ее отдать. Например, лед может долго плавать в воде, если температура всех окружающих тел будет одинакова и равна 0°С.
Пусть имеется только твердая фаза вещества, которая получает энергию от других тел. Тогда сначала будет возрастать и молекулярно-потенциальная и молекулярно-кинетическая энергии этого вещества, так как и расстояния между частицами в кристаллической решетке и скорости их движения будут увеличиваться. Затем, при определенной температуре, начнется разрушение кристаллической решетки. Пока все вещество не расплавится, его температура остается неизменной, а вся получаемая веществом энергия идет только на работу по преодолению сил молекулярного сцепления. Когда останется только жидкая фаза, то, продолжая получать энергию, она будет уже нагреваться, т. е. начнет возрастать ее молекулярно-кинетическая энергия.
Если жидкая фаза будет отдавать свою энергию окружающим телам, то все описанные процессы повторятся в обратном порядке.
На рис. 12.1 показаны графики изменения температуры вещества при плавлении и отвердевании.

Отрезок  ((рис. 12.1, а) выражает количество теплоты, полученное веществом при нагревании в твердом состоянии (от
((рис. 12.1, а) выражает количество теплоты, полученное веществом при нагревании в твердом состоянии (от  до
до  ), отрезок
), отрезок  — при плавлении и отрезок
— при плавлении и отрезок  — при нагревании в жидком состоянии. Отрезок
— при нагревании в жидком состоянии. Отрезок  (рис. 12.1,6) выражает количество теплоты, отданной веществом при охлаждении в жидком состоянии (от
(рис. 12.1,6) выражает количество теплоты, отданной веществом при охлаждении в жидком состоянии (от  до
до  ), отрезок
), отрезок  — при отвердевании и отрезок
— при отвердевании и отрезок  — при охлаждении в твердом состоянии. Опыт показывает, что плавление и отвердевание определенного вещества происходит при одинаковой температуре, не изменяющейся, пока совместно существуют твердая и жидкая фазы вещества. Эта температура называется температурой плавления. Отметим, что при плавлении и отвердевании вещества всегда существует резкая граница между твердой и жидкой фазами.
— при охлаждении в твердом состоянии. Опыт показывает, что плавление и отвердевание определенного вещества происходит при одинаковой температуре, не изменяющейся, пока совместно существуют твердая и жидкая фазы вещества. Эта температура называется температурой плавления. Отметим, что при плавлении и отвердевании вещества всегда существует резкая граница между твердой и жидкой фазами.
Как показывает опыт, у аморфных веществ процессов плавления и отвердевания не наблюдается. При нагревании они постепенно размягчаются, а при охлаждении постепенно густеют. Температура аморфных веществ в указанных случаях непрерывно изменяется, а границы между твердой -и жидкой фазами не существует, так как вся их масса имеет однородный вид.
Итак, плавление и кристаллизацию можно наблюдать только у кристаллических тел.
Удельная теплота плавления
Изучение процессов плавления и отвердевания показало, что изменение внутренней энергии вещества при этих процессах прямо пропорционально его массе т. Поскольку изменение энергии в таких случаях выражают количеством теплоты плавления  , имеем
, имеем

Теплота плавления  зависит также от рода вещества и внешних условий. Эта зависимость выражается коэффициентом пропорциональности
зависит также от рода вещества и внешних условий. Эта зависимость выражается коэффициентом пропорциональности  . Величина
. Величина  , характеризующая зависимость изменения внутренней энергии вещества в процессе его плавления или отвердевания от рода вещества и внешних условий, называется удельной теплотой плавления. Удельная теплота плавления вещества измеряется количеством теплоты, необходимым для плавления единицы массы этого вещества, взятого при температуре плавления:
, характеризующая зависимость изменения внутренней энергии вещества в процессе его плавления или отвердевания от рода вещества и внешних условий, называется удельной теплотой плавления. Удельная теплота плавления вещества измеряется количеством теплоты, необходимым для плавления единицы массы этого вещества, взятого при температуре плавления:

Определим единицу удельной теплоты плавления  , в СИ:
, в СИ:

В СИ за единицу  , принимают такую удельную теплоту плавления, при которой для плавления массы в 1 кг при неизменной температуре затрачивается 1 Дж энергии.
, принимают такую удельную теплоту плавления, при которой для плавления массы в 1 кг при неизменной температуре затрачивается 1 Дж энергии.
Удельную теплоту плавления определяют опытным путем и при расчетах берут из таблиц.
Изменение объема и плотности вещества при плавлении и отвердевании
При плавлении происходит переход от упорядоченного расположения частиц в решетке твердого тела к их беспорядочному расположению в жидкости; поэтому можно ожидать, что при плавлении и отвердевании вещества будет происходить заметное изменение его объема. Опыт подтверждает это предположение. Например, при затвердевании расплавленного в пробирке нафталина в нем образуется углубление.
Оказывается, что у огромного большинства веществ объем при плавлении увеличивается, а при отвердевании уменьшается. Очевидно, при этом изменяется и плотность этих веществ: при плавлении плотность уменьшается, а при отвердевании увеличивается. Это легко подтвердить опытами. Например, кристаллики твердого нафталина тонут в расплавленном нафталине.
Проделав такого рода опыт с висмутом, мы Рис. 12.2. убедимся в том, что твердый висмут плавает в жидком висмуте.

Лед также плавает в воде. Некоторые вещества, например висмут, лед, галлий, германий, кремний, чугун, при плавлении сжимаются, а при отвердевании расширяются. Эти отклонения от общего правила объясняются особенностями строения кристаллических решеток этих веществ. Так, кристаллическая решетка германия и кремния (решетка типа алмаза, см. рис. 11.8) отличается невысокой плотностью упаковки атомов, и при плавлении эти вещества уменьшаются в объеме.
На рис. 12.2 показано расположение молекул льда в пространственной решетке, где видно, что молекулы Н20 расположены вплотную друг к другу, но при этом образуют ажурную конструкцию, в которой имеются значительные внутренние пустоты. При плавлении расстояния между ближайшими молекулами Н20 увеличиваются, как и у других веществ, но ажурное строение кристалла ломается и за счет заполнения молекулам внутренних пустот общий объем вещества уменьшается. Поэтому вода оказывается плотнее льда.
Исследования показали, что после плавления в воде остаются отдельные части кристаллической решетки, в которых сохраняются пустоты. Они постепенно разрушаются лишь в процессе дальнейшего нагревания воды. Поэтому вода сжимается при нагревании до температуры 4°С. При 4°С процессы исчезновения пустот и увеличения расстояний между молекулами при нагревании компенсируются, и при дальнейшем нагревании вода начинает расширяться. При охлаждении воды все описанные процессы происходят в обратном порядке. Таким образом, вода имеет наибольшую плотность лишь при 4°С.
Это свойство воды имеет огромное значение в природе. Расширение воды при замерзании ведет к разрушению горных пород, предохраняет водоемы от промерзания и т. п. (Подумайте, почему на дне рек и озер зимой сохраняется температура 4°С.)
Изменение объема металлов при плавлении и отвердевании имеет существенное значение в литейном деле.
Зависимость температуры и теплоты плавления от давления. Точка плавления
Опыт показывает, что изменение внешнего давления на твердое вещество отражается на температуре плавления этого вещества. В тех случаях, когда объем вещества при плавлении возрастает, увеличение внешнего давления, которое затрудняет процесс плавления, приводит к повышению температуры плавления. Если же объем вещества при плавлении уменьшается, то увеличение внешнего давления ведет к понижению температуры плавления этого вещества, так как повышенное давление в этом случае помогает процессу плавления. Отметим, что только очень большое увеличение давления заметно изменяет температуру плавления вещества. Например, чтобы понизить температуру плавления льда на 1 кельвин, давление нужно повысить на 130 атмосфер.
Температуру плавления вещества при нормальном атмосферном давлении называют точкой плавания вещества.
Оказывается, что удельная теплота плавления  , тоже зависит от давления. При больших внешних давлениях вещество в процессе расширения должно совершать заметную работу против сил внешнего давления. Поэтому у тех веществ, которые при плавлении расширяются, удельная теплота плавления при увеличении внешнего давления возрастает, а у льда, висмута и галлия — убывает. Например, если при нормальном давлении для ртути
, тоже зависит от давления. При больших внешних давлениях вещество в процессе расширения должно совершать заметную работу против сил внешнего давления. Поэтому у тех веществ, которые при плавлении расширяются, удельная теплота плавления при увеличении внешнего давления возрастает, а у льда, висмута и галлия — убывает. Например, если при нормальном давлении для ртути  = 11,5 . 103 Дж/кг и для висмута
= 11,5 . 103 Дж/кг и для висмута  =54,5 . 103 Дж/кг, то при давлении 12 . 103 атм
=54,5 . 103 Дж/кг, то при давлении 12 . 103 атм  =13,2 . 103 Дж/кг и
=13,2 . 103 Дж/кг и  = 38,1 . 103 Дж/кг.
= 38,1 . 103 Дж/кг.
Уравнение теплового баланса при плавлении и кристаллизации
Многие расчеты процессов теплообмена, в которых происходят плавление и отвердевание, проводят с помощью уравнения теплового баланса. В качестве примера рассмотрим, как составляется такое уравнение при определении удельной теплоты плавления льда с помощью калориметра.
Возьмем калориметр массой  , в котором находится некоторое количество воды
, в котором находится некоторое количество воды  при температуре
при температуре  . Чтобы определить
. Чтобы определить  льда, бросим в калориметр кусочек тающего льда массой
льда, бросим в калориметр кусочек тающего льда массой  при температуре
при температуре  . Допустим, что, когда весь лед растаял, в калориметре установилась температура
. Допустим, что, когда весь лед растаял, в калориметре установилась температура  . Тогда можно считать, что лед получал теплоту, когда таял, а образовавшаяся из него вода — когда нагревалась до температуры
. Тогда можно считать, что лед получал теплоту, когда таял, а образовавшаяся из него вода — когда нагревалась до температуры  , т. е.
, т. е.

Отдавали же теплоту калориметр и находившаяся в нем вода. Поэтому

Так как  имеем
имеем

Из последнего уравнения по результатам, полученным из опыта, вычисляют удельную теплоту плавления льда. Она равна  =3,3 . 105 Дж/кг.
=3,3 . 105 Дж/кг.
Растворы и сплавы. Охлаждающие смеси
Из практики известно, что в воде хорошо растворяются различные соли и многие другие вещества, например сахар. При этом оказывается, что такие вещества распадаются на отдельные молекулы, которые равномерно перемешиваются с молекулами воды. Таким образом, раствор представляет собой равномерную смесь молекул растворенного вещества и растворителя.
Поваренная соль хорошо растворяется в воде, но можно насыпать в воду столько соли, что она перестанет растворяться. Это относится и к большинству других растворов. Такой раствор, в котором какое-либо вещество больше растворяться уже не может, называется насыщенным. Но бывают растворы, в которых молекулы двух веществ при растворении могут перемешиваться в любой пропорции, например раствор этилового спирта в воде (или воды в спирте).
При растворении твердых веществ в жидкости необходимо затратить энергию, которая называется теплотой растворения. Поэтому при таком растворении часто наблюдается охлаждение раствора. Так, при растворении нашатыря в воде температура заметно понижается. Отметим, что, когда между растворяемым веществом и растворителем происходит химическая реакция, может произойти нагревание раствора.
На растворение многих веществ влияет температура. (Например, при повышении температуры растворимость сахара резко возрастает, а растворимость воздуха в воде уменьшается.) Растворимость многих газов при увеличении давления может резко возрастать. (Напомним, что в вине или в воде при повышенном давлении растворяется много углекислого газа. При быстром подъеме из глубоких слоев воды водолаз может погибнуть от «кессонной болезни», так как при резком падении давления из крови выделяются растворенные в ней газы и кровь как бы закипает.) Растворяться в жидком растворителе могут и твердые вещества, и жидкости, и газы. Но далеко не всякие вещества образуют растворы. Так, ртуть и керосин не дают растворов в воде.
При охлаждении или выпаривании насыщенного раствора твердого вещества можно наблюдать его кристаллизацию. Таким путем удобно выращивать большие монокристаллы. Для этого в насыщенном растворе подвешивают маленький кристаллик из растворенного вещества и очень медленно выпаривают раствор.
Растворенное вещество понижает температуру затвердевания растворителя и повышает температуру его кипения, Так, например, концентрированный раствор поваренной соли в воде замерзает при температуре —21°С, а раствор хлористого кальция — при —55°С. Поэтому смесь снега с солью иногда используют как охлаждающую смесь. Сначала в такой смеси образуется небольшое количество раствора соли в воде, затем происходит дальнейшее растворение в нем кристаллов смеси, что вызывает значительное понижение ее температуры.
Расплавив различные вещества и смешав их в определенной пропорции, можно получить разнообразные сплавы. Иногда при этом образуются твердые растворы. К ним относится сталь — она представляет собой раствор углерода в железе. Атомы углерода в стали располагаются в междоузлиях решетки железа, т. е. внедрены между атомами железа. В твердых растворах атомы одного металла в узлах решетки могут замещать атомы другого. Примером такого раствора могут служить сплавы меди и золота.
В технике часто бывают нужны материалы с такими свойствами, которые не встречаются у природных веществ. Тогда подбирают подходящий материал, создавая новые сплавы с нужными свойствами. Одни сплавы обладают большой, пластичностью, другие — большой механической прочностью и легкостью, третьи имеют очень низкую температуру плавления, четвертые обладают большой жаропрочностью и т. д. Поэтому создание новых сплавов и изучение их свойств является одной из важнейших задач современной науки и техники.
Испарение твердых тел (сублимация)
Многие твердые вещества обладают запахом. Примером таких веществ являются камфара и нафталин. Это доказывает, что при определенных условиях твердые вещества могут переходить из твердого состояния в газообразное, минуя жидкое. Действительно, запах создается молекулами твердых веществ, которые попадают к нам в нос. Следовательно, в воздухе имеются пары этих веществ.
Процесс испарения твердых тел аналогичен испарению жидкостей (§ 7.2). Все твердые вещества испаряются, но чаще всего паров этих веществ бывает так мало, что их невозможно обнаружить.
Испарение твердых тел называется возгонкой или сублимацией (от латинского «сублимаре» — возносить). На опыте легко обнаружить возгонку льда и снега. Например, зимой можно заметить уменьшение инея на ветвях деревьев с течением времени.
В пищевой промышленности для понижения температуры часто пользуются «сухим льдом» (твердая двуокись углерода, С02), который переходит непосредственно в газообразное состояние. Сушка продуктов и других материалов с помощью сублимации широко используется в различных отраслях производства.
Часто можно наблюдать и обратный переход из газообразного состояния непосредственно в твердое, минуя жидкое состояние (десублимация). На окнах зимой иногда можно видеть быстрый рост кристалликов льда в виде красивых и разнообразных узоров на стеклах, которые образуются непосредственно из водяных паров, находящихся в воздухе.
Очевидно, что испарение твердого тела, как и испарение жидкости, происходит с поглощением теплоты. Количество теплоты, необходимое для превращения твердого тела в пар при неизменной температуре, называется теплотой сублимации.
Для одного и того же вещества теплота сублимации больше, чем теплота парообразования из жидкости, поскольку при испарении твердого тела происходит еще и разрушение его кристаллической решетки, что также требует затраты энергии (как и при плавлении). Ясно, что при десублимации выделяется такая же теплота, какая поглощается при сублимации (если внешние условия одинаковы).
Диаграмма состоянии вещества. Тройная точка
Выше говорилось, что состояние вещества зависит от внешних условий, и в первую очередь от давления и температуры. Поэтому для каждого вещества на основе экспериментальных данных можно составить диаграмму состояний в координатах р и Т, по которой легко определить, в каком состоянии будет находиться это вещество и что с ним будет происходить при изменении внешних условий.
На рис. 12.3 схематически изображена такая диаграмма для вещества, когда в рассматриваемом пространстве, кроме этого вещества, ничего нет.

Кривая КС есть уже известная нам зависимость давления насыщающего пара взятого вещества от температуры, где К — критическая точка (рис. 8.9), а точка С соответствует температуре затвердевания жидкости под давлением ее насыщающих паров (при потере энергии этим веществом). Кривая АС выражает зависимость от температуры давления насыщающих паров, находящихся над поверхностью твердого тела. Температура плавления вещества зависит от давления, на диаграмме линией ВС показана и эта зависимость.
Каждая точка на диаграмме соответствует равновесному состоянию вещества, т. е. такому, в котором оно может находиться неопределенно долгое время. Часть диаграммы слева от линии АСВ соответствует твердому состоянию вещества; область, ограниченная линией ВСК,— жидкому, а область справа от линии АСК — газообразному состоянию. Линия КС соответствует равновесию жидкой и газообразной фаз, линия ВС — равновесию жидкой и твердой фаз и АС—равновесию твердой и газообразной фаз.
При неизменных внешних условиях (р и Т), соответствующих какой-либо точке на линиях равновесия фаз АС, ВС или КС, две фазы вещества могут находиться в подвижном равновесии, при котором из одной фазы в другую переходит одинаковое число молекул. Это равновесие может сохраняться как угодно долго, если энергия не подводится к веществу и не отводится от него.
Точке С соответствуют единственные для данного вещества значения р и Т, при которых все три фазы этого вещества могут находиться в равновесии. Точку С на диаграмме состояний вещества, которая изображает равновесие между всеми тремя фазами этого вещества, называют тройной точкой. У воды, например, в тройной точке давление равно 610 Па, а температура равна 273,16 К (эта температура использована для определения кельвина; см. § 4.5).
Если внешние условия изменяются (р или Т, или р и Т одновременно), то точка, соответствующая этим условиям, перемещается на диаграмме (например, нагревание или охлаждение при постоянном давлении соответствует перемещению точки по горизонтальной прямой). Когда точка на диаграмме переходит из одной области в другую, происходит переход вещества из одного состояния в другое. Так, при переходе через линию ВС происходит плавление или кристаллизация, через КС — испарение или конденсация, через АС — сублимация или десублимация. Поэтому линии равновесия фаз ВС, КС и АС называют еще линиями фазовых переходов, а диаграмму состояний — диаграммой фазовых переходов.
Напомним, что фазовые превращения связаны с изменением внутренней энергии вещества и происходят с поглощением (или выделением) теплоты фазового превращения — теплоты плавления (кристаллизации), парообразования (конденсации), сублимации (десублимации).
На диаграмме состояний (рис. 12.3) видно, что сублимация и десублимация возможны при температурах и давлениях меньших, чем в тройной точке. Так, лед может возгоняться только при температуре ниже 273,16 К, когда давление водяных паров над поверхностью льда меньше давления насыщающего водяного пара.
Углекислота в тройной точке имеет температуру, равную —56,6°С, и давление 5,11 атм. Поэтому при атмосферном давлении углекислота может существовать только в твердом или газообразном состоянии и «сухой лед» превращается непосредственно в газ; при нормальном давлении температура его сублимации равна —78°С.
Температура и давление в тройной точке для различных веществ различны. Поэтому в большинстве случаев при обычных условиях сублимации не наблюдают.
Оказывается, что давление и температура в тройной точке для раствора всегда меньше, чем для чистого растворителя.
Линия СВ в большинстве случаев немного отклонена от вертикали вправо от точки С, а для льда, висмута, галлия, германия, кремния —влево (§ 12.4). У воды в точке С р=610 Па (4,58мм рт. ст.) и Т=273,16 К (т. е. 0,01°С), а при нормальном давлении (р= 1,013 . 105 Па, или 760 мм рт. ст.) температура плавления льда равна 273,15 К (0°С).
Заметим, что в неустойчивом состоянии жидкость может находиться в области пара (перегретая жидкость) или в области твердой фазы (переохлажденная жидкость). Пересыщенный пар тоже может оказаться в области жидкости или в области твердого состояния. Однако твердая фаза всегда переходит в жидкую или газообразную на кривой АСВ. Таким образом, перегретых кристаллов в природе не бывает.
Важные особенности имеет диаграмма состояний гелия (рис. 12.4).

На этой диаграмме видно, что линии равновесия твердой фазы о жидкой и жидкой фазы с газообразной нигде не пересекаются, т. е. у гелия нет тройной точки. Другие вещества с такой особенностью неизвестны.
Критическая температура гелия равна 5,25 К. Следовательно, гелий можно перевести в жидкое состояние, только охладив его ниже этой температуры. Опыты, выполненные П. Л. Капицей, показали, что при небольших давлениях гелий остается в жидком состоянии даже при температуре, как угодно близкой к абсолютному нулю. Все другие вещества переходят в твердое состояние при значительно более высоких температурах. Гелий же переходит в твердое состояние лишь под давлением в несколько десятков атмосфер (рис. 12.4). Линия сублимации у гелия отсутствует, т. е. твердый гелий’ни при каких условиях не может быть в равновесии со своим паром.
Жидкий гелий обладает важной особенностью. При температурах выше 2,19 К он обладает обычными для сжиженных газов свойствами и называется гелий-I. Когда гелий, находящийся под давлением его насыщающих паров, охлаждают ниже температуры 2,19 К, происходит резкое изменение его свойств, и он (оставаясь жидким) переходит в новое состояние, в котором его называют гелий-II. В этом состоянии гелий является как бы смесью двух жидкостей, одна из которых — обычный гелий-I, а другая представляет собой сверхтекучую компоненту, абсолютно лишенную вязкости. Эти две компоненты могут свободно двигаться одна внутри другой без взаимодействия между собой. Сверхтекучая компонента без всякого трения протекает через самые узкие капилляры и щели.
На диаграмме (рис. 12.4) области существования гелия-I и гелия-II разделены штриховой линией. Сверхтекучая компонента, образующаяся при переходе гелий-I — гелий-II, увеличивается при дальнейшем понижении температуры, и при абсолютном нуле весь жидкий гелий должен перейти в сверхтекучее состояние.
Явление сверхтекучести гелия, открытое П. Л. Капицей, было объяснено на основе квантовой механики выдающимся советским ученым Л. Д. Ландау. Согласно квантовой теории энергия молекул при абсолютном нуле не равна нулю, как это следует из классической кинетической теории вещества (§ 4.5). Молекулы даже при абсолютном нуле обладают так называемой нулевой энергией — наименьшей возможной для них энергией. У гелия силы взаимодействия между атомами очень малы, и нулевая энергия гелия оказывается достаточной, чтобы воспрепятствовать атомам гелия образовать кристаллическую решетку. Только с помощью большого внешнего давления можно сблизить атомы гелия настолько, чтобы они образовали кристалл. Сверхтекучая компонента в гелий-II, появляющаяся при температурах, близких к абсолютному нулю, и состоит из атомов гелия с нулевой энергией.
Услуги по физике:
- Заказать физику
- Заказать контрольную работу по физике
- Помощь по физике
Лекции по физике:
- Физические величины и их измерение
- Основные законы механики
- Прямолинейное равномерное движение
- Прямолинейное равнопеременное движение
- Сила
- Масса
- Взаимодействия тел
- Механическая энергия
- Импульс
- Вращение твердого тела
- Криволинейное движение тел
- Колебания
- Колебания и волны
- Механические колебания и волны
- Бегущая волна
- Стоячие волны
- Акустика
- Звук
- Звук и ультразвук
- Движение жидкости и газа
- Молекулярно-кинетическая теория
- Молекулярно-кинетическая теория строения вещества
- Молекулярно – кинетическая теория газообразного состояния вещества
- Теплота и работа
- Температура и теплота
- Термодинамические процессы
- Идеальный газ
- Уравнение состояния идеального газа
- Изменение внутренней энергии
- Переход вещества из жидкого состояния в газообразное и обратно
- Кипение, свойства паров, критическое состояние вещества
- Водяной пар в атмосфере
- Тепловое расширение тел
- Энтропия
- Процессы перехода из одного агрегатного состояния в другое
- Тепловое расширение твердых и жидких тел
- Свойства газов
- Свойства жидкостей
- Свойства твёрдых тел
- Изменение агрегатного состояния вещества
- Тепловые двигатели
- Электрическое поле
- Постоянный ток
- Переменный ток
- Магнитное поле
- Электромагнитное поле
- Электромагнитное излучение
- Электрический заряд (Закон Кулона)
- Электрический ток в металлах
- Электрический ток в электролитах
- Электрический ток в газах и в вакууме
- Электрический ток в полупроводниках
- Электромагнитная индукция
- Работа, мощность и тепловое действие электрического тока
- Термоэлектрические явления
- Распространение электромагнитных волн
- Интерференционные явления
- Рассеяние
- Дифракция рентгеновских лучей на кристалле
- Двойное лучепреломление
- Магнитное поле и электромагнитная индукция
- Электромагнитные колебания и волны
- Природа света
- Распространение света
- Отражение и преломление света
- Оптические приборы и зрение
- Волновые свойства света
- Действия света
- Линзы и получение изображений с помощью линз
- Оптические приборы и глаз
- Фотометрия
- Излучение и спектры
- Квантовые свойства излучения
- Специальная теория относительности в физике
- Теория относительности
- Квантовая теория и природа поля
- Строение и свойства вещества
- Физика атомного ядра
- Строение атома


