Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?
Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
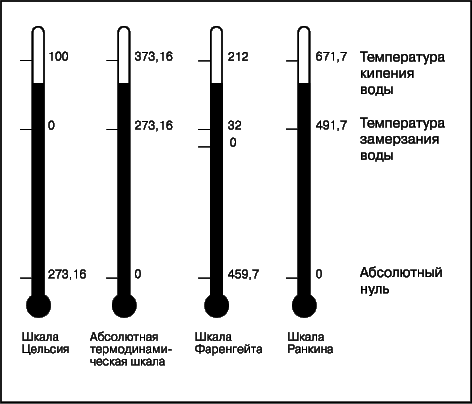
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 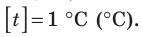
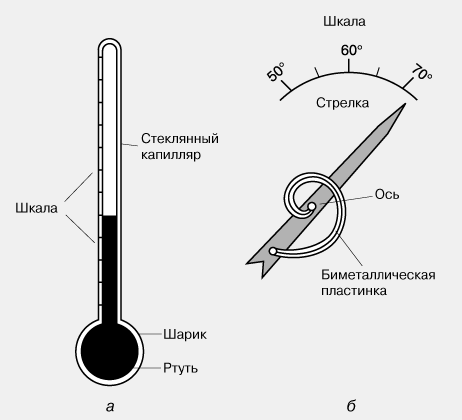
Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 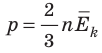
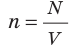
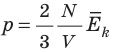
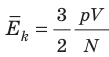
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 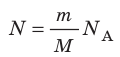
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 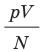
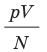
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 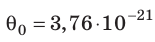
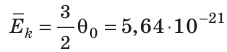
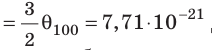
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
- температура по шкале Кельвина связана с величиной
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
ТЕПЛОТА, кинетическая часть внутренней энергии вещества, определяемая интенсивным хаотическим движением молекул и атомов, из которых это вещество состоит. Мерой интенсивности движения молекул является температура. Количество теплоты, которым обладает тело при данной температуре, зависит от его массы; например, при одной и той же температуре в большой чашке с водой заключается больше теплоты, чем в маленькой, а в ведре с холодной водой его может быть больше, чем в чашке с горячей водой (хотя температура воды в ведре и ниже).
Теплота играет важную роль в жизни человека, в том числе и в функционировании его организма. Часть химической энергии, содержащейся в пище, превращается в теплоту, благодаря чему температура тела поддерживается вблизи 37° С. Тепловой баланс тела человека зависит также от температуры окружающей среды, и люди вынуждены расходовать много энергии на обогрев жилых и производственных помещений зимой и на охлаждение их летом. Большую часть этой энергии поставляют тепловые машины, например котельные установки и паровые турбины электростанций, работающих на ископаемом топливе (угле, нефти) и вырабатывающих электроэнергию.
До конца 18 в. теплоту считали материальной субстанцией, полагая, что температура тела определяется количеством содержащейся в нем «калорической жидкости», или «теплорода». Позднее Б.Румфорд, Дж.Джоуль и другие физики того времени путем остроумных опытов и рассуждений опровергли «калорическую» теорию, доказав, что теплота невесома и ее можно получать в любых количествах просто за счет механического движения. Теплота сама по себе не является веществом – это всего лишь энергия движения его атомов или молекул. Именно такого понимания теплоты придерживается современная физика.
В этой статье мы рассмотрим, как связаны между собой теплота и температура и каким образом измеряют эти величины. Предметом нашего обсуждения будут также следующие вопросы: передача теплоты от одной части тела к другой; перенос теплоты в вакууме (пространстве, не содержащем вещества); роль теплоты в современном мире.
ТЕПЛОТА И ТЕМПЕРАТУРА
Количество тепловой энергии в веществе нельзя определить, наблюдая за движением каждой его молекулы по отдельности. Напротив, только изучая макроскопические свойства вещества, можно найти усредненные за некий период времени характеристики микроскопического движения многих молекул. Температура вещества – это средний показатель интенсивности движения молекул, энергия которого и есть тепловая энергия вещества.
Один из самых привычных, но и наименее точных способов оценки температуры – на ощупь. Трогая предмет, мы судим о том, горячий он или холодный, ориентируясь на свои ощущения. Конечно, эти ощущения зависят от температуры нашего тела, что подводит нас к понятию теплового равновесия – одному из важнейших при измерении температуры.
Тепловое равновесие.
Очевидно, что если два тела A и B (рис. 1) плотно прижать друг к другу, то, потрогав их спустя достаточно долгое время, мы заметим, что температура их одинакова. В этом случае говорят, что тела A и B находятся в тепловом равновесии друг с другом. Однако тела, вообще говоря, не обязательно должны соприкасаться, чтобы между ними существовало тепловое равновесие, – достаточно, чтобы их температуры были одинаковыми. В этом можно убедиться с помощью третьего тела C, приведя его сначала в тепловое равновесие с телом A, а затем сравнив температуры тел C и B. Тело C здесь играет роль термометра. В строгой формулировке этот принцип называется нулевым началом термодинамики: если тела A и B находятся в тепловом равновесии с третьим телом C, то эти тела находятся также в тепловом равновесии друг с другом. Этот закон лежит в основе всех способов измерения температуры.
Измерение температуры.
Если мы хотим проводить точные эксперименты и вычисления, то таких оценок температуры, как горячий, теплый, прохладный, холодный, недостаточно – нам нужна проградуированная температурная шкала. Существует несколько таких шкал, и за точки отсчета в них обычно взяты температуры замерзания и кипения воды. Четыре наиболее распространенные шкалы представлены на рис. 2. Стоградусная шкала, по которой точке замерзания воды соответствует 0°, а точке кипения 100°, называется шкалой Цельсия по имени А.Цельсия, шведского астронома, который описал ее в 1742. Полагают, что впервые применил эту шкалу шведский натуралист К.Линней. Сейчас шкала Цельсия является самой распространенной в мире. Температурная шкала Фаренгейта, в которой точкам замерзания и кипения воды соответствуют крайне неудобные числа 32 и 212°, была предложена в 1724 Г.Фаренгейтом. Шкала Фаренгейта широко распространена в англоязычных странах, но ею почти не пользуются в научной литературе. Для перевода температуры по Цельсию (°С) в температуру по Фаренгейту (°F) существует формула °F = (9/5)°C + 32, а для обратного перевода – формула °C = (5/9)(°F–32).
Обе шкалы – как Фаренгейта, так и Цельсия, – весьма неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды и выражается отрицательным числом. Для таких случаев были введены абсолютные шкалы температур, в основе которых лежит экстраполяция к так называемому абсолютному нулю – точке, в которой должно прекратиться молекулярное движение. Одна из них называется шкалой Ранкина, а другая – абсолютной термодинамической шкалой; температуры по ним измеряются в градусах Ранкина (°R) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля, а точка замерзания воды соответствует 491,7° R и 273,16 K. Число градусов и кельвинов между точками замерзания и кипения воды по шкале Цельсия и абсолютной термодинамической шкале одинаково и равно 100; для шкал Фаренгейта и Ранкина оно тоже одинаково, но равно 180. Градусы Цельсия переводятся в кельвины по формуле K = °C + 273,16, а градусы Фаренгейта – в градусы Ранкина по формуле °R = °F + 459,7.
В основе действия приборов, предназначенных для измерения температуры, лежат разные физические явления, связанные с изменением тепловой энергии вещества, – изменения электрического сопротивления, объема, давления, излучательных характеристик, термоэлектрических свойств. Один из наиболее простых и знакомых инструментов для измерения температуры – ртутный стеклянный термометр, изображенный на рис. 3,а. Шарик с ртутью в нижней части термометра располагают в среде или прижимают к предмету, температуру которого хотят измерить, и в зависимости от того, получает шарик тепло или отдает, ртуть расширяется или сжимается и ее столбик поднимается или опускается в капилляре. Если термометр заранее проградуирован и снабжен шкалой, то можно прямо узнать температуру тела.
Другой прибор, действие которого основано на тепловом расширении, – биметаллический термометр, изображенный на рис. 3,б. Основной его элемент – спиральная пластинка из двух спаянных металлов с разными коэффициентами теплового расширения. При нагревании один из металлов расширяется сильнее другого, спираль закручивается и поворачивает стрелку относительно шкалы. Такие устройства часто используют для измерения температуры воздуха в помещениях и на улице, однако они не подходят для определения локальной температуры.
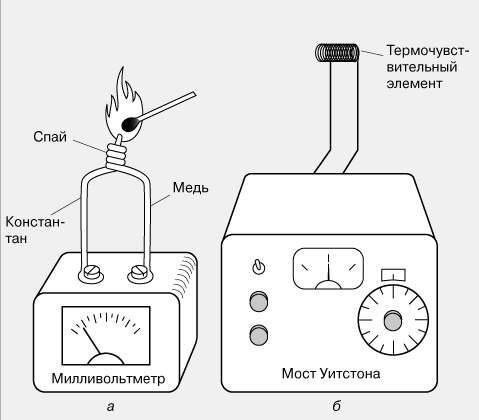
Локальную температуру измеряют обычно с помощью термопары, представляющей собой две проволочки из разнородных металлов, спаянные с одного конца (рис. 4,а). При нагревании такого спая на свободных концах проволочек возникает ЭДС, обычно составляющая несколько милливольт. Термопары делают из разных металлических пар: железа и константана, меди и константана, хромеля и алюмеля. Их термо-ЭДС практически линейно меняется с температурой в широком температурном диапазоне.
Известен и другой термоэлектрический эффект – зависимость сопротивления проводящего материала от температуры. Он лежит в основе работы электрических термометров сопротивления, один из которых изображен на рис. 4,б. Сопротивление небольшого термочувствительного элемента (термопреобразователя) – обычно катушки из тонкой проволоки – сравнивают с сопротивлением проградуированного переменного резистора, используя мост Уитстона. Выходной прибор может быть проградуирован непосредственно в градусах.
Для измерения температуры раскаленных тел, испускающих видимый свет, используют оптические пирометры. В одном из вариантов этого устройства свет, излучаемый телом, сравнивают с излучением нити лампы накаливания, помещенной в фокальную плоскость бинокля, через который смотрят на излучающее тело. Электрический ток, нагревающий нить лампы, изменяют до тех пор, пока при визуальном сравнении свечения нити и тела не обнаружится, что между ними установилось тепловое равновесие. Шкала прибора может быть проградуирована непосредственно в единицах температуры.
Технические достижения последних лет позволили создать новые датчики температуры. Например, в тех случаях, когда нужна особенно высокая чувствительность, вместо термопары или обычного термометра сопротивления используют полупроводниковое устройство – термистор. В качестве термопреобразователей применяют также изменяющие свое фазовое состояние красители и жидкие кристаллы, особенно в тех случаях, когда температура поверхности тела изменяется в широком диапазоне. Наконец, используется инфракрасная термография, в которой получают ИК-изображение объекта в условных цветах, где каждый цвет отвечает определенной температуре. Этот способ измерения температуры находит самое широкое применение – от медицинской диагностики до проверки теплоизоляции помещений. См. также ФИЗИКА ТВЕРДОГО ТЕЛА; ЖИДКИЙ КРИСТАЛЛ.
Измерение количества теплоты.
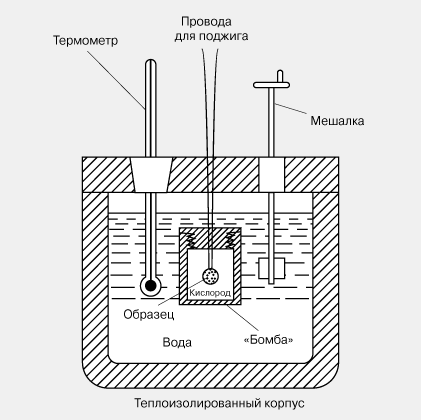
Тепловую энергию (количество теплоты) тела можно измерить непосредственно с помощью так называемого калориметра; простой вариант такого прибора изображен на рис. 5. Это тщательно теплоизолированный закрытый сосуд, снабженный устройствами для измерения температуры внутри него и иногда заполняемый рабочей жидкостью с известными свойствами, например водой. Чтобы измерить количество теплоты в небольшом нагретом теле, его помещают в калориметр и ждут, когда система придет в тепловое равновесие. Количество теплоты, переданное калориметру (точнее, наполняющей его воде), определяют по повышению температуры воды.
Количество теплоты, выделяющейся в ходе химической реакции, например горения, можно измерить, поместив в калориметр небольшую «бомбу». В «бомбе» находятся образец, к которому подведены электрические провода для поджига, и соответствующее количество кислорода. После того как образец полностью сгорает и устанавливается тепловое равновесие, определяют, насколько повысилась температура воды в калориметре, а отсюда – количество выделившейся теплоты. См. также КАЛОРИМЕТРИЯ.
Единицы измерения теплоты.
Теплота представляет собой одну из форм энергии, а поэтому должна измеряться в единицах энергии. В международной системе СИ единицей энергии является джоуль (Дж). Допускается также применение внесистемных единиц количества теплоты – калорий: международная калория равна 4,1868 Дж, термохимическая калория – 4,1840 Дж. В зарубежных лабораториях результаты исследований часто выражают с помощью т.н. 15-градусной калории, равной 4,1855 Дж. Выходит из употребления внесистемная британская тепловая единица (БТЕ): БТЕсредн = 1,055 Дж.
Источники теплоты.
Основными источниками теплоты являются химические и ядерные реакции, а также различные процессы преобразования энергии. Примерами химических реакций с выделением теплоты являются горение и расщепление компонентов пищи. Почти вся теплота, получаемая Землей, обеспечивается ядерными реакциями, протекающими в недрах Солнца. Человечество научилось получать теплоту с помощью управляемых процессов деления ядер, а теперь пытается использовать с той же целью реакции термоядерного синтеза. В теплоту можно превращать и другие виды энергии, например механическую работу и электрическую энергию. Важно помнить, что тепловую энергию (как и любую другую) можно лишь преобразовать в другую форму, но нельзя ни получить «из ничего», ни уничтожить. Это один из основных принципов науки, называемой термодинамикой.
ТЕРМОДИНАМИКА
Термодинамика – это наука о связи между теплотой, работой и веществом. Современные представления об этих взаимосвязях сформировались на основе трудов таких великих ученых прошлого, как Карно, Клаузиус, Гиббс, Джоуль, Кельвин и др. Термодинамика объясняет смысл теплоемкости и теплопроводности вещества, теплового расширения тел, теплоты фазовых переходов. Эта наука базируется на нескольких экспериментально установленных законах – началах.
Начала термодинамики.
Сформулированное выше нулевое начало термодинамики вводит понятия теплового равновесия, температуры и термометрии. Первое начало термодинамики представляет собой утверждение, имеющее ключевое значение для всей науки в целом: энергию нельзя ни уничтожить, ни получить «из ничего», так что полная энергия Вселенной есть величина постоянная. В простейшей форме первое начало термодинамики можно сформулировать так: энергия, которую получает система, минус энергия, которую она отдает, равна энергии, остающейся в системе. На первый взгляд это утверждение кажется очевидным, но не в такой, например, ситуации, как сгорание бензина в цилиндрах автомобильного двигателя: здесь получаемая энергия является химической, отдаваемая –механической (работой), а энергия, остающаяся в системе, – тепловой.
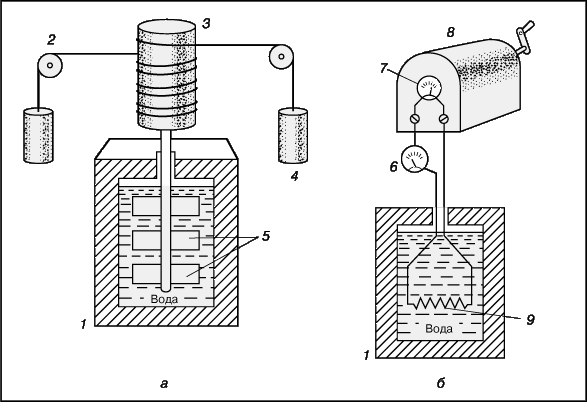
Итак, ясно, что энергия может переходить из одной формы в другую и что такие преобразования постоянно происходят в природе и технике. Более ста лет назад Дж.Джоуль доказал это для случая превращения механической энергии в тепловую с помощью устройства, показанного на рис. 6,а. В этом устройстве опускающиеся и поднимающиеся грузы вращали вал с лопастями в заполненном водой калориметре, в результате чего вода нагревалась. Точные измерения позволили Джоулю определить, что одна калория теплоты эквивалентна 4,186 Дж механической работы. Устройство, изображенное на рис. 6,б, использовалось для определения теплового эквивалента электрической энергии.
Первое начало термодинамики объясняет многие обыденные явления. Например, становится ясно, почему нельзя охладить кухню с помощью открытого холодильника. Предположим, что мы теплоизолировали кухню от окружающей среды. По проводу питания холодильника в систему непрерывно подводится энергия, но при этом никакой энергии система не отдает. Таким образом, ее полная энергия возрастает, и в кухне становится все теплее: достаточно потрогать трубки теплообменника (конденсатора) на задней стенке холодильника, и вы поймете бесполезность его как «охлаждающего» устройства. Но если бы эти трубки были выведены за пределы системы (например, за окно), то кухня отдавала бы больше энергии, чем получала, т.е. охлаждалась бы, а холодильник работал как оконный кондиционер.
Первое начало термодинамики – закон природы, исключающий создавание заново или уничтожение энергии. Однако оно ничего не говорит о том, как протекают в природе процессы передачи энергии. Так, мы знаем, что горячее тело нагреет холодное, если эти тела привести в соприкосновение. Но сможет ли холодное тело само по себе передать запас своей теплоты горячему? Последняя возможность категорически отвергается вторым началом термодинамики.
Первое начало исключает также возможность создания двигателя с коэффициентом полезного действия (КПД) более 100% (подобный «вечный» двигатель мог бы сколь угодно долго отдавать больше энергии, чем сам потребляет). Нельзя построить двигатель даже с КПД, равным 100%, так как некоторая часть подводимой к нему энергии обязательно должна быть потеряна им в виде менее полезной тепловой энергии. Так, колесо не будет крутиться сколь угодно долго без подвода энергии, поскольку вследствие трения в подшипниках энергия механического движения будет постепенно переходить в теплоту, пока колесо не остановится.
Тенденцию к превращению «полезной» работы в менее полезную энергию – теплоту – можно сопоставить с другим процессом, который происходит, если соединить два сосуда, содержащие разные газы. Подождав достаточно долго, мы обнаруживаем в обоих сосудах однородную смесь газов – природа действует так, что упорядоченность системы уменьшается. Термодинамическая мера этой неупорядоченности называется энтропией, и второе начало термодинамики можно сформулировать иначе: процессы в природе всегда протекают так, что энтропия системы и ее окружения увеличивается. Таким образом, энергия Вселенной остается постоянной, а ее энтропия непрерывно растет.
Теплота и свойства веществ.
Различные вещества обладают разной способностью накапливать тепловую энергию; это зависит от их молекулярной структуры и плотности. Количество теплоты, необходимое для повышения температуры единицы массы вещества на один градус, называется его удельной теплоемкостью. Теплоемкость зависит от условий, в которых находится вещество. Например, чтобы нагреть на 1 К один грамм воздуха в воздушном шаре, требуется больше теплоты, чем для такого же его нагрева в герметичном сосуде с жесткими стенками, поскольку часть энергии, сообщаемой воздушному шару, расходуется на расширение воздуха, а не на его нагревание. Поэтому, в частности, теплоемкость газов измеряют раздельно при постоянном давлении и при постоянном объеме.
При повышении температуры интенсивность хаотического движения молекул возрастает – большинство веществ при нагревании расширяется. Степень расширения вещества при повышении температуры на 1 К называется коэффициентом теплового расширения.
Чтобы вещество перешло из одного фазового состояния в другое, например из твердого в жидкое (а иногда сразу в газообразное), оно должно получить определенное количество тепла. Если нагревать твердое тело, то его температура будет повышаться до тех пор, пока оно не начнет плавиться; до завершения плавления температура тела будет оставаться постоянной, несмотря на подвод тепла. Количество теплоты, необходимое для плавления единицы массы вещества, называется теплотой плавления. Если подводить тепло и дальше, то расплавленное вещество нагреется до кипения. Количество теплоты, необходимое для испарения единицы массы жидкости при данной температуре, называется теплотой парообразования.
Молекулярно-кинетическая теория.
Молекулярно-кинетическая теория объясняет макроскопические свойства вещества, рассматривая на микроскопическом уровне поведение атомов и молекул, составляющих это вещество. При этом используется статистический подход и делаются некоторые предположения относительно самих частиц и характера их движения. Так, молекулы считаются твердыми шариками, которые в газовых средах находятся в непрерывном хаотическом движении и пробегают значительные расстояния от одного столкновения до другого. Столкновения считаются упругими и происходят между частицами, размер которых мал, а число очень велико. Ни один из реальных газов не соответствует в точности этой модели, однако большинство газов достаточно близки к ней, чем и обусловлена практическая ценность молекулярно-кинетической теории.
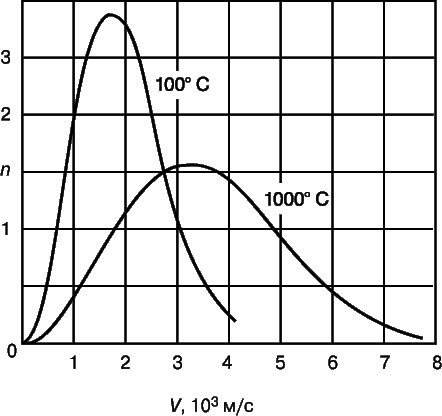
Исходя из этих представлений и используя статистический подход, Максвелл вывел распределение скоростей молекул газа в ограниченном объеме, названное впоследствии его именем. Это распределение представлено графически на рис. 7 для некой заданной массы водорода при температурах 100 и 1000° C. По оси ординат откладывается число молекул, движущихся со скоростью, указанной на оси абсцисс. Полное число частиц равно площади под каждой кривой и в обоих случаях одинаково. Из графика видно, что большинство частиц имеет скорости, близкие к некоторому среднему значению, и лишь малое их число обладает весьма высокими или низкими скоростями. Средние скорости при указанных температурах лежат в интервале 2000–3000 м/с, т.е. очень велики.
Большое число столь быстро движущихся молекул газа действует со вполне измеримой силой на окружающие тела. Микроскопические силы, с которыми многочисленные молекулы газа ударяют о стенки сосуда, складываются в макроскопическую величину, называемую давлением. При подводе энергии к газу (повышении температуры) средняя кинетическая энергия его молекул возрастает, частицы газа чаще и сильнее ударяют о стенки, давление повышается, и если стенки не вполне жесткие, то они растягиваются и объем газа увеличивается. Так микроскопический статистический подход, лежащий в основе молекулярно-кинетической теории, позволяет объяснить явление теплового расширения, о котором мы говорили.
Еще один результат молекулярно-кинетической теории – закон, описывающий свойства газа, который удовлетворяет перечисленным выше требованиям. Это так называемое уравнение состояния идеального газа связывает давление, объем и температуру одного моля газа и имеет вид равенства
PV = RT,
где P – давление, V – объем, T – температура, а R – универсальная газовая постоянная, равная (8,31441 ± 0,00026) Дж/(мольЧК). См. также МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ; ТЕРМОДИНАМИКА.
ТЕПЛОПЕРЕДАЧА
Теплопередача – это процесс переноса теплоты внутри тела или от одного тела к другому, обусловленный разностью температур. Интенсивность переноса теплоты зависит от свойств вещества, разности температур и подчиняется экспериментально установленным законам природы. Чтобы создавать эффективно работающие системы нагрева или охлаждения, разнообразные двигатели, энергоустановки, системы теплоизоляции, нужно знать принципы теплопередачи. В одних случаях теплообмен нежелателен (теплоизоляция плавильных печей, космических кораблей и т.п.), а в других он должен быть как можно больше (паровые котлы, теплообменники, кухонная посуда).
Существуют три основных вида теплопередачи: теплопроводность, конвекция и лучистый теплообмен.
Теплопроводность.
Если внутри тела имеется разность температур, то тепловая энергия переходит от более горячей его части к более холодной. Такой вид теплопередачи, обусловленный тепловыми движениями и столкновениями молекул, называется теплопроводностью; при достаточно высоких температурах в твердых телах его можно наблюдать визуально. Так, при нагревании стального стержня с одного конца в пламени газовой горелки тепловая энергия передается по стержню, и на некоторое расстояние от нагреваемого конца распространяется свечение (с удалением от места нагрева все менее интенсивное).
Интенсивность теплопередачи за счет теплопроводности зависит от градиента температуры, т.е. отношения DТ/Dx разности температур на концах стержня к расстоянию между ними. Она зависит также от площади поперечного сечения стержня (в м2) и коэффициента теплопроводности материала [в соответствующих единицах Вт/(мЧК)]. Соотношение между этими величинами было выведено французским математиком Ж.Фурье и имеет следующий вид:
где q – тепловой поток, k – коэффициент теплопроводности, а A – площадь поперечного сечения. Это соотношение называется законом теплопроводности Фурье; знак «минус» в нем указывает на то, что теплота передается в направлении, обратном градиенту температуры.
Из закона Фурье следует, что тепловой поток можно понизить, уменьшив одну из величин – коэффициент теплопроводности, площадь или градиент температуры. Для здания в зимних условиях последние величины практически постоянны, а поэтому для поддержания в помещении нужной температуры остается уменьшать теплопроводность стен, т.е. улучшать их теплоизоляцию.
В таблице представлены коэффициенты теплопроводности некоторых веществ и материалов. Из таблицы видно, что одни металлы проводят тепло гораздо лучше других, но все они являются значительно лучшими проводниками тепла, чем воздух и пористые материалы.
|
ТЕПЛОПРОВОДНОСТЬ НЕКОТОРЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ |
|
|
Вещества и материалы |
Теплопроводность, Вт/(м×К) |
|
Металлы |
|
| Алюминий |
205 |
| Бронза |
105 |
| Висмут |
8,4 |
| Вольфрам |
159 |
| Железо |
67 |
| Золото |
287 |
| Кадмий |
96 |
| Магний |
155 |
| Медь |
389 |
| Мышьяк |
188 |
| Никель |
58 |
| Платина |
70 |
| Ртуть |
7 |
| Свинец |
35 |
| Цинк |
113 |
|
Другие материалы |
|
| Асбест |
0,08 |
| Бетон |
0,59 |
| Воздух |
0,024 |
| Гагачий пух (неплотный) |
0,008 |
| Дерево (орех) |
0,209 |
| Магнезия (MgO) |
0,10 |
| Опилки |
0,059 |
| Резина (губчатая) |
0,038 |
| Слюда |
0,42 |
| Стекло |
0,75 |
| Углерод (графит) |
15,6 |
Теплопроводность металлов обусловлена колебаниями кристаллической решетки и движением большого числа свободных электронов (называемых иногда электронным газом). Движение электронов ответственно и за электропроводность металлов, а потому неудивительно, что хорошие проводники тепла (например, серебро или медь) являются также хорошими проводниками электричества.
Тепловое и электрическое сопротивление многих веществ резко уменьшается при понижении температуры ниже температуры жидкого гелия (1,8 K). Это явление, называемое сверхпроводимостью, используется для повышения эффективности работы многих устройств – от приборов микроэлектроники до линий электропередачи и больших электромагнитов.
Конвекция.
Как мы уже говорили, при подводе тепла к жидкости или газу увеличивается интенсивность движения молекул, а вследствие этого повышается давление. Если жидкость или газ не ограничены в объеме, то они расширяются; локальная плотность жидкости (газа) становится меньше, и благодаря выталкивающим (архимедовым) силам нагретая часть среды движется вверх (именно поэтому теплый воздух в комнате поднимается от батарей к потолку). Данное явление называется конвекцией. Чтобы не расходовать тепло отопительной системы впустую, нужно пользоваться современными обогревателями, обеспечивающими принудительную циркуляцию воздуха.
Конвективный тепловой поток от нагревателя к нагреваемой среде зависит от начальной скорости движения молекул, плотности, вязкости, теплопроводности и теплоемкости и среды; очень важны также размер и форма нагревателя. Соотношение между соответствующими величинами подчиняется закону Ньютона
q = hA (TW – TҐ),
где q – тепловой поток (измеряемый в ваттах), A – площадь поверхности источника тепла (в м2), TW и TҐ – температуры источника и его окружения (в кельвинах). Коэффициент конвективного теплопереноса h зависит от свойств среды, начальной скорости ее молекул, а также от формы источника тепла, и измеряется в единицах Вт/(м2ЧК).
Величина h неодинакова для случаев, когда воздух вокруг нагревателя неподвижен (свободная конвекция) и когда тот же нагреватель находится в воздушном потоке (вынужденная конвекция). В простых случаях течения жидкости по трубе или обтекания плоской поверхности коэффициент h можно рассчитать теоретически. Однако найти аналитическое решение задачи о конвекции для турбулентного течения среды пока не удается. Турбулентность – это сложное движение жидкости (газа), хаотичное в масштабах, существенно превышающих молекулярные.
Если нагретое (или, наоборот, холодное) тело поместить в неподвижную среду или в поток, то вокруг него образуются конвективные токи и пограничный слой. Температура, давление и скорость движения молекул в этом слое играют важную роль при определении коэффициента конвективного теплопереноса.
Конвекцию необходимо учитывать при проектировании теплообменников, систем кондиционирования воздуха, высокоскоростных летательных аппаратов и многих других устройств. Во всех подобных системах одновременно с конвекцией имеет место теплопроводность, причем как между твердыми телами, так и в окружающей их среде. При повышенных температурах существенную роль может играть и лучистый теплообмен.
Лучистый теплообмен.
Третий вид теплопередачи – лучистый теплообмен – отличается от теплопроводности и конвекции тем, что теплота в этом случае может передаваться через вакуум. Сходство же его с другими способами передачи тепла в том, что он тоже обусловлен разностью температур. Тепловое излучение – это один из видов электромагнитного излучения. Другие его виды – радиоволновое, ультрафиолетовое и гамма-излучения – возникают в отсутствие разности температур.
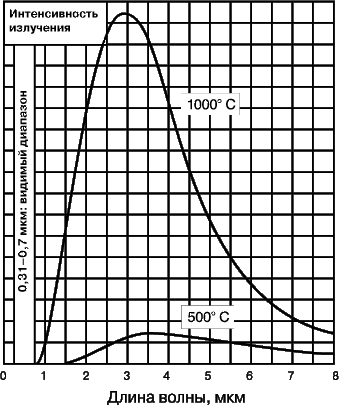
На рис. 8 представлена зависимость энергии теплового (инфракрасного) излучения от длины волны. Тепловое излучение может сопровождаться испусканием видимого света, но его энергия мала по сравнению с энергией излучения невидимой части спектра.
Интенсивность теплопередачи путем теплопроводности и конвекции пропорциональна температуре, а лучистый тепловой поток пропорционален четвертой степени температуры и подчиняется закону Стефана – Больцмана
где, как и ранее, q – тепловой поток (в джоулях в секунду, т.е. в Вт), A – площадь поверхности излучающего тела (в м2), а T1 и T2 – температуры (в кельвинах) излучающего тела и окружения, поглощающего это излучение. Коэффициент s называется постоянной Стефана – Больцмана и равен (5,66961±0,00096)Ч10–8 Вт/(м2 ЧК4).
Представленный закон теплового излучения справедлив лишь для идеального излучателя – так называемого абсолютно черного тела. Ни одно реальное тело таковым не является, хотя плоская черная поверхность по своим свойствам приближается к абсолютно черному телу. Светлые же поверхности излучают сравнительно слабо. Чтобы учесть отклонение от идеальности многочисленных «серых» тел, в правую часть выражения, описывающего закон Стефана – Больцмана, вводят коэффициент, меньший единицы, называемый излучательной способностью. Для плоской черной поверхности этот коэффициент может достигать 0,98, а для полированного металлического зеркала не превышает 0,05. Соответственно лучепоглощательная способность высока для черного тела и низка для зеркального.
Жилые и офисные помещения часто обогревают небольшими электрическими теплоизлучателями; красноватое свечение их спиралей – это видимое тепловое излучение, близкое к границе инфракрасной части спектра. Помещение же обогревается теплотой, которую несет в основном невидимая, инфракрасная часть излучения. В приборах ночного ви^дения применяются источник теплового излучения и приемник, чувствительный к ИК-излучению, позволяющий видеть в темноте.
Мощным излучателем тепловой энергии является Солнце; оно нагревает Землю даже на расстоянии 150 млн. км. Интенсивность солнечного излучения, регистрируемая год за годом станциями, расположенными во многих точках земного шара, составляет примерно 1,37 Вт/м2. Солнечная энергия – источник жизни на Земле. Ведутся поиски способов наиболее эффективного ее использования. Созданы солнечные батареи, позволяющие обогревать дома и получать электроэнергию для бытовых нужд.
РОЛЬ ТЕПЛОТЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
Глобальные процессы теплообмена не сводятся к нагреванию Земли солнечным излучением. Массивными конвекционными потоками в атмосфере определяются суточные изменения погодных условий на всем земном шаре. Перепады температуры в атмосфере между экваториальными и полярными областями совместно с кориолисовыми силами, обусловленными вращением Земли, приводят к появлению непрерывно изменяющихся конвекционных потоков, таких, как пассаты, струйные течения, а также теплые и холодные фронты. См. также КЛИМАТ; МЕТЕОРОЛОГИЯ И КЛИМАТОЛОГИЯ.
Перенос тепла (за счет теплопроводности) от расплавленного ядра Земли к ее поверхности приводит к извержению вулканов и появлению гейзеров. В некоторых регионах геотермальная энергия используется для обогрева помещений и выработки электроэнергии.
Теплота – непременный участник почти всех производственных процессов. Упомянем такие наиболее важные из них, как выплавка и обработка металлов, работа двигателей, производство пищевых продуктов, химический синтез, переработка нефти, изготовление самых разных предметов – от кирпичей и посуды до автомобилей и электронных устройств.
Многие промышленные производства и транспорт, а также теплоэлектростанции не могли бы работать без тепловых машин – устройств, преобразующих теплоту в полезную работу. Примерами таких машин могут служить компрессоры, турбины, паровые, бензиновые и реактивные двигатели.
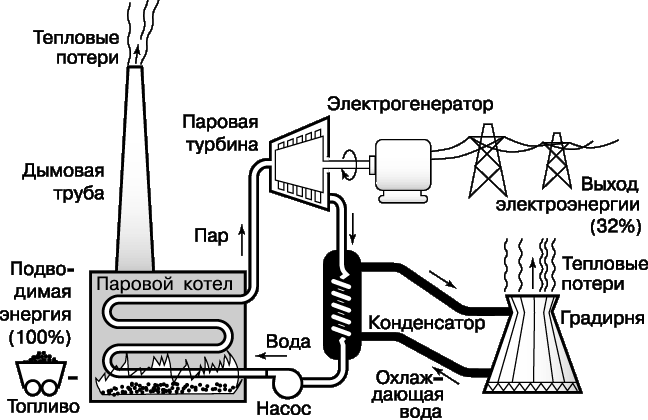
Одной из наиболее известных тепловых машин является паровая турбина, в которой реализуется часть цикла Ранкина, используемого на современных электростанциях. Упрощенная схема этого цикла представлена на рис. 9. Рабочую жидкость – воду – превращают в перегретый пар в паровом котле, нагреваемом за счет сжигания ископаемого топлива (угля, нефти или природного газа). Пар высокого давления вращает вал паровой турбины, которая приводит в действие генератор, вырабатывающий электроэнергию. Отработанный пар конденсируется при охлаждении проточной водой, которая поглощает часть теплоты, не использованной в цикле Ранкина. Далее вода подается в охлаждающую башню (градирню), откуда часть тепла уходит в атмосферу. Конденсат с помощью насоса возвращают в паровой котел, и весь цикл повторяется.
Все процессы в цикле Ранкина иллюстрируют описанные выше начала термодинамики. В частности, согласно второму началу, часть энергии, потребляемой электростанцией, должно рассеиваться в окружающей среде в виде теплоты. Оказывается, что таким образом теряется примерно 68% энергии, первоначально содержавшейся в ископаемом топливе. Заметного повышения КПД электростанции можно было бы достигнуть, лишь повысив температуру парового котла (которая лимитируется жаропрочностью материалов) или понизив температуру среды, куда уходит тепло, т.е. атмосферы.
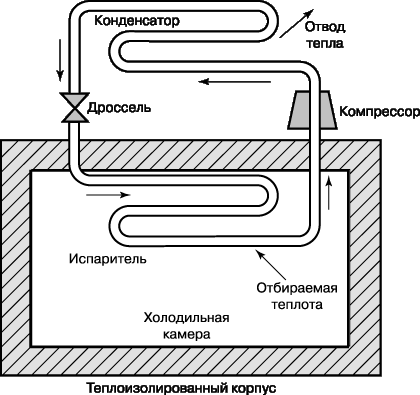
Другой термодинамический цикл, имеющий большое значение в нашей повседневной жизни, – это парокомпрессорный холодильный цикл Ранкина, схема которого представлена на рис. 10. В холодильниках и бытовых кондиционерах энергия для его обеспечения подводится извне. Компрессор повышает температуру и давление рабочего вещества холодильника – фреона, аммиака или углекислого газа. Перегретый газ подается в конденсатор, где охлаждается и конденсируется, отдавая тепло окружающей среде. Жидкость, выходящая из патрубков конденсатора, проходит через дросселирующий клапан в испаритель, и часть ее испаряется, что сопровождается резким понижением температуры. Испаритель отбирает у камеры холодильника тепло, которое нагревает рабочую жидкость в патрубках; эта жидкость подается компрессором в конденсатор, и цикл снова повторяется.
Холодильный цикл, представленный на рис. 10, можно использовать и в тепловом насосе. Такие тепловые насосы летом отдают тепло горячему атмосферному воздуху и кондиционируют помещение, а зимой, наоборот, отбирают тепло у холодного воздуха и обогревают помещение.
Важным источником теплоты для таких целей, как производство электроэнергии и транспортные перевозки, служат ядерные реакции. В 1905 А.Эйнштейн показал, что масса и энергия связаны соотношением E = mc2, т.е. могут переходить друг в друга. Скорость света c очень велика: 300 тыс. км/с. Это означает, что даже малое количество вещества может дать огромное количество энергии. Так, из 1 кг делящегося вещества (например, урана) теоретически можно получить энергию, которую за 1000 суток непрерывной работы дает электростанция мощностью 1 МВт.
| Температура | |
|---|---|
 , ,  |
|
| Размерность | Θ |
| Единицы измерения | |
| СИ | К |
| СГС | К |
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел.
Живые существа способны воспринимать ощущения тепла и холода непосредственно, с помощью органов чувств. Однако точное определение температуры требует, чтобы температура измерялась объективно, с помощью приборов. Такие приборы называются термометрами и измеряют так называемую эмпирическую температуру. В эмпирической шкале температур устанавливаются одни реперные точки и число делений между ними — так были введены используемые ныне шкалы Цельсия, Фаренгейта и другие. Измеряемая в кельвинах абсолютная температура вводится по одной реперной точке[1] с учётом того, что в природе существует минимальное предельное значение температуры — абсолютный нуль. Верхнее значение температуры ограничено планковской температурой.
Если система находится в тепловом равновесии, то температура всех её частей одинакова. В противном случае в системе происходит передача энергии от более нагретых частей системы к менее нагретым, приводящая к выравниванию температур в системе, и говорят о распределении температуры в системе или скалярном поле температур. В термодинамике температура — интенсивная термодинамическая величина.
Наряду с термодинамическим, в других разделах физики могут вводиться и другие определения температуры. В молекулярно-кинетической теории показывается, что температура пропорциональна средней кинетической энергии частиц системы. Температура определяет распределение частиц системы по уровням энергии (см. Статистика Максвелла — Больцмана), распределение частиц по скоростям (см. Распределение Максвелла), степень ионизации вещества (см. Уравнение Саха), спектральную плотность излучения (см. Формула Планка), полную объёмную плотность излучения (см. Закон Стефана — Больцмана) и т. д. Температуру, входящую в качестве параметра в распределение Больцмана, часто называют температурой возбуждения, в распределение Максвелла — кинетической температурой, в формулу Саха — ионизационной температурой, в закон Стефана — Больцмана — радиационной температурой. Для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, и их называют просто температурой системы[2].
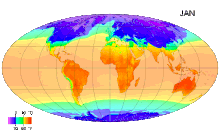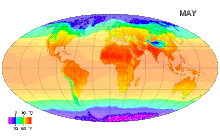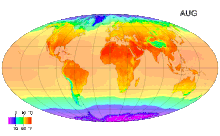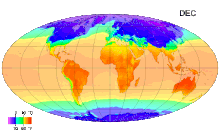
Среднемесячные температуры поверхности с 1961 по 1990 годы
Среднегодовая температура по всему миру
Тепловые колебания сегмента альфа-спирали белка: амплитуда колебаний увеличивается с повышением температуры.
В Международной системе величин (англ. International System of Quantities, ISQ) термодинамическая температура выбрана в качестве одной из семи основных физических величин системы. В Международной системе единиц (СИ), основанной на Международной системе величин, единица этой температуры — кельвин — является одной из семи основных единиц СИ[3]. В системе СИ и на практике используется также температура Цельсия, её единицей является градус Цельсия (°С), по размеру равный кельвину[4]. Это удобно, так как большинство климатических процессов на Земле и процессов в живой природе связаны с диапазоном от −50 до +50 °С.
Температура как локальный параметр. Температурное поле[править | править код]
Физика сплошных сред рассматривает температуру как локальную макроскопическую переменную, то есть величину, характеризующую мысленно выделяемую область (элементарный объём) сплошной среды (континуума), размеры которой бесконечно малы по сравнению с неоднородностями среды и бесконечно велики по отношению к размерам частиц (атомов, ионов, молекул и т. п.) этой среды[5]. Значение температуры может меняться от точки к точке (от одного элементарного объёма к другому); распределение температуры в пространстве в данный момент времени задаётся скалярным полем температуры (температурным полем)[6]. Температурное поле может быть как нестационарным (изменяющимся во времени), так и не зависящим от времени стационарным. Среду с одинаковыми во всех точках значениями температуры называют термически однородной. Математически температурное поле описывают уравнением зависимости температуры 

Термодинамическое определение[править | править код]
История термодинамического подхода[править | править код]
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых[источник не указан 3468 дней][7].
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдаёт ли живая ткань тепло или получает его.
Некоторые квантовомеханические системы (например, рабочее тело лазера, в котором присутствуют инверсно заселённые уровни) могут находиться в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передаётся от системы к телу, а не наоборот (подробнее см. Отрицательная абсолютная температура).
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Равновесная и неравновесная температуры[править | править код]
Система, находящаяся в состоянии термодинамического равновесия, имеет стационарное температурное поле. Если в такой системе отсутствуют адиабатические (энергонепроницаемые) перегородки, то все части системы имеют одну и ту же температуру. Иначе говоря, равновесная температура термически однородной системы не зависит явно от времени (но может меняться в квазистатических процессах). Неравновесная система в общем случае имеет нестационарное температурное поле, в котором каждый элементарный объём среды имеет собственную неравновесную температуру, в явном виде зависящую от времени.
Температура в феноменологической термодинамике[править | править код]
Определение температуры в феноменологической термодинамике зависит от способа построения математического аппарата данной дисциплины (см. Аксиоматика термодинамики).
Отличия в формальных определениях термодинамической температуры в различных системах построения термодинамики не означают большую наглядность некоторых из таких систем по сравнению с другими, ибо во всех этих системах, во-первых, в описательном определении температуру рассматривают как меру нагретости/охлаждённости тела, и, во-вторых, содержательные определения, устанавливающие связь между термодинамической температурой и используемыми для её измерения температурными шкалами, совпадают.
В рациональной термодинамике, изначально отвергающей деление этой дисциплины на термодинамику равновесную и термодинамику неравновесную (то есть не проводящей различия между равновесной и неравновесной температурами), температура есть первоначальная неопределяемая переменная, описываются только такими свойствами, которые можно выразить языком математики[8]. Понятия энергии, температуры, энтропии и химического потенциала вводятся в рациональной термодинамике одновременно; по отдельности определить их принципиально нельзя. Методика введения этих понятий показывает, что можно ввести в рассмотрение много различных температур, отвечающих разным энергетическим потокам. Например, можно ввести температуры трансляционных и спинорных движений, температуру радиационных излучений и т. д.[9].
Нулевое начало (закон) вводит в равновесную термодинамику понятие эмпирической температуры[10][11][12][13] как параметра состояния, равенство которого во всех точках есть условие термического равновесия в системе без адиабатических перегородок.
В подходе к построению термодинамики, используемом последователями Р. Клаузиуса[14], равновесные параметры состояния — термодинамическую температуру 


|
(Термодинамическая температура и энтропия по Клаузиусу) |
где 
В аксиоматике Каратеодори[15][16] 
В системе аксиом А. А. Гухмана[18][19] изменение внутренней энергии системы 



|
(Уравнение Гухмана) |
причём тепловым потенциалом служит термодинамическая температура 

В термодинамике Гиббса равновесную температуру выражают через внутреннюю энергию и энтропию[22][23][24]

|
(Термодинамическая температура по Гиббсу) |
где 
Аксиоматика Фалька и Юнга[25] при определении энтропии не делает различия между равновесными и неравновесными состояниями, и, следовательно, даваемое в этой системе аксиом определение температуры через энтропию и внутреннюю энергию одинаково применимо для любых термически однородных систем:
![Tequiv left[left({frac {partial S}{partial U}}right)_{{{x_{i}}}}right]^{{-1}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/3199aedd04aecf0811bc8ef796f064be37d4cbac)
|
(Термодинамическая температура по Фальку и Юнгу) |
где 
Принцип локального равновесия разрешает для неравновесных систем заимствовать определение температуры из равновесной термодинамики и использовать данную переменную в качестве неравновесной температуры элементарного объёма среды[26].
В расширенной неравновесной термодинамике (РНТ), базирующейся на отказе от принципа локального равновесия, неравновесную температуру задают посредством соотношения, аналогичного используется в аксиоматике Фалька и Юнга (см. Термодинамическая температура по Фальку и Юнгу), но с другим набором независимых переменных для энтропии[27]. Локально-равновесная термодинамическая температура по Гиббсу также отличается от РНТ-неравновесной температуры выбором независимых переменных для энтропии[27].
В аксиоматике Н. И. Белоконя[28]. исходное определение температуры вытекает из постулата Белоконя, носящего название — постулат второго начала
термостатики. Температура есть единственная функция состояния тел, определяющая направление самопроизвольного теплообмена между этими телами, то есть тела, находящиеся в тепловом равновесии, имеют одинаковую температуру в любой температурной шкале. Отсюда следует, что два тела, не имеющие теплового контакта между собой, но каждое из которых находится в тепловом равновесии с третьим (измерительный прибор), имеют одинаковую температуру.
Эмпирическая, абсолютная и термодинамическая температуры[править | править код]
Температура не может быть измерена непосредственно. Об изменении температуры судят по изменению других физических свойств тел (объёма, давления, электрического сопротивления, ЭДС, интенсивности излучения и др.), однозначно с ней связанных (так называемых термометрических свойств). Количественно же температура определяется указанием способа её измерения с помощью того или иного термометра. Такое определение ещё не фиксирует ни начало отсчёта, ни единицу измерения температуры, поэтому любой метод измерения температуры связан с выбором температурной шкалы. Эмпирическая температура — это температура, измеренная в выбранной температурной шкале.
Даваемые феноменологической термодинамикой определения термодинамической температуры не зависят от выбора термометрического свойства, использованного для её измерения; единицу измерения температуры задают с помощью одной из термодинамических температурных шкал.
В термодинамике в качестве аксиомы принимается основанное на опыте положение о том, что равновесная термодинамическая температура есть величина, для всех систем ограниченная с одной стороны, причём температура, соответствующая этой границе, одинакова для всех термодинамических систем и, следовательно, может быть использована в качестве естественной реперной точки шкалы температур. Если этой реперной точке присвоить равное нулю значение температуры, то температуры в шкале, базирующейся на данном репере, всегда будут иметь один и тот же знак[29]. Приписывая второй реперной точке положительное значение температуры, получают абсолютную температурную шкалу с положительными температурами; температуру отсчитываемую от абсолютного нуля, называют абсолютной температурой[30]. Соответственно термодинамическую температуру, отсчитываемую от абсолютного нуля, называют абсолютной термодинамической температурой (см. Шкала температур Кельвина). Примером эмпирической температурной шкалы с отсчётом температуры от абсолютного нуля служит международная практическая температурная шкала.
Температурная шкала Цельсия не является абсолютной.
Некоторые авторы под абсолютностью температуры подразумевают не её отсчёт от абсолютного нуля, а независимость температуры от выбора термометрического свойства, используемого для её измерения[31][32].
Отрицательные абсолютные температуры[править | править код]
Равновесная термодинамическая абсолютная температура всегда положительна (см. Эмпирическая, абсолютная и термодинамическая температуры). Использование отрицательных (по шкале Кельвина) температур есть удобный математический приём описания неравновесных систем с особыми свойствами[33]. Приём этот состоит в мысленном выделении в самостоятельную подсистему объектов с особыми свойствами, входящих в состав физической системы, и сепаратном рассмотрении полученной парциальной подсистемы. Иными словами, один и тот же объём пространства рассматривается как одновременно занимаемый двумя и более парциальными подсистемами, слабо взаимодействующими друг с другом.
Примером использования данного подхода может служить рассмотрение ядерных спинов находящегося в магнитном поле кристалла как системы, слабо зависящей от тепловых колебаний кристаллической решётки. При быстром изменении направления магнитного поля на обратное, когда спины не успевают следовать за изменяющимся полем, система ядерных спинов некоторое время будет иметь отрицательную неравновесную температуру[34], то есть с формальной точки зрения в это время в одной и той же пространственной области будут находиться две слабо взаимодействующие системы с разными температурами[35]. В силу всё-таки имеющего место взаимодействия температуры обеих систем спустя какое-то время сравняются.
Формализм классической феноменологической термодинамики может быть дополнен представлениями об отрицательных абсолютных температурах[36][35]. В соответствии с постулатом Тиссы внутренняя энергия любой системы ограничена снизу, и эта граница соответствует абсолютному нулю температуры[37]. В системах, у которых имеется не только нижняя, но и верхняя граница внутренней энергии, с ростом температуры внутренняя энергия увеличивается и достигает своего предельного значения; дальнейшее повышение температуры 







Молекулярно-кинетическое определение[править | править код]
В молекулярно-кинетической теории (МКТ) температура определяется как величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
… мерилом температуры является не само движение, а хаотичность этого движения. Хаотичность состояния тела определяет его температурное состояние, и эта идея (которая впервые была разработана Больцманом), что определённое температурное состояние тела вовсе не определяется энергией движения, но хаотичностью этого движения, и является тем новым понятием в описании температурных явлений, которым мы должны пользоваться…П. Л. Капица[40]
Для одноатомного идеального газа температура может быть записана как
,
где 


Определение температуры в статистической физике[править | править код]
В статистической физике, как и в термодинамическом подходе, температура определяется производной от энергии системы по её энтропии:
(если объём и число частиц в системе неизменны, частная производная заменяется полной). В рамках статфизики существует конкретное выражение для энтропии, позволяющее выполнять вычисления:
,
где 


Введённая таким образом величина 

Измерение температуры[править | править код]
Типичный термометр со шкалой по Цельсию, показывающий −17 градусов
Для измерения термодинамической температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры. Классическим примером термодинамического термометра может служить газовый термометр, в котором температуру определяют методом измерения давления газа в баллоне постоянного объёма. Известны также термометры абсолютные радиационные, шумовые, акустические.
Термодинамические термометры — это очень сложные установки, которые невозможно использовать для практических целей. Поэтому большинство измерений производится с помощью практических термометров, которые являются вторичными, так как не могут непосредственно связывать какое-то свойство вещества с температурой. Для получения функции интерполяции они должны быть отградуированы в реперных точках международной температурной шкалы.
Для измерения температуры какого-либо тела обычно измеряют какой-либо физический параметр, связанный с температурой, например, геометрические размеры (см. Дилатометр) для газов — объём или давление, скорость звука, электрическую проводимость, электромагнитные спектры поглощения или излучения (например, пирометры и измерение температуры фотосфер и атмосфер звёзд — в последнем случае по доплеровскому уширению спектральных линий поглощения или излучения).
В повседневной практике температуру обычно измеряют с помощью специальных приборов — контактных термометров. При этом термометр приводят в тепловой контакт с исследуемым телом, и, после установления термодинамического равновесия тела и термометра, — выравнивания их температур, по изменениям некоторого измеримого физического параметра термометра судят о температуре тела. Тепловой контакт между термометром и телом должен быть достаточным, чтобы выравнивание температур происходило быстрее, также, ускорение выравнивания температур достигается снижением теплоёмкости термометра по сравнению с исследуемым телом, обычно, уменьшением размеров термометра. Снижение теплоёмкости термометра также меньше искажает результаты измерения, так как меньшая часть теплоты исследуемого тела отбирается или передаётся термометру. Идеальный термометр имеет нулевую теплоёмкость[41].
Средства измерения температуры часто проградуированы по относительным шкалам — Цельсия или Фаренгейта.
На практике для измерения температуры также используют
- жидкостные и механические термометры,
- термопару,
- термометр сопротивления,
- газовый термометр,
- пирометр.
Самым точным практическим термометром является платиновый термометр сопротивления[42].
Разработаны новейшие методы измерения температуры, основанные на измерении параметров лазерного излучения[43].
Единицы и шкала измерения температуры[править | править код]
Поскольку температура — это мера средней кинетической энергии теплового движения частиц системы[44], наиболее естественно было бы измерять её в энергетических единицах (то есть в системе СИ в джоулях; см. также эВ). Исходя из соотношения температуры и энергии частиц в одноатомном идеальном газе Eкин = 3⁄2kТ[45]. В температурных единицах 1 эВ соответствует 11 604,518 12 К[46] (см. постоянная Больцмана)[47].
Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому все практические шкалы измеряют температуру в условных единицах — градусах.
Абсолютная температура. Шкала температур Кельвина[править | править код]
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что равно −273,15 °C и −459,67 °F.
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Важное значение имеет разработка на основе термодинамической шкалы Кельвина Международных практических шкал, основанных на реперных точках — фазовых переходах чистых веществ, определенных методами первичной термометрии. Первой международной температурной шкалой являлась принятая в 1927 г. МТШ-27. С 1927 г. шкала несколько раз переопределялась (МТШ-48, МПТШ-68, МТШ-90): менялись реперные температуры, методы интерполяции, но принцип остался тот же — основой шкалы является набор фазовых переходов чистых веществ с определенными значениями термодинамических температур и интерполяционные приборы, градуированные в этих точках. В настоящее время действует шкала МТШ-90. Основной документ (Положение о шкале) устанавливает определение Кельвина, значения температур фазовых переходов (реперных точек)[48] и методы интерполяции.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что цена одного деления по шкале Кельвина равна цене деления шкалы Цельсия, а цена деления шкалы Ранкина эквивалентна цене деления термометров со шкалой Фаренгейта. Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K, 0 °C, 32 °F.
Масштаб шкалы Кельвина был привязан к тройной точке воды (273,16 К), при этом от неё зависела постоянная Больцмана. Это создавало проблемы с точностью интерпретации измерений высоких температур. Поэтому в 2018—2019 годах в рамках изменений в СИ было введено новое определение кельвина, основанное на фиксации численного значения постоянной Больцмана, вместо привязки к температуре тройной точки[49].
Шкала Цельсия[править | править код]
В технике, медицине, метеорологии и в быту в качестве единицы измерения температуры используется шкала Цельсия. В настоящее время в системе СИ термодинамическую шкалу Цельсия определяют через шкалу Кельвина[4]: t(°С) = Т(К) — 273,15 (точно), то есть цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина. По шкале Цельсия температура тройной точки воды равна приблизительно 0,008 °C,[50] и, следовательно, точка замерзания воды при давлении в 1 атм очень близка к 0 °C. Точка кипения воды, изначально выбранная Цельсием в качестве второй реперной точки со значением, по определению равным 100 °C, утратила свой статус одного из реперов. По современным оценкам, температура кипения воды при нормальном атмосферном давлении в термодинамической шкале Цельсия составляет около 99,975 °C. Шкала Цельсия очень удобна с практической точки зрения, поскольку вода и её состояния распространены и крайне важны для жизни на Земле. Ноль по этой шкале является особой точкой для метеорологии, поскольку связан с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта[править | править код]
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а 100 градусов Цельсия — 212 градусов Фаренгейта.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724 году.
Шкала Реомюра[править | править код]
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°Ré), 1 °Ré равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °Ré) и кипения воды (80 °Ré)
1 °Ré = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Энергия теплового движения при абсолютном нуле[править | править код]
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному.
… современное понятие абсолютного нуля не есть понятие абсолютного покоя, наоборот, при абсолютном нуле может быть движение — и оно есть, но это есть состояние полного порядка …П. Л. Капица[40]
Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остаётся в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 106 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения,
сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Температуры абсолютного нуля достичь невозможно. Наиболее низкая температура (450±80)⋅10−12К конденсата Бозе-Эйнштейна атомов натрия была получена в 2003 г. исследователями из МТИ[51]. При этом пик теплового излучения находится в области длин волн порядка 6400 км, то есть примерно радиуса Земли.
Температура и излучение[править | править код]
Излучаемая телом энергия пропорциональна четвёртой степени его температуры. Так, при 300 К с квадратного метра поверхности излучается до 450 ватт. Этим объясняется, например, ночное охлаждение земной поверхности ниже температуры окружающего воздуха. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Переходы из разных шкал[править | править код]
| Шкала | Условное обозначение | из Цельсия (°C) | в Цельсий |
|---|---|---|---|
| Фаренгейт | (°F) | [°F] = [°C] × 9⁄5 + 32 | [°C] = ([°F] − 32) × 5⁄9 |
| Кельвин | (K) | [K] = [°C] + 273,15 | [°C] = [K] − 273,15 |
| Ранкин (Rankin) | (°R) | [°R] = ([°C] + 273,15) × 9⁄5 | [°C] = ([°R] − 491,67) × 5⁄9 |
| Делиль (Delisle) | (°Д или °De) | [°De] = (100 − [°C]) × 3⁄2 | [°C] = 100 − [°De] × 2⁄3 |
| Ньютон (Newton) | (°N) | [°N] = [°C] × 33⁄100 | [°C] = [°N] × 100⁄33 |
| Реомюр (Réaumur) | (°Re, °Ré, °R) | [°Ré] = [°C] × 4⁄5 | [°C] = [°Ré] × 5⁄4 |
| Рёмер (Rømer) | (°Rø) | [°Rø] = [°C] × 21⁄40 + 7,5 | [°C] = ([°Rø] − 7,5) × 40⁄21 |
Сравнение температурных шкал[править | править код]
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный нуль | 0 | −273,15 | −459,67 | 0 | 559,725 | −90,14 | −218,52 | −135,90 |
| Температура таяния смеси Фаренгейта (соль,лёд и хлорид аммония)[52] | 255,37 | −17,78 | 0 | 459,67 | 176,67 | −5,87 | −14,22 | −1,83 |
| Температура замерзания воды (Нормальные условия) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| Средняя температура человеческого тела¹ | 309,75 | 36,6 | 98,2 | 557,9 | 94,5 | 12,21 | 29,6 | 26,925 |
| Температура кипения воды (Нормальные условия) | 373,15 | 100 | 212 | 671,67 | 0 | 33 | 80 | 60 |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Солнце² | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ Нормальная средняя температура человеческого тела — +36,6 °C ±0,7 °C, или +98,2 °F ±1,3 °F. Приводимое обычно значение +98,6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения +37 °C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная.[53]
² Некоторые значения в этой таблице являются округлёнными. Например, температура поверхности Солнца равняется 5800 кельвинам очень приближённо. Однако для остальных температурных шкал уже дан точный результат перевода 5800 кельвинов в данную шкалу.
Характеристика фазовых переходов[править | править код]
Для описания точек фазовых переходов различных веществ используют следующие значения температуры:
- Температура плавления
- Температура кипения
- Температура отжига
- Температура спекания
- Температура синтеза
- Температура почвы
- Гомологическая температура
- Тройная точка
- Температура Дебая (Характеристическая температура)
- Температура Кюри
- Температура Нееля
Психология восприятия[править | править код]
Как показывают результаты многочисленных экспериментов, ощущение холода или тепла зависит не только от температуры и влажности окружающей среды, но и от настроения. Так, если испытуемый чувствует себя одиноким, например, находится в помещении с людьми, которые не разделяют его взглядов или ценностей, или просто находится далеко от других людей, то для него комната становится холоднее, и наоборот[54].
Интересные факты[править | править код]
|
|
Этот раздел представляет собой неупорядоченный список разнообразных фактов о предмете статьи. Пожалуйста, приведите информацию в энциклопедический вид и разнесите по соответствующим разделам статьи. Списки предпочтительно основывать на вторичных обобщающих авторитетных источниках, содержащих критерий включения элементов в список. (21 апреля 2021) |
- Самая высокая температура, созданная человеком, ~ 10⋅1012 К (что сравнимо с температурой Вселенной в первые секунды её жизни) была достигнута в 2010 году при столкновении ионов свинца, ускоренных до околосветовых скоростей. Эксперимент был проведён на Большом адронном коллайдере[55].
- Самая высокая теоретически возможная температура — планковская температура. Более высокая температура по современным физическим представлениям не может существовать, так как придание дополнительной энергии системе, нагретой до такой температуры, не увеличивает скорости частиц, а только порождает в столкновениях новые частицы, при этом число частиц в системе растёт, а также растёт и масса системы. Можно считать, что это температура «кипения» физического вакуума. Она примерно равна 1,41679(11)⋅1032 K (примерно 142 нониллиона K).
- Поверхность Солнца имеет температуры около 6000 K, а солнечное ядро — около 15 000 000 K.
- При очень низкой температуре, полученной в 1995 году Эриком Корнеллом и Карлом Виманом из США при охлаждении атомов рубидия удалось получить конденсат Бозе-Эйнштейна[56][57]. Температура была выше абсолютного нуля на 170 миллиардных долей кельвина (1,7⋅10−7 K).
- Самой низкой температурой, полученной в эксперименте, является температура в 50 пикокельвинов (5⋅10−11 K), полученная группой из Стенфордского университета в 2015 году[58].
- Рекордно низкая температура на поверхности Земли −89,2 °С была зарегистрирована на советской внутриконтинентальной научной станции Восток, Антарктида (высота 3488 м над уровнем моря) 21 июля 1983 года[59][60]. В июне 2018 года появилась информация о температуре −98 °С, зарегистрированной в Антарктиде[61].
- 9 декабря 2013 года на конференции Американского геофизического союза группа американских исследователей сообщила о том, что 10 августа 2010 года температура воздуха в одной из точек Антарктиды опускалась до −135,8 °F (−93,2 °С). Данная информация была выявлена в результате анализа спутниковых данных НАСА[62]. По мнению выступавшего с сообщением Т. Скамбоса (англ. Ted Scambos) полученное значение не будет зарегистрировано в качестве рекордного, поскольку определено в результате спутниковых измерений, а не с помощью термометра[63].
- Рекордно высокая температура воздуха вблизи поверхности земли +56,7 ˚C была зарегистрирована 10 июля 1913 года на ранчо Гринленд в долине Смерти (штат Калифорния, США)[64][65].
- Семена высших растений сохраняют всхожесть после охлаждения до −269 °C.[источник не указан 844 дня]
См. также[править | править код]
- Отрицательная абсолютная температура
- Цветовая температура
- Яркостная температура
- Антенная температура
- Тепловой насос
- Виртуальная температура
- Температура воздуха
- Температура тела
Примечания[править | править код]
- ↑ В качестве реперной точки 10-я Генеральная конференция по мерам и весам в 1954 году приняла тройную точку воды, приписав ей точное значение температуры 273,16 К по определению.
- ↑ Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — С. 741. — 944 с.
- ↑ The SI brochure Архивная копия от 26 апреля 2006 на Wayback Machine Описание СИ на сайте Международного бюро мер и весов
- ↑ 1 2 ГОСТ 8.417-2002. Государственная система обеспечения единства измерений. Единицы величин. Дата обращения: 3 декабря 2018. Архивировано 20 сентября 2018 года.
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, с. 84.
- ↑ Температурное поле. БСЭ, 3-е изд., 1976, т. 25. Дата обращения: 27 марта 2015. Архивировано 2 апреля 2015 года.
- ↑ Татьяна Данина. Механика тел. — Litres, 2017-09-05. — 163 с. — ISBN 9785457547490. Архивная копия от 26 апреля 2018 на Wayback Machine
- ↑ Трусделл К., Термодинамика для начинающих, 1970, с. 117.
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, с. 48.
- ↑ Физика. Большой энциклопедический словарь, 1998, с. 751.
- ↑ Залевски К., Феноменологическая и статистическая термодинамика, 1973, с. 11–12.
- ↑ Вукалович М. П., Новиков И. И., Термодинамика, 1972, с. 11.
- ↑ Зоммерфельд А., Термодинамика и статистическая физика, 1955, с. 11.
- ↑ Клаузиус Р., Механическая теория тепла, 1934.
- ↑ Каратеодори К., Об основах термодинамики, 1964.
- ↑ Борн М., Критические замечания по поводу традиционного изложения термодинамики, 1964.
- ↑ Базаров И. П., Термодинамика, 2010, с. 57.
- ↑ Гухман А. А., Об основаниях термодинамики, 1986.
- ↑ Леонова В. Ф., Термодинамика, 1968.
- ↑ Базаров И. П., Термодинамика, 2010, с. 29, 58, 127, 171.
- ↑ Кубо Р., Термодинамика, 1970, с. 20–21.
- ↑ Гиббс Дж. В., Термодинамика. Статистическая механика, 1982, с. 93.
- ↑ Guggenheim E. A., Thermodynamics, 1986, p. 15.
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1986, p. 35.
- ↑ Falk G., Jung H., Axiomatik der Thermodynamik, 1959, p. 156.
- ↑ Дьярмати И., Неравновесная термодинамика, 1974, с. 26.
- ↑ 1 2 Jou D. e. a., Extended Irreversible Thermodynamics, 2010, p. 48.
- ↑ Белоконь Н. И., Основные принципы термодинамики, 1968, с. 10.
- ↑ Базаров И. П., Термодинамика, 2010, с. 62.
- ↑ Абсолютная температура. БСЭ, 3-е изд., 1969, т. 1. Дата обращения: 27 марта 2015. Архивировано 21 февраля 2015 года.
- ↑ Пригожин И., Кондепуди Д., Современная термодинамика, 2002, с. 23, 83, 86.
- ↑ Сорокин В. С., Макроскопическая необратимость и энтропия. Введение в термодинамику, 2004, с. 60.
- ↑ Отрицательная температура. БСЭ, 3-е изд., 1975, т. 19. Дата обращения: 27 марта 2015. Архивировано 2 апреля 2015 года.
- ↑ Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1, 2002, с. 262.
- ↑ 1 2 3 4 Поулз Д., Отрицательные абсолютные температуры, 1964.
- ↑ Базаров И. П., Термодинамика, 2010, с. 136–148.
- ↑ Tisza L., Generalized Thermodynamics, 1966, p. 125.
- ↑ Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1, 2002, с. 261.
- ↑ Базаров И. П., Термодинамика, 2010, с. 137–138.
- ↑ 1 2 Капица П. Л. Свойства жидкого гелия // Природа. — Наука, 1997. — № 12. Архивировано 21 февраля 2016 года.
- ↑ Шахмаев Н. М. и др. Физика: Учебник для 10 класса общеобразовательных учреждений. — М.: Просвещение, 1996. — С. 21. — 240 с. — ISBN 5090067937.
- ↑ Платиновый [[термометр сопротивления]] — основной прибор МТШ-90. Дата обращения: 5 мая 2010. Архивировано 8 июня 2010 года.
- ↑ Лазерная термометрия. Дата обращения: 5 мая 2010. Архивировано 8 июня 2010 года.
- ↑ Температура // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Электронвольт // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — Т. 5. Стробоскопические приборы — Яркость. — С. 545. — 760 с. — ISBN 5-85270-101-7.
- ↑ http://physics.nist.gov/cuu/Constants/Table/allascii.txt Архивная копия от 8 декабря 2013 на Wayback Machine Fundamental Physical Constants — Complete Listing
- ↑ Conversion factors for energy equivalents. Дата обращения: 17 февраля 2021. Архивировано 26 января 2021 года.
- ↑ Реперные точки МТШ-90. Дата обращения: 5 мая 2010. Архивировано 17 сентября 2011 года.
- ↑ Разработка нового определения кельвина. Дата обращения: 5 мая 2010. Архивировано 8 июня 2010 года.
- ↑ Д. А. Паршин, Г. Г. Зегря. Критическая точка. Свойства вещества в критическом состоянии. Тройная точка. Фазовые переходы II рода. Методы получения низких температур. Статистическая термодинамика. Лекция 11. Санкт-Петербургский академический университет. Дата обращения: 2 июня 2011. Архивировано из оригинала 3 декабря 2012 года.
- ↑ Belle Dumé. Bose-Einstein condensates break temperature record (англ.) (12 сентября 2003). Дата обращения: 24 июля 2013. Архивировано 25 июля 2013 года.
- ↑ Фаренгейта шкала // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ О различных измерениях температуры тела Архивная копия от 26 сентября 2010 на Wayback Machine (англ.)
- ↑ Тальма Лобель, 2014, с. 24.
- ↑ BBC News — Large Hadron Collider (LHC) generates a ‘mini-Big Bang’. Дата обращения: 15 ноября 2010. Архивировано 15 ноября 2010 года.
- ↑ Всё про всё. Рекорды температуры. Дата обращения: 16 декабря 2009. Архивировано 25 сентября 2013 года.
- ↑ Чудеса науки. Дата обращения: 16 декабря 2009. Архивировано из оригинала 1 декабря 2012 года.
- ↑ Where is the coldest experiment on Earth? (англ.). Дата обращения: 23 февраля 2020. Архивировано 23 февраля 2020 года.
- ↑ Самая низкая температура на поверхности Земли. National Geographic Россия. Дата обращения: 9 декабря 2013. Архивировано из оригинала 13 декабря 2013 года.
- ↑ World: Lowest Temperature (англ.). Arizona State University. Дата обращения: 9 декабря 2013. Архивировано из оригинала 16 июня 2010 года.
- ↑ Учёные зафиксировали в Антарктиде самую низкую температуру на планете. Дата обращения: 27 июня 2018. Архивировано 27 июня 2018 года.
- ↑ NASA-USGS Landsat 8 Satellite Pinpoints Coldest Spots on Earth (англ.). NASA. Дата обращения: 10 декабря 2013. Архивировано 12 декабря 2013 года.
- ↑ Antarctica sets low temperature record of -135.8 degrees (англ.). FoxNews. Дата обращения: 10 декабря 2013. Архивировано 11 декабря 2013 года.
- ↑ Старый температурный рекорд оспорен. Компьюлента. Дата обращения: 30 ноября 2013. Архивировано из оригинала 3 декабря 2013 года.
- ↑ Press Release No. 956 (англ.). World Meteorological Organizayion. Дата обращения: 30 ноября 2013. Архивировано из оригинала 6 апреля 2016 года.
Литература[править | править код]
- Callen H. B. Thermodynamics and an Introduction to Thermostatistics (англ.). — 2nd ed. — N. Y. e. a.: John Wiley, 1986. — XVI + 493 p. — ISBN 0471862568, 9780471862567.
- Falk G., Jung H. Axiomatik der Thermodynamik (нем.) // Flügge S. (ed.). Encyclopedia of Physics / Flügge S. (Hrsg.). Handbuch der Physik. — Springer-Verlag, 1959. — Vol. III/2. Principles of Thermodynamics and Statistics / Band III/2. Prinzipien der Thermodynamik und Statistik, S. 119–175.
- Guggenheim E. A. Thermodynamics: An Advanced Treatment for Chemists and Physicists. — 8th ed. — Amsterdam: North-Holland, 1986. — XXIV + 390 p. — ISBN 0444869514, 9780444869517.
- Jou D., Casas-Vázquez J., Lebon G. Extended Irreversible Thermodynamics (англ.). — 4th ed. — N. Y.—Dordrecht—Heidelberg—London: Springer, 2010. — XVIII + 483 p. — ISBN 978-90-481-3073-3. — doi:10.1007/978-90-481-3074-0.
- Tisza Laszlo. Generalized Thermodynamics. — Cambridge (Massachusetts) — London (England): The M.I.T. Press, 1966. — XI + 384 p.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 112 с.
- Борн М. Критические замечания по поводу традиционного изложения термодинамики // Развитие современной физики. — М.: Наука, 1964. — С. 223—256.
- Вукалович М. П., Новиков И. И. Термодинамика. — М.: Машиностроение, 1972. — 671 с.
- Гиббс Дж. В. Термодинамика. Статистическая механика / Отв. ред. Д. Н. Зубарев. — М.: Наука, 1982. — 584 с. — (Классики науки).
- Гухман А. А. Об основаниях термодинамики. — Алма-Ата: Изд-во АН КазССР, 1947. — 106 с.
- Гухман А. А. Об основаниях термодинамики. — М.: Энергоатомиздат, 1986. — 384 с.
- Дьярмати И. Неравновесная термодинамика. Теория поля и вариационные принципы. — М.: Мир, 1974. — 304 с.
- Жилин П. А. Рациональная механика сплошных сред. — 2-е изд. — СПб.: Изд-во Политехн. ун-та, 2012. — 584 с. — ISBN 978-5-7422-3248-3.
- Залевски К. Феноменологическая и статистическая термодинамика: Краткий курс лекций / Пер. с польск. под. ред. Л. А. Серафимова. — М.: Мир, 1973. — 168 с.
- Зоммерфельд А. Термодинамика и статистическая физика / Пер. с нем.. — М.: Изд-во иностр. лит-ры, 1955. — 480 с.
- Каратеодори К. Об основах термодинамики // Развитие современной физики. — М.: Наука, 1964. — С. 3—22.
- Клаузиус Р. Механическая теория тепла // Второе начало термодинамики. — М.—Л.: Гостехиздат, 1934. — С. 70—158.
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — 5-е изд. — М.: Физматлит, 2002. — 616 с. — (Теоретическая физика в 10 томах. Том 5). — ISBN 5-9221-0054-8.
- Леонова В. Ф. Термодинамика. — М.: Высшая школа, 1968. — 159 с.
- Поулз Д. Отрицательные абсолютные температуры и температуры во вращающихся системах координат // Успехи физических наук. — Российская академия наук, 1964. — Vol. 84, № 4. — С. 693—713.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур / Пер. с англ. — М.: Мир, 2002. — 462 с.
- Рудой Ю. Г. Математическая структура равновесной термодинамики и статистической механики. — М. — Ижевск: Институт компьютерных исследований, 2013. — 368 с. — ISBN 978-5-4344-0159-3.
- Сивухин Д. В. Термодинамика и молекулярная физика. — Москва: «Наука», 1990.
- Сорокин В. С. Макроскопическая необратимость и энтропия. Введение в термодинамику. — М.: ФИЗМАТЛИТ, 2004. — 174 с. — ISBN 5-9221-0507-8.
- Спасский Б. И. История физики Ч.I. — Москва: «Высшая школа», 1977.
- Тальма Лобель. Теплая чашка в холодный день: Как физические ощущения влияют на наши решения = Sensation The New Science of Physical Intelligence. — М.: Альпина Паблишер, 2014. — 259 с. — ISBN 978-5-9614-4698-2.
- Трусделл К. Термодинамика для начинающих // Механика. Периодический сборник переводов иностранных статей. — М.: Мир, 1970. — № 3 (121), с. 116—128.
- Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — 944 с. — ISBN 5-85270-306-0.
Ссылки[править | править код]
- Current map of global surface temperatures (англ.)
- Miller, J. Cooling molecules the optoelectric way (англ.) // Physics Today : magazine. — 2013. — Vol. 66, no. 1. — P. 12—14. — doi:10.1063/pt.3.1840. — Bibcode: 2013PhT….66a..12M. Архивировано 15 мая 2016 года.

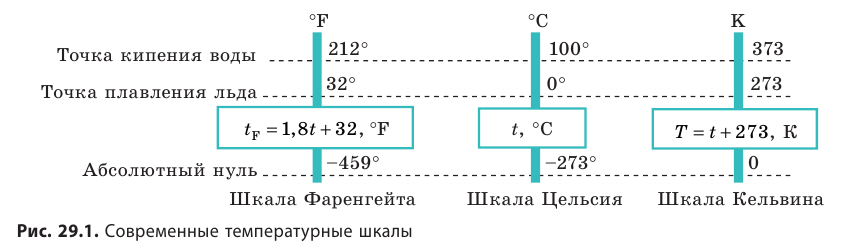

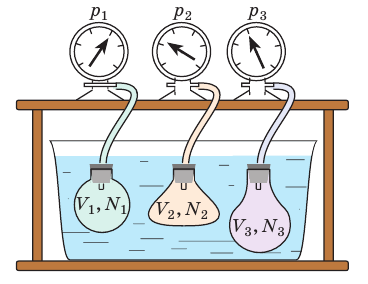
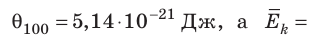
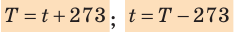
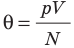 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 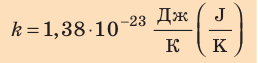
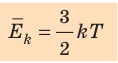 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (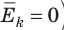 ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.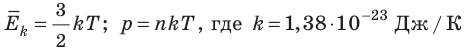 — постоянная Больцмана.
— постоянная Больцмана.