Полное условие задачи
В калориметре находился 1 кг льда. Какой была температура льда, если после добавления в калориметр 15 г воды, имеющей температуру 20 °С, в нем установилось тепловое равновесие при – 2 °С? (Теплообменом с окружающей средой и теплоемкостью колориметра пренебречь.)
Краткое условие задачи
Решение задачи
Количество теплоты, необходимое для нагревания льда, находящегося в калориметре, до температуры теплового равновесия найдем по формуле:
Количество теплоты, отдаваемое водой при охлаждении ее до температуры кристаллизации равно:
Количество теплоты, выделяющейся при кристаллизации воды при температуре кристаллизации, найдем следующим образом:
Количество теплоты, выделяющейся при охлаждении льда, полученного из воды, до температуры теплового равновесия будет равным:
Составим теперь уравнение теплового баланса:
Перепишем его с учетом выражений (1) – (4):
Выразим отсюда начальную температуру льда, находившегося в калориметре до добавления воды:
Подставим данные и найдем численный ответ:
Ответ: – 5 °С.
В этом параграфе мы изучим несколько новых терминов. Определим их. Теплообмен – это явление перехода внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы. Количество теплоты – это энергия, перешедшая от одного тела к другому при теплообмене.
На рисунке показан калориметр – прибор для измерения количества теплоты. Простейший калориметр состоит из двух стаканов: внутреннего алюминиевого и внешнего пластмассового, которые разделены воздушным промежутком.
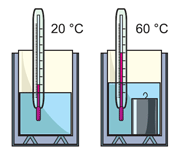
Рассмотрим пример. Во внутренний стакан нальём 100 г воды. Измерим её температуру: 20 °С. Погрузим в воду горячее тело – металлический цилиндрик. Внутри калориметра начнётся теплообмен, и некоторое количество теплоты перейдёт от цилиндрика к воде, в результате чего её температура повысится (см. рисунок). Вычислим изменение температуры воды:
Δt°воды = 60 °С – 20 °С = 40 °С .
Зная, что масса воды 100 г, инженер-теплотехник скажет: вода получила 100 г · 40 °С = 4000 калорий теплоты. В отличие от теплотехники, в физике количество теплоты выражают в джоулях (как и любую другую энергию). Для этого применяют специальную формулу:
| Q = c·m·Δt° | Q – количество теплоты, Дж с – удельная теплоёмкость, Дж/(кг°С) m – масса тела или вещества, кг Δt° – изменение температуры тела, °С |
Удельная теплоёмкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С.
Используя таблицу (см. далее), легко подсчитать, что вода внутри калориметра получила от цилиндрика 16,8 кДж теплоты:
Qводы = 4200 Дж/(кг°С) · 0,1 кг · 40 °С = 16800 Дж .
Формулу Q = cmΔt° применяют не только в том случае, когда вещество нагревается. Её также используют для подсчёта количества теплоты, которое отдают охлаждающиеся тела. Например, вода внутри отопительных батарей в квартире или классе.
Удельные теплоёмкости всех веществ измерены и занесены в специальные таблицы. Например, для воды в жидком состоянии с = 4200 Дж/(кг°С). Это значение показывает, что для нагревания 1 кг воды на 1 °С потребуется 4200 Дж теплоты. Можно сказать и иначе: каждый килограмм воды, остывая на 1 °С, отдаёт окружающим телам 4200 Дж тепловой энергии.
| Удельные теплоёмкости некоторых веществ, Дж/(кг°С) | ||||
| Алюминий | 920 | Вода | 4200 | |
| Железо | 460 | Лёд | 2100 | |
| Латунь | 400 | Масло подсолн. | 1700 |
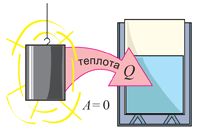
Поясним, почему в определении теплообмена присутствуют слова «без совершения механической работы». Вспомним, что в § 5-е мы рассмотрели опыт с манометром и горячей гирей. Тогда внутренняя энергия гири уменьшалась. Часть этой энергии превращалась в механическую работу – удлинялся «столбик» жидкости в манометре. В опыте с калориметром внутренняя энергия цилиндрика также уменьшалась. Однако теперь она превращалась во внутреннюю энергию воды без совершения работы (см. рисунок; для наглядности цилиндрик изображён вне калориметра).
Калориметрические измерения показывают, что теплообмен всегда протекает так, что убыль внутренней энергии одних тел сопровождается таким же приращением внутренней энергии других тел, участвующих в теплообмене. Это – одно из проявлений закона сохранения и превращения энергии.
|
|
Макеты страниц
Для
сравнения теплоемкостей разных тел пользуются калориметром. Калориметр
представляет собой металлический сосуд с крышкой, имеющий форму стакана. Сосуд
ставят на пробки, помещенные в другой, больший сосуд так, что между обоими
сосудами остается слой воздуха (рис. 367). Все эти предосторожности уменьшают
отдачу теплоты окружающим телам.
Рис. 367.
Калориметр
Сосуд
наполняют известным количеством воды, температура которой до опыта измеряется
(пусть она равна ). Затем берут тело, теплоемкость
которого хотят измерить, и нагревают до известной температуры (например,
помещают в пары кипящей воды, так что температура ). Нагретое тело опускают в воду
калориметра, закрывают крышку и, помешивая мешалкой, ждут, пока температура в
калориметре установится (это будет, когда вода и тело примут одинаковую
температуру). Тогда отмечают эту температуру .
Из
результатов опытов можно найти удельную теплоемкость тела , пользуясь тем, что
уменьшение энергии охлаждающегося тела равно увеличению энергии нагревающейся
при этом воды и калориметра, т. е. применяя закон сохранения энергии.
При
не очень точных измерениях можно считать, что вода калориметра, сам калориметр,
мешалка и тело, теплоемкость которого измеряется, за время опыта не успеют
отдать заметное количество теплоты окружающим телам.
(При
более точных измерениях надо внести соответственные поправки.) Поэтому суммы
энергий тела, воды, калориметра и мешалки до и после опыта можно считать
одинаковыми. Иначе говоря, энергия тела уменьшается при опыте настолько,
насколько увеличивается энергия воды, калориметра и мешалки. Температура тела
понижается на .
Так как никакой работы внутри калориметра не производится, то убыль энергии
тела равна ,
где —
удельная теплоемкость вещества тела, — масса тела.
Вода
нагревается на и
приращение ее энергии равно , где
— удельная теплоемкость воды,
— масса воды в
калориметре. Предположим, что калориметр и мешалка сделаны из одного материала
и общая их масса равна , а удельная теплоемкость их
материала равна . Энергия калориметра и мешалки
получит приращение, равное . Энергией, необходимой для
нагревания термометра, можно пренебречь, так как она обычно невелика.
Приравнивая убыль энергии тела приращению энергии воды, калориметра и мешалки,
получим
.
Это
равенство часто называют уравнением теплового баланса. Разрешая его
относительно ,
находим

Таким
образом, измерив найдем удельную теплоемкость
исследуемого тела , если известны удельные
теплоемкости воды и материала калориметра
. Удельная
теплоемкость воды может быть принята равной
(§ 208).
Удельную теплоемкость материала калориметра нужно определить отдельно:
например, путем наблюдения теплового баланса при опускании в калориметр тела,
сделанного из того же материала, что и стенки калориметра (т. е. сделав ). Определив раз
навсегда удельную теплоемкость материала калориметра , мы сможем делать все
дальнейшие определения, используя полученное соотношение.
Удельная
теплоемкость ряда веществ приведена в табл. 5. В тех случаях, когда температура
не указана, значения удельной теплоемкости даны для комнатной температуры. В
таблице показано на примере воды, меди и свинца, что удельная теплоемкость зависит
от температуры. У твердых тел при повышении температуры она увеличивается. При
очень низких температурах удельная теплоемкость всех тел быстро падает. Следует
обратить внимание на очень большую по сравнению с другими веществами удельную
теплоемкость воды. Заслуживает внимания также то, что удельная теплоемкость
льда вдвое меньше теплоемкости воды. У других веществ теплоемкости в твердом и
жидком состояниях также резко отличаются друг от друга.
Таблица 5.
Удельная теплоемкость некоторых веществ
|
Вещество |
|
Вещество |
|
|
Алюминий |
0,880 |
Медь |
0,280 |
|
Асбест |
0,210 |
» |
0,380 |
|
Вода |
4,180 |
Песок |
0,840 |
|
» |
4,220 |
Ртуть |
0,126 |
|
Воздух, |
1,010 |
Свинец |
0,130 |
|
Железо |
0,460 |
» |
0,032 |
|
Кирпич |
0,840 |
» |
0,143 |
|
Латунь |
0,390 |
Сера |
0,710 |
|
Лед |
2,100 |
Сосновое |
2,520 |
|
Стекло |
0,840 |
Зная
удельную теплоемкость вещества, всегда можно рассчитать, какое количество воды
имеет такую же теплоемкость, как и данное тело (так называемый водяной
эквивалент). Пусть, например, стакан калориметра сделан из латуни и имеет массу
100 г. Его теплоемкость равна . Следовательно, водяной эквивалент
этого стакана равен . Нагревая в таком стакане 300 г воды, можно считать, что мы нагреваем только воду, но в количестве не 300 г, а 309,3
г. Теперь можно ответить на вопрос, каким образом в опыте, описанном в §
203, Джоуль мог учесть нагревание, кроме воды, также и сосуда. Он мог сделать
это, пользуясь понятием водяного эквивалента.
209.1.
Два куска из одинакового материала (например, оба железные), но разной массы
нагреты до различных температур. Увеличится или уменьшится их общий объем, если
горячий кусок передаст некоторое количество теплоты холодному?
209.2.
В латунный стакан массы 163 г, имеющий температуру , вливают 100
г воды при и 200 г воды при
. Пренебрегая
обменом теплотой с окружающими телами, определите окончательную температуру
воды. Предположим, что температуры вливаёмых порций воды равны указанным выше,
но что имеет место обмен теплотой через стенки сосуда с окружающими предметами,
Кай повлияет это обстоятельство на окончательную температуру воды в случае,
если сперва наливается горячая, а потом холодная вода, и в случае, когда
порядок наливания воды обратный?
Оглавление
- ОТ ИЗДАТЕЛЬСТВА
- ИЗ ПРЕДИСЛОВИЯ К ПЕРВОМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- Глава I. Кинематика
- § 1. Движение тел
- § 2. Кинематика. Относительность движения и покоя.
- § 3. Траектория движения
- § 4. Поступательное и вращательное движения тела
- § 5. Движение точки
- § 6. Описание движения точки
- § 7. Измерение длины
- § 8. Измерение промежутков времени
- § 9. Равномерное прямолинейное движение и его скорость
- § 10. Знак скорости при прямолинейном движении
- § 11. Единицы скорости
- § 12. Графики зависимости пути от времени
- § 13. Графики зависимости скорости от времени
- § 14. Неравномерное прямолинейное движение
- § 15. Мгновенная скорость
- § 16. Ускорение при прямолинейном движении
- § 17. Скорость прямолинейного равноускоренного движения
- § 18. Знак ускорения при прямолинейном движении
- § 19. Графики скорости при прямолинейном равноускоренном движении
- § 20. Графики скорости при произвольном неравномерном движении
- § 21. Нахождение пути, пройденного при неравномерном движении, при помощи графика скорости
- § 22. Путь, пройденный при равнопеременном движении
- § 23. Векторы
- § 24. Разложение вектора на составляющие
- § 25. Криволинейное движение
- § 26. Скорость криволинейного движения
- § 27. Ускорение при криволинейном движении
- § 28. Движение относительно разных систем отсчета
- § 29. Кинематика космических движений
- Глава II. Динамика
- § 30. Задачи динамики
- § 31. Закон инерции
- § 32. Инерциальные системы отсчета
- § 33. Принцип относительности Галилея
- § 34. Силы
- § 35. Уравновешивающиеся силы. О покое тела и о движении по инерции
- § 36. Сила — вектор. Эталон силы
- § 37. Динамометры
- § 38. Точка приложения силы
- § 39. Равнодействующая сила
- § 40. Сложение сил, направленных по одной прямой
- § 41. Сложение сил, направленных под углом друг к другу
- § 42. Связь между силой и ускорением
- § 43. Масса тела
- § 44. Второй закон Ньютона
- § 45. Единицы силы и массы
- § 46. Системы единиц
- § 47. Третий закон Ньютона
- § 48. Примеры применения третьего закона Ньютона
- § 49. Импульс тела
- § 50. Система тел. Закон сохранения импульса
- § 51. Применения закона сохранения импульса
- § 52. Свободное падение тел
- § 53. Ускорение свободного падения
- § 54. Падение тела без начальной скорости и движение тела, брошенного вертикально вверх
- § 55. Вес тела
- § 56. Масса и вес
- § 57. Плотность вещества
- § 58. Возникновение деформаций
- § 59. Деформации в покоящихся телах, вызванные действием только сил, возникающих при соприкосновении
- § 60. Деформации в покоящихся телах, вызванные силой тяжести
- § 61. Деформации тела, испытывающего ускорение
- § 62. Исчезновение деформаций при падении тел
- § 63. Разрушение движущихся тел
- § 64. Силы трения
- § 65. Трение качения
- § 66. Роль сил трения
- § 67. Сопротивление среды
- § 68. Падение тел в воздухе
- Глава III. Статика
- § 69. Задачи статики
- § 70. Абсолютно твердое тело
- § 71. Перенос точки приложения силы, действующей на твердое тело
- § 72. Равновесие тела под действием трех сил
- § 73. Разложение сил на составляющие
- § 74. Проекции сил. Общие условия равновесия
- § 75. Связи. Силы реакции связей. Тело, закрепленное на оси
- § 76. Равновесие тела, закрепленного на оси
- § 77. Момент силы
- § 78. Измерение момента силы
- § 79. Пара сил
- § 80. Сложение параллельных сил. Центр тяжести
- § 81. Определение центра тяжести тел
- § 82. Различные случаи равновесия тела под действием силы тяжести
- § 83. Условия устойчивого равновесия под действием силы тяжести
- § 84. Простые машины
- § 85. Клин и винт
- Глава IV. Работа и энергия
- § 86. «Золотое правило» механики
- § 87. Применения «золотого правила»
- § 88. Работа силы
- § 89. Работа при перемещении, перпендикулярном к направлению силы
- § 90. Работа силы, направленной под любым углом к перемещению
- § 91. Положительная и отрицательная работа
- § 92. Единица работы
- § 93. О движении по горизонтальной плоскости
- § 94. Работа силы тяжести при движении по наклонной плоскости
- § 95. Принцип сохранения работы
- § 96. Энергия
- § 97. Потенциальная энергия
- § 98. Потенциальная энергия упругой деформации
- § 99. Кинетическая энергия
- § 100. Выражение кинетической энергии через массу и скорость тела
- § 101. Полная энергия тела
- § 102. Закон сохранения энергии
- § 103. Силы трения и закон сохранения механической энергии
- § 104. Превращение механической энергии во внутреннюю энергию
- § 105. Всеобщий характер закона сохранения энергии
- § 106. Мощность
- § 107. Расчет мощности механизмов
- § 108. Мощность, быстроходность и размеры механизма
- § 109. Коэффициент полезного действия механизмов
- Глава V. Криволинейное движение
- § 110. Возникновение криволинейного движения
- § 111. Ускорение при криволинейном движении
- § 112. Движение тела, брошенного в горизонтальном направлении
- § 113. Движение тела, брошенного под углом к горизонту
- § 114. Полет пуль и снарядов
- § 115. Угловая скорость
- § 116. Силы при равномерном движении по окружности
- § 117. Возникновение силы, действующей на тело, движущееся по окружности
- § 118. Разрыв маховиков
- § 119. Деформация тела, движущегося по окружности
- § 120. «Американские горки»
- § 121. Движение на закруглениях пути
- § 122. Движение подвешенного тела по окружности
- § 123. Движение планет
- § 124. Закон всемирного тяготения
- § 125. Искусственные спутники Земли
- Глава VI. Движение в неинерциальных системах отсчета и силы инерции
- § 126. Роль системы отсчета
- § 127. Движение относительно разных инерциальных систем отсчета
- § 128. Движение относительно инерциальной и неинерциальной систем отсчета
- § 129. Поступательно движущиеся неинерциальиые системы
- § 130. Силы инерции
- § 131. Эквивалентность сил инерции и сил тяготения
- § 132. Невесомость и перегрузки
- § 133. Является ли Земля инерциальиой системой отсчета?
- § 134. Вращающиеся системы отсчета
- § 135. Силы инерции при движении тела относительно вращающейся системы отсчета
- § 136. Доказательство вращения Земли
- § 137. Приливы
- Глава VII. Гидростатика
- § 138. Подвижность жидкости
- § 139. Силы давления
- § 140. Измерение сжимаемости жидкости
- § 141. «Несжимаемая» жидкость
- § 142. Силы давления в жидкости передаются во все стороны
- § 143. Направление сил давления
- § 144. Давление
- § 145. Мембранный манометр
- § 146. Независимость давления от ориентации площадки
- § 147. Единицы давления
- § 148. Определение сил давления по давлению
- § 149. Распределение давления внутри жидкости
- § 150. Закон Паскаля
- § 151. Гидравлический пресс
- § 152. Жидкость под действием силы тяжести
- § 153. Сообщающиеся сосуды
- § 154. Жидкостный манометр
- § 155. Устройство водопровода. Нагнетательный насос
- § 156. Сифон
- § 157. Сила давления на дно сосуда
- § 158. Давление воды в морских глубинах
- § 159. Прочность подводной лодки
- § 160. Закон Архимеда
- § 161. Измерение плотности тел на основании закона Архимеда
- § 162. Плавание тел
- § 163. Плавание несплошных тел
- § 164. Устойчивость плавания кораблей
- § 165. Всплывание пузырьков
- § 166. Тела, лежащие на дне сосуда
- Глава VIII. Аэростатика
- § 167. Механические свойства газов
- § 168. Атмосфера
- § 169. Давление атмосферы
- § 170. Другие опыты, показывающие существование атмосферного давления
- § 171. Разрежающие насосы
- § 172. Влияние атмосферного давления на уровень жидкости в трубке
- § 173. Максимальная высота столба жидкости
- § 174. Опыт Торричелли. Ртутный барометр и барометр-анероид
- § 175. Распределение атмосферного давления по высоте
- § 176. Физиологическое действие пониженного давления воздуха
- § 177. Закон Архимеда для газов
- § 178. Воздушные шары и дирижабли
- § 179. Применение сжатого воздуха в технике
- Глава IX. Гидродинамика и аэродинамика
- § 180. Давление в движущейся жидкости
- § 181. Течение жидкости по трубам
- § 182. Закон Бернулли
- § 183. Жидкость в неинерциальных системах отсчета
- § 184. Реакция движущейся жидкости и ее использование
- § 185. Перемещение на воде
- § 186. Ракеты
- § 187. Реактивные двигатели
- § 188. Баллистические ракеты
- § 189. Взлет ракеты с Земли
- § 190. Сопротивление воздуха
- § 191. Эффект Магиуса и циркуляция
- § 192. Подъемная сила крыла и полет самолета
- § 193. Турбулентность в потоке жидкости или газа
- § 194. Ламинарное течение
- РАЗДЕЛ ВТОРОЙ. ТЕПЛОТА. МОЛЕКУЛЯРНАЯ ФИЗИКА
- Глава X. Тепловое расширение твердых и жидких тел
- § 195. Тепловое расширение твердых и жидких тел
- § 196. Термометры
- § 197. Формула линейного расширения
- § 198. Формула объемного расширения
- § 199. Связь между коэффициентами линейного и объемного расширения
- § 200. Измерение коэффициента объемного расширения жидкостей
- § 201. Особенности расширения воды
- Глава XI. Работа. Теплота. Закон сохранения энергии
- § 202. Изменения состояния тел
- § 203. Нагревание тел при совершении работы
- § 204. Изменение внутренней энергии тел при теплопередаче
- § 205. Единицы количества теплоты
- § 206. Зависимость внутренней энергии тела от его массы и вещества
- § 207. Теплоемкость тела
- § 208. Удельная теплоемкость
- § 209. Калориметр. Измерение теплоемкостей
- § 210. Закон сохранения энергии
- § 211. Невозможность «вечного двигателя»
- § 212. Различные виды процессов, при которых происходит передача теплоты
- Глава XII. Молекулярная теория
- § 213. Молекулы и атомы
- § 214. Размеры атомов и молекул
- § 215. Микромир
- § 216. Внутренняя энергия с точки зрения молекулярной теории
- § 217. Молекулярное движение
- § 218. Молекулярное движение в газах, жидкостях и твердых телах
- § 219. Броуновское движение
- § 220. Молекулярные силы
- Глава XIII. Свойства газов
- § 221. Давление газа
- § 222. Зависимость давления газа от температуры
- § 223. Формула, выражающая закон Шарля
- § 224. Закон Шарля с точки зрения молекулярной теории
- § 225. Изменение температуры газа при изменении его объема. Адиабатические и изотермические процессы
- § 226. Закон Бойля — Мариотта
- § 227. Формула, выражающая закон Бойля — Мариотта
- § 228. График, выражающий закон Бойля — Мариотта
- § 229. Зависимость между плотностью газа и его давлением
- § 230. Молекулярное толкование закона Бойля — Мариотта
- § 231. Изменение объема газа при изменении температуры
- § 232. Закон Гей-Люссака
- § 233. Графики, выражающие законы Шарля и Гей-Люссака
- § 234. Термодинамическая температура
- § 235. Газовый термометр
- § 236. Объем газа и термодинамическая температура
- § 237. Зависимость плотности газа от температуры
- § 238. Уравнение состояния газа
- § 239. Закон Дальтона
- § 240. Плотность газов
- § 241. Закон Авогадро
- § 242. Моль. Постоянная Авогадро
- § 243. Скорости молекул газа
- § 244. Об одном из способов измерения скоростей движения молекул газа (опыт Штерна)
- § 245. Удельные теплоемкости газов
- § 246. Молярные теплоемкости
- § 247. Закон Дюлонга и Пти
- Глава XIV. Свойства жидкостей
- § 248. Строение жидкостей
- § 249. Поверхностная энергия
- § 250. Поверхностное натяжение
- § 251. Жидкостные пленки
- § 252. Зависимость поверхностного натяжения от температуры
- § 253. Смачивание и несмачивание
- § 254. Расположение молекул у поверхности тел
- § 255. Значение кривизны свободной поверхности жидкости
- § 256. Капиллярные явления
- § 257. Высота поднятия жидкости в капиллярных трубках
- § 258. Адсорбция
- § 259. Флотация
- § 260. Растворение газов
- § 261. Взаимное растворение жидкостей
- § 262. Растворение твердых тел в жидкостях
- Глава XV. Свойства твердых тел. Переход тел из твердого состояния в жидкое
- § 263. Введение
- § 264. Кристаллические тела
- § 265. Аморфные тела
- § 266. Кристаллическая решетка
- § 267. Кристаллизация
- § 268. Плавление и отвердевание
- § 269. Удельная теплота плавления
- § 270. Переохлаждение
- § 271. Изменение плотности веществ при плавлении
- § 272. Полимеры
- § 273. Сплавы
- § 274. Затвердевание растворов
- § 275. Охлаждающие смеси
- § 276. Изменения свойств твердого тела
- Глава XVI. Упругость и прочность
- § 277. Введение
- § 278. Упругие и пластические деформации
- § 279. Закон Гука
- § 280. Растяжение и сжатие
- § 281. Сдвиг
- § 282. Кручение
- § 283. Изгиб
- § 284. Прочность
- § 285. Твердость
- § 286. Что происходит при деформации тел
- § 287. Изменение энергии при деформации тел
- Глава XVII. Свойства паров
- § 288. Введение
- § 289. Пар насыщенный и ненасыщенный
- § 290. Что происходит при изменении объема жидкости и насыщенного пара
- § 291. Закон Дальтона для пара
- § 292. Молекулярная картина испарения
- § 293. Зависимость давления насыщенного пара от температуры
- § 294. Кипение
- § 295. Удельная теплота парообразования
- § 296. Охлаждение при испарении
- § 297. Изменение внутренней энергии при переходе вещества из жидкого состояния в парообразное
- § 298. Испарение при кривых поверхностях жидкости
- § 299. Перегревание жидкости
- § 300. Пересыщение паров
- § 301. Насыщение пара при возгонке
- § 302. Превращение газа в жидкость
- § 303. Критическая температура
- § 304. Сжижение газов в технике
- § 305. Вакуумная техника
- § 306. Водяной пар в атмосфере
- Глава XVIII. Физика атмосферы
- § 307. Атмосфера
- § 308. Тепловой баланс Земли
- § 309. Адиабатические процессы в атмосфере
- § 310. Облака
- § 311. Искусственные осадки
- § 312. Ветер
- § 313. Предсказание погоды
- Глава XIX. Тепловые машины
- § 314. Условия, необходимые для работы тепловых двигателей
- § 315. Паросиловая станция
- § 316. Паровой котел
- § 317. Паровая турбина
- § 318. Поршневая паровая машина
- § 319. Конденсатор
- § 320. Коэффициент полезного действия теплового двигателя
- § 321. Коэффициент полезного действия паросиловой станции
- § 322. Бензиновый двигатель внутреннего сгорания
- § 323. Коэффициент полезного действия двигателя внутреннего сгорания
- § 324. Двигатель Дизеля
- § 325. Реактивные двигатели
- § 326. Передача теплоты от холодного тела к горячему
- Ответы и решения к упражнениям
- Предметный указатель
Химики и физики используют метод, известный как калориметрия, для измерения количества тепла, выделяемого или поглощаемого во время химической реакции. Калориметр обычно состоит из контейнера, заполненного жидкостью, обычно водой, термометра для контроля температуры и устройства для перемешивания воды. Сам калориметр может быть таким же простым, как чашка из пенопласта. Расчеты из калориметрии основаны на первом законе термодинамики, который утверждает, что энергия не может быть создана или разрушена. Применительно к калориметрии это означает, что любое тепло, выделяемое во время химической реакции, должно передаваться калориметру или, более конкретно, воде внутри калориметра. Поэтому, если химик или физик могут измерить тепло, поглощаемое водой, то они знают количество тепла, выделяемое реакцией.
TL; DR (слишком долго; не читал)
Вы можете рассчитать прирост тепла с помощью калориметра, измерив изменение температуры известной массы жидкости, если теплоемкость жидкости также известна.
Измерьте изменение температуры
Рассчитайте изменение температуры дельта (T) воды в калориметре по уравнению дельта (T) = конечная температура – начальная температура. Предполагая, что реакция была экзотермической, т.е. она выделяла тепло, дельта (Т) должна демонстрировать положительное значение. Если реакция была эндотермической, то есть поглощала тепло, то дельта (Т) должна быть отрицательной. Таким образом, если начальная температура составляла 24, 0 градуса Цельсия, а конечная температура составляла 33, 4 градуса Цельсия, то дельта (Т) = 33, 4-24, 0 = 9, 6 градуса Цельсия, и реакция была экзотермической.
Найти водную массу
Рассчитайте массу воды в калориметре. Если вы следовали набору инструкций, таких как лабораторная процедура в учебнике, инструкции должны были включать этап, на котором либо измерялся фиксированный объем воды, например, в градуированном цилиндре, либо колпачок для калориметра взвешивают на весах до и после добавления воды. Если вы измерили фиксированный объем воды, то масса в граммах будет равна объему в миллилитрах. Если вы взвесили калориметр до и после добавления воды, то масса воды будет равна массе калориметра и воды вместе минус масса пустой чашки. Например, если пустая чашка для калориметра весила 4, 65 г, а калориметр с водой – 111, 88 г, то масса воды составляла 111, 88 – 4, 65 = 107, 23 г.
Найти тепло
Рассчитайте тепло, полученное калориметром, Q, в соответствии с уравнением Q = m * c * delta (T), где m представляет массу воды, рассчитанную на шаге 2, c представляет теплоемкость воды, или 4, 184 джоулей на грамм на градус Цельсия, Дж / гС и дельта (Т) представляет собой изменение температуры, рассчитанное на шаге 1. Продолжая пример с шагов 1 и 2, Q = 107, 23 г * 4, 184 Дж / гС * 9, 6 С = 4, 3 * 10 ^ 3 Дж, или 4, 3 кДж. Это представляет тепло, поглощенное калориметром.
At some point in your life, you have probably wondered what a calorie is after looking at a nutrition-information label for a given food. Other than something many people like to see lower numbers associated with when they scan such labels, what is a calorie?
And how do “calories” add mass to living systems, if this is in fact what happens? And how can you be sure the number of calories listed for a given item — be this value reassuring or depressing — has been accurately determined?
Heat is one of many properties of the ambient world that you can probably describe well in a few of your own well-chosen words, but it has a more focused meaning in the physical sciences. The calorie is a measure of heat, as is the joule (J) and the British thermal unit (btu). The study of heat exchange is a branch of physical science known as calorimetry, which in turn relies on devices called calorimeters.
Intuitively, you might find it odd that chilled or frozen foods like ice cream and cheesecake can pack a lot of what is supposedly heat into a small serving. Also, if calories somehow translate to heat, shouldn’t foods that supply more of it actually lead to weight loss rather than added body mass?
These are good questions, and after you “burn” through the rest of this article, you’ll have these answers and much more to take to your next calorimetry lab or sports-nutrition discussion.
What Is Heat in Physics?
Heat can be thought of chiefly as thermal energy. Like other forms of energy, it has units of joules (or the equivalent in non-SI units). Heat is an elusive quantity in that it is difficult to measure directly. Instead, changes in temperature under controlled experimental conditions can be used to determine whether a system has gained or lost heat.
The fact that heat is treated as energy means that keeping track of it is a mathematically straightforward exercise, even if experiments sometimes make it difficult to establish conditions in which no heat energy escapes and eludes measurement. But because of fundamental realities such as the law of conservation of energy, heat tabulation is fairly simple in principle.
Materials have different levels of resistance to changing temperatures when a given amount of heat is added to a fixed amount of that substance. That is, if you took 1 kilogram of substance A and 1 kilogram of substance B and added the same amount of heat to each, with no heat permitted to leave either system, the temperature of A might increase by only one-fifth as much as the temperature of substance B does.
This would mean that substance A has a specific heat five times that of substance A, a concept to be explored in detail below.
Units of Heat and the “Calorie”
The “calorie” listed on nutrition labels is in fact a kilocalorie, or kcal. So in reality, a typical can of sugared soda has about 120,000 calories, expressed by convention as a calorie in everyday communication.
- Calor is the Latin word for, appropriately enough, heat.
The calorie is equivalent to about 4.184 J, meaning that the kcal treated as a calorie on food labels is equal to 4,184 J or 4.184 kJ. The rate of energy expenditure (joules per second) in physical science is called power, and the SI unit is the watt (W), equal to 1 J/s. One kcal is therefore a sufficient amount of energy to power a system humming along at 0.35 to 0.4 kW (350 J/s) for about 12 seconds:
P = E/t, so t = E/P = 4.186 kJ/(0.35 kJ/s) = 12.0.
- A trained endurance athlete such as a bicyclist or runner is capable of maintaining such a power output over extended periods. In theory, then, a 100-“calorie” (100-kcal) energy drink could keep an Olympic road cyclist or marathon runner going for about 100 times 12 seconds, or 20 minutes. Because the human system is not nearly 100 percent mechanically efficient, it actually requires more than 300 kcal to operate at close to full aerobic capacity for this long.
The calorie is defined as the amount of heat required to increase the temperature of 1 gram of water by 1 degree Celsius. One problem with this is that there is a slight variation of the c of water with temperature across the range of temperatures at which H2O is a liquid. The “specific” in “specific heat” refers not only to specific materials but to a specific temperature.
-
The specific heats of most materials are given at 20
°C or 25 °C.
Heat Capacity and Specific Heat Defined
Technically, the terms “heat capacity” and “specific heat capacity” mean different things, even though you may see these used interchangeably in less-rigorous sources.
Heat capacity, when originally coined, referred simply to the amount of heat required to warm an entire object (which may be made of multiple materials) by a given amount. Specific heat capacity refers to the amount of heat needed to raise the temperature of 1 gram of a specific material by 1 degree Celsius or Kelvin (°C or K).
- While the Celsius and Kelvin temperature scales are not the same, they are different by a fixed amount, as °C + 273 = K where K cannot be negative. This means that a given numerical change in temperature in one scale produces the same magnitude of change in the other, unlike the case with Fahrenheit-Celsius interconversions.
Rather than shorten “specific heat capacity” to “heat capacity,” instead use the term specific heat, as is the convention in reputable sources.
What Is Calorimetry?
The purpose of a calorimeter is to capture the heat released in some process, such as an exothermic chemical reaction, that would otherwise be lost to the environment. When the temperature change of the system and the mass and specific heat of the calorimeter assembly are known, the amount of heat put into the system by the process can be determined. Examples are provided in a subsequent section.
A calorimeter can be built from a number of different materials, with the condition that they be insulating (i.e., not permissive of heat transfer; the term is also used in electromagnetism to refer to resistance against electrical charge transfer).
One common version can be made from a Styrofoam cup and a well-fitting lid. In this coffee-cup calorimeter, water is usually used as a solvent, and a thermometer and (if needed) stirring stick are fitted snugly through small holes in the lid of the cup.
The Calorimetry Formula
The change in heat of a closed system (positive by definition in the case of a calorimeter) is given by the product of the mass of the system, the heat capacity of the calorimeter and the change in temperature of the system:
Q = mC∆T
Where:
- Q = heat evolved (equal to heat absorbed − heat released) in joules (J)
- m = mass in kilograms (kg)
- c = specific heat capacity in J/kg⋅°C (or J/kg⋅K)
- ∆T = temperature change in °C (or K)
The heat that is liberated from whatever exothermic (heat-releasing) chemical reaction occurs in the calorimeter would ordinarily disperse into the environment. This is a loss chalked up to a change in a thermodynamic quantity known as enthalpy that describes both the internal energy of the system and changes in the system’s pressure-volume relationship. This heat is instead trapped between the solvent and the lid of the cup.
Earlier, the idea of conservation of energy was introduced. Because the heat entering the calorimeter must equal the heat liberated by the system within the calorimeter consisting of the reactants and products themselves, the sign of the heat change for this system is negative and has the same magnitude as the heat gained by the calorimeter.
The above and related statements assume that only no heat or negligible amounts of heat escape from the calorimeter. Heat moves from warmer to cooler areas when insulation is not present, so without proper insulation, heat will leave the calorimeter assembly for the ambient environment unless the environmental temperature is warmer than that of the calorimeter.
Some Common Specific Heat Capacities
The following chart includes the specific heat in J/kg⋅°C of some commonly encountered elements and compounds.
- H2O, ice: 2.108
- H2O, water: 4.184
- H2O, water vapor: 2.062
- Methanol: 2.531
- Ethanol: 2.438
- Benzene: 1.745
- Carbon, graphite: 0.709
- Carbon, diamond: 0.509
- Aluminum: 0.897
- Iron: 0.449
- Copper: 0.385
- Gold: 0.129
-
Mercury: 0.140
-
Table salt (NaCl): 0.864
- Quartz: 0.742
- Calcite: 0.915
Note that water has an unusually large heat capacity. It is perhaps counterintuitive that a gram of water will warm by less than one-tenth as much as a gram of water given the same amount of added heat, but this is important to life around the planet.
Water makes up about three-fourths of your body, making you able to tolerate major swings in environmental temperature. More broadly, the oceans act as heat reservoirs to help stabilize temperatures worldwide.
The Heat Capacity of a Calorimeter
Now you are ready for some calculations involving calorimeters.
Example 1: First, take the simple case of a gram of sodium hydroxide (NaOH) being dissolved in 50 mL of water at 25 °C. Take the heat capacity of water at this temperature to be 4.184 J/kg⋅°C and consider the 50 mL of water to have a mass of 50 grams, or 0.05 kg. If the temperature of the solution increases to 30.32 °C, how much heat is gained by the calorimeter?
You have Q = mc∆T = (0.05 kg)(4.184 kJ/kg⋅°C)(30.32 − 5.32 °C)
= 1.113 kJ or 1,113 J.
Example 2: Now consider the case of a home solar energy storage unit, a device becoming more popular over time. Assume this device uses 400 L of water for storing thermal energy.
On a clear summer day, the initial temperature of the water is 23.0 °C. During the course of the day, the temperature of the water rises to 39.0 °C as it circulates through the “water wall” of the unit. How much energy has been stored in the water?
Again, assume the mass of water is 400 kg, that is, that the density of water can be considered to be exactly 1.0 within this temperature range (this is a simplification).
The equation of interest this time is:
Q = mc∆T = (400 kg)(4.184 kJ/kg⋅°C)(39 °C − 23 °C)
= 26,778 J = 26.78 kJ.
This is enough energy to power a 1.5-kW space heater for about 17 seconds:
(26.78 kJ)(kW/(kJ/s)/(1.5 kW) = 17.85 s
Most likely, the homeowners have a different use planned for it if they live in a solar house.
Calorimetry Calculator
You can use online calculators that allow you to convert easily between units of specific heat, including unusual but not completely extinct units such as Btu/lbmoF.