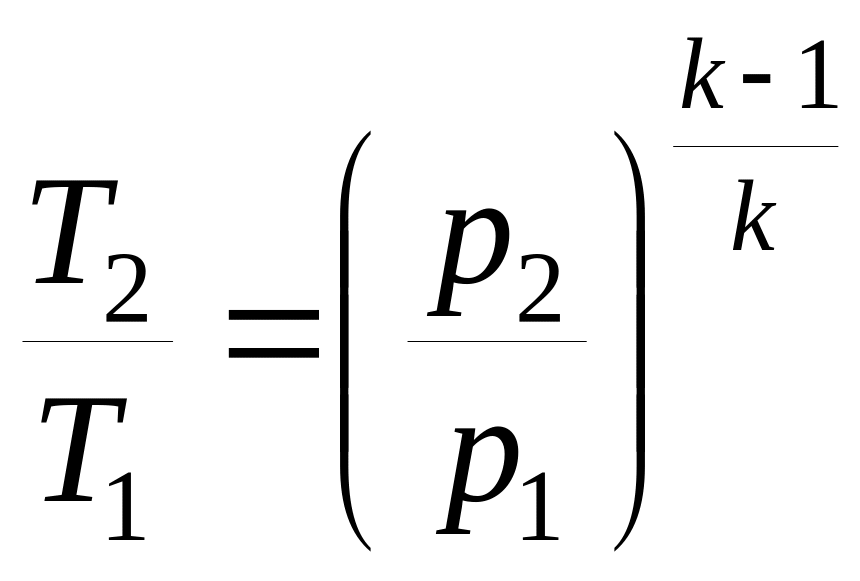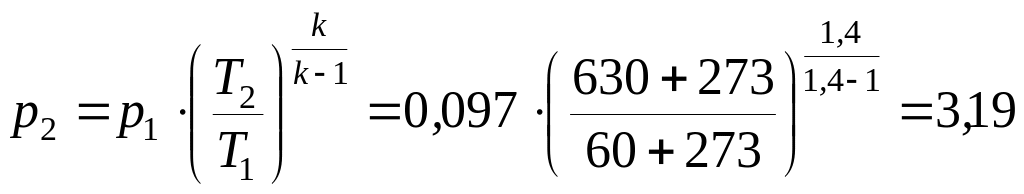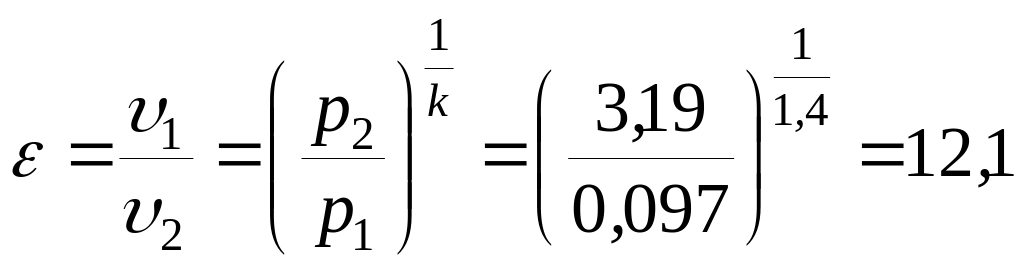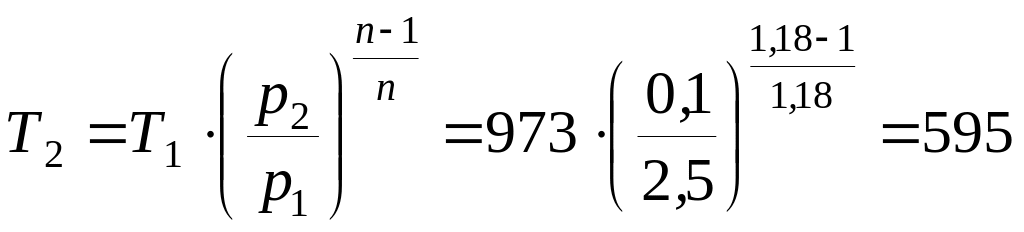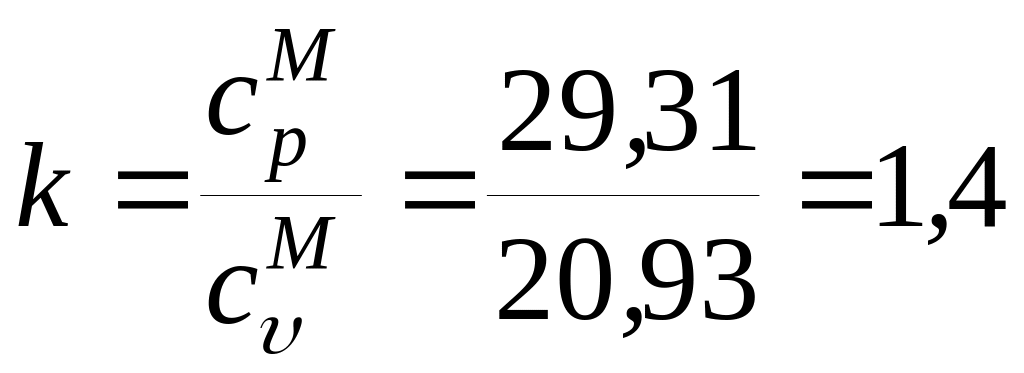Какая температура установится в сосуде?
Знаток
(286),
на голосовании
4 года назад
Голосование за лучший ответ
Рустам Искендеров
Искусственный Интеллект
(133392)
4 года назад
Будем исходить из обозначений Н. Чайковского. m1= 1 кг, С1= 4,2 кДж/(кг*оС), t1= 20оС, m2= 1 кг, С2= 2,1 кДж/(кг*оС), t2= -10оС, L= 330 кДж/кг.
При решении таких задач (“вода – лёд”) в общем случае исходят из двух “легенд”: 1) лёд тает полностью; 2) лёд тает частично. Если расчёт температуры по первой легенде даёт неотрицательное значение, то установившаяся температура будет равна этому найденному значению. Если отрицательное, то верна вторая легенда – лёд растаял частично, в сосуде установилась t= 0оС.
Н. Чайковский, исходя из первой легенды, составил верный тепловой баланс; но решая его относительно установившейся температуры, допустил описку. Д. б.:
t=[C1*m1*t1-m2(L+C2*|t2|)]/[C1*(m1+m2)].
Подставляя численные значения, находим: t= -21,4oC, что является абсурдом. Значит, верна вторая легенда. ОТВЕТ: t= 0oC.
Составить тепловой баланс по этой легенде необходимости нет, ибо в данной задаче требуется найти только установившуюся температуру.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Как найти температуру воздуха при постоянном давлении
Всякое изменение состояния газа принято считать термодинамическим процессом. При этом самые простейшие процессы, протекающие в идеальном газе, называют изопроцессами. При изопроцессе масса газа и еще один его параметр (давление, температура или объем) остаются постоянными, остальные же изменяются.

Вам понадобится
- – калькулятор;
- – исходные данные;
- – карандаш;
- – линейка;
- – ручка.
Инструкция
Изопроцесс, в котором давление остается постоянным, называется изобарным. Существующая зависимость между объемом газа и его температурой при постоянном давлении этого газа была установлена опытным путем французским ученым Л. Гей Люссаком в 1808 году. Он показал, что объем идеального газа при постоянном давлении увеличивается с возрастанием температуры. Другими словами, объем газа прямо пропорционален его температуре при условии постоянного давления.
Описанная выше зависимость была выражена в формуле: Vt = V0(1 + αt), где V0 – объем газа при температуре нуль градусов, Vt – объем газа при температуре t, которая измерена по шкале Цельсия, α – величина термического коэффициента объемного расширения. Абсолютно для всех газов α = (1/273°С–1). А значит, Vt = V0(1 + (1/273)t). Отсюда, t = (Vt – V0)/((1/273)/V0).
Подставьте в эту формулу исходные данные и подсчитайте значение температуры при постоянном давлении для идеального газа.
Обратите внимание на то, что полученный результат справедлив лишь для идеального газа. Реальные газы подчинены данной зависимости лишь в достаточно разреженном состоянии, то есть, когда показатели давления воздуха и его температуры не имеют критического значения, при котором начинается процесс сжижения газа. Давление большинства газов при комнатной температуре изменяет от 10 до 102 атмосфер.
Графически изобразите зависимость температуры, давления и объема воздуха. Так, график зависимости объема и температуры будет выглядеть в виде прямой, которая выходит из точки Т=0. Данная прямая называется изобарой.
Видео по теме
Обратите внимание
Помните: идеальный газ – это разряженный газ, в котором пренебрегают взаимодействие между молекулами.
Полезный совет
Изменение состояния газа при постоянной температуре называют изометрическим процессом: для данного газа при неизменной температуре тела произведение давления газа на его объем – постоянная величина. Изохорный процесс протекает в газе при условии, если объем постоянен.
Источники:
- Закон Гей-Люссака
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Найдите правильный ответ на вопрос ✅ «Воздух объемом v1=20 л находится в сосуде под давлением p=2.8*10^5 Па при температуре t1=27c. Определите температуру воздуха T2, если при …» по предмету 📘 Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Физика » Воздух объемом v1=20 л находится в сосуде под давлением p=2.8*10^5 Па при температуре t1=27c. Определите температуру воздуха T2, если при изобарном его нагревании была совершена работа A=760 Дж
Задача 1.
В закрытом сосуде емкостью V
= 0,6 м3
содержится азот при давлении р1
= 0,5 МПа и температуре t1
= 20 C.
В результате охлаждения сосуда азот,
содержащийся в нем, теряет 105 кДж теплоты.
Принимая теплоемкость азота постоянной,
определить, какие давление и температура
(C)
устанавливаются в сосуде после охлаждения.
Решение.
Количество отводимой
теплоты равно:
– Q
= mc(t2
– t1).
Откуда следует,
что температура азота после охлаждения
будет равна:
.
Массу азота
определим из уравнения Клапейрона:
кг.
Массовая теплоемкость
азота при постоянном объеме определяется
как для двухатомного газа. По Приложению
1 ПЗ 4 сМ
= 20,93 кДж/(кмольК):
кДж/(кгК).
Тогда
C.
Так как азот
охлаждался в емкости с постоянным
объемом, то давление азота после
охлаждения определим из уравнения для
изохорного процесса:
МПа.
Ответ: t2
= – 20,7 C,
р2
= 0,43 МПа.
Задача 2.
В установке воздушного отопления внешний
воздух при t1
= – 15 C
нагревается в калорифере при р
= const
до 60 C.
Какое количество теплоты надо затратить
для нагревания 1010 м3
наружного воздуха? Давление воздуха
считать равным 755 мм рт.ст.
Решение.
Количество теплоты,
подводимое к воздуху, будет равно:
Q
= mcр(t2
– t1).
Массу воздуха
определим из уравнения Клапейрона:
кг.
Массовая теплоемкость
воздуха при постоянном давлении
определяется как для двухатомного газа.
По Приложению 1 ПЗ 4 срМ
= 29,31 кДж/(кмольК):
кДж/(кгК).
Тогда Q
= mcр(t2
– t1)
= 1372
1,012
(60 – (–15) = 104,2 МДж.
Ответ: Q
= 104,2 МДж.
Задача 3.
25 кг воздуха при t
= 27 C
изотермически сжимаются до тех пор,
пока давление не становится равным 4,15
МПа. На сжатие затрачивается работа L
= – 8,0 МДж. Найдите начальное давление
и объем, конечный объем и теплоту,
отведенную от воздуха.
Решение.
Так как при
изотермическом процессе U
= 0, то Q
= L
= – 8,0 МДж.
Начальное давление
определим из выражения по определению
количества теплоты для изотермического
процесса:
.
Подставив в
полученную формулу
,
окончательно получим:
МПа.
Начальный объем
определим из уравнения Клапейрона:
м3.
Конечный объем
определим из уравнения изотермического
процесса:
м3.
Ответ: р1
= 0,101 МПа, V1
= 21,3 м3,
V2
= 0,518 м3,
Q
= – 8,0 МДж.
Задача 4.
В двигателе Дизеля топливо, впрыскиваемое
в цилиндр, самовоспламеняется при
соприкосновении со сжатым воздухом,
имеющим температуру большую, чем
температура воспламенения топлива.
Определите
минимальную необходимую степень сжатия
= 1/2
и давление в конце сжатия р2,
если температура воспламенения топлива
равна 630 C.
Перед началом сжатия воздух в цилиндре
имеет параметры р1
= 0,097 МПа, t1
= 60 C.
Сжатие считать адиабатным. Задачу
решить, не учитывая зависимости
теплоемкости от температуры и принимая
k
= 1,40.
Решение.
Давление
в конце сжатия определим из уравнения
адиабатного процесса:
МПа.
Отношение 1/2,
то есть степень сжатия
определим из другого уравнения адиабатного
процесса:
.
Ответ: р2
= 3,19 МПа,
= 12,1.
Задача 5.
Азот массой 1 кг в начальном состоянии
имеет параметры р1
= 2,5 МПа и
t1
= 700 C.
После политропного расширения (показатель
политропы n
= 1,18) его давление р2
= 0,1 МПа.
Определите изменение внутренней энергии
u1-2,
количество теплоты q1-2,
сообщенное азоту в процессе 1-2, и работу
расширения l1-2.
Решение.
Сначала определим
температуру газа в конце процесса
расширения:
К.
Изменение удельной
внутренней энергии при совершении
политропного процесса определяется по
формуле:
u1-2
= c(T2
– T1)
=
кДж/кг.
Удельное количество
теплоты, сообщенное азоту в процессе
1-2, при совершении политропного процесса
определяется по формуле:
q1-2
= cn(T2
– T1)
=
,
где
– показатель адиабаты для двухатомных
газов.
Тогда q1-2
=
кДж/кг.
Удельная работа
расширения при совершении политропного
процесса определяется по формуле:
l1-2
=
кДж/кг.
Проверку сделаем
по уравнению первого закона термодинамики:
u1-2
= q1-2
– l1-2
= 345 – 624 = –279
–283 кДж/кг, т.е. задача решена верно.
Ответ: u1-2
= –283
кДж/кг, q1-2
= 345 кДж/кг, l1-2
= 624 кДж/кг.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #