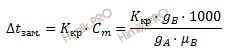Температура замерзания раствора
Вычислите температуру замерзания раствора 5%-ного раствора этилового спирта (C2H5OH), зная, что криоскопическая константа воды 1,86 0С.
Решение задачи
Следствие из закона Рауля: температура замерзания раствора ниже температуры замерзания чистого растворителя:
Где:
Dt зам. — понижение температуры замерзания раствора (температура кристаллизации);
Ккр. – криоскопическая постоянная;
Cm– моляльная концентрация;
gB – масса растворенного вещества;
gA – масса растворителя;
µB – молярная масса растворенного вещества.
Температура замерзания раствора. Пусть масса раствора равна 100 грамм, следовательно, масса растворённого вещества равна 5 грамм, а масса растворителя 100 – 5 = 95 грамм.
Учитывая, что молярная масса этилового спирта (C2H5OH) равна 46 г/моль (смотри таблицу Менделеева), получаем:
Dt зам. = 1,86 ⋅ 1000 ⋅ 5 / 46 ⋅ 95 = 2,13 (0С).
Вода кристаллизуется при температуре 0 0С, следовательно, температура замерзания раствора:
tзам = -2,13 (0С).
Ответ:
температуру замерзания раствора -2,3 0С.
В этой статье мы узнаем подробные объяснения того, как найти точку замерзания раствора, а также ее различные методы и факты.
Температура замерзания является важным свойством вещества; это одновременно физический и химический процесс, который изменяет природу вещества из-за изменений температуры. Он переходит из одной формы вещества в другую, и существуют различные методы измерения точки замерзания вещества.
Давайте сначала изучим точку замерзания / депрессию точки замерзания.
Температура замерзания и депрессия точки замерзания
Температура замерзания является важным физическим и химическим свойством вещества.
- Это температура, при которой элементы в своей жидкой форме превращаются в твердое вещество. Для разных веществ он разный. Принимая во внимание, что снижение температуры замерзания также является фундаментальным свойством растворов, в которых добавленные растворенные вещества снижают нормальное замерзание используемого растворителя.
- FPD зависит главным образом от концентрации растворенного вещества, а не от других свойств.
- Например, соль уменьшает точка замерзания воды при низких температурах так что c не может превратить его в лед.
- Мы можем использовать закон Благдена, чтобы вычислить это, который сочетает в себе как закон Рауля, так и уравнение Клаузиуса-Клапейрона.
Изучить, как найти FP решения, используя моляльность.
Как найти точку замерзания раствора с моляльностью?
Чтобы найти точку замерзания, во-первых, мы должны измерить понижение точки замерзания раствора; используя моляльность, мы можем рассчитать его по формуле, показанной ниже,
∆Тf = Кf m
Здесь,
∆T указывает на изменения, происходящие при температуре замерзания.
m символизирует моляльность принятого раствора
Kf указывает на понижение точки замерзания растворителя, которое всегда постоянно и дается в зависимости от используемых растворителей.
Чтобы лучше понять это, давайте решим пример.
Проблема 1
Рассмотрим в районе Химачал, и хлористый кальций разбрасывают по дорогам, покрытым льдом, чтобы он растопил лед и расчистил заблокированные дороги. Для этой цели они использовали раствор, содержащий 7.08 моль CaCl.2 в 0.6 кг воды?
Решение: дано 7.08 моль CaCl.2 в 600 г (0.6 кг) H2O
Сначала найдем понижение точки замерзания, используя
∆Тf = Кf m
TРешения = Тводы – ∆Тf
m = (моль растворенного вещества / кг растворителя) и К = 1.86°С/м
m = (7.08 моль CaCl) / (600 г H2О)= 11.8 м
∆T =(11.8м) (1.86°С/м) = 21.94°С
TРешения = Тводы – ∆Тf
TРешения = 0.0° C – 21.94 ° C
TРешения = -21.94°С
Температура замерзания вновь полученного раствора составляет -21.94°С.
Какова точка замерзания в градусах Цельсия и Фаренгейта?
Точка замерзания, как правило, может быть выражена в двух температурных шкалах: одна по шкале Фаренгейта, а другая по шкале Цельсия.
- Во-первых, дайте нам знать о температурной шкале Фаренгейта. В этой шкале более низкая температура основана на 32° для точки замерзания воды и более высокая 212° для точки кипения воды; разница между малой и большой температурными точками составляет 180 равных точек.
- Следующей шкалой является шкала Цельсия. В этой шкале нижняя температура основана на 0°C для замерзания. точки воды и выше 100°C для кипения точка воды.
Теперь пришло время понять замораживание точка воды в деталях.
Почему температура замерзания воды?
Как правило, мы знаю, что вода замерзает и точка плавления будет 0°C по шкале Цельсия или 32°F по шкале Фаренгейта.
- Если происходит переохлаждение воды, то температура снижается; еще одна причина снижения температуры замерзания и плавления связана с наличием примесей, что приводит к понижению температуры замерзания.
- Природа атомов, присутствующих в воде, распространяется во время кристаллообразования. Это действие заставляет лед казаться менее плотным, чем вода, заставляя его плавать. Это действие молекул в процессе замерзания вызывает давление, снижающее температуру замерзания воды.
Знать, как нанести точку замерзания на график.
Как найти точку замерзания на графике?
Мы можем легко найти точку замерзания любого раствора, построив график зависимости температуры от времени или через температуру от моляльности.
- После построения значений мы можем провести две прямые линии в верхней и нижней части точки замерзания. Температуру, которая получается на пересечении этих двух линий, можно считать точкой замерзания данного раствора.
- На этом графике мы можем найти понижение точки замерзания, так как считается разницей в температурном диапазоне растворителя и раствора. ΔТf может дать депрессию точки замерзания на участке.
Знать метод расчета температуры замерзания раствора электролита.
Как рассчитать температуру замерзания раствора электролита?
Раствор электролита представляет собой тип раствора, который состоит из таких элементов, как ионы, атомы или молекулы.
- В этом растворе потеря и приобретение электронов делают его проводящим. Можно даже считать эти растворы электролитов ионными растворами, но мы не можем считать электролиты ионами в некоторых крайних случаях.
- Для расчета температуры замерзания раствора электролита можно использовать ту же формулу ∆Tf = Кf м, который используется для расчета точки замерзания с использованием моляльности. Но прежде чем использовать формулу, мы должны проанализировать количество ионов и рассчитать его моляльность. Позже с помощью К.f, мы можем измерить температуру замерзания данного раствора электролита.
Чтобы понять это ясно, давайте решим пример.
Проблема 2
Измерьте температуру замерзания раствора, содержащего 0.624 г CaCl.2 в 165 г H20?
Решение:
O,624 г CaCl2 х (1 моль CaCl2) / (111 г CaCl2)= 0.0056212 моль CaCl2
Fiсначала рассчитайте моляльность раствора хлорида кальция
Моляльность = (0.0056212 моль CaCl2) / (0.165 кг H2O)= 0.034067 моль/кг
CaCl 
0.3406 m 
∆Тf = Кf m
∆Тf = (1.86°C/м) x 0.1085 м
∆Тf = 0.201 ° С
TРешения = Тводы – ∆Тf
TРешения = 0.0°С – 0.201°С
TРешения = –0.201°С
Температура замерзания электролитического раствора составляет -0.201°С.
Часто задаваемые вопросы | FAQs
Как найти температуру замерзания раствора и температуру кипения любого раствора?
Моляльность можно использовать для определения температуры кипения и замерзания любого раствора.
Во-первых, мы должны умножить общее количество частиц, образовавшихся в растворе при его растворении, на моляльность раствора, обозначенную буквой «m». Сделав это, мы получим значение общей концентрации растворенных частиц в растворе. После сравнения этих значений более высокая концентрация раствора приводит к высокой температуре кипения, тогда как более низкое значение соответствует низкой температуре замерзания.
Почему у воды одинаковые температуры плавления и замерзания?
Плавление и замерзание — два разных физических процесса.
Для воды это жидкое вещество с одинаковой температурной точкой как для процесса плавления, так и для процесса замерзания. В процессе замерзания атомы воды теряют энергию, прекращают движение и объединяются в прочную структуру, что приводит к образованию твердого тела. Плавление противоположно замерзанию. Но оба происходят при одной и той же температуре.
Дайте простое определение точки замерзания?
Температура замерзания различна для каждого вещества.
Это температура, при которой рассматриваемая жидкость становится твердой. Как видно в случае точки плавления, давление увеличивается, что постепенно увеличивает температуру замерзания. Для некоторых веществ точка замерзания будет меньше точки плавления в зависимости от природы веществ — например, органические соединения, такие как жиры, смеси и т. д.
Каким методом можно перевести градусы Фаренгейта в градусы Цельсия?
Формула, которая широко используется для преобразования температуры из градусов Фаренгейта в градусы Цельсия, упоминается ниже:
Чтобы перевести шкалу Фаренгейта в шкалу Цельсия, сначала нужно из любого заданного значения температуры вычесть 32, а затем умножить полученные числа на 5556 или на (5/9). Это Формула преобразования F° в C°.
Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
методичка по общей химии.doc
Скачиваний:
223
Добавлен:
17.05.2015
Размер:
2.72 Mб
Скачать
|
1-й |
–
|
|
2-й |
–
|
|
Уравнение |
–
|
|
Изотонический |
– |
Так, в соответствии
со вторым законом Рауля: повышение
температуры кипения или понижение
температуры замерзания разбавленных
растворов неэлектролитов пропорционально
числу частиц растворенного вещества и
не зависит от его природы:
Δtзам.=
К·Сm
, Δtкип.
= Е·Сm,
где Δt– понижение температуры замерзания
или повышение температуры кипения
раствора, ˚С;
К и Е – криоскопическая
и эбулиоскопическая константы
соответственно;
Сm– моляльная концентрация растворенного
вещества, моль/кг.
Таким образом,
указанные формулы позволяют определить
температуры кипения и замерзания
растворов неэлектролитов по их
концентрации, а также находить мольную
массу растворенного вещества по понижению
температуры кипения или замерзания
растворов.
Пример 1. Определите температуру замерзания раствора, содержащего 54 г глюкозы с6н12о6 в 250 г воды. Криоскопическая константа воды равна 1,86.
Решение.
В 250 г воды содержится 54 г глюкозы,
следовательно, в 1000 г ее содержание
составит: 54·1000/250=216 г, что составляет
216/180, или 1,2 моля, так как мольная масса
глюкозы равна 180 г/моль. Вычислим понижение
температуры замерзания:
Δtзам.
= К·Сm
= 1,86·1,2 =
2,23.
Таким образом,
раствор будет замерзать при температуре
–2,23 С.
Контрольные задания.
2-й закон Рауля
-
На сколько градусов
повысится температура кипения воды,
если в 100 г воды растворить 9 г глюкозы
С6Н12О6? -
8 г глюкозы
растворили в 180 мл воды. При какой
температуре замерзнет такой раствор? -
При растворении
0,4 г некоторого вещества в 10 г воды
температура кристаллизации раствора
понижается на 1,240.
Вычислить молекулярную массу растворенного
вещества. -
В каком количестве
воды следует растворить 0,5 кг глицерина
С3Н8О3
для получения раствора с температурой
кристаллизации – 30С? -
Вычислите
процентную концентрацию водного
раствора метанола СН3ОН,
температура кристаллизации которого
-2,79 °С. Криоскопическая константа воды
1,86°. -
При
какой приблизительно температуре будет
кипеть 50 %-ный водный раствор С12Н22О11,
если эбуллиоскопическая константа
воды равна 0,52°? -
Раствор,
содержащий 3,04 г камфары С10Н16О
в 100 г бензола, кипит при +80,714 °С.
Температура кипения бензола +80,2 °С.
Вычислите эбуллиоскопическую константу
бензола. -
Температура
кристаллизации раствора, содержащего
66,3 г некоторого электролита в 500 мл
воды, равна -0,558°С. Вычислите мольную
массу растворенного вещества, если
криоскопическая константа воды равна
1,86°. -
Вычислите
криоскопическую константу уксусной
кислоты, зная, что раствор, содержащий
4,25 г антрацена С4Н10
в 100 г уксусной кислоты, кристаллизуется
при температуре -15,718 °С. Температура
кристаллизации уксусной кислоты + 0,65
°С. -
Раствор,
содержащий 2,7 г фенола С6Н5ОН
в 75 г бензола, замерзает при +3,5°, тогда
как чистый бензол замерзает при 5,5°.
Вычислите криоскопическую константу
бензола. -
В
каком количестве воды (эбуллиоскопическая
константа Н2О
равна 0,52°) следует растворить 23 г
глицерина С3Н8О3,
чтобы получить раствор с температурой
кипения 100,104°? -
При
какой приблизительно температуре будет
кристаллизоваться 40 %-ный раствор
этилового спирта С2Н5ОН,
если криоскопическая константа воды
равна 1,86°? -
Сколько
граммов сахарозы C12H22O11
надо растворить в 100 г воды, чтобы:
а)
понизить ее температуру замерзания на
1°; б) повысить температуру кипения на
1°?
-
Вычислите
мольную массу неэлектролита, зная, что
раствор, содержащий 2,25 г этого вещества
в 250 г Н2О,
кристаллизуется при температуре -0,279
°С. Криоскопическая константа воды
равна 1,86°. -
Вычислите
температуру кипения 15%-го водного
раствора пропилового спирта С3Н7ОН.
Эбуллиоскопическая константа воды
равна 0,52º. -
Температура
кипения ацетона 56,1ºС, а его эбуллиоскопическая
константа равна 1,73. Вычислить температуру
кипения 8%-го раствора глицерина С3Н6О3
в ацетоне. -
Вычислите
температуру кристаллизации 2%-го раствора
этилового спирта С2Н5ОН.
Криоскопическая константа воды 1,86º. -
При
растворении 4,86г серы в 60г бензола
температура кипения его повысилась на
0,81º. Сколько атомов содержит молекула
серы в этом растворе? Эбуллиоскопическая
константа бензола равна 2,57º. -
Определите
температуру замерзания раствора,
содержащего мочевину (NН2)2СО
массой 0,625г в воде массой 50г. Криоскопическая
константа воды равна 1,86º -
Сколько
граммов мочевины (NН2)2СО
следует растворить в 75г воды, чтобы
температура кристаллизации получилась
0,456? Криоскопическая константа воды
1,86º
1- й Закон Рауля.
Уравнение Вант – Гоффа.
-
При 200
С осмотическом давление
осм
водного раствора некоторого электролита
равно 4,38*105Па.
Чему равноосм
если раствор разбавить в три раза, а
температуру повысить до 400С? -
Осмотическое
давление раствора, в 250 мл которого
содержится 2,3 г растворенного
неэлектролита, при 270С
равно 249 кПа. Вычислите молярную массу
растворенного вещества. -
Чему равна масса
этилового спирта, содержащегося в 1 л
раствора, если этот раствор при 200
С изотоничен раствору анилинаC6H5NH2
, в 4 л которого содержится 18,6 г анилина? -
Как изменится
осмотическое давление раствора
неэлектрлита концентрации 0,5 моль/л
при его нагревании от 250С
до 750С? -
Будет ли изотоничены
водные растворы глюкозы и этилового
спирта, если их массовые доли составляют
15% для глюкозы и 5 для спирта? -
Какова масса
растворенного в 1,5 л раствора анилина
C6H5NH2
, если осматическое давление такого
раствора при 170С
равно 193кПа? -
Рассчитайте
осм
при 200С:
а) сахарозы С12Н22О11;
б) глюкозы в С6Н12О6
; в)этилового
спирта С2Н5ОН,
содержащих по 72 г соответствующего
вещества в 1 л раствора. В каком случае
осмотическое давление будет наибольшим? -
Найдите молярную
массу неэлектролита, если при растворении
28 г вещества при 270С
осмотическое давление составило 700
кПа. -
При 315 К давлении
насыщенного пара над водой равно 82
кПа. Насколько понизится давление
насыщенного водяного пара при указанной
температуре, если в 540 г воды растворить
36 г глюкозы С6Н12О6
?Чему равно
осмотическое давление такого раствора,
если р=1,01 г/см3? -
Рассчитайте
давление насыщенного пара бензолом
над раствором нафталинаС10Н8
в бензоле при 400С,
если в 400 г раствора содержится 128 г
нафталина, а давление насыщенного пара
чистого бензола при указанной температуре
равно 24144,6 Па. -
Определите
осмотическое давление раствора сахарозы
при 00С,
если при 200С
осмотическое давление этого раствора
равно 1,066*105Па.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Boiling and freezing points of pure substances are well-known and easily looked up. For instance, almost everyone knows that the freezing point of water is 0 degrees Celsius, and the boiling point of water is 100 degrees Celsius. Freezing and boiling points change when matter is dissolved into a liquid; freezing points become lower and boiling points become higher. Dissolving salt into water will have these effects on the freezing and boiling points of the water. Calculating new boiling and freezing points of solutions is relatively easy to do.
Calculating a Change in Freezing Point
Look up the freezing point of the liquid (solvent) for which you are calculating the new freezing point. You can find the freezing point of any chemical on the material safety data sheet that accompanies it. For example, water has a freezing point of 0 degrees Celsius.
Calculate the molal concentration of the solution that will be created after you add your dissolved substance (solute) to the solvent. For instance, consider a solution created by dissolving 0.5 moles of salt into 1 liter (L) of water. One liter of water has a mass of 1 kilogram (kg), so:
Molality = moles of solute / mass of solvent = 0.5 / 1 = 0.5 m
You can obtain the moles of your solute by dividing the number of grams dissolved by its molecular mass (see Resources).
Look up the freezing point depression constant (K) for the solvent you are using. A freezing point depression constant is an experimentally determined number that indicates the degree to which a change in a liquid’s solute concentration affects its freezing point. Water has a freezing point depression constant of 1.86.
Plug your values into the following equation to calculate the new freezing point of your solution:
Freezing point = old freezing point – K x molality
Our water example would look like this:
Freezing point = 0 – 1.86 x 0.5 = -0.93 degrees Celsius
Calculating a Change in Boiling Point
Look up the boiling point of the solvent for which you are calculating the new boiling point. You can find the boiling point for any liquid on the material safety data sheet that accompanies it. For example, water has a boiling point of 100 degrees Celsius.
Calculate the molal concentration of the solution that will be created after you add your solute to the solvent. For instance, consider a solution created by dissolving 0.5 moles of salt into 1 liter (L) of water. One liter of water has a mass of 1 kilogram (kg), so:
Molality = moles of solute / mass of solvent = 0.5 / 1 = 0.5 m
Look up the boiling point elevation constant (K) for the solvent you are using. A boiling point elevation constant is an experimentally determined number that indicates the degree to which a change in a liquid’s solute concentration affects its boiling point. Water has a boiling point elevation constant of 0.512.
Plug your values into the following equation to calculate the new boiling point of your solution:
Boiling point = old boiling point + K x molality
Our water example would look like this:
Boiling point = 100 + 0.512 x 0.5 = 100.256 degrees Celsius
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 сентября 2021 года; проверки требуют 4 правки.
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Первый закон Рауля[править | править код]
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
- Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем), удобнее использовать другую формулировку:
- Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
На поверхности оказывается меньше молекул растворителя, способных испаряться — ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Отклонения от закона Рауля[править | править код]
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями, а противоположные случаи — отрицательными отклонениями.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Второй закон Рауля[править | править код]
Отличие давления паров над раствором от давления паров над чистым растворителем существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Понижение температуры кристаллизации растворов[править | править код]
См. также: понижение точки замерзания (англ. Freezing-point depression)
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около −2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
- Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов[править | править код]
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
- Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Криоскопическая и эбулиоскопическая константы[править | править код]
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно, криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1,86 и 0,52 K·моль−1·кг, соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов[править | править код]
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
-
-
;
-
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Литература[править | править код]
- Стромберг А. Г., Семченко Д. П. Физическая химия — М. : Высшая школа, 1999. — 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия — М. : Мир, 1978. — 645 с.