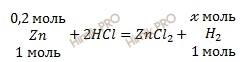Вычислить объем водорода
13,5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H2) составляет 85 % . Вычислить объем водорода, который выделился?
Решение задачи
Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Учитывая, что молярная масса цинка (Zn) равна 65 г/моль (смотри таблицу Менделеева), найдем химическое количество цинка (Zn) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (Zn) = 13,5 / 65 = 0,2 (моль).
Вычислить объем водорода. По уравнению реакции найдем химическое количество водорода (H2) (теоретический выход), который выделяется в ходе реакции:
1 моль Zn вытесняет 1 моль водорода (H2)
0,2 моль Zn вытесняет х моль водорода (H2)
Откуда:
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем водорода, который образуется в ходе реакции:
Получаем:
V теор.(H2) = 0,2 ∙ 22,4 = 4,48 (л).
Вычислим объем водорода практический по формуле:
Получаем:
V практ. (H2) = 85 ⋅ 4,48 / 100 = 3,81 (л).
Ответ:
объем водорода равен 3,81 литра.
Рассчитать объем водорода.
Рассчитать объем водорода (газа) при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем водорода (газа), если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула водорода H₂.
Расчет объема водорода (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 20 г водорода
Рассчитать объем газа: азота, водорода, гелия
Рассчитать объем водорода (газа) при нормальных условиях:
Рассчитать объем водорода (газа):
Теория:
Рассчитать объем водорода (газа) при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(Н₂) = 2·1,008 = 2,016 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем водорода (газа), если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(Н₂) = 2·1,008 = 2,016 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 20 г водорода:
Рассчитайте объем для 20 г водорода при нормальных условиях.
V = m · Vm / M = 20 грамм · 22,4 л/моль / 2,016 г/моль = 222,222 литра.
Рассчитайте объем для 20 г водорода при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 20 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 2,016 г/моль) = 833,462 литра.
Рассчитать объем газа: азота, водорода, гелия
Коэффициент востребованности
1 623
Какие нужны данные чтобы правильно вычислить объем водорода?
Анонимный вопрос
18 декабря 2017 · 2,3 K
Иллюстратор, минералог, любитель старинного костюма. · 29 дек 2017
Если речь идёт о нормальных условиях, то нужно знать массу вступающего в реакцию металла и его молярную массу (её можно посмотреть в таблице Менделеева). Отсюда мы узнаём, сколько моль водорода выделяется; молярный объём водорода, как и любого газа, при н.у. равен 22,4 л/моль. Отсюда легко вычисляется объём.
1,3 K
Комментировать ответ…Комментировать…
Вычислите объём водорода, который можно получить при полном разложении 250 л метана, если объемная доля выхода водорода равна 60 %. Объемы газов измерены при одинаковых условиях. Ответ укажите в литрах с точностью до целых. CH4→C+2H2
Ответ:
300л
Объяснение:
Дано:
V(CH4)=250л
φвых(H2)=60%
Найти:
V(H2)-?
——————–
Для начала найдём теоретический выход продукты реакции:
CH4→C+2H2
Видим что водорода выделилось в два раза больше значит и объём будет в 2 раза больше – 250*2=500л
Vпр=φвых(H2)* Vтеор=0,6*500=300л
Приложения:
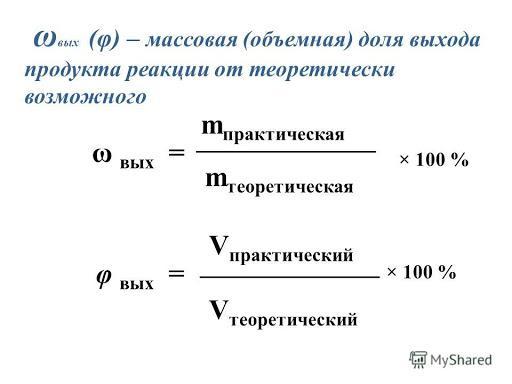
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
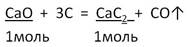 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.