Загрузить PDF
Загрузить PDF
В химии термин “теоретический выход” используется для описания максимального количества продукта, которое может получиться в результате химической реакции. Сначала следует записать сбалансированное химическое уравнение и определить ключевой компонент реакции. После того как вы измерите количество этого компонента, можно будет рассчитать количество продукта реакции. Это и будет теоретический выход продукта реакции. В реальных экспериментах часть продукта обычно теряется из-за неидеальных условий.
-
1
Начните со сбалансированного уравнения химической реакции. Уравнение реакции подобно рецепту. С левой стороны в нем приведены реагенты, а с правой — продукты реакции. В правильно сбалансированном уравнении химической реакции слева и справа стоит одинаковое число атомов каждого элемента.[1]
-
2
Рассчитайте молярные массы реагентов. С помощью таблицы Менделеева или справочника определите молярные массы атомов всех элементов, которые входят в участвующие в реакции соединения. Сложите их, чтобы определить молярную массу каждого реагента. Проделайте это для одной молекулы соединения. Рассмотрим еще раз реакцию между кислородом и глюкозой с образованием углекислого газа и воды:
→
.[2]
-
3
Переведите количество каждого реагента из граммов в моли. В реальном эксперименте известны массы реагентов в граммах. Чтобы перевести их в количество молей, поделите массу каждого реагента на его молярную массу.[3]
-
4
Определите соотношение реагентов. Моль используется в химии для того, чтобы по массе вещества определить количество его молекул. Определив количество молей кислорода и глюкозы, вы узнаете, сколько молекул каждого вещества вступает в реакцию. Чтобы найти соотношение между двумя реагентами, поделите число молей одного реагента на количество молей другого реагента.[4]
- В рассматриваемом примере в начале реакции имеется 1,25 моля кислорода и 0,139 моля глюкозы. Таким образом, отношение количества молекул кислорода к числу молекул глюкозы составляет 1,25 / 0,139 = 9,0. Это означает, что молекул кислорода в 9 раз больше, чем молекул глюкозы.
-
5
Найдите стехиометрическое соотношение реагентов. Посмотрите на сбалансированное уравнение химической реакции. Коэффициенты перед каждой молекулой показывают относительное количество данного вида молекул, необходимое для протекания реакции. Уравнение химической реакции дает так называемое стехиометрическое соотношение реагентов, при котором они будут расходоваться полностью.[5]
- Для данной реакции имеем
. Коэффициенты указывают на то, что на каждую молекулу глюкозы требуется 6 молекул кислорода. Таким образом, стехиометрическое соотношение для этой реакции составляет 6 молекул кислорода / 1 молекула глюкозы = 6,0.
- Для данной реакции имеем
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В большинстве химических реакций один из реагентов расходуется раньше остальных. Этот реагент называют ключевым компонентом реакции. Он определяет, как долго будет продолжаться данная реакция и каким будет теоретический выход продукта реакции. Сравните два рассчитанных соотношения, чтобы определить ключевой компонент реакции:[6]
- В рассматриваемом примере начальное количество молей кислорода в 9 раз превышает число молей глюкозы. Согласно уравнению, стехиометрическое отношение кислорода к глюкозе составляет 6:1. Следовательно, у нас имеется больше кислорода, чем требуется, поэтому второй реагент, глюкоза, является ключевым компонентом реакции.
Реклама
-
1
Посмотрите на уравнение и определите ожидаемый продукт реакции. Правая часть уравнения содержит продукты реакции. Если уравнение сбалансировано, коэффициенты перед каждым продуктом реакции показывают его относительное количество в молях. Они соответствуют теоретическому выходу продуктов реакции в том случае, если взять стехиометрическое соотношение реагентов.[7]
-
2
Запишите количество молей ключевого компонента реакции. Всегда следует сравнивать число молей реагента с количеством молей продукта реакции. Сравнение их масс не даст правильного результата.[8]
- В рассматриваемом примере ключевым компонентом реакции является глюкоза. Расчеты молярной массы показали, что 25 граммов глюкозы соответствуют 0,139 моля.
-
3
Сравните соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению и поделите количество молекул ожидаемого продукта на число молекул ключевого компонента реакции.
-
4
Умножьте найденное отношение на количество ключевого компонента реакции в молях. В результате вы получите теоретический выход ожидаемого продукта реакции в молях.
- В рассматриваемом примере 25 граммов глюкозы соответствуют 0,139 моля. Отношение углекислого газа к глюкозе равно 6:1. То есть ожидается, что из каждого моля глюкозы получится шесть молей углекислого газа.
- Теоретический выход углекислого газа составляет (0,139 моля глюкозы) x (6 молей углекислого газа / 1 моль глюкозы) = 0,834 моля углекислого газа.
-
5
Переведите полученный результат в граммы. Это обратно тому, что вы делали, когда в самом начале вычисляли количество молей реагента. Если известно ожидаемое число молей, достаточно умножить его на молярную массу продукта реакции, чтобы получить его теоретический выход в граммах.[9]
- В нашем примере молярная масса CO2 составляет около 44 г/моль (молярная масса углерода ~12 г/моль, кислорода ~16 г/моль, в итоге имеем 12 + 16 + 16 = 44).
- Умножьте 0,834 моля CO2 x 44 г/моль CO2 = ~36,7 грамма. Таким образом, теоретический выход продукта реакции равен 36,7 грамма CO2.
-
6
При желании проделайте такие же вычисления для других продуктов реакции. Во многих экспериментах интерес представляет лишь один продукт реакции. Однако если вы хотите найти теоретический выход второго продукта, просто повторите вычисления.
- В нашем примере вторым продуктом реакции является вода,
. Согласно сбалансированному уравнению реакции, из 6 молекул глюкозы получается 6 молекул воды. Это соответствует соотношению 1:1. Таким образом, если в начале реакции имеется 0,139 моля глюкозы, в конце должно получиться 0,139 моля воды.
- Умножьте количество молей воды на ее молярную массу. Молярная масса воды составляет 2 + 16 = 18 г/моль. В результате получаем 0,139 моля H2O x 18 г/моль H2O = ~2,50 грамма. Таким образом, в данном эксперименте теоретический выход воды составит 2,50 грамма.
Реклама
- В нашем примере вторым продуктом реакции является вода,
Об этой статье
Эту страницу просматривали 23 616 раз.
Была ли эта статья полезной?
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Перед проведением химических реакций полезно знать, сколько продукта будет произведено с заданным количеством реагентов. Это известно как теоретическая доходность . Это стратегия, которую следует использовать при вычислении теоретического выхода химической реакции. Ту же стратегию можно применить для определения количества каждого реагента, необходимого для производства желаемого количества продукта.
Содержание
- Расчет теоретического выхода образца
- Расчет реагента, необходимого для получения заданного количества продукта
- Краткий обзор теоретической доходности
- Источники
Расчет теоретического выхода образца
10 граммов газообразного водорода сжигаются в присутствии избытка газообразного кислорода для получения воды. Сколько воды производится?
Реакция, при которой газообразный водород соединяется с газообразным кислородом с образованием воды:
H 2 (g) + O 2 (g) → H 2 O (l )
Шаг 1. Убедитесь, что ваши химические уравнения являются сбалансированными уравнениями.
Приведенное выше уравнение не сбалансировано. После балансировки уравнение принимает следующий вид:
2 H 2 (g) + O 2 (g) → 2 H 2 O (l)
Шаг 2: Определите мольные отношения между реагентами и продуктом.
Это значение является мостом между реагентом и продуктом.
Мольное соотношение – это стехиометрическое соотношение между количеством одного соединения и количеством другого соединения в реакции. Для этой реакции на каждые два моля использованного газообразного водорода получается два моля воды. Молярное соотношение между H 2 и H 2 O составляет 1 моль H 2 /1 моль H 2 O.
Шаг 3: Рассчитайте теоретический выход реакции.
Теперь достаточно информации для определения теоретической доходности. Используйте стратегию:
- Используйте молярную массу реагента для преобразования граммов реагента в моль реагента
- Используйте молярное соотношение между реагентом и продуктом для преобразования молей реагента в моли продукта
- Используйте молярную массу продукта для преобразования молей продукта в граммы продукта.
В форме уравнения:
граммы продукта = граммы реагента x (1 моль реагента/молярная масса реагента) x (мольное соотношение продукт/реагент) x (молярная масса продукта/1 моль продукта)
Теоретический выход нашей реакции рассчитывается с использованием:
- молярная масса H 2 газа = 2 грамма
- молярная масса H 2 O = 18 граммов
граммов H 2 O = граммы H 2 x (1 моль H 2 /2 грамма H 2 ) x (1 моль H 2 O/1 моль H 2 ) x (18 граммов H 2 O /1 моль H 2 O)
У нас было 10 граммов H 2 газа, поэтому:
граммов H 2 O = 10 г H 2 x (1 моль H 2 /2 г H 2 ) x (1 моль H 2 O/1 моль H 2 ) x (18 г H 2 O/1 моль H 2 O)
Все юни ts, кроме граммов H 2 O, компенсируются, оставляя:
граммы H 2 O = (10 x 1/2 x 1 x 18) граммов H 2 O
граммов H 2 O = 90 граммов H 2 O
Теоретически десять граммов газообразного водорода с избытком кислорода производят 90 граммов воды.
Расчет реагента, необходимого для получения заданного количества продукта
Эту стратегию можно немного изменить, чтобы рассчитать количество реагентов, необходимых для производства заданного количества продукта. Давайте немного изменим наш пример: сколько граммов газообразного водорода и газообразного кислорода необходимо для производства 90 граммов воды?
Мы знаем количество водорода, необходимое для первый пример, но для расчета:
граммы реагента = граммы продукта x (1 моль продукта/молярная масса продукта) x (мольное соотношение реагент/продукт ) x (граммы реагента/молярная масса реагента)
Для газообразного водорода:
граммов H 2 = 90 граммов H 2 O x (1 моль H 2 O/18 г) x (1 моль H 2 /1 моль H 2 O) x (2 г H 2 /1 моль H 2 )
граммы H 2 = (90 x 1/18 x 1 x 2) граммов H 2 граммов H 2 = 10 граммов H 2
Это согласуется с первым примером. Чтобы определить необходимое количество кислорода, необходимо мольное отношение кислорода к воде. На каждый моль использованного газообразного кислорода получается 2 моля воды. Молярное соотношение газообразного кислорода и воды составляет 1 моль O 2 /2 моль H 2 O..
Уравнение для граммов O 2 принимает следующий вид:
граммов O 2 = 90 граммов H 2 O x (1 моль H 2 O/18 г) x (1 моль O 2 /2 моль H 2 O) x (32 г O 2 /1 моль H 2)
граммов O 2 = (90 x 1/18 x 1 /2 x 32) грамма O 2
граммов O 2 = 80 граммов O 2
Для производства 90 граммов воды необходимо 10 граммов газообразного водорода и 80 граммов газообразного кислорода.
Теоретические расчеты выхода просты, если у вас есть сбалансированные уравнения для определения мольных соотношений, необходимых для связывания реагентов и продукта.
Краткий обзор теоретической доходности
- Сбалансируйте уравнения.
- Найдите мольное соотношение между реагентами и продукт.
- Рассчитайте, используя следующую стратегию: Преобразование rt граммов в моль, используйте молярное соотношение для мостиковых продуктов и реагентов, а затем преобразуйте моль обратно в граммы. Другими словами, поработайте с родинками, а затем преобразуйте их в граммы. Не работайте с граммами и предполагайте, что вы получите правильный ответ.
Для получения дополнительных примеров изучите теоретическую задачу о выходе и водную решение проблем с примером химической реакции.
Источники
- Петруччи, Р.Х., Харвуд, WS и Херринг, Ф. (2002) Общая химия , 8-е издание. Прентис Холл. ISBN 0130143294.
- Vogel, A. I .; Tatchell, A.R .; Furnis, B.S .; Hannaford, A.J .; Смит, П. У. Г. (1996) Учебник практической органической химии Фогеля (5-е изд.). Пирсон. ISBN 978-0582462366.
- Уиттен, К.В., Гэйли, К.Д. и Дэвис Р. (1992) Общая химия , 4-е издание. Издательство колледжа Сондерс. ISBN 0030723736.
Download Article
Download Article
The theoretical yield is a term used in chemistry to describe the maximum amount of product that you expect a chemical reaction could create. You need to begin with a [Balance-Chemical-Equations|balanced chemical equation]] and define the limiting reactant. When you measure the amount of that reactant that you will be using, you can calculate the amount of product. This is the theoretical yield of the equation. To learn how to calculate theoretical yield using the theoretical yield formula, keep reading!
-
1
Start with a balanced chemical equation. A chemical equation is like a recipe. It shows the reactants (on the left side) reacting to form products (on the right side). A properly balanced equation will show the same number of atoms going into the equation as reactants as you have coming out in the form of products.[1]
-
2
Calculate the molar mass of each reactant. Using the periodic table or some other reference, look up the molar mass of each atom in each compound. Add them together to find the molar mass of each compound of reactant. Do this for a single molecule of the compound.[2]
Consider again the equation of converting oxygen and glucose into carbon dioxide and water:→
Advertisement
-
3
Convert the amount of each reactant from grams to moles. For an actual experiment, you will know the mass in grams of each reactant that you are using. Divide this value by that compound’s molar mass to convert the amount to moles.[3]
-
4
Determine the molar ratio of the reactants. A mole is a tool used in chemistry to count molecules, based on their mass. By determining the number of moles of both oxygen and glucose, you know how many molecules of each you are starting with. To find the ratio between the two, divide the number of moles of one reactant by the number of moles of the other.[4]
- In this example, you are starting with 1.25 moles of oxygen and 0.139 moles of glucose. Thus, the ratio of oxygen to glucose molecules is 1.25 / 0.139 = 9.0. This ratio means that you have 9 times as many molecules of oxygen as you have of glucose.
-
5
Find the ideal ratio for the reaction. Look at the balanced equation for the reaction. The coefficients in front of each molecule tell you the ratio of the molecules that you need for the reaction to occur. If you use exactly the ratio given by the formula, then both reactants should be used equally.[5]
- For this reaction, the reactants are given as
. The coefficients indicate that you need 6 oxygen molecules for every 1 glucose molecule. The ideal ratio for this reaction is 6 oxygen / 1 glucose = 6.0.
- For this reaction, the reactants are given as
-
6
Compare the ratios to find the limiting reactant. In most chemical reactions, one of the reactants will be used up before the others. The one that gets used up first is called the limiting reactant. This limiting reactant determines how long the chemical reaction can take place and the theoretical yield you can expect. Compare the two ratios you calculated to identify the limiting reactant:[6]
- In this example, you are beginning with 9 times as much oxygen as glucose, when measured by number of moles. The formula tells you that your ideal ratio is 6 times as much oxygen as glucose. Therefore, you have more oxygen than required. Thus, the other reactant, glucose in this case, is the limiting reactant.
Advertisement
-
1
Review the reaction to find the desired product. The right side of a chemical equation shows the products created by the reaction. The coefficients of each product, if the reaction is balanced, tells you the amount to expect, in molecular ratios. Each product has a theoretical yield, meaning the amount of product you would expect to get if the reaction is perfectly efficient.[7]
-
2
Write down the number of moles of your limiting reactant. You must always compare moles of reactant to moles of product. If you try to compare the mass of each, you will not reach the correct results.[8]
- In the example above, glucose is the limiting reactant. The molar mass calculations found that the initial 25g of glucose are equal to 0.139 moles of glucose.
-
3
Compare the ratio of molecules in product and reactant. Return to the balanced equation. Divide the number of molecules of your desired product by the number of molecules of your limiting reactant.[9]
-
4
Multiply the ratio by the limiting reactant’s quantity in moles. The answer is the theoretical yield, in moles, of the desired product.[10]
- In this example, the 25g of glucose equate to 0.139 moles of glucose. The ratio of carbon dioxide to glucose is 6:1. You expect to create six times as many moles of carbon dioxide as you have of glucose to begin with.
- The theoretical yield of carbon dioxide is (0.139 moles glucose) x (6 moles carbon dioxide / mole glucose) = 0.834 moles carbon dioxide.
-
5
Convert the result to grams. This is the reverse of your earlier step of calculating the number of moles or reactant. When you know the number of moles that you expect, you will multiply by the molar mass of the product to find the theoretical yield in grams.[11]
- In this example, the molar mass of CO2 is about 44 g/mol. (Carbon’s molar mass is ~12 g/mol and oxygen’s is ~16 g/mol, so the total is 12 + 16 + 16 = 44.)
- Multiply 0.834 moles CO2 x 44 g/mol CO2 = ~36.7 grams. The theoretical yield of the experiment is 36.7 grams of CO2.
-
6
Repeat the calculation for the other product if desired. In many experiments, you may only be concerned with the yield of one product. If you wish to find the theoretical yield of both products, just repeat the process.
- In this example, the second product is water,
. According to the balanced equation, you expect 6 molecules of water to come from 1 molecule of glucose. This is a ratio of 6:1. Therefore, beginning with 0.139 moles of glucose should result in 0.834 moles of water.
- Multiply the number of moles of water by the molar mass of water. The molar mass is 2 + 16 = 18 g/mol. Multiplying by the product, this results in 0.834 moles H2O x 18 g/mol H2O = ~15 grams. The theoretical yield of water for this experiment is 15 grams.
- In this example, the second product is water,
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
Doesn’t one molecule of glucose produce six molecules of water, not one?
Yes. One molecule of glucose plus six molecules of oxygen = six molecules of water plus six molecules of carbon dioxide.
-
Question
What should I do if there is more than one reactant?
Find out which of the reactants is the “limiting” reactant and use that to calculate the theoretical yield. This can be done using Part 1 of this article.
-
Question
What should I do if the reactants have the same number of moles?
That’s not a problem! It only means that the molar ratio of your reactants is 1. In the next step, you need to compare it to the ideal molar ratio from your chemical equation to find the limiting reactant and continue as described in the article.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
References
About This Article
Article SummaryX
To calculate theoretical yield, start by finding the limiting reactant in the equation, which is the reactant that gets used up first when the chemical reaction takes place. Then, write down the number of moles in the limiting reactant. Next, divide the number of molecules of your desired product by the number of molecules of your limiting reactant to find the ratio of molecules between them. Then, multiply the ratio by the limiting reactant’s quantity in moles. Finally, convert your answer to grams. To learn how to determine the limiting reactant in the equation, continue reading the article!
Did this summary help you?
Thanks to all authors for creating a page that has been read 987,129 times.
Reader Success Stories
-
Cold_ Lobster
May 5, 2022
“This explained it better than my actual chemistry teacher!”
Did this article help you?
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
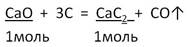 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.



























