Загрузить PDF
Загрузить PDF
В химии термин “теоретический выход” используется для описания максимального количества продукта, которое может получиться в результате химической реакции. Сначала следует записать сбалансированное химическое уравнение и определить ключевой компонент реакции. После того как вы измерите количество этого компонента, можно будет рассчитать количество продукта реакции. Это и будет теоретический выход продукта реакции. В реальных экспериментах часть продукта обычно теряется из-за неидеальных условий.
-
1
Начните со сбалансированного уравнения химической реакции. Уравнение реакции подобно рецепту. С левой стороны в нем приведены реагенты, а с правой — продукты реакции. В правильно сбалансированном уравнении химической реакции слева и справа стоит одинаковое число атомов каждого элемента.[1]
-
2
Рассчитайте молярные массы реагентов. С помощью таблицы Менделеева или справочника определите молярные массы атомов всех элементов, которые входят в участвующие в реакции соединения. Сложите их, чтобы определить молярную массу каждого реагента. Проделайте это для одной молекулы соединения. Рассмотрим еще раз реакцию между кислородом и глюкозой с образованием углекислого газа и воды:
→
.[2]
-
3
Переведите количество каждого реагента из граммов в моли. В реальном эксперименте известны массы реагентов в граммах. Чтобы перевести их в количество молей, поделите массу каждого реагента на его молярную массу.[3]
-
4
Определите соотношение реагентов. Моль используется в химии для того, чтобы по массе вещества определить количество его молекул. Определив количество молей кислорода и глюкозы, вы узнаете, сколько молекул каждого вещества вступает в реакцию. Чтобы найти соотношение между двумя реагентами, поделите число молей одного реагента на количество молей другого реагента.[4]
- В рассматриваемом примере в начале реакции имеется 1,25 моля кислорода и 0,139 моля глюкозы. Таким образом, отношение количества молекул кислорода к числу молекул глюкозы составляет 1,25 / 0,139 = 9,0. Это означает, что молекул кислорода в 9 раз больше, чем молекул глюкозы.
-
5
Найдите стехиометрическое соотношение реагентов. Посмотрите на сбалансированное уравнение химической реакции. Коэффициенты перед каждой молекулой показывают относительное количество данного вида молекул, необходимое для протекания реакции. Уравнение химической реакции дает так называемое стехиометрическое соотношение реагентов, при котором они будут расходоваться полностью.[5]
- Для данной реакции имеем
. Коэффициенты указывают на то, что на каждую молекулу глюкозы требуется 6 молекул кислорода. Таким образом, стехиометрическое соотношение для этой реакции составляет 6 молекул кислорода / 1 молекула глюкозы = 6,0.
- Для данной реакции имеем
-
6
Сравните соотношения, чтобы найти ключевой компонент реакции. В большинстве химических реакций один из реагентов расходуется раньше остальных. Этот реагент называют ключевым компонентом реакции. Он определяет, как долго будет продолжаться данная реакция и каким будет теоретический выход продукта реакции. Сравните два рассчитанных соотношения, чтобы определить ключевой компонент реакции:[6]
- В рассматриваемом примере начальное количество молей кислорода в 9 раз превышает число молей глюкозы. Согласно уравнению, стехиометрическое отношение кислорода к глюкозе составляет 6:1. Следовательно, у нас имеется больше кислорода, чем требуется, поэтому второй реагент, глюкоза, является ключевым компонентом реакции.
Реклама
-
1
Посмотрите на уравнение и определите ожидаемый продукт реакции. Правая часть уравнения содержит продукты реакции. Если уравнение сбалансировано, коэффициенты перед каждым продуктом реакции показывают его относительное количество в молях. Они соответствуют теоретическому выходу продуктов реакции в том случае, если взять стехиометрическое соотношение реагентов.[7]
-
2
Запишите количество молей ключевого компонента реакции. Всегда следует сравнивать число молей реагента с количеством молей продукта реакции. Сравнение их масс не даст правильного результата.[8]
- В рассматриваемом примере ключевым компонентом реакции является глюкоза. Расчеты молярной массы показали, что 25 граммов глюкозы соответствуют 0,139 моля.
-
3
Сравните соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению и поделите количество молекул ожидаемого продукта на число молекул ключевого компонента реакции.
-
4
Умножьте найденное отношение на количество ключевого компонента реакции в молях. В результате вы получите теоретический выход ожидаемого продукта реакции в молях.
- В рассматриваемом примере 25 граммов глюкозы соответствуют 0,139 моля. Отношение углекислого газа к глюкозе равно 6:1. То есть ожидается, что из каждого моля глюкозы получится шесть молей углекислого газа.
- Теоретический выход углекислого газа составляет (0,139 моля глюкозы) x (6 молей углекислого газа / 1 моль глюкозы) = 0,834 моля углекислого газа.
-
5
Переведите полученный результат в граммы. Это обратно тому, что вы делали, когда в самом начале вычисляли количество молей реагента. Если известно ожидаемое число молей, достаточно умножить его на молярную массу продукта реакции, чтобы получить его теоретический выход в граммах.[9]
- В нашем примере молярная масса CO2 составляет около 44 г/моль (молярная масса углерода ~12 г/моль, кислорода ~16 г/моль, в итоге имеем 12 + 16 + 16 = 44).
- Умножьте 0,834 моля CO2 x 44 г/моль CO2 = ~36,7 грамма. Таким образом, теоретический выход продукта реакции равен 36,7 грамма CO2.
-
6
При желании проделайте такие же вычисления для других продуктов реакции. Во многих экспериментах интерес представляет лишь один продукт реакции. Однако если вы хотите найти теоретический выход второго продукта, просто повторите вычисления.
- В нашем примере вторым продуктом реакции является вода,
. Согласно сбалансированному уравнению реакции, из 6 молекул глюкозы получается 6 молекул воды. Это соответствует соотношению 1:1. Таким образом, если в начале реакции имеется 0,139 моля глюкозы, в конце должно получиться 0,139 моля воды.
- Умножьте количество молей воды на ее молярную массу. Молярная масса воды составляет 2 + 16 = 18 г/моль. В результате получаем 0,139 моля H2O x 18 г/моль H2O = ~2,50 грамма. Таким образом, в данном эксперименте теоретический выход воды составит 2,50 грамма.
Реклама
- В нашем примере вторым продуктом реакции является вода,
Об этой статье
Эту страницу просматривали 23 506 раз.
Была ли эта статья полезной?
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
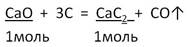 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Содержание
- Как найти теоретический выход химия
- Расчет практического выхода продукта реакции в химии
- Выход продукта химической реакции
- Понятие селективности и материального баланса
- Как увеличить выход продукта реакции, способы расчета, формулы
- Как рассчитать теоретический выход продукта реакции, примеры задач
Как найти теоретический выход химия
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Найти: -?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи
=80% или 0,8
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи | |
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ | ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции | 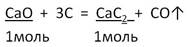 |
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
, следовательно
6. Определяем массу (объём) реагента по формуле:
m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2 . Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3 . Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4 . К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Источник
Расчет практического выхода продукта реакции в химии
Выход продукта химической реакции
Выход продукта химической реакции — масса продукта, образовавшегося в результате реакции.
- теоретическим — рассчитанным по уравнению реакции;
- фактическим — полученным реально в процессе химической реакции.
Если эти два показателя равны, то считают, что реакция идет с количественным выходом. Такую реакцию называют стехиометрической.
Но большинство реакции на практике не дают количественного выхода по следующим причинам:
- при взаимодействии органических соединений образуются побочные продукты;
- обратимость реакций;
- реагенты имеют примеси;
- потери газообразных веществ, если оборудование недостаточно герметично;
- потери при кристаллизации и др.
Поэтому для определения эффективности реакции было введено понятие:
относительный выход = ф а к т и ч е с к и й = п р а к т и ч е с к и й в ы х о д т е о р е т и ч е с к и й в ы х о д × 100 % .
Для реакции с количественным выходом относительный выход равен 100%.
Выход продукта реакции определяется двумя параметрами: селективностью и степенью превращения.
Понятие селективности и материального баланса
Селективность — критерий, с помощью которого в химии определяют отношение массы определенного (целевого) продукта к общей массе полученных продуктов.
Степень превращения (конверсии) показывает отношение количества исходного реагента (обычно более дорогостоящего) к количеству полученного целевого продукта.
Например, этот критерий позволяет оценить, какое количество метана C H 4 превратилось в угарный газ CO при конверсии водяным паром. Может быть выражена не только через количество вещества, но и через любые пропорциональные ему величины: массу, объем.
Для обеспечения максимального выхода целевого продукта недостаточно только высокой степени конверсии (значительное количество вещества может вступить в реакцию, но не участвовать в образовании целевого продукта) или хорошей селективности, выход продукта определяется совокупностью этих факторов.
Например, N0 моль исходного вещества А вступило в реакцию, из них прореагировало Nx моль со следующим распределением:
- на образование продукта B было израсходовано NB моль;
- на образование побочных продуктов C и D было израсходовано NC и ND моль вещества A.
Тогда селективность S реакции по целевому продукту B составит:
Степень превращения реагента A для данного примера будет равна соотношению между числом моль прореагировавшего вещества A к общему числу моль, которые были затрачены на реакцию:
Выход продукта ηB в этом примере будет равен соотношению между числом моль реагента A, пошедшего на образование целевого продукта, к числу моль, которые были затрачены на реакцию:
Таким образом, между выходом продукта B, селективностью процесса относительно образования B и степенью превращения исходного реагента A существует взаимосвязь:
Селективность подразделяют на:
- полную (интегральную) — соотношение между количеством полученного целевого продукта и всех продуктов процесса;
- мгновенную (дифференциальную) — соотношение между скоростью целевой реакции и скоростью расходования исходного реагента.
Селективность важна для катализаторов, чтобы избирательно увеличивать скорость целевой реакции при наличии нескольких побочных. Высокой селективностью отличаются ферменты (95 — 100%), для гетерогенных катализаторов этот показатель достигает 70%. Гомогенные занимают промежуточное значение.
Выход, степень превращения и селективность — величины безразмерные, учитываются при составлении материального баланса процесса.
Материальный баланс (баланс масс) выводится на основании закона сохранения массы вещества.
Для химических процессов можно сформулировать его так: суммарная масса исходных веществ в начале реакции должна быть равна суммарной массе всех полученных продуктов (целевых и побочных), включая неиспользованные реагенты и растворители, в конце реакции.
Материальный баланс составляется с расчетом расхода реагентов и полученных продуктов на единицу основного продукта. Поскольку на производство вещества поступают в виде смесей, при составлении материального баланса учитывается масса всех компонентов отдельно для твердой, жидкой и газовой фаз. Для процессов, которые идут в несколько стадий, баланс составляется для каждой стадии отдельно.
Материальный баланс, как и выход продукта, может быть:
- теоретическим — определяют по результатам расчетов химиков-технологов на основании экспериментальных выработок;
- фактическим — получают в ходе производственного процесса. Всегда меньше теоретического из-за потерь.
Как увеличить выход продукта реакции, способы расчета, формулы
Фактический выход конкретного химического процесса можно увеличивать при регулировании следующих факторов:
- температура;
- давление;
- скорость перемешивания;
- присутствие катализатора;
- чистота исходных материалов;
- эффективность процесса извлечения продуктов;
- использование одного или нескольких реагентов в избытке и др.
Для каждой химической реакции, лежащей в основе промышленного производства, необходимо эффективно использовать ресурсы, максимально повысить выход целевого продукта, но при этом он должен быть надлежащего качества и в достаточном количестве. Для это обязательно рассчитывают выход продукта.
Расчет выхода продукта
- массовая доля выхода продукта ω (омега) = m п р m т е о р × 100 % ;
- объемная доля выхода продукта ω (омега) = V г а з п р V г а з т е о р × 100 % .
Например, если процент выхода равен ω=80%, это означает, что количество полученного продукта составляет 80% от теоретически возможного.
Выход продукта реакции можно выразить также через коэффициент, обозначается буквой η (эта):
Выход продукта η = ν п р ν т е о р = m п р m т е о р = V г а з п р V г а з т е о р .
Как рассчитать теоретический выход продукта реакции, примеры задач
Алгоритм расчета теоретического выхода ηтеор приведен на примере решения следующей задачи:
При взаимодействии 9,84 г оксида железа (III) и 12 г монооксида углерода СО образовались железо и углекислый газ. Рассчитайте теоретический выход (в молях и граммах) железа.
1. Записать уравнение химической реакции:
- F e 2 O 3 + C O → F e + C O 2 ↑ ;
- реагенты (исходные вещества) → продукты реакции.
2. Расставить коэффициенты так, чтобы в обеих частях уравнения количество атомов каждого элемента было одинаковым:
- F e 2 O 3 + 3 C O → 2 F e + 3 C O 2 ↑ ;
- 2 атома Fe, 3 атома C, 6 атомов O = 2 атома Fe, 3 атома C, 6 атомов O.
3. Вычислить молярные массы реагентов и целевого продукта (для взятого примера — Fe). Из таблицы Менделеева или справочника узнать атомные массы Ar всех составляющих элементов и посчитать молярные массы М 1 моля каждого исходного вещества и целевого продукта:
- M ( F e 2 O 3 ) = A r ( F e ) × 2 + A r ( O ) × 3 = 56 × 2 + 16 × 3 = 160 г / м о л ь ,
- M ( C O ) = A r ( C ) + A r ( O ) = 12 + 16 = 28 г / м о л ь ,
- M ( F e ) = A r ( F e ) = 56 г / м о л ь .
4. Найти количество вещества ν каждого реагента:
- ν ( F e 2 O 3 ) = m F e 2 O 3 M F e 2 O 3 = 9 , 84 г 160 г / м о л ь = 0 , 0615 м о л ь ;
- ν ( C O ) = m C O M C O = 12 г 28 г / м о л ь = 0 , 43 м о л ь .
Примечание
Если в условии задачи указана масса только одного реагента, то он считается ключевым, и все дальнейшие расчеты выполняются по нему; ν второго исходного вещества вычислять не нужно (пункт 5 пропускается).
5. Для определения ключевого компонента — реагента, который расходуется быстрее остальных, следует определить продолжительность реакции и теоретический выход:
- составляется соотношение числа молей одного реагента к числу молей другого:
ν ( C O ) ν ( F e 2 O 3 ) = 0 , 43 м о л ь 0 , 0615 м о л ь = 7 .
Это говорит о том, что количество используемого для реакции CO в 7 раз больше, чем количество F e 2 O 3 ;
- сравниваются стехиометрические коэффициенты при реагентах, которые показывают, сколько молекул каждого вещества требуется для проведения реакции:
F e 2 O 3 + 3 C O → 2 F e + 3 C O 2 ↑ .
На одну молекулу F e 2 O 3 должно приходится 3 молекулы CO.
Можно сделать заключение, что CO взят в избытке и расчет следует вести по F e 2 O 3 , который является ключевым компонентом.
6. Fe 2 O 3 160 г / м о л ь 9 . 84 г + 3 CO 28 г / м о л ь 12 г → 2 Fe 56 г / м о л ь m т е о р г + 3 C O 2 ↑ .
По закону кратных соотношений, чтобы найти теоретическое количество целевого продукта νтеор, нужно количество расчетного компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
νтеор= 0,0615 моль :1 × 2= 0,123 моль — это и есть теоретический выход продукта.
7. Масса продукта (Fe), соответствующая данному количеству вещества, будет равна:
m т е о р = ν т е о р × M п р о д у к т а = 0 , 0615 м о л ь × 56 г / м о л ь = 6 , 888 г .
Если в задаче требуется рассчитать теоретический выход одного или нескольких побочных продуктов, то для каждого из них вычисляется молярная масса (пункт 3), а затем последовательность действий повторяется с 6 пункта.
На практике также важен расчет фактического выхода продукта ηпракт или массовой доли выхода продукта ω в %.
| 1. Записываем краткое условие задачи | |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
| 5. Находим количество вещества реагента по УХР |
Известно: масса реагента (одного или нескольких) и масса продукта.
Нужно найти: практический выход ηпракт или массовую (объемную) долю ω в % одного или нескольких продуктов реакции.
Пример. При взаимодействии 6,9 г натрия с 100 г воды получили 3 л водорода (н.у.). Вычислите объёмную долю выхода газа (в %).
1. Записать уравнение реакции: N a + H 2 O → N a O Н + H 2 ↑.
2. Расставить коэффициенты: 2 N a + 2 H 2 O → 2 N a O Н + H 2 ↑ .
3. Вычислить молярные массы реагентов и целевого продукта:
- M ( N a ) = 23 г / м о л ь ;
- M ( Н 2 O ) = M ( H ) × 2 + M ( O ) = 1 × 2 + 16 = 18 г / м о л ь .
Так как нужно узнать объемную долю выхода продукта, то вместо M ( H 2 ) берется значение молярного объема V m ( H 2 ) = 22 , 4 л / м о л ь (по закону Авогадро, 1 моль любого газа (н.у) занимает объем 22,4 л).
4. Вычислить количество вещества для реагентов:
- ν ( N a ) = m ( N a ) M ( N a ) = 6 , 9 г 23 г / м о л ь = 0 , 3 м о л ь ;
- ν ( H 2 O ) = m ( H 2 O ) M ( H 2 O ) = 100 г 18 г / м о л ь = 5 , 6 м о л ь ;
5. Определить ключевой компонент:
- соотношение ν ( H 2 O ) ν ( N a ) = 5 , 6 м о л ь 0 , 3 м о л ь = 18 , 7 ;
- стехиометрические коэффициенты у обоих реагентов = 2, следовательно, воды взято в избытке, расчет будет по натрию.
6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
ν т е о р ( Н 2 ) = 0 , 3 : 2 × 1 = 0 , 15 м о л ь .
7. Теоретический объем V т е о р ( Н 2 ) = ν т е о р ( Н ) × V m ( H 2 ) = 0 , 15 м о л ь × 22 , 4 л / м о л ь = 3 , 36 л .
8. Объемная доля выхода продукта: ω = V п р V т е о р × 100 % = 3 л 3 , 36 л × 100 % = 89 , 3 %
Известно: Масса реагента и практический выход продукта.
Нужно найти: Массу продукта реакции.
Пример. Какой объем аммиака в литрах (н.у.) можно получить при взаимодействии 13,4 моль водорода с азотом, если практический выход η ( N H 3 ) = 0 , 43 ?
1 + 2 . N 2 + 3 H 2 → 2 N H 3 .
Пункты 3 и 4 не нужны, так как в условии уже указано количество вещества реагента:
- ν ( H 2 ) = 13 , 4 м о л ь ;
- V m ( Н 2 ) = 22 , 4 л / м о л ь ;
- V m ( N Н 3 ) = 22 , 4 л / м о л ь .
Поскольку дано количество вещества только одного реагента, то расчет ведется по нему. Пункт 5 пропускаем.
6. Чтобы найти теоретическое количество целевого продукта νтеор, нужно количество ключевого компонента поделить на коэффициент при нем и умножить на коэффициент при целевом продукте:
ν т е о р ( N Н 3 ) = 13 , 4 : 3 × 2 = 8 , 9 м о л ь .
7. η = ν п р ν т е о р , тогда фактическое количество вещества νпракт= η×νтеор= 0,43×8,9 моль = 3,83 моль.
8. Фактический объем Vпракт= νпракт × Vm= 3,83 моль × 22,4 л/моль= 85,8 л.
Известно: Масса продукта и его практический выход.
Нужно найти: массу реагента.
Пример. Сколько граммов водорода требуется для реакции с углеродом при получении бензола, C6H6, если теоретический выход 105,3 г, а массовая доля выхода равна 95,8%?
1 + 2 . 6 C + 3 H 2 → C 6 H 6 .
3. Вычислить молярные массы реагентов и целевого продукта:
- M ( Н 2 ) = A r × 2 = 1 , 008 × 2 = 2 , 016 г / м о л ь ;
- M m ( C 6 H 6 ) = A r ( C ) × 6 + A r ( H ) × 6 = 12 × 6 + 1 , 008 × 6 = 78 , 05 г / м о л ь .
4. Вычислить mпракт. Так как ω = m п р m т е о р × 100 % , т о m п р а к т = m т е о р × ω / 100 .
m п р а к т ( C 6 H 6 ) = 105 , 3 г × 95 , 8 / 100 = 100 , 9 г .
5. Вычислить количество вещества продукта реакции: ν ( C 6 H 6 ) = m ( C 6 H 6 ) M ( C 6 H 6 ) = 100 , 9 г 78 , 05 г / м о л ь = 1 , 3 м о л ь .
6. Чтобы найти количество реагента, нужно количество продукта реакции разделить на коэффициент при нем и умножить на коэффициент при реагенте:
ν ( H 2 ) = 1 , 3 : 1 × 3 = 3 , 9 м о л ь — количество водорода, необходимое для реакции.
7. Масса водорода m ( H 2 ) = ν ( H 2 ) × M ( Н 2 ) = 3 , 9 м о л ь × 2 , 016 г / м о л ь = 7 , 8 г .
Источник
Adblock
detector
| Тип задачи | Решение (см. Алгоритм) |
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.
Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:
Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4. |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим |
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4. |
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим |
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3. |
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |
































