Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
![]()
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
![]()
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
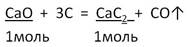 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам
|
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле
|
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Что такое массовая доля в химии? Знаете ли вы ответ? Как находить массовую долю элемента в веществе? Сам процесс вычисления вовсе не так сложен. А вы еще испытываете затруднения в подобных задачах? Тогда вам улыбнулась удача, вы нашли эту статью! Интересно? Тогда скорее читайте, сейчас вы все поймете.
Что такое массовая доля?
Итак, для начала выясним, что такое массовая доля. Как находить массовую долю элемента в веществе, ответит любой химик, так как они часто употребляют этот термин при решении задач или во время пребывания в лаборатории. Конечно, ведь ее расчет – их повседневная задача. Чтобы получить определенное количество того или иного вещества в лабораторных условиях, где очень важен точный расчет и все возможные варианты исхода реакций, необходимо знать всего пару простых формул и понимать суть массовой доли. Поэтому эта тема так важна.

Этот термин обозначается символом “w” и читается как “омега”. Он выражает отношение массы данного вещества к общей массе смеси, раствора или молекулы, выражается дробью или в процентах. Формула расчета массовой доли:
w = m вещества / m смеси.
Преобразуем формулу.
Мы знаем, что m=n*M, где m – масса; n – количество вещества, выраженное в единицах измерения моль; M – молярная масса вещества, выраженная в грамм/моль. Молярная масса численно равна молекулярной. Только молекулярная масса измеряется в атомных единицах масс или а. е. м. Такая единица измерения равна одной двенадцатой доле массы ядра углерода 12. Значение молекулярной массы можно найти в таблице Менделеева.
Количество вещества n нужного объекта в данной смеси, равно индексу, умноженному на коэффициент при данном соединении, что очень логично. Например, чтобы рассчитать количество атомов в молекуле, надо узнать, сколько атомов нужного вещества находится в 1 молекуле = индекс, и умножить это число на количество молекул = коэффициент.
Не стоит бояться таких громоздких определений или формул, в них прослеживается определенная логика, поняв которую, можно даже сами формулы не учить. Молярная масса M равна сумме атомных масс Ar данного вещества. Напомним, что атомная масса – масса 1 атома вещества. То есть исходная формула массовой доли:
w = ( n вещества*M вещества)/m смеси.
Из этого можно сделать вывод, что если смесь состоит из одного вещества, массовую долю которого надо вычислить, то w=1, так как масса смеси и масса вещества совпадают. Хотя смесь априори не может состоять из одного вещества.
Так, с теорией разобрались, но как находить массовую долю элемента в веществе на практике? Сейчас все покажем и расскажем.

Проверка усвоенного материала. Задача легкого уровня
Сейчас мы разберем две задачи: легкого и среднего уровня. Читайте далее!
Необходимо узнать массовую долю железа в молекуле железного купороса FeSO4*7 H2O. Как решить эту задачу? Рассмотрим решение далее.
Решение:
Возьмем 1 моль FeSO4*7 H2O, тогда узнаем количество железа, умножив коэффициент железа на его индекс: 1*1=1. Дан 1 моль железа. Узнаем его массу в веществе: из значения в таблице Менделеева видно, что атомная масса железа 56 а. е. м. = 56 грамм/моль. В данном случае Ar=M. Следовательно, что m железа = n*M = 1 моль* 56 грамм/моль = 56 г.
Теперь нужно найти массу всей молекулы. Она равна сумме масс исходных веществ, то есть 7 моль воды и 1 моль сульфата железа.
m= (n воды* M воды) + (n сульфата железа*M сульфата железа) = (7 моль*(1*2+16) грамм/моль) + (1 моль* (1 моль*56 грамм/моль+1 моль*32 грамм/моль + 4 моль*16 грамм/моль) = 126+152=278 г.
Остается лишь разделить массу железа на массу соединения:
w=56г/278 г=0.20143885~0.2=20%.
Ответ: 20%.
Задача среднего уровня
Решим более сложную задачу. В 500 г воды растворено 34 г нитрата кальция. Нужно найти массовую долю кислорода в полученном растворе.
Решение
Так как при взаимодействии Ca(NO3)2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
Нам нужно найти массовую долю кислорода в растворе. Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде. Для этого посчитаем моль воды по формуле n=m/M.
n воды=500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H2O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO3)2. Для этого узнаем количество самого вещества:
n Ca(NO3)2=34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O= 29.2 моль*16 грамм/моль=467.2 г.
m раствора=m воды + m Ca(NO3)2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O=467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
Решение расчётных задач на
тему:
«
Массовая и объёмная доля выхода продукта реакции от теоретически возможного».
При обучении учащихся решению расчётных задач по химии учителя
сталкиваются с рядом проблем
·
решая задачу, учащиеся не понимают сущности задач и
хода их решения;
·
не анализируют содержание задачи;
·
не определяют последовательность действий;
·
неправильно используют химический язык,
математические действия и обозначение физических величин и др.;
Преодоление этих недостатков является одной из главных целей, который
ставит перед собой учитель, приступая к обучению решению расчетных задач.
Задача учителя состоит в том, чтобы научить учащихся анализировать
условия задач, через составление логической схемы решения конкретной задачи.
Составление логической схемы задачи предотвращает многие ошибки, которые
допускают учащиеся.
Цели урока:
·
формирование умения анализировать условие задачи;
·
формирование умения определять тип расчетной
задачи, порядок действий при ее решении;
·
развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
·
овладеть способами решения химических задач с
использованием понятия “массовая доля выхода продукта реакции от
теоретического”;
·
отработать навыки решения расчетных задач;
·
способствовать усвоению материала, имеющего
отношение к производственным процессам;
·
стимулировать углубленное изучение теоретических
вопросов, интерес к решению творческих задач.
Ход урока
Определяем причину и сущность ситуации, которые описываются в задачах
“на выход продукта от теоретического”.
В реальных химических реакциях масса продукта всегда оказывается меньше
расчетной. Почему?
·
Многие химические реакции обратимы и не доходят до
конца.
·
При взаимодействии органических веществ часто
образуются побочные продукты.
·
При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не вступает в реакции.
·
Часть газообразных веществ может улетучиться.
·
При получении осадков часть вещества может остаться
в растворе.
Вывод:
·
масса теоретическая всегда больше практической;
·
объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%, практический выход всегда меньше
100%.
Количество продукта, рассчитанное по уравнению реакции, – теоретический
выход, соответствует 100%.
Доля выхода продукта реакции (![]() –
–
“этта”) – это отношение массы полученного вещества к массе, которая должна была
бы получиться в соответствии с расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного
вещества и продукта реакции. Определить
выход продукта.
2. Даны массы исходного
вещества и выход продукта реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта. Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3
г хлора, было получено 24,3 г хлорида железа (III). Рассчитайте выход продукта
реакции.
2. Над 16 г серы пропустили водород при нагревании. Определите объем
(н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от
теоретически возможного.
3. Какой объём оксида углерода (II) был взят для восстановления оксида
железа (III), если получено 11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности данных (известные вещества)
– условия задачи (“выход” и т.п.) – и вопроса (вещества, параметры которых
требуется найти). Кроме этого, в ней есть система зависимостей, которые
связывают искомое с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или теоретические, названы в условии
задачи?
5. Какие из данных можно непосредственно использовать для расчётов по
уравнениям реакций, а какие необходимо преобразовать, используя массовую долю
выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически возможного.
1. Запишите уравнение химической реакции и расставьте коэффициенты.
2. Под формулами веществ напишите количество вещества согласно
коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся практическую массу к
теоретической и умножив на 100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен выход продукта.
1. Запишите “дано” и “найти”, запишите уравнение, расставьте
коэффициенты.
2. Найдите теоретическое количество вещества для исходных веществ. n =![]()
3. Найдите теоретическое количество вещества продукта реакции, согласно
коэффициентам.
4. Вычислите теоретические массу или объем продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем продукта реакции (умножьте
массу теоретическую или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны масса продукта реакции и
выход продукта.
1. По известному практическому объёму или массе, найдите теоретический
объём или массу (используя долю выхода продукта).
![]()
2. Найдите теоретическое количество вещества для продукта.
3. Найдите теоретическое количество вещества для исходного вещества,
согласно коэффициентам.
4. С помощью теоретического количества вещества найдите массу или объем
исходных веществ в реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112
л (н.у.) кислорода и получили 760 г оксида серы (VI). Чему равен выход
продукта в процентах от теоретически возможного?
2. При взаимодействии азота и водорода получили 95
г аммиака NH3 с
выходом 35%. Какие объёмы азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком углерода. Определите массу
образовавшегося металла, если выход продукта реакции равен 65%.
Сколько литров аммиака (NH3) образуется при взаимодействии 112
килограмм азота (N2) с водородом (H2)? Выход от теоретически
возможного 80% (нормальные условия).
Решение задачи
Запишем уравнение реакции образования аммиака (NH3):
![]()
Напомню, что под выходом от теоретически возможногопродукта реакции
понимают отношение массы (объема, числа молей) практически полученного вещества
к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
![]()
Выход от теоретически возможного. Учитывая, что молярная
масса азота (N2) равна 28 г/моль (смотри таблицу Менделеева), найдем химическое
количество азота (N2) по формуле, устанавливающей связь между химическим
количеством вещества и массой:
![]()
Получаем:
n (N2) = 112000 /28 = 4000 (моль) = 4 (кмоль).
По уравнению реакции найдем химическое количество аммиака (NH3)
(теоретическое химическое количество вещества), которое выделяется в ходе реакции
образования аммиака (NH3):

из 1 моль N2 образуется 2 моль NH3
из 4000 моль N2 образуется х моль NH3
Откуда:
![]()
Выход от теоретически возможного.
По формуле, устанавливающей связь между химическим количеством вещества
и объемом, вычислим объем аммиака (NH3), который образуется в ходе
реакции:
![]()
Получаем:
V теор.( NH3) = 8000 ∙ 22,4 = 179200 (л).
Вычислим объем аммиака (NH3) практический (выход от
теоретически возможного) по формуле:
![]()
Выход от теоретически возможного.
Получаем:
V практ. (NH3) = 80 ⋅ 179200 / 100 = 143360 (л) = 143,36
(м3).
Ответ:
объем аммиака (NH3) равен 143,36
м3.
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
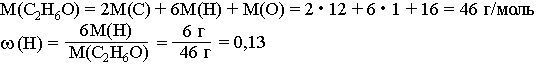
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
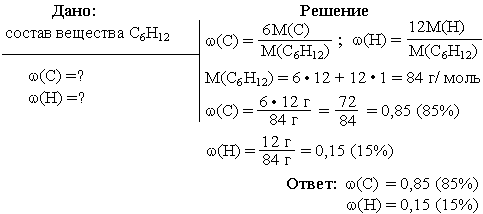
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.

Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции:
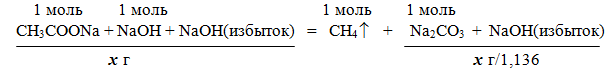

При обучении учащихся решению расчётных задач
по химии учителя сталкиваются с рядом проблем
- решая задачу, учащиеся не понимают сущности
задач и хода их решения; - не анализируют содержание задачи;
- не определяют последовательность действий;
- неправильно используют химический язык,
математические действия и обозначение
физических величин и др.;
Преодоление этих недостатков является одной из
главных целей, который ставит перед собой
учитель, приступая к обучению решению расчетных
задач.
Задача учителя состоит в том, чтобы научить
учащихся анализировать условия задач, через
составление логической схемы решения конкретной
задачи. Составление логической схемы задачи
предотвращает многие ошибки, которые допускают
учащиеся.
Цели урока:
- формирование умения анализировать условие
задачи; - формирование умения определять тип расчетной
задачи, порядок действий при ее решении; - развитие познавательных, интеллектуальных и
творческих способностей.
Задачи урока:
- овладеть способами решения химических задач с
использованием понятия “массовая доля выхода
продукта реакции от теоретического”; - отработать навыки решения расчетных задач;
- способствовать усвоению материала, имеющего
отношение к производственным процессам; - стимулировать углубленное изучение
теоретических вопросов, интерес к решению
творческих задач.
Ход урока
Определяем причину и сущность ситуации,
которые описываются в задачах “на выход
продукта от теоретического”.
В реальных химических реакциях масса продукта
всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят
до конца. - При взаимодействии органических веществ часто
образуются побочные продукты. - При гетерогенных реакциях вещества плохо
перемешиваются, и часть веществ просто не
вступает в реакции. - Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может
остаться в растворе.
Вывод:
- масса теоретическая всегда больше
практической; - объём теоретический всегда больше объёма
практического.
Теоретический выход составляет 100%,
практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению
реакции, – теоретический выход, соответствует 100%.
Доля выхода продукта реакции (![]() – “этта”) – это отношение
– “этта”) – это отношение
массы полученного вещества к массе, которая
должна была бы получиться в соответствии с
расчетом по уравнению реакции.
Три типа задач с понятием “выход продукта”:
1. Даны массы исходного вещества и продукта
реакции. Определить выход продукта.
2. Даны массы исходного вещества и выход продукта
реакции. Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Задачи.
1. При сжигании железа в сосуде, содержащем 21,3 г
хлора, было получено 24,3 г хлорида железа (III).
Рассчитайте выход продукта реакции.
2. Над 16 г серы пропустили водород при
нагревании. Определите объем (н.у.) полученного
сероводорода, если выход продукта реакции
составляет 85% от теоретически возможного.
3. Какой объём оксида углерода (II) был взят для
восстановления оксида железа (III), если получено
11,2г железа с выходом 80% от теоретически
возможного.
Анализ задач.
Каждая задача складывается из совокупности
данных (известные вещества) – условия задачи
(“выход” и т.п.) – и вопроса (вещества, параметры
которых требуется найти). Кроме этого, в ней есть
система зависимостей, которые связывают искомое
с данными и данные между собой.
Задачи анализа:
1) выявить все данные;
2) выявить зависимости между данными и
условиями;
3) выявить зависимости между данным и искомым.
Итак, выясняем:
1. О каких веществах идет речь?
2. Какие изменения произошли с веществами?
3. Какие величины названы в условии задачи?
4. Какие данные – практические или
теоретические, названы в условии задачи?
5. Какие из данных можно непосредственно
использовать для расчётов по уравнениям реакций,
а какие необходимо преобразовать, используя
массовую долю выхода?
Алгоритмы решения задач трёх типов:
Определение выхода продукта в % от теоретически
возможного.
1. Запишите уравнение химической реакции и
расставьте коэффициенты.
2. Под формулами веществ напишите количество
вещества согласно коэффициентам.
3. Практически полученная масса известна.
4. Определите теоретическую массу.
5. Определите выход продукта реакции (%), отнеся
практическую массу к теоретической и умножив на
100%.
6. Запишите ответ.
Расчет массы продукта реакции, если известен
выход продукта.
1. Запишите “дано” и “найти”, запишите
уравнение, расставьте коэффициенты.
2. Найдите теоретическое количество вещества
для исходных веществ. n =![]()
3. Найдите теоретическое количество вещества
продукта реакции, согласно коэффициентам.
4. Вычислите теоретические массу или объем
продукта реакции.
m = M * n или V = Vm * n
5. Вычислите практические массу или объем
продукта реакции (умножьте массу теоретическую
или объем теоретический на долю выхода).
Расчет массы исходного вещества, если известны
масса продукта реакции и выход продукта.
1. По известному практическому объёму или массе,
найдите теоретический объём или массу (используя
долю выхода продукта).
![]()
2. Найдите теоретическое количество вещества
для продукта.
3. Найдите теоретическое количество вещества
для исходного вещества, согласно коэффициентам.
4. С помощью теоретического количества вещества
найдите массу или объем исходных веществ в
реакции.
Домашнее задание.
Решите задачи:
1. Для окисления оксида серы (IV) взяли 112 л (н.у.)
кислорода и получили 760 г оксида серы (VI). Чему
равен выход продукта в процентах от теоретически
возможного?
2. При взаимодействии азота и водорода получили
95 г аммиака NH3 с выходом 35%. Какие объёмы
азота и водорода были взяты для реакции?
3. 64,8 г оксида цинка восстановили избытком
углерода. Определите массу образовавшегося
металла, если выход продукта реакции равен 65%.
