Что такое изотермический процесс
Изотермический процесс – процесс изменения состояния идеального газа при постоянной температуре.
Главное условие: T=const
С разницей в 14 лет закон открыли Роберт Бойль (1662 г.) и Эдм Мариотт (1676 г.) Название дано в честь обоих ученых.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Закон Бойля-Мариотта
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
(T-const\P_1V_1=P_2V_2\\\)
Или соотношение:
(frac{p_1}{p_2}=frac{V_2}{V_1}\\\)
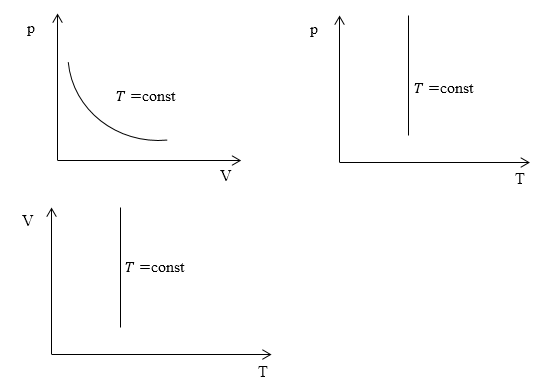
Закон выражается графиками:
1. Зависимость давления от объема:
2. Зависимость давления от температуры:
3. Зависимость объема от температуры:
Как изменяется внутренняя энергия при изотермическом процессе
Внутренняя энергия изменяется вместе с температурой. Отличительной чертой изотермического процесса является его протекание с постоянной температурой. Из этого следует, что внутренняя энергия не изменяется.
Формула количества теплоты в изотермическом процессе
Запишем первый закон термодинамики:
(Q=triangle U+A\\\ )
(Q-количество;теплоты;(Дж)\triangle U-изменение;внутренней;энергии;(Дж)\А-работа;(Дж)\\\)
Поскольку температура постоянна, то изменение внутренней энергии равно нулю. Уравнение принимает вид:
(triangle Q=A\\\)
Все тепло расходуется на работу газа.
Для изотермического процесса характерен определенный процесс, который происходит с газовым веществом, который в свою очередь имеет неизменную массу и постоянную неизменяемую температуру вещества.
Изотермический процесс для температуры газа, основные формулы и величины
Формулы
Изотермический процесс характеризует состояние газа и данное состояние записывается следующими формулами:
[p_{1} V_{1}=v R T]
[p_{2} V_{2}=v R T]
Изотермический процесс для системы координат
Характерные изотермические процессы зачастую отражают на термодинамических графиках и диаграммах.
Если рассмотреть подробно график можно увидеть линию, именно ее и принято называть изотермой. Она непосредственно является основной характеристикой процесса.
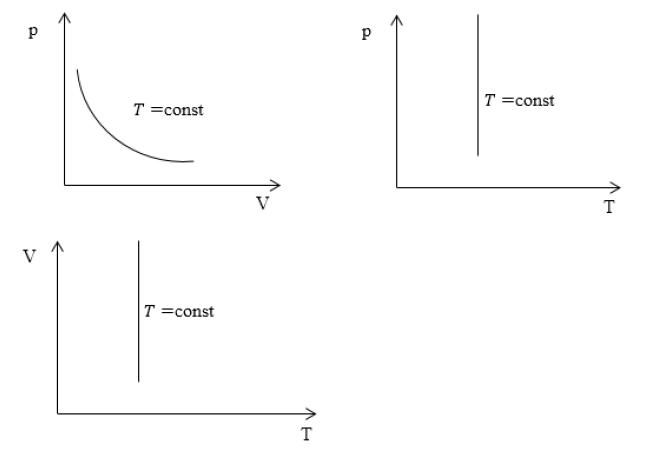
Изотермический процесс — закон Бойля-Мариотта
Разделим уравнение для второго состояния газа на выражение первого состояния и получим основное уравнение изотермического процесса.
[frac{p_{2} V_{2}}{p_{1} V_{1}}=1] или [p V=mathrm{const}] (постоянное значение)
Полученное уравнение и будет называться законом Бойля-Мариотта.
Данный процесс осуществляется с использованием тепловой энергии.
В случае, когда объем увеличивается, или отводится, для его уменьшения.
Составим первое значение термодинамики.
Затем постепенно получим уравнение для определения работы.
А также вычисления внутренней энергии и количества теплоты тела при изотермическом процессе.
[delta Q=d cup+d A=frac{i}{2} v R d T+p d V]
Температура является неизменной, поэтому, изменение значения внутренней энергии будет равняться нулевому значению. [(d cup=0)].
Из этого следует, что для изотермического процесса все подводимое тепло направлено на работу, которую совершает газ:
[ Delta Q=int_{V_{1}}^{V_{2}} d A ]
где:
- [delta Q] — тепло элементарного характера, которое подводится ко всей системе;
- dA — работа элементарного типа, совершаемая газом в изотермическом процессе;
- i — количество свободных степеней газовых молекул;
- R — газовое значение постоянной;
- d — значение молей для газа;
- V1— первоначальное значение объема газа;
- V2— окончательное значение объема газа.
[A=int_{V_{1}}^{V_{2}} p d V]
Давление газа, которое зависит от уравнения газа в идеальном состоянии.
[p V=v R T rightarrow p=frac{v R T}{V}]
Подставим вышеуказанное выражение в подынтегральное выражение:
[A=int_{V_{1}}^{V_{2}} frac{v R T}{V}=v R T int_{V_{1}}^{V_{2}} frac{d V}{V}=mathrm{u} R T ln left(frac{V_{2}}{V_{1}}right)]
Составленное уравнение необходимо определения значения работы, которую совершает газ в изотермическом процессе.
[ A=v R T ln left(frac{p_{1}}{p_{2}}right) ]
[ Delta Q=A ]
Нет времени решать самому?
Наши эксперты помогут!
Как найти изотермический процесс — примеры решения задач
Пример №1
Основное содержание задания: газ идеального состояния, имеет способность расширяется, имея постоянную температуру, от объема.
[V_{1}=0.2 mathrm{~m}^{3}]
[V_{2}=0.6 mathrm{~m}^{3}]
Известно сила давления во втором состоянии и оно равняется [p_{2}=1 cdot 10^{5} mathrm{Pi a}].
Определить:
- Величину изменения внутренней энергии газа;
- Значение работы, которую совершает газовое вещество в данном процессе;
- Какое необходимое количество теплоты получает газ в процессе работы.
Методика решения:
Внутренняя энергия газа неизменна, так как процесс который рассматривается в задаче, является изотермическим:
[Delta mathrm{U}=0]
Из основного закона термодинамики можно определить:
[Delta cup=A]
[A=v R T ln left(frac{V_{2}}{V_{1}}right)]
Составим и запишем уравнение, которое отражает окончательное (конечное) состояние газа:
[p_{2} V_{2}=v R T rightarrow T=frac{p_{2} V_{2}}{v R}]
Подставим в уравнение для температуры вышеизложенные формулы и получим решение:
[A=v R frac{p_{2} V_{2}}{v R} ln left(frac{V_{2}}{V_{1}}right)=p_{2} V_{2} ln left(frac{V_{2}}{V_{1}}right) .]
Следовательно, все величины расположены в международной системе единиц (СИ), можно провести вычисления и определить неизвестные значения:
[A=0.6 cdot 10^{5} ln left(frac{0.6}{0.2}right)=0.6 cdot 10^{5} cdot 1.1=6.6 cdot 10^{4} text { (Дж) }]
Ответ задачи:
- значение изменения внутренней энергии газа в рассматриваемой процессе равно нулевому значению.
- работа, которая совершается в процессе газовым веществом равняется [6,6 cdot 10^{4} text { Дж }].
- Необходимое количество тепловой энергии равно: [6,6 cdot 10^{4} text { Дж }].
Пример №2
Задание: изображен график, где изменяется идеальное состояние массы газа равное m в координатных осях p (V).
Нужно перенесите данный процесс на координатные оси в p(T).
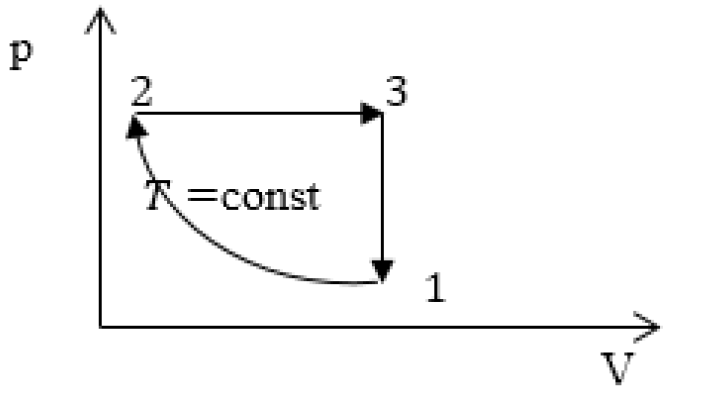
На данном графике изображен круговой процесс.
Где:
- Прямая 1-2 является изотермическим процессом с константой [(T=text { cons } t)]. Следовательно значение объема будет уменьшается [(mathrm{V} downarrow)], а давления соответственно расти [(p uparrow)].
- Прямая 2-3 отражает изобарический процесс [(p=text { const })]
const). Для данного процесса характерно увеличение объема [mathrm{V} uparrow] и применяя закон Гей-Люссака, увеличение [Т uparrow]
- Прямая (отрезок) 3-1 является изохорным процессом объем будет постоянной величиной [(mathrm{V}=text { const })], а [p downarrow],а исходя из закона Шарля [T downarrow].
Все перечисленные процессы изобразим на координатных осях p(T).
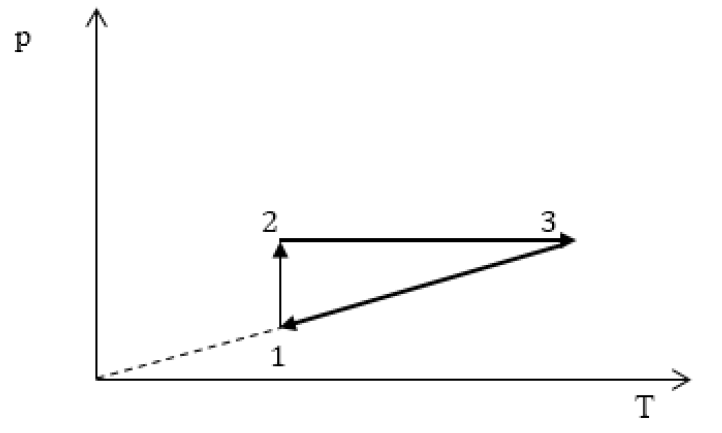
Изотермическим
называется процесс, протекающий при
постоянной температуре.
|
|
|
|
Рис. процесса |
Рис. |
1. Уравнение процесса –
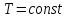
2. График процесса.
Из уравнения состояния следует, что


Следовательно, графиком процесса вр,υ
– координатах является
равнобокая
гипербола
(рис. 2.7).
3. Связь между
параметрами состояния газа. Для этого
запишем уравнение состояния для точек
2 и 1 и разделим их друг на друга


Так как в
изотермическом процессе

то

(2.20)
4.
Теплоемкость газа в изотермическом
процессе
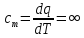
так как в этом процессе
а
5. Определение
количества теплоты q,
подведенной к газу, совершенной им
работы l
и изменения его внутренней энергии Δu:

(2.21)
Если

то, согласно равенству (2.21),
Значит, при подводе теплоты к газу его
удельный объем возрастает и наоборот
(рис. 2.7).
Таким образом,
в изотермическом процессе теплота,
сообщаемая газу, идет на совершение им
работы расширения против внешних сил.
Используя график
изотермического процесса (рис. 2.8), можно
показать, что изменение внутренней
энергии газа в любом процессе

Действительно, во всех процессахa,
b
и c,
начинающихся в точке 0 и заканчивающихся
на изотерме, изменение внутренней
энергии будет одинаково, т.е.

так как начальное и конечное значение
температуры в этих процессах одно и то
же.
Но согласно первому
закону термодинамики в изохорном
процессе a
теплота, подведенная к газу, идет только
на увеличение его внутренней энергии,
т.к. в этом процессе газ не совершает
работу, т.е.

Как установлено выше, в изохорном
процессе
Отсюда следует, что в любом процессе

|
|
|
Рис. и |
2.9. Адиабатный процесс
Адиабатным
называется процесс, протекающий при
отсутствии теплообмена с окружающей
средой
(т.е. при q =
0).
1. Уравнение
процесса.
Для вывода уравнения
процесса запишем уравнение первого
закона термодинамики в двух формах:

или в виде


Разделив второе
уравнение на первое, получим
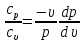

где

Проинтегрировав
последнее уравнение, получим


Откуда следует
выражение для уравнения адиабатного
процесса в виде

(2.22) 2. График процесса. Из
уравнения процесса (2.22) следует, что

– координатах – это
неравнобокая
гипебла.
Так как k
>1, то адиабата протекает круче изотермы
(рис. 2.9).
3. Связь между
параметрами состояния газа. Для этого
запишем уравнение адиабаты для точек
2 и 1 и разделим их друг на друга
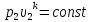

Тогда получим

(2.23)
Из уравнения
состояния, записанного для точек 1 и 2
(рис. 2.9), следует, что

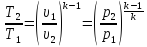
(2.24)
4.
Теплоемкость газа в адиабатном процессе.
Так как в этом процессе

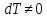

5. Определение
количества теплоты q,
подведенной к газу, совершенной им
работы l
и изменения его внутренней энергии Δu:
-
количество тепла,
подведенного к газу
;
-
изменение внутренней
энергии газа
;
-
для адиабатного
процесса по определению q
= 0. Тогда из
первого закона термодинамики следует,
что при q
= 0 работа
расширения газа

(2.25)
т.
е. в адиабатном процессе работа газа
совершается за счет убыли его внутренней
энергии.Поэтому, как видно из
формулы (2.25), адиабатное расширение газа
(т.е. при
температуры, а сжатиеповышением.
Из уравнения Майера



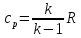
тогда
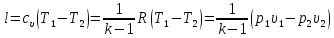
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pvn= const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс

Изохорный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
p/T = R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p2/p1 = T2/T1.
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
q= cv(T2 — T1).
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Δu = cv(T2 — T1).
Изменение энтропии в изохорном процессе определяется по формуле:
s2 – s1= Δs = cvln(p2/p1) = cvln(T2/T1).
Изобарный процесс
Изобарный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v/T = R/p = const
или
v2/v1 = T2/T1,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l = p(v2 – v1).
Т. к. pv1 = RT1 и pv2 = RT2, то
l = R(T2 – T1).
Количество теплоты при cp = const определяется по формуле:
q = cp(T2 – T1).
Изменение энтропии будет равно:
s2 – s1= Δs = cpln(T2/T1).
Изотермический процесс
Изотермический процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
или
p2/p1 = v1/v2,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l = RTln (v2 – v1) = RTln (p1 – p2).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q = l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s2 – s1= Δs = Rln(p1/p2) = Rln(v2/v1).
Адиабатный процесс
Адиабатный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du + pdv = 0
или
Δu+ l = 0,
следовательно
Δu= —l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
dq = cадdT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
Известно, что
сp/cv = k
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
pvk = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
kвоздуха = 1,4
kперегретого пара = 1,3
kвыхлопных газов ДВС = 1,33
kнасыщенного влажного пара = 1,135
Из предыдущих формул следует:
l= — Δu = cv(T1 – T2);
i1 – i2= cp(T1 – T2).
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
pvn= const.
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
p2/p1 = (v1/v2)n; T2/T1 = (v1/v2)n-1; T2/T1 = (p2/p1)(n-1)/n.
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
q = (u2 – u1) + l.
Поскольку
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p0v = const, p1/∞v = const, pv∞ = const – изохора;
pvk = const (n = k) – адиабата.
n > 0 – гиперболические кривые,
n < 0 – параболы.
По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.
Запишем уравнение для двух состояний идеального газа:
[p_1V_1=nu RTleft(1right),]
[p_2V_2=nu RT left(2right).]
Закон Бойля-Мариотта
Разделим уравнение (2) на уравнение (1), получим уравнение изотермического процесса:
[frac{p_2V_2}{p_1V_1}=1 (3)]
или
[pV=const left(4right).]
Уравнение (4) называют законом Бойля-Мариотта.
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изотермического процесса:
[delta Q=dU+dA=frac{i}{2}nu RdT+pdV, left(5right).]
Температура не изменяется, следовательно, изменение внутренней энергии равно нулю ($dU=0$). Получается, что в изотермическом процессе все подводимое тепло идет на совершение газом работы:
[triangle Q=intlimits^{V_2}_{V_1}{dA}left(6right),]
где $delta Q $- элементарное тепло, подводимое к системе, $dA$- элементарная работа, которую совершает газ в процессе, i – число степеней свободы молекулы газа, R — универсальная газовая постоянная, d -количество молей газа, $V_1$- начальный объем газа, $V_2$- конечный объем газа.
[A=intlimits^{V_2}_{V_1}{pdV}left(7right).]
Используем уравнение состояния идеального газа, выразим из него давление:
[pV=nu RTto p=frac{nu RT}{V}left(8right).]
Подставим уравнение (8) в подынтегральное выражение уравнения (7):
[A=intlimits^{V_2}_{V_1}{frac{nu RT}{V}dV}=nu RTintlimits^{V_2}_{V_1}{frac{dV}{V}}=nu RTlnleft(frac{V_2}{V_1}right)left(9right).]
Уравнение (9) — выражение для работы газа в изотермическом процессе. Уравнение (9) можно записать через отношение давлений, если использовать закон Бойля-Мариотта, в таком случае:
[A=nu RTlnleft(frac{p_1}{p_2}right)left(10right)]
[triangle Q=A (11),]
Уравнение (11) определяет количество теплоты, сообщаемое газу массы m в изотермическом процессе$.
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изотермический процесс, называется изотермой (рис.1).
Рис. 1
Пример 1
Задание: Идеальный одноатомный газ расширяется при постоянной температуре от объема $V_1=0,2 м^3$ до $V_2=0,6 м^3$. Давление в состоянии 2 равно $p_2=1cdot {10}^5 Па$. Определить:
- Изменение внутренней энергии газа.
- Работу, которую совершает газ в этом процессе.
- Количество теплоты, получаемое газом.
Решение:
Так как процесс изотермический, то внутренняя энергия газа не изменяется:
[triangle U=0.]
Из первого начала термодинамики, следовательно:
[triangle Q=A left(1.1right).]
[A=nu RTlnleft(frac{V_2}{V_1}right)left(1.2right).]
Запишем уравнение конечного состояния идеального газа:
[p_2V_2=nu RTto T=frac{p_2V_2}{nu R} left(1.3right).]
Подставим выражение для температуры из (1.3) в (1.2), получим:
[A=nu Rfrac{p_2V_2}{nu R}lnleft(frac{V_2}{V_1}right)=p_2V_2lnleft(frac{V_2}{V_1}right)left(1.4right).]
Так как все величины в данных находятся в СИ, проведем расчет:
[A=0,6cdot {10}^5lnleft(frac{0,6}{0,2}right)=0,6cdot {10}^5cdot 1,1=6,6{cdot 10}^4(Дж)]
Ответ: Изменение внутренней энергии газа в заданном процессе равно нулю. Работа, которую совершает газ в этом процессе $6,6{cdot 10}^4Дж.$ Количество теплоты, получаемое газом в данном процессе, $6,6{cdot 10}^4Дж$.





 ;
;