Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 ноября 2020 года; проверки требует 1 правка.
Теплоёмкость определяется суммой поступательных, вращательных и удвоенным числом колебательных степеней свободы.
Теплоёмкость идеального газа — отношение количества теплоты, сообщённой газу 


Удельная и молярная теплоёмкость[править | править код]
Молярная теплоёмкость — теплоёмкость 1 моля вещества [2]:
где 


Теплоёмкость единичной массы вещества называется удельной теплоёмкостью и, в системе СИ, измеряется в Дж/(кг·К)[1].
Формула расчёта удельной теплоёмкости[1][2]:
- где c — удельная теплоёмкость, m — масса нагреваемого (охлаждающегося) вещества.
Теплоёмкость идеального газа в изопроцессах[править | править код]
Адиабатический[править | править код]
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть 

Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: 
Изотермический[править | править код]
В изотермическом процессе постоянна температура, то есть 

Изохорный[править | править код]
В изохорном процессе постоянен объём, то есть 
А для идеального газа
Таким образом,
где 
Другая формула:
где 

Изобарный[править | править код]
Молярная теплоёмкость при постоянном давлении обозначается как 

Уравнение Майера вытекает из первого начала термодинамики[4]:
.
В рассматриваемом случае, согласно определению теплоёмкости:
Учитываем, что работа газа равна [4]:
Согласно уравнению Менделеева-Клапейрона для одного моля газа[1]:
Подставляя уравнение (4) в (3) получаем:
Так как энергия одной молекулы равна 
Молекулярно-кинетическая теория позволяет вычислить значения молярной теплоёмкости для классического идеального газа газов через значение универсальной газовой постоянной исходя из уравнения (6) и предположения, что молекулы газа не взаимодействуют между собой[5]:
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Теплоёмкость реального газа может значительно отклонятся от теплоёмкости идеального газа. Так при температуре в 25 °С и атмосферном давлении атомарный водород имеет теплоёмкость 2,50R , а атомарный кислород — 2,63R. Также теплоёмкость реального газа зависит от температуры[5].
См. также[править | править код]
- Идеальный газ
- Первое начало термодинамики
- Теплоёмкость
Комментарии[править | править код]
- ↑ i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы
- ↑ 1 2 При жёсткой связи между атомами, то есть колебательные степени свободы исключены из рассмотрения. Примером трёхатомной линейной молекулы служит цианистый водород HCN.
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 Савельев, 2001, с. 26—30.
- ↑ 1 2 Базаров И. П., Термодинамика, 2010, с. 41.
- ↑ 1 2 Савельев, 2001, с. 30—31.
- ↑ 1 2 Савельев, 2001, с. 18-20.
- ↑ 1 2 3 Савельев, 2001, с. 61-63.
Литература[править | править код]
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.— Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Белоконь Н. И. Основные принципы термодинамики. — М.: Недра, 1968. — 110 с.
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
Теплоемкость газов
При
сообщении телу некоторого количества
теплоты изменяется его температура (за
исключением агрегатных превращений и
вообще изотермических процессов).
Характеристиками такого изменения
являются различные теплоемкости:
теплоемкость тела CT,
удельная теплоемкость вещества c,
молярная теплоемкость C.
Понятия
теплоемкости тела и удельной теплоемкости
рассмотрены тут.
Молярная
теплоемкость C —
величина, равная количеству теплоты,
необходимому для нагревания 1 моль
вещества на 1 К:
C=QνΔT.(1)
Единицей
молярной теплоемкости в СИ является
джоуль на моль-Кельвин (Дж/моль·К).
Удельная
теплоемкость связана с молярной
соотношением
C=cM.
В
отличие от такой, например, характеристики
вещества, как его молекулярная
масса Mr удельная
теплоемкость вещества не является
неизменным параметром. Удельная
теплоемкость может резко изменяться
при переходе вещества из одного
агрегатного состояния в другое. Так,
вода в газообразном состоянии имеет
удельную теплоемкость 2,2·103 Дж/кг·К
а в жидком 4,19·103 Дж/кг·К
.
Теплоемкость
зависит и от условий, при которых
происходит передача теплоты телу.
Последнее особенно относится к газам.
Например, при изотермическом расширении
газа ему передается некоторое количество
теплоты Q >
0, а ΔΤ =
0. Следовательно, удельная теплоемкость
газа при изотермическом процессе
c=QmΔT→∞.
При
адиабатном сжатии (расширении) газ не
получает теплоты и не передает ее
окружающим телам (Q =
0), а температура газа изменяется (ΔΤ ≠
0). Следовательно, удельная теплоемкость
газа при адиабатном процессе
c=QmΔT=0.
Наибольший
интерес представляет теплоемкость для
случаев, когда нагревание происходит
при постоянном объеме или при постоянном
давлении. В первом случае теплоемкость
называется теплоемкостью при постоянном
объеме или изохорной теплоемкостью
(cV,CV),
во втором — теплоемкостью при постоянном
давлении или изобарной теплоемкостью
(cp, Cp).
Если
объем не изменяется (ΔV =
0), то работа, совершенная газом, так же
равна нулю (А =
0). Согласно первому закону термодинамики
Q=ΔU и CTV=ΔUΔT,
Откуда
ΔU=CTV⋅ΔT=cVmΔT.(2)
Следовательно, теплоемкость
при постоянном объеме равна изменению
внутренней энергии газа при изменении
температуры на 1 К.
Если
газ идеальный, то в формуле (2)
ΔU=i2mMRΔT.
Тогда
молярная теплоемкость при постоянном
объеме CV=ΔUMΔT,
где ΔUM=i2RΔT —
изменение внутренней энергии 1 моль
газа. Из этих равенств теплоемкость
газа при постоянном объеме — CTV=i2mMR;
молярная теплоемкость газа при постоянном
объеме — CV=i2R.
Если
газ нагревается при постоянном давлении,
то согласно первому закону термодинамики
Q=ΔU+A,
где A=pΔV=mMRΔT.
Тогда
теплоемкость газа при постоянном
давлении
CTp=QΔT=ΔUΔT+mMR=CTV+mMR=i+2imMR.
Молярная
теплоемкость при постоянном давлении:
Cp=CV+R — уравнение
Майера;
Cp=i2R+R=i+2iR.
Таким
образом, теплоемкость при постоянном
давлении всегда больше теплоемкости
при постоянном объеме. Их отношение
равно
γ=CpCV=i+2i.
где γ —
показатель адиабаты (коэффициент
Пуассона).
Из-за
малости величины коэффициента объемного
расширения твердых и жидких тел работой,
совершаемой ими при нагревании при
постоянном давлении, можно пренебречь
и считать, что теплоемкости при постоянном
объеме и постоянном давлении практически
совпадают. Поэтому теплоемкость твердых
и жидких тел при заданной температуре
может считаться вполне определенной
величиной.
Адиабатический
процесс
Адиабати́ческий,
или адиаба́тный
проце́сс (от др.-греч. ἀδιάβατος —
«непроходимый») — термодинамический
процесс в
макроскопической системе, при котором
система не обменивается теплотой с
окружающим пространством. Серьёзное
исследование адиабатических процессов
началось в XVIII веке[1].
Адиабатический
процесс является частным случаем политропного
процесса,
так как при нём теплоёмкость газа
равна нулю и, следовательно, постоянна[2].
Адиабатические процессы обратимы только
тогда, когда в каждый момент времени
система остаётся равновесной (например,
изменение состояния происходит достаточно
медленно) и изменения энтропии не
происходит. Некоторые авторы (в
частности, Л. Д. Ландау)
называли адиабатическими только
обратимые адиабатические процессы[3].
Обратимый
адиабатический процесс для идеального
газа описывается
уравнением Пуассона.Линия,
изображающая адиабатный процесс на
термодинамической диаграмме,
называетсяадиабатой
Пуассона.
Примером необратимого адиабатического
процесса может быть распространение ударной
волны в
газе. Такой процесс описывается ударной
адиабатой.
Адиабатическими можно считать процессы
в целом ряде явлений природы. Так же
такие процессы получили ряд применений
в технике.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q, то его температура и внутренняя энергия претерпевают изменения.
Необходимое для нагревания 1 кг вещества на 1 К количество теплоты Q носит название удельной теплоемкости вещества c, а ее формула выглядит следующим образом:
c=Qm∆T.
В большом количестве ситуаций удобной для использования является молярная теплоемкость C:
C=M·c, где M представляет собой молярную массу вещества.
Теплоемкость, полученная таким способом, не является однозначной характеристикой вещества. Исходя из первого закона термодинамики, можно сказать, что изменение внутренней энергии тела зависимо не только от количества полученной теплоты, но и от величины совершенной телом работы. В разных условиях осуществления процесса теплопередачи тело может совершать различную работу. Таким образом, переданное телу одинаковое количество теплоты способно провоцировать изменения его внутренней энергии и, соответственно, температуры.
Подобной неоднозначностью при определении теплоемкости характеризуются только газообразные вещества. Объем в процессе нагрева практически не меняет своей величины, что сводит работу расширения к нулю. По этой причине вся полученная телом теплота уходит на изменение его внутренней энергии. Газ в процессе теплопередачи может значительно менять свой объем и совершать работу, чем отличается от твердых тел и жидкостей. Таким образом, теплоемкость газообразного вещества имеет зависимость от характера термодинамического процесса.
Изопроцессы в газах
Чаще всего рассматриваются два значения теплоемкости газов:
- CV являющаяся молярной теплоемкостью в изохорном процессе (V=const);
- Cp представляющая собой молярную теплоемкость в изобарном процессе (p=const).
При условии постоянного объема газ не совершает работы: A=0. Исходя из первого закона термодинамики для 1 моля газа, можно сказать, что справедливым является следующее выражение:
QV=CV∆T=∆U.
Изменение величины ΔU внутренней энергии газа прямо пропорционально изменению значения ΔT его температуры.
В условиях процесса при постоянном давлении первый закон термодинамики дает такую формулу:
Qp=∆U+p(V2-V1)=CV∆T+pV.
В котором ΔV является изменением объема 1 моля идеального газа при изменении его температуры на ΔT. Таким образом, можно заявить, что:
Cp=Qp∆T=CV+p∆V∆T.
Из уравнения состояния идеального газа, записанного для 1 моля, может выражаться отношение ΔVΔT:
pV=R.
В котором R представляет собой универсальную газовую постоянную. При условии постоянства давления p=const, можно записать следующее:p∆V=R∆T или ∆V∆T=Rp.
Из этого следует, что выражающее связь между молярными теплоемкостями Cp и CV соотношение имеет вид (формула Майера):
Cp=CV+R.
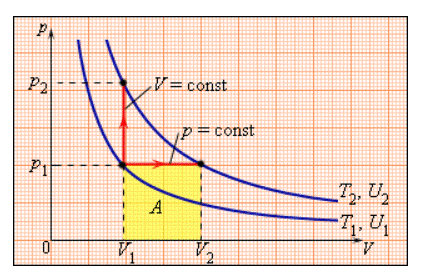
В процессе с неизменным давлением молярная теплоемкость Cp газа всегда превышает молярную теплоемкость CV в процессе с не подверженным изменениям объемом, что демонстрируется на рисунке 3.10.1.
Рисунок 3.10.1. Два возможных процесса нагревания газа на ΔT=T2 –T1. При p=const газ совершает работу A=p1(V2 – V1). Поэтому Cp>CV.
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом занимает важное место в термодинамике и обозначается в виде греческой буквы γ.
γ=CpCV.
Данное отношение включено в формулу для адиабатического процесса.
Между двумя изотермами, обладающими температурами T1 и T2 на диаграмме (p, V) реальны различные варианты перехода. Так как для всех подобных переходов изменение величины температуры ΔT=T2 –T1 является одним и тем же, выходит, что изменение значения
ΔU внутренней энергии тоже одинаково. С другой стороны, совершенные при этом работы A и количества теплоты Q, полученные в результате теплообмена, выйдут разными для различных путей перехода. Из этого следует, что газа имеет относительно приближенное к бесконечности число теплоемкостей. Cp и CV представляют собой частные, однако, очень важные для теории газов, значения теплоемкостей.
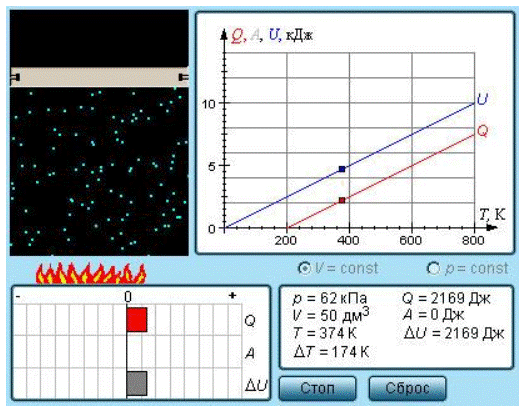
Рисунок 3.10.2. Модель теплоемкости идеального газа.
Термодинамические процессы, в которых теплоемкость газа не подвергается изменениям, носят название политропических.
Каждый изопроцесс являются политропическим. В изотермическом процессе ΔT=0, из-за чего CT=∞. В адиабатическом процессе ΔQ=0, выходит, что Cад=0.
Стоит обратить внимание на то, что «теплоемкость» и «количество теплоты» являются крайне неудачными терминами, доставшимися современной науке в качестве наследства теории теплорода, которая господствовала в XVIII веке.
Данная теория представляла теплоту в виде содержащегося в телах особого невесомого вещества. Считалось, что оно не подвержено уничтожению и не может быть созданным. Явление нагрева объясняли повышением, а охлаждение – понижением содержания в телах теплорода. Однако теория теплорода оказалась несостоятельной, так как не смогла дать ответа на вопрос, почему одинаковое изменение внутренней энергии тела возможно получить, приводя ему разное количество теплоты в зависимости от совершаемой им работы. По этой причине утверждение, что в данном теле содержится некоторый запас теплорода лишено смысла.
Молекулярно-кинетическая теория
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией E→ поступательного движения молекул и абсолютной температурой T:
E→=32kT.
Внутренняя энергия 1 моля идеального газа эквивалентна произведению E→ на число АвогадроNА:
U=32kNAT=32RT.
При условии изменения температуры на величину ΔT внутренняя энергия изменяется на величину:
U=32R∆T=CV∆T.
Коэффициент пропорциональности между ΔU и ΔT эквивалентен теплоемкости CV в условиях постоянного давления:
CV=32R=12,47 ДЖ/моль·К.
Данное выражение подтверждается экспериментами с газами, которые состоят из одноатомных молекул вроде гелия, неона или аргона. При этом для двухатомных (водород, азот) и многоатомных (углекислый газ) газов такое соотношение не согласуется с полученными в результате опытов данными. Причина этого расхождения заключается в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию как поступательного, так и вращательного их движения.
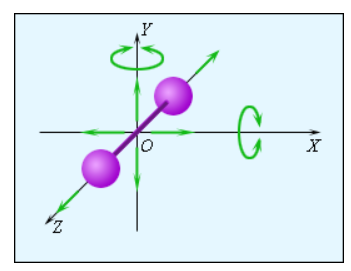
Рисунок 3.10.3. Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы.
Рисунок 3.10.3 иллюстрирует модель двухатомной молекулы. Молекула имеет возможность производить пять независимых типов движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y.
Опытным путем выяснено, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких значениях температуры. В условиях обычных температур вращение вокруг оси Z не происходит.
Каждое независимое движение в молекуле носит название степени свободы.
Выходит, что одноатомная молекула обладает 3 поступательными степенями свободы, «жесткая» двухатомная молекула 5 степенями, то есть 3 поступательными и 2 вращательными, а многоатомная молекула 6 степенями свободы, из которых 3 приходятся на поступательные и 3 на вращательные.
В классической статистической физике доказывается теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 12kT.
Из данной теоремы следует, что для молярных теплоемкостей газа Cp и CV и их отношения
γ справедлива запись в следующем виде:
CV=i2R, Cp=Cv+R=i+22R, γ=CpCV=i+2i,
где i представляет собой количество степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i=3)
CV=32R, Cp=Cv+R=52R, γ=CpCV=53=1,66.
Для газа, состоящего из двухатомных молекул (i=5)
CV=52R, Cp=Cv+R=72R, γ=CpCV=75=1,4.
Для газа, состоящего из многоатомных молекул (i=6)
CV=3R, Cp=Cv+R=4R, γ=CpCV=43=1,33.
В обычных условиях экспериментально измеренные теплоемкости многих газов неплохо согласуются с приведенными выражениями, но в целом классическая теория теплоемкости газов вполне удовлетворительной не является. Существует колоссальное число примеров со значительной разницей между результатами эксперимента и теорией. Данный факт объясняется тем, что классическая теория не может полностью учесть, связанную с внутренними движениями в молекуле энергию.
Теорема о равномерном распределении энергии по степеням свободы может быть применена и по отношению к тепловому движению частиц в твердом теле. Входящие в состав кристаллической решетки атомы колеблются около положений равновесия. Энергия данных колебаний представляет собой внутреннюю энергию твердого тела. Каждый конкретный атом может колебаться в кристаллической решетке в трех взаимно перпендикулярных направлениях. Выходит, что каждый атом имеет 3 колебательные степени свободы. При условии гармонических колебаний средняя кинетическая энергия эквивалентна средней потенциальной энергии. По этой причине в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT.
Внутренняя энергия 1 моля твердого вещества равна следующему выражению:
U=3RNAkt=3Rt.
Следовательно, молярная теплоемкость вещества в твердом состоянии равняется:
С=3R=25,12 Дж/моль·К.
Данное выражение носит название закона Дюлонга–Пти. Для твердых тел почти нет различия между Cp и CV по причине пренебрежительно малой работы при сжатии или расширении.
Опыт показывает, что молярная теплоемкость у многих твердых тел (химических элементов) при обычных температурах на самом деле близка к 3R. При этом, в условиях низких температур заметны довольно сильные расхождения между теорией и экспериментом. Таким образом, гипотеза о равномерном распределении энергии по степеням свободы может считаться лишь приближением. Заметная в опыте зависимость теплоемкости от температуры объясняется только при условии использования квантовых представлений.
Теплоемкости при постоянном давлении и постоянном объеме
При сообщении телу некоторого количества теплоты изменяется его температура (за исключением агрегатных превращений и вообще изотермических процессов). Характеристиками такого изменения являются различные теплоемкости: теплоемкость тела CT, удельная теплоемкость вещества c, молярная теплоемкость C.
Понятия теплоемкости тела и удельной теплоемкости рассмотрены тут.
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
(~C = frac{Q}{nu Delta T} . qquad (1))
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
Удельная теплоемкость связана с молярной соотношением
(~C = cM. )
В отличие от такой, например, характеристики вещества, как его молекулярная масса Mr удельная теплоемкость вещества не является неизменным параметром. Удельная теплоемкость может резко изменяться при переходе вещества из одного агрегатного состояния в другое. Так, вода в газообразном состоянии имеет удельную теплоемкость 2,2·103 Дж/кг·К а в жидком 4,19·103 Дж/кг·К .
Теплоемкость зависит и от условий, при которых происходит передача теплоты телу. Последнее особенно относится к газам. Например, при изотермическом расширении газа ему передается некоторое количество теплоты Q > 0, а ΔΤ = 0. Следовательно, удельная теплоемкость газа при изотермическом процессе
(~c = frac{Q}{m Delta T} to infty .)
При адиабатном сжатии (расширении) газ не получает теплоты и не передает ее окружающим телам (Q = 0), а температура газа изменяется (ΔΤ ≠ 0). Следовательно, удельная теплоемкость газа при адиабатном процессе
(~c = frac{Q}{m Delta T} = 0 .)
Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме или изохорной теплоемкостью (cV, CV), во втором — теплоемкостью при постоянном давлении или изобарной теплоемкостью (cp, Cp).
Если объем не изменяется (ΔV = 0), то работа, совершенная газом, так же равна нулю (А = 0). Согласно первому закону термодинамики
(~Q = Delta U) и (~C_{TV} = frac{Delta U}{Delta T},)
Откуда
(~Delta U = C_{TV} cdot Delta T = c_V m Delta T . qquad (2))
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К.
Если газ идеальный, то в формуле (2)
(~Delta U = frac i2 frac mM R Delta T .)
Тогда молярная теплоемкость при постоянном объеме (~C_V = frac{Delta U_M}{Delta T}), где (~Delta U_M = frac i2 R Delta T) — изменение внутренней энергии 1 моль газа. Из этих равенств теплоемкость газа при постоянном объеме — (~C_{TV} = frac i2 frac mM R); молярная теплоемкость газа при постоянном объеме — (~C_V = frac i2 R).
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
(~Q = Delta U + A,)
где (~A = p Delta V = frac mM R Delta T).
Тогда теплоемкость газа при постоянном давлении
(~C_{Tp} = frac{Q}{Delta T} = frac{Delta U}{Delta T} + frac mM R = C_{TV} + frac mM R = frac{i + 2}{i} frac mM R .)
Молярная теплоемкость при постоянном давлении:
(~C_p = C_V + R) — уравнение Майера;
(~C_p = frac i2 R + R = frac{i + 2}{i} R .)
Таким образом, теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме. Их отношение равно
(~gamma = frac{C_p}{C_V} = frac{i + 2}{i} .)
где γ — показатель адиабаты (коэффициент Пуассона).
Из-за малости величины коэффициента объемного расширения твердых и жидких тел работой, совершаемой ими при нагревании при постоянном давлении, можно пренебречь и считать, что теплоемкости при постоянном объеме и постоянном давлении практически совпадают. Поэтому теплоемкость твердых и жидких тел при заданной температуре может считаться вполне определенной величиной.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 159-161.