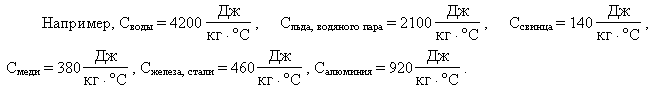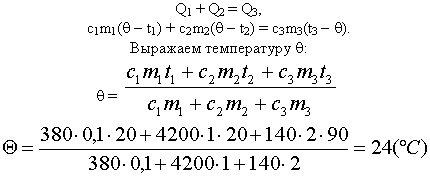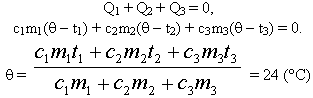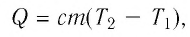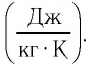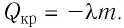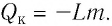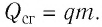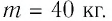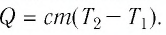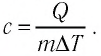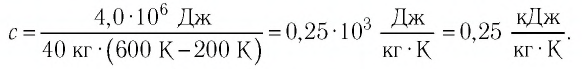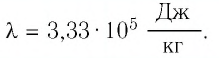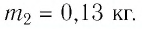Пособие рекомендовано учащимся, желающим
получить практические навыки в решении задач на
теплообмен, и может быть полезным для учителей и
абитуриентов.
При соприкосновении тел, имеющих разные
температуры, между этими телами происходит
теплообмен. С точки зрения
молекулярно-кинетической теории, это
объясняется так: молекулы более нагретого тела
имеют большую кинетическую энергию, чем молекулы
тела, менее нагретого. При “столкновениях”
молекул соприкасающихся тел происходит процесс
выравнивания их средних кинетических энергий.
Молекулы более нагретого тела теряют часть своей
кинетической энергии, при этом нагретое тело
будет остывать. Кинетическая энергия молекул
холодного тела возрастает, поэтому температура
этого тела будет увеличиваться. В конечном итоге
кинетические энергии молекул обоих тел
сравняются, и температуры тел станут
одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в
процессе теплообмена, называют количеством
теплоты (Q).
Количество теплоты, как и все другие виды
энергии, измеряется в системе СИ в Джоулях: [Q] = Дж.
(Здесь и в дальнейшем единицы измеряются в
системе СИ.)
Нагревание или охлаждение
При нагревании или охлаждении тела количество
теплоты, поглощаемое или выделяемое им,
рассчитывается по формуле:
Q = сm(t2 – t1), (1)
где m – масса тела, кг;
(t2 – t1) – разность температур
тела,° С (или К);
с – удельная теплоёмкость вещества, из
которого состоит тело,
Удельная теплоёмкость вещества – это
количество теплоты, которое нужно сообщить
одному килограмму данного вещества, чтобы
увеличить его температуру на 1° С (или это
количество теплоты, которое выделяет один
килограмм данного вещества, остывая на 1° С).
Значения удельных теплоемкостей других
веществ можно найти в справочниках, а также в
школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия
увеличивается. Это требует притока энергии к
телу от других тел. Значит, оно поглощает
некоторое количество теплоты, принимая его от
других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия
уменьшается. Поэтому остывающее тело отдаёт
кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в
результате теплообмена, обозначают греческой
буквой (тэта).
В формуле (1) произведение cm для каждого
конкретного тела есть величина постоянная. Её
называют теплоёмкостью тела и обозначают С:
C = c m.(2)
Размерность теплоемкости: Теплоемкость тела показывает,
сколько энергии нужно подвести к данному телу,
чтобы нагреть его на 1° С (или сколько энергии
выделяет это тело, остывая на 1° С).
Теплообмен между телами, имеющими одинаковые
температуры, не происходит, даже если
контактируют вещества, находящиеся в разных
агрегатных состояниях. Например, при температуре
плавления (0° С) лёд и вода могут находиться
бесконечно долго, при этом количество льда и
количество воды останутся неизменными.
Аналогично ведут себя пар и жидкость,
находящиеся при температуре кипения. Теплообмен
между ними не происходит.
Плавление или кристаллизация
Если при нагревании тела его температура
достигнет температуры плавления, то начинает
происходить процесс перехода этого вещества из
твердого состояния в жидкое. При этом идут
изменения в расположении и характере
взаимодействия молекул. Температура при
плавлении не изменяется. Это означает, что
средние кинетические энергии молекул жидкости и
твердого тела при температуре плавления
одинаковы. Однако внутренняя энергия тела при
плавлении возрастает за счет увеличения энергии
взаимодействия молекул. Количество теплоты,
поглощаемое телом при плавлении, рассчитывается
по формуле
(3)
где m – масса тела, кг;
–
удельная теплота плавления,
При кристаллизации, наоборот, внутренняя
энергия тела уменьшается на величину и эта теплота данным
телом выделяется. Она поглощается другими
телами, участвующими в теплообмене.
Удельная теплота плавления показывает,
сколько энергии нужно сообщить одному
килограмму данного вещества, взятого при
температуре плавления, чтобы полностью
превратить его при этой температуре в жидкость
(или сколько энергии выделяет 1 кг жидкости,
взятой при температуре кристаллизации, если вся
она при этой температуре полностью превратится в
твёрдое тело).
Удельную теплоту плавления любого вещества
можно найти в справочниках. Для льда же
Температура плавления у каждого вещества своя.
Её также можно найти в справочниках. Важно
подчеркнуть, что температура плавления вещества
равна температуре кристаллизации этого же
вещества. У льда tпл = 0° С.
Кипение или конденсация
При достижении жидкостью температуры кипения
начинает происходить другой фазовый переход –
кипение, при котором расстояния между молекулами
значительно увеличиваются, а силы
взаимодействия молекул уменьшаются. Вся
подводимая к жидкости теплота идет на разрыв
связей между молекулами. При конденсации пара в
жидкость, наоборот, расстояния между молекулами
значительно сокращаются, а силы взаимодействия
молекул увеличиваются. Для кипения жидкости
энергию к жидкости нужно подводить, при
конденсации пара энергия выделяется. Количество
теплоты, поглощаемое при кипении или выделяемое
при конденсации, рассчитывается по формуле:
где m – масса тела, кг; L – удельная
теплота парообразования,
Удельная теплота парообразования
показывает, сколько энергии нужно сообщить
одному килограмму жидкости, взятой при
температуре кипения, чтобы при этой температуре
полностью превратить её в пар (для конденсации:
сколько энергии выделяет один килограмм пара,
взятого при температуре конденсации, полностью
превращаясь в жидкость).
При одинаковом давлении температура кипения и
температура конденсации одного и того же
вещества одинаковы.
Температуры кипения и удельные теплоты
парообразования также можно найти в
справочниках. Для воды же они соответственно
равны: рис. 9 (при нормальном атмосферном
давлении).
Уравнение теплового баланса
Тела, участвующие в теплообмене, представляют
собой термодинамическую систему.
Термодинамическая система называется теплоизолированной,
если она не получает энергию извне и не отдаёт её;
теплообмен происходит только между телами,
входящими в эту систему. Для любой
теплоизолированной системы тел справедливо
следующее утверждение: количество теплоты,
отданное одними телами, равно количеству
теплоты, принимаемому другими телами.
Qотд. = Qполуч. (5)
Это утверждение описывает частный случай
закона сохранения и превращения энергии в
применении к процессу теплообмена. А формула (5)
является одним из видов уравнения теплового
баланса.
При решении задач с помощью данного вида
уравнения теплового баланса в формуле (1) в
качестве t2 следует брать большую
температуру, а в качестве t1 – меньшую.
Тогда разность (t2 – t1) будет
положительна и всё произведение cm(t2–t1)
также будет положительным. Все теплоты, отданные
и полученные, будут положительными.
Уравнение теплового баланса можно записать и в
таком виде:
Q1+ Q2+…+ Qn= 0, (6)
где n – количество тел системы.
Алгебраическая сумма всех количеств теплоты
(поглощенных и выделенных) в теплоизолированной
системе равна нулю.
Q1, Q2, …, Qn – это теплоты,
поглощаемые или выделяемые участниками
теплообмена. Очевидно, что в этом случае какие-то
теплоты должны быть положительны, а какие-то –
отрицательны. При записи уравнения теплового
баланса в виде (6) всегда t2 – конечная
температура, а t1 – начальная.
Если тело нагревается, то разность (t2 – t1)
положительна и все произведение cm(t2 – t1)
положительно. То есть Q > 0 тогда, когда теплота к
данному телу подводится.
А если t2 < t1 (тело остывает), то
разность (t2 – t1) отрицательна, то есть
Q < 0. В этом случае тело энергию выделяет.
Если при фазовом переходе энергия к телу
подводится (плавление, кипение), то Q > 0; если
тело выделяет энергию (кристаллизация,
конденсация), то Q < 0.
В принципе уравнения (5) и (6) равносильны.
Результат решения задачи не зависит от того,
каким видом уравнения пользуемся. Выбор способа
решения – за читателем.
Применим уравнение теплового баланса для
решения ряда задач (здесь приводим лишь одну
задачу, остальные материалы можно найти по
адресу http:// kirov-festival.nm.ru).
Задача 1
В медном калориметре массой 100 г находится 1 кг
воды при температуре 20° С. В воду опускают
свинцовую деталь массой 2 кг, имеющую температуру
90° С. До какой температуры нагреется вода? (В этой
и последующих задачах потерями теплоты в
калориметре пренебречь.)
Решение
 |
Проведём анализ:
Вода и калориметр При опускании в воду с температурой 20° С |
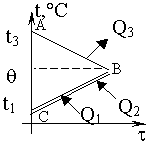 |
Изменение температур тел с течением времени удобно изображать на графике зависимости t(t ). Отрезок АВ соответствует |
| Два параллельных отрезка СВ соответствуют графикам изменения температур калориметра и воды. Стрелки, идущие к ним, показывают, что для нагревания калориметра и воды требуется энергия Q1 и Q2, которую они поглощают. |
|
| Решим задачу с использованием уравнения теплового баланса в виде (5): |
Решим задачу с использованием уравнения
теплового баланса в виде (6):
Ответ: Вода нагреется до 24° С.
Предлагаю читателю самостоятельно сделать
проверку размерности.
Напомним, остальной материал (полноценную
версию пособия) можно найти по адресу http:// kirov-festival.nm.ru.
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
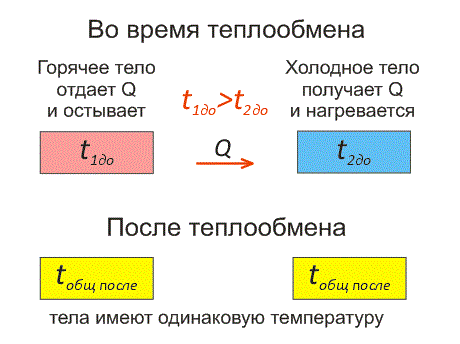
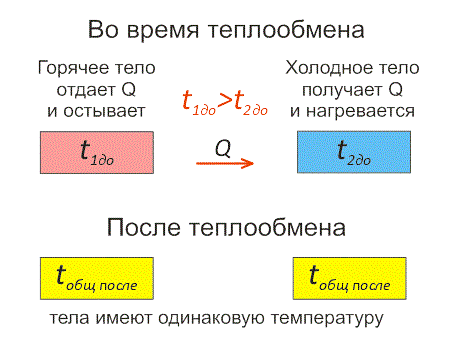
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
Определение
Термодинамика — это одна из основных частей физики. Она применяется в таких отраслях как: гидродинамика, аэродинамика, оптика, физическая химия и другие прикладные разработки.
Возникновение термодинамики относят к 19 веку, ведь именно в этот момент начала развиваться теплотехника. А термодинамика является ее теоретической основой.
Содержание современное термодинамики:
Изучение законов тепловой формы движения материи и все связанные с этим явления.
Цель термодинамики — это изучение общих закономерностей преобразования энергии.
При этом обязательно учитывается внутренняя энергия тел (Q ) , а именно ее изменение.
При этом меняться она может двумя способами:
- Совершение работы над системой. То есть преобразования механической энергии во внутреннюю энергию.
- Передача тепла — теплообмен.
Количество теплоты, которая была получена телом
В процессе теплообмена изменение внутренней энергии тела, это ни что иное как результат работы внешних сил. Однако это не та работа, которая связана со сменой внешних параметров системы, а работа производится благодаря молекулярным силам.
Пример 1
Соприкосновение тела и горячего газа. При таком взаимодействии через столкновение молекул тела с молекулами газа происходит передача энергии газа.
Мера измерения, которая применяется в процессе теплообмена при изменении внутренней энергии тела выступает количество тепла (Q).
Виды теплообмена:
- теплопроводность;
- конвекция (конвективный теплообмен);
- излучение (теплообмен при помощи излучения).
Рассмотрим пример с помощью рисунка теплообмена ниже.
Пример 2
Есть два тела:
Одно имеет более высокую температуру и второе — низкую температуру.
Первое будет остывать и отдавать тепловую энергию до тех пор, когда температура двух тел не станет идентичной. Это будет называться тепловым равновесием взаимодействующих тел.
Когда работ в системе не совершается, но при этом к ней проводится тепло. При таком раскладе в соответствии с законом сохранения энергии (первым началом термодинамики) все тепло, которое будет передано системе, идет на увеличение внутренней энергии системы:
[Delta Q=Delta U text { (№1) }]
В этом случае, [triangle U] каждого тела при нагревании будет равняться массе тела (m) умноженной на удельную теплоемкость вещества (c) и умноженное на изменение температуры тела [(triangle T)].
[Delta U=m c Delta T(text { №2) }]
При плавлении и кристаллизации для расчета [triangle U] будет использована следующая формула:
[Delta U=pm lambda m text { (№3) }]
[lambda-] удельная теплота плавления или кристаллизации вещества.
m — масса тела.
Для определения при конденсации или парообразования применяем:
[Delta U=pm r m text { (№4) }]
r — удельная теплота конденсации или парообразования.
m — масса тела.
При этом не следует забывать, что все вышеупомянутые процессы: плавление, кристаллизация, конденсация, парообразование происходят без изменения температуры, то есть при постоянной температуре.
По изложению формул под номерами три и четыре, мы можем ясно увидеть, что изменение внутренней энергии системы не зависит от температуры.
Когда топливо полностью подлежит сгоранию выделяется теплота, которую можно определить с помощью следующей формуле:
[Delta Q=Delta U=q m text { (№5) }]
q — удельная теплота сгорания топлива.
m — масса тела.
Сохранение тепловой энергии и уравнение теплового баланса
При остывании одного тела, происходит отдача тепловой энергии, то есть теплообмен с окружающей средой. Утерянная теплота Q будет иметь знак “минус”.
При нагревании тела — оно получает тепловую энергию. И та приобретенная теплота Q будет иметь знак “плюс”.
Формулы
В изолированной системе может происходить только теплообмен. Один из главных законов в физике, а именно в термодинамике, является закон сохранения и превращения энергии.
В том случае, когда в системе, которая изолирована, не происходит никаких процессов превращений кроме теплообмена, количество теплоты, которая будет отдана телами (их внутренняя энергия будет уменьшаться) будет равна количеству тепла полученного телами (их внутренняя энергия будет увеличиваться). Но не смотря на процесс теплообмена, общая -суммарная энергия системы будет неизменна и мы сможем записать первое начало термодинамики с помощью формулы:
[Delta U=sum_{i=1}^{n} Delta U_{i}=0(mathrm{№} 6)]
Это и является уравнением теплового баланса.
Также можно его выразить иначе. Общее количество тепла, которое выделилось в изолированной системе будет равное суммарному количеству тепла, которое было поглощено в системе. Записать это можно в следующем виде:
[Q_{1}+Q_{2}+Q_{2}+ldots+Q_{n}=Q_{1}^{prime}+Q_{2}^{prime}+Q_{2}^{prime}+ldots Q_{k}^{prime} text { (№7). }]
Если брать смысл теплового баланса, он заключается в сохранении энергии для процессов, связанных с теплообменом в термоизолированных системах.
Нет времени решать самому?
Наши эксперты помогут!
Пример теплообмена между холодным и горячим телом
Пример 3
В горячую воду с температурой +80 градусов Цельсия, которая имеет массу двести грамм, добавили охлажденную воду, имеющею температуру +15 градусов Цельсия с массой сто грамм.
Вопрос:
Какая температура будет у смешанной воды после того, как произойдет тепловое равновесия?
Примечание: не учитывать теплообмен с окружающей средой.
В данном случае, мы с вами рассмотрим упрощенную задачу, для лучшего понимания закона сохранения энергии. В данной задаче, мы не будем учитывать осуществляемый теплообмен с емкостью, которая наполнена водой.
Решение:
Считаем систему изолированной, так как в условии было сказано, что окружающая среда не будет участвовать в теплообмене.
Из-за того, что теплообмен с окружающей средой и воздухом происходить не будет, вся тепловая энергия, которую получит холодная вода, будет отдана горячей водой
- Записываем уравнение теплового баланса:
[Q_{text {остывания горячей воды }}+Q_{text {нагревания холодной воды }}] - Записываем формулу для каждого количества теплоты:
[Q_{text {остывания горячей воды }}=mathrm{C}_{text {воды }}^{*} m_{text {горячей воды }} *left(t_{text {общ }}-t_{text {горячей воды }}right)]
[Q_{text {нагревания холодной воды }}=mathrm{C}_{text {воды }}^{*} m_{text {холодной воды }}^{*}left(t_{text {общ }}-t_{text {холодной воды }}right)]
Примечания:
- [c_{воды}] — берем из справочника
- Массу воды обязательно переводим в килограммы
- Разность [left(t_{text {общ }}-t_{text {горячей воды }}right)] будет с отрицательным знаком, потому что ее окончательная температура будет меньше ее изначальной.
- Подставляем выражения и выводим окончательную формулу:
[c_{text {воды }} * m_{text {горячей воды }} *left(t_{text {общ }}-t_{text {горячей воды }}right)+c_{text {воды }} * m_{text {холодной воды }} * left(t_{о б щ}-t_{text {холодной воды }}right)] - Заменяем символы числами:
[begin{aligned}
&4200 * 0,2 *left(t_{text {общ }}-80right)+4200 * 0,1 *left(t_{text {общ }}-15right)=0 \
&840 *left(t_{text {общ }}-80right)+420 *left(t_{text {общ }}-15right)=0
end{aligned}] - Раскрываем скобки и получаем ответ [t_{text {общ }}=58,33]
Ответ: Температура смешанной воды будет равна 58,33 градуса Цельсия.
Пример на определение массы пара
Пример 4
В латунный калориметр, который имеет массу [m_{k}=0.1] килограмм со льдом, который имеет массу [m_{i}=1] килограмм , которые имеют общую температуру [T_{k i}=200 mathrm{~K}], начали пускать пар, который имеет температуру [T_{p}=400 mathrm{~K}]. После этого, в калориметре изменилась температура и стала постоянной [Theta=300 K].
Вопрос:
Какую массу имел пар?
Примечание:
Считать, что система, состоящая из льда, колориметра и пара — изолирована. Следовательно, теплообмена с окружающей средой нет.
Решение:
Исходя из условия задачи, мы можем сделать вывод, что все процессы теплообмена, которые будут происходить в системе, можно описать с помощью уравнения теплового баланса, учитывая агрегатные превращения.
В результате того, что лед плавится при помощи пара, калориметр наполняется водой ( если делать выводы по температуре, которая установилась в калориметре [Theta=300 K=27] градусов Цельсия). Происходит теплообмен сред: пар отдает свою теплоту, а калориметр со льдом её получают.
К исходным данным добавляем справочные:
- Удельная теплоемкость пара [c_{p}=1,7 * 10^{3} frac{text { Дж }}{кгК}]
- Удельная теплоемкость воды [c_{v}=4,2 * 10^{3}frac{text{ Дж }}{кгК}]
- Удельная теплоемкость льда [c_{i}=2,1 * 10^{3} frac{text { Дж }}{кгK}]
- Удельная теплоемкость латуни [c_{k}=0,386 * 10^{3} frac{ text { Дж }}{кгК}]
- Удельная теплотапарообразования воды [r=2,1 * 10^{6} frac{text { Дж }}{кг}]
- Удельная теплотапри плавлении льда [lambda=3,3 * 10^{5} frac{text { Дж }}{кг}]
Чтобы решить данную задачу, мы должны описывать каждую стадию изменения внутренней энергии.
- Пар, когда отдает теплоту, начинает остывать от своей температуры [T_{p}] до конденсированной [T_{k o n d}], которая равняется 373 К.
- Пар будет конденсироваться при постоянной температуре
- Вода, которая была получена из пара будет остывать до температуры [Theta].
- Как результат внутренняя энергия пара становится меньше [Delta U_{1}=Q_{o t d}=m_{p} c_{p}left(T_{p}-T_{c o n d}right)+m_{p} r+m_{p} c_{v}left(T_{k o n d}-Thetaright)].
- Происходит нагревания льда благодаря тому, что он получает теплоту от пара и он от [T_{k i}] доходит до [T_{text {plav }}] и равняется 273 K.
- Плавление льда
- Нагревание воды до температуры [Theta].
- Как результат, внутренняя энергия льда будет увеличена.
[Delta U_{1}=Q_{text {poluch }}=m_{i} c_{i}left(T_{text {plav }}-T_{k i}right)+m_{i} lambda+m_{i} c_{v}(Theta-T_{text {plav }})] - Происходит теплообмен с калориметром и он нагревается до [Theta].
Составляем уравнение теплового баланса:
[Delta U_{1}=Delta U_{2}+Delta U_{3}]
Для описания всего процесса составим уравнение теплового баланса:
[begin{aligned}
&m_{p} c_{p}left(T_{p}-T_{text {cond }}right)+m_{p} r+m_{p} c_{v}left(T_{text {kond }}-Thetaright)= \
&m_{i} c_{i}left(T_{text {plav }}-T_{k i}right)+m_{i} lambda+m_{i} c_{v}left(Theta-T_{text {plav }}right)+ \
&m_{k} c_{k}left(Theta-T_{k i}right)
end{aligned}]
[m_{p}=frac{m_{i} c_{i}left(T_{p l a v}-T_{k i}right)+m_{i} lambda+m_{i} c_{V}left(Theta-T_{text {plav }}right) m_{k} c_{k}left(Theta-T_{k i}right)}{c_{p}left(T_{p}-T_{text {cond }}right)+r+c_{V}left(T_{text {kond }}-Thetaright)}]
Заменяем символы на цифры:
[begin{aligned}
&m_{p}= \
&frac{1 * 2,1 * 10^{3} *(273-200)+1 * 3,3 * 10^{5}+1 * 4,2 * 10^{3} *(300-273)+0.1 * 3,9 * 10^{3} *}{1.7 * 10^{3} *(400-373)+2,1 * 10^{6}+4,2 * 10^{3} *(373-300)} \
&=frac{9,8 * 10^{5}}{2.5 * 10^{6}}=0.392(кг)
end{aligned}]
Ответ: Масса пара будет равна примерно 392 грамма.
Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
Теплообмен
Другим способом изменения внутренней энергии термодинамической системы является теплообмен.
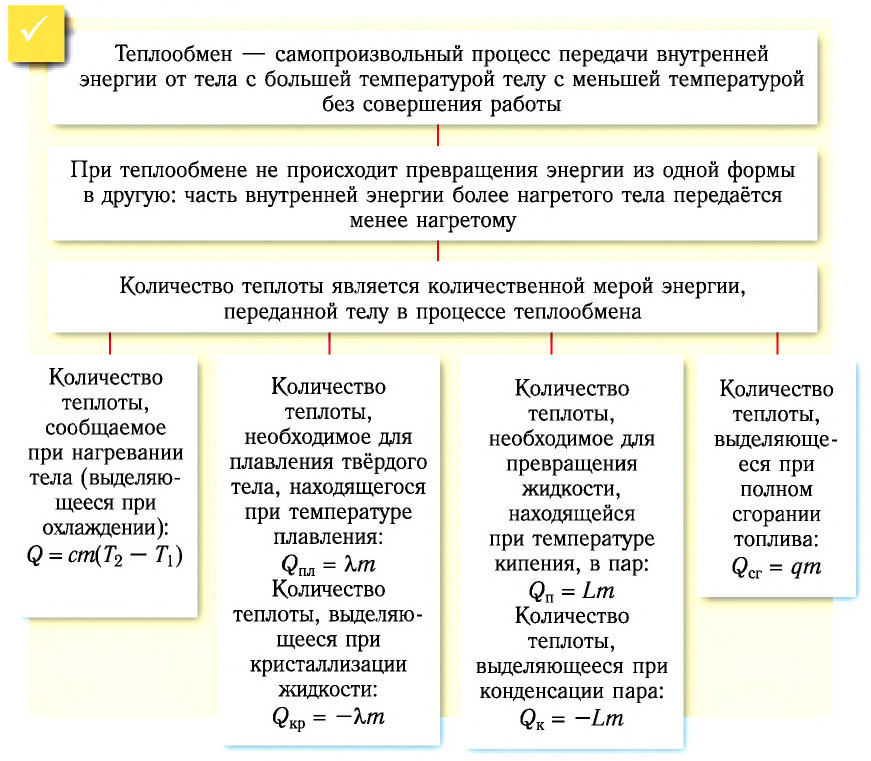
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
Количество теплоты и удельная теплоёмкость
Количественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где 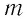
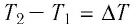
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин 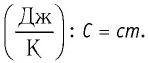
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 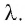
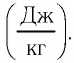
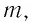
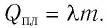
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм 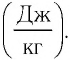
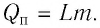
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания 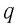
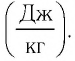
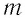
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
- Заказать решение задач по физике
Примеры решения задач
Пример №1
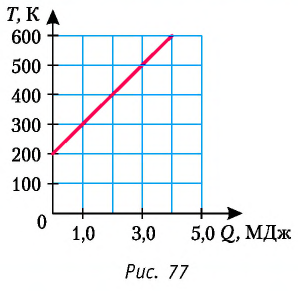
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры 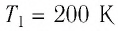
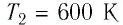
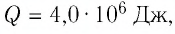
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: 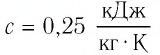
Пример №2
В налитую в сосуд воду, масса которой 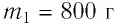
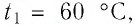
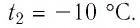
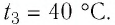
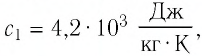
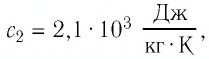
Решение:
Ответ:
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
Роман Алексеевич Лалетин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Как уже отмечалось, в термодинамике изучают общие закономерности преобразования энергии. Учитывается изменение внутренней энергии тел ($triangle U$). Ее изменение возможно двумя способами: совершением над системой работы (превращение механической энергии во внутреннюю) и передачей тепла (теплообмена).
Количество теплоты, полученное телом
Процесс обмена внутренними энергиями соприкасающихся тел, который не сопровождается совершением работы, называется теплообменом. Энергия, которая передана телу в результате теплообмена, называется количеством теплоты, полученным телом. Вообще говоря, изменение внутренней энергии тела в процедуре теплообмена – результат работы внешних сил, только это не работа, связанная с изменением внешних параметров системы. Это работа, которую производят молекулярные силы. Например, если привести в соприкосновении тело с горячим газом, то энергия газа передается через столкновения молекул газа с молекулами тела.
Сделаем домашку
с вашим ребенком за 380 ₽
Уделите время себе, а мы сделаем всю домашку с вашим ребенком в режиме online
Бесплатное пробное занятие
*количество мест ограничено
Мерой изменения внутренней энергии тела в процессе теплообмена выступает количество теплоты ($Q$).
В том случае, когда в системой работа не совершается, а тепло к системе подводится, то в соответствии с первым началом термодинамики (да законом сохранения энергии, что, в общем, эквивалентно) все тепло, переданное телу (системе), идет на изменение (увеличение) внутренней энергии тела (системы):
[triangle Q=triangle Uleft(1right).]
В таком случае $triangle U$ каждого тела системы при нагревании:
[triangle U=mctriangle T left(2right),]
где m — масса тела, c — удельная теплоемкость вещества, $triangle T$- изменение температуры тела.
$triangle U$ при плавлении или кристаллизации:
[triangle U=pm lambda m left(3right),]
где $lambda $ — удельная теплота плавления вещества.
$triangle U$ при парообразовании или конденсации:
[triangle U=pm rm left(4right),]
где r — удельная теплота парообразования.
Здесь необходимо напомнить, что процессы плавления, кристаллизации, парообразовании, конденсации происходят при постоянных температурах. Из формул (3 и 4) видно, что изменение внутренней энергии тела от температуры не зависит.
При полном сгорании топлива выделяется количество теплоты, которое определяется формулой:
[triangle Q=triangle U=qm left(5right),]
где q — удельная теплота сгорания топлива.
Уравнение теплового баланса
В системе, если она изолирована, происходит только теплообмен. Одним из основных законов физики и, в частности, термодинамики является закон сохранения и превращения энергии. Если в изолированной системе тел не происходит никаких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых увеличивается. При этом суммарная энергия системы не изменяется, и тогда первое начало термодинамики записывается в следующем виде:
[triangle U=sumlimits^n_{i=1}{triangle U_i=0}(6)]
Это уравнение называют уравнением теплового баланса.
Или по-другому: суммарное количества теплоты, которое выделяется в теплоизолированной системе равно количеству теплоты (суммарному), которое в этой системе поглощается.
[Q_1+Q_2+Q_2+dots +Q_n=Q’_1+Q’_2+Q’_2+dots Q’_kleft(7right).]
По своему смыслу уравнение теплового баланса — это закон сохранения энергии для процессов теплообмена в термоизолированных системах.
«Теплообмен. Уравнение теплового баланса» 👇
Пример 1
Задание: В латунный калориметр массой $m_k=$0,1 кг со льдом массы $m_i=$1,0 кг, имеющих температуру $Т_{ki}=$200 К, пустили пар при температуре $Т_p=$400 К, после чего в калориметре установилась температура $theta =$300 К. Определить массу $m_p$ пара. Считать систему лед-калориметр-пар изолированной.
Решение:
По условию задачи теплообмен рассматриваемой системы с внешней средой не происходит. Поэтому внутренняя энергия системы не изменяется. Значит, все процессы, происходящие в системе, можно описать уравнением теплового баланса с учетом агрегатных превращений. В результате процесса плавления льда с помощью пара в калориметре останется вода (если судить по температуре, которая установилась по условию задачи ${theta =300К=27{rm{}^circ!C}}$). В системе пар отдает теплоту (его внутренняя энергия уменьшается), а калориметр и лед теплоту получают (их внутренняя энергия увеличивается).
Добавим к исходным данным необходимые нам табличные данные:
Удельная теплоемкость пара $c_p$=1,7${cdot 10}^3frac{Дж}{кгК}$,
Удельная теплоемкость воды $c_v$=4,2$cdot {10}^3frac{Дж}{кгК}$,
Удельная теплоемкость льда $c_i$=2,1$cdot {10}^3frac{Дж}{кгК}$,
Удельная теплоемкость латуни $c_k$=0, 386$cdot {10}^3frac{Дж}{кгК}$,
Удельная теплота парообразования воды $r$=2,1$cdot {10}^6frac{Дж}{кг}$
Удельная теплота плавления льда $lambda $=3,3$cdot {10}^5frac{Дж}{кг}$
При решении задачи необходимо описать все стадии изменения внутренней энергии тел.
- Пар, отдавая теплоту, остывает от температуры $Т_p$ до $Т_{kond}$=373К (температура конденсирования водяного пара при нормальных условиях).
- Пар конденсируется при постоянной температуре $Т_{kond}$.
- Полученная из пара вода остывает до температуры $theta $.
- Лед, получая теплоту, нагревается от $Т_{ki}$ до $Т_{plav}$=273 К (температура плавления льда при нормальных условиях).
- Лед плавится.
- Вода (полученная изо льда) нагревается до температуры $theta $.
- Калориметр, принимая теплоту, нагревается от $Т_{ki}$ до $theta $.
В результате внутренняя энергия пара уменьшается на:
$triangle U_1=Q_{otd}=m_pc_p(Т_p-Т_{kond}$)+$ m_pr+m_pc_v(Т_{kond}$-$ theta )$
В результате внутренняя энергия льда увеличивается на:
$triangle U_2=Q’_{poluch}=m_ic_i(Т_{plav}-Т_{ki}$)+$ m_ilambda +m_ic_v({theta -Т}_{plav})$.
В результате его внутренняя энергия возрастает на:
[triangle U_3=Q”_{poluch}=m_kc_k(theta -T_{ki})]
Составим уравнение теплового баланса:
$triangle U_1=triangle U_2+triangle U_3$ или $Q_{otd}=Q’_{poluch}+Q”_{poluch}$
Для описания, имеющегося у нас процесса, уравнение теплового баланса получит вид:
$m_pc_p(Т_p-Т_{kond}$)+$ m_pr+m_pc_v(Т_{kond}$-$ theta )$=$ m_ic_i(Т_{plav}-Т_{ki}$)+$ m_ilambda +m_ic_vleft({theta -Т}_{plav}right)+m_kc_k(theta -T_{ki})$
откуда
[m_p=frac{m_ic_i(Т_{plav}-Т_{ki})+ m_ilambda +m_ic_vleft({theta -Т}_{plav}right)+m_kc_k(theta -T_{ki}) }{c_p(Т_p-Т_{kond})+ r+c_v(Т_{kond}- theta )}]
Подставим имеющиеся данные, произведем расчет:
[m_p=frac{1,cdot 2,1cdot {10}^3left(273-200right)+1cdot 3,3cdot {10}^5+1cdot 4,2cdot {10}^3left(300-273right)+0,1cdot 3,9cdot {10}^3(300-200)}{1,7{cdot 10}^3left(400-373right)+2,1cdot {10}^6+4,2cdot {10}^3(373-300)}=frac{2,1cdot {10}^3cdot 73+3,3cdot {10}^5+4,2cdot {10}^3cdot 27+3,9cdot {10}^2cdot 100}{1,7{cdot 10}^3cdot 27+2,1cdot {10}^6+4,2cdot {10}^3cdot 73}=frac{1,5cdot {10}^5+3,3cdot {10}^5+1,1cdot {10}^5+3,9cdot {10}^5}{4,59{cdot 10}^3+2,1cdot {10}^6+3,1{cdot 10}^5}=frac{9,8cdot {10}^5}{2,5cdot {10}^6}=0,392 (кг)]
Ответ: Масса пара приблизительно 392 гр.
Пример 2
Задание: Снеготаялка имеет КПД ($eta $) равный 25%. Какую массу льда модно растопить, если сжечь ($m_w$) 1 тонну дров, а температура льда минус $t_i=-$100C$to T_i=263K$.
Решение:
Удельная теплота плавления льда $lambda $=3,3$cdot {10}^5frac{Дж}{кг}$.
Удельная теплоемкость льда $c_i$=2,1$cdot {10}^3frac{Дж}{кгК}.$
Удельная теплота сгорания дров q = 12,6$cdot {10}^6frac{Дж}{кг}.$
Количество теплоты, которое пойдет на плавление льда, рассчитаем как:
[Q^+=eta Q=eta qm_{w }left(2.1right).]
Формула для расчета количества теплоты, которое необходимо для того, чтобы расплавить массу льда, равную m, будет иметь вид:
[Q^-=mc_ileft(T_0-T_iright)+lambda m left(2.2right),]
где $T_0=273 K$ — температура плавления льда при нормальных условиях.
Составим уравнение теплового баланса, выразим искомую массу:
[Q^+=Q^-=eta qm_{w }=mc_ileft(T_0-T_iright)+lambda m to m=frac{eta qm_{w }}{c_ileft(T_0-T_iright)+lambda }left(2.3right).]
Все данные в СИ, проведем расчет:
[m=frac{0,25cdot 12,6cdot {10}^61000}{2,1cdot {10}^3cdot 10+3,3cdot {10}^5}=frac{3,15cdot {10}^9}{3,51cdot {10}^5}approx 9cdot {10}^3left(кгright).]
Ответ: Можно расплавить примерно 9т льда.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме