Закономерности протекания химических реакций. Теплоты образования веществ
Задача 293.
Определить  образования этилена, используя следующие данные:
образования этилена, используя следующие данные:
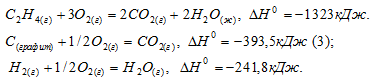
Решение:
Обозначим искомую величину [ (С2Н4)] за x. Для расчета
(С2Н4)] за x. Для расчета  (С2Н4) используем уравнение из следствия закона Гесса:
(С2Н4) используем уравнение из следствия закона Гесса:
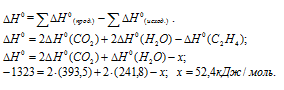
Ответ: 52,4 кДж/моль.
Задача 294.
Сравнить  реакции восстановления оксида железа (III) различными восстановителями при 298 К:
реакции восстановления оксида железа (III) различными восстановителями при 298 К:
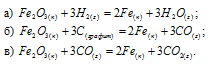
Решение:
По табличным данным стандартные энтальпии образования Fe2O3(к), Н2O(г) и СО(г) соответственно равны -822,2, -241,8, -110,5 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета  используем уравнение из следствия закона Гесса:
используем уравнение из следствия закона Гесса:
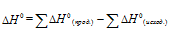
Тогда
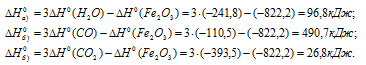
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) 26,8 кДж.
Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 200С до 300С по формуле:
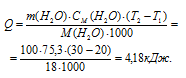
Табличные данные стандартных энтальпий образования СН4(г), Н2О(ж) и СО2(г) соответственно равны -74,9, -285,8 и -393,5кДж/моль. Стандартные энтальпии простых веществ принято считать равными нулю.
Уравнение реакции горения метана имеет вид:
CH4(г) + 2О2(г) = СО2(г) + 2Н2О(ж)
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
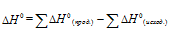
Тогда
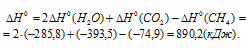
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
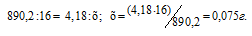
Ответ: 0,075г.
Задача 296.
Вычислить  образования MgСО3(к.) при 298 К, пользуясь следующими данными:
образования MgСО3(к.) при 298 К, пользуясь следующими данными:
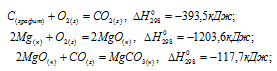
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
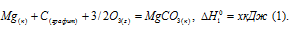
Затем запишем уравнения реакций образования CO2, MgO и MgCO3 из CO2 и MgO:
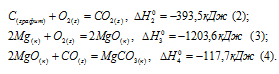
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
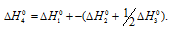
Подставляя значения энтальпий образования веществ, находим искомую величину:
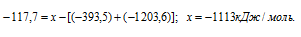
Ответ: -1113 кДж/моль.
Задача 297.
Исходя из  образования Н2О(г) и следующих данных:
образования Н2О(г) и следующих данных:
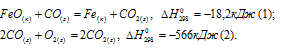
вычислить  реакции:
реакции:
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение  можно вычислить, если из 1/2 второго уравнения вычесть первое уравнение, получим:
можно вычислить, если из 1/2 второго уравнения вычесть первое уравнение, получим:
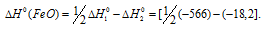
Тогда  можно найти согласно следствию закона из Гесса:
можно найти согласно следствию закона из Гесса:
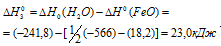
Ответ: 23,0 кДж.
Условие задачи полностью выглядит так:
6*. Определите теплоту образования этилена, если
Задача из главы Химические реакции по предмету Химия из задачника Химия 11, Габриелян (11 класс)
Если к данной задачи нет решения – не переживайте. Наши администраторы стараются дополнять сайт решениями для тех задач
и упражнения где это требуется и которые не даны в решебниках и сборниках с ГДЗ. Попробуйте зайти позже. Вероятно, вы найдете то, что искали 🙂
Рады приветствовать учеников всех учебных заведений всех возрастов на нашем сайте!
Здесь вы найдете решебники и решения задач бесплатно, без регистрации.
Горение C2H4 выражается уравнением:
C2H4 + 3O2 = 2C O2 + 2 H2O
В уравнении реакции 1 моль этилена, значит в термохимическом уравнении тепловой
эффект нужно соотнести именно с 1 моль этилена. Если при горении 2 моль этилена
выделяется 2822 кДж теплоты, то при горении 1 моль этилена будет выделяться в 2 раза
меньше теплоты, то есть 1411 кДж и термохимическое уравнение имеет вид:
C2H4 + 3O2 = 2CO2 + 2H2O + 1411 кДж
Теплоты образования продуктов реакции
C + O2 = CO2 + 393 кДж
H2 + 1/2O2 = H2O + 286кДж
Соответствующее уравнение для теплоты образования этилена
2C + 2H2 = C2H4 + Q
Необходимо рассчитать Q
Выразим из каждого уравнения образование сложного вещества, поступая с членами
термохимического уравнения так же, как с членами алгебраического уравнения, используя
перенос в другую часть уравнения с противоположным знаком.
CO2: C + O2 – 393 = CO2
H2O: H2 + 1/2O2 – 286 = H2O
C2H4: 2C + 2H2 – Q = C2H4
Подставим в термохимическое уравнение горения этилена
2C + 2H2 – Q + 3O2 = 2(C + O2 – 393) + 2(H2 + 1/2O2 – 286) + 1411
2C + 2H2 – Q + 3O2 = 2C + 2O2 – 786 +2H2 + O2 – 572 +1411
Сокращаем 2C, 2H2, 3O2 – 2O2, O2
Остается:
-Q = 1411 – 572 – 786 = 53
Q = -53 кДж
Соответственно теплота образования этилена из простых веществ равна -53 кДж/моль
Найдите правильный ответ на вопрос ✅ «При сгорании 2 моль этилена в кислороде выделилось 2822 кДж теплоты. Определите теплоту образования этилена, если теплоты образования СО2 и …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » При сгорании 2 моль этилена в кислороде выделилось 2822 кДж теплоты. Определите теплоту образования этилена, если теплоты образования СО2 и Н2 О равны 393 кДж/моль и 286 кДж/моль соответственно.
Ле Мур
Просветленный
(28048)
12 лет назад
Согласно следствию из закона Гесса, тепловой эффект реакции равен разности межу энтальпиями образования продуктов реакции и энтальпиями образования исходных веществ. При этом энтальпия образования простых веществ равна 0. Составим термохимическое уравнение для данной реакции:
∆Н р-ции = (2∆ Н0298 (СО2 ) + 2∆ Н0298 (Н2О )) – ∆ Н0298 (С2H4 )
Из полученного уравнения выразим энтальпию образования этилена:
∆ Н0298 (С2H4 )= ∆Н р-ции – (2∆ Н0298 (СО2 ) + 2∆ Н0298 (Н2О )
Подставляя исходные значения, получим:
∆ Н0298 (С2H4 )= -1408,0 – (2*(-393,5) + 2*(-285,8)) = -49,4 кДж/моль
