В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.

Благодаря закону Гесса (закону аддитивности теплот реакций) нам совсем не нужно считать теплоты всех реакций; достаточно иметь сведения о теплОтах лишь того минимума реакций, из которых можно получить все остальные. Подобный минимум, принятый всеми учеными и инженерами, представляет собой теплоты образования соединений из входящих в них чистых элементов в стандартных состояниях. А что же такое: стандартные состояния?
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
* Кельвин (обозначение «К») – еще один показатель измерения температуры, наряду с Цельсия. Пока вам просто следует запомнить, что 0°С = 273 К, соответственно 1°С = 274 К, -1°С = 272 К, а -273°С = 0 К. Самой низкой температурой считается 0 К и называется абсолютным нулем.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
- C(графит) + 2H2(г.) → CH4(г.) ΔH = -74,8 кДж (1)
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- H2(г.) + ½O2(г.) → H2O(ж.) ΔH = -285,8 кДж (3)
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.

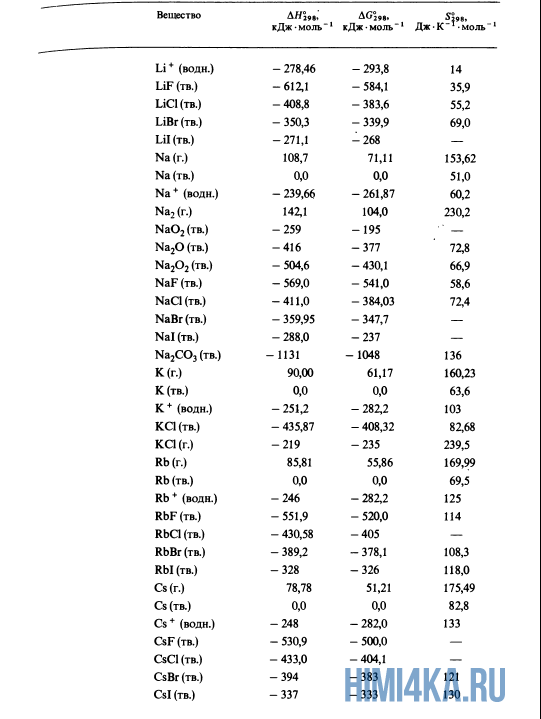
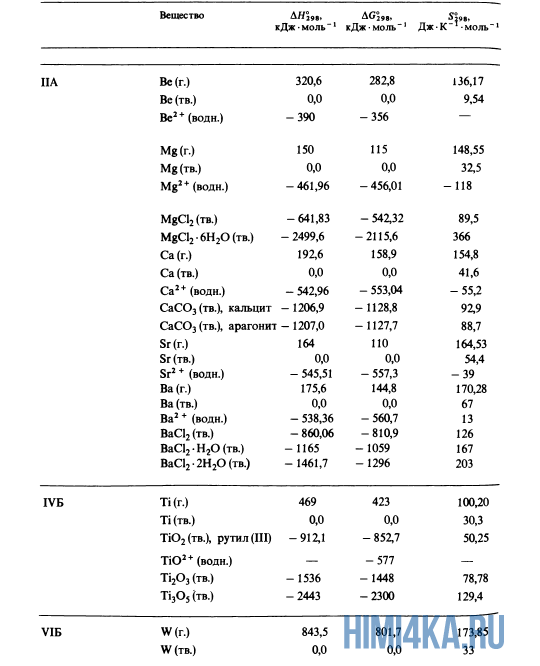
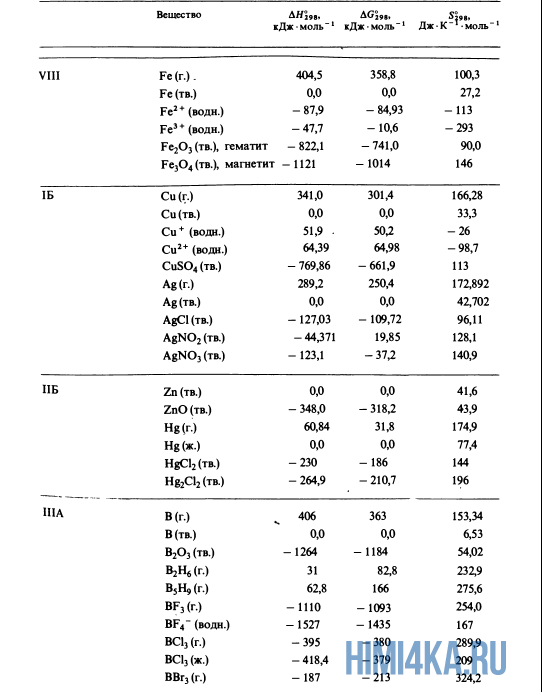
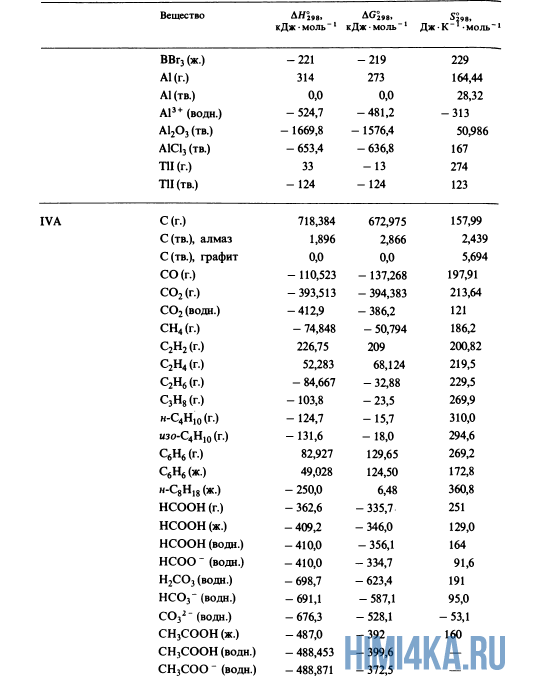
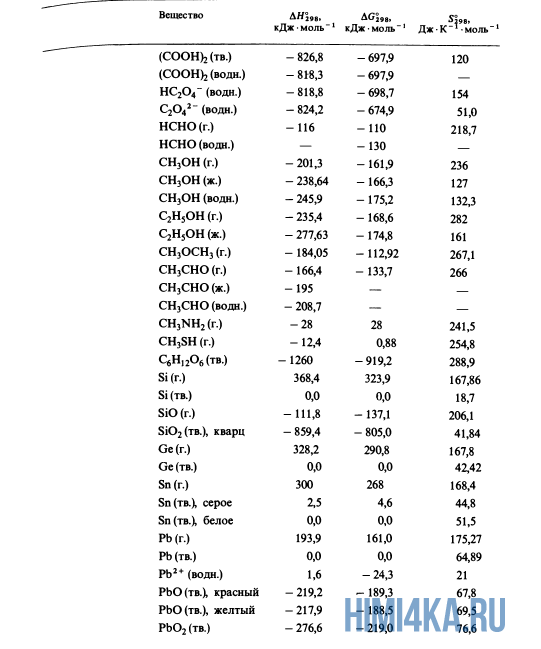
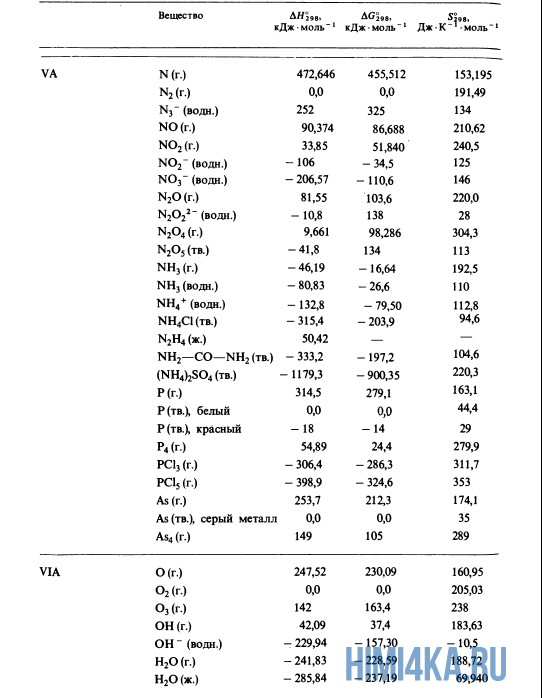
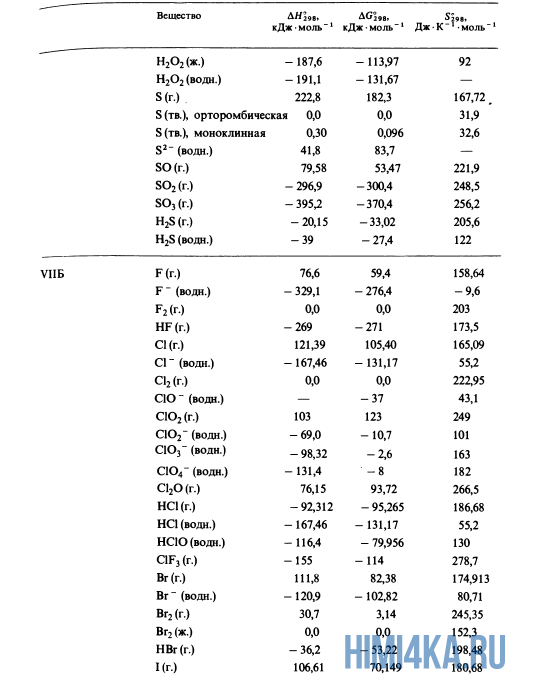
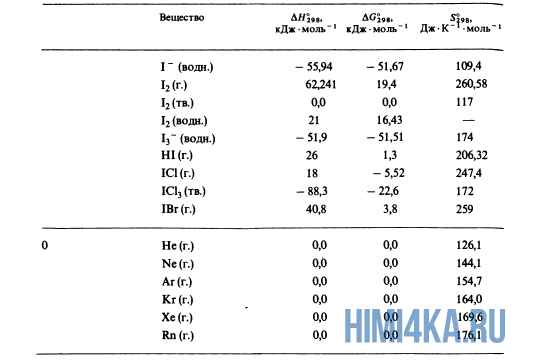
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- 2H2(г.) + O2(г.) → 2H2O(ж.) ΔH = -571,6 кДж 2×(3)
- CH4(г.) → C(графит) + 2H2(г.) ΔH = +74,8 кДж -(1)
В итоге получаем:
- CH4(г.) + O2(г.) → C(алмаз) + 2H2O(ж.) ΔH = -494,9 кДж (4)
Теплота реакции вычисляется точно таким же способом, просто из теплот образования продуктов реакции вычитаем теплоты образования реагентов, учитывая все коэффициенты:
- ΔH = (+1,9) + 2(-285,8) — (-74,8) = -494,9 кДж
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Решение:
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
- Fe2O3(тв.) + 3C(графит) → 2Fe(тв.) + 3CO(г.)
- -822,1 0,0 0,0 -110,5 ΔH, кДж·моль-1
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
- ΔH° = 2(0,0) + 3(-110,5) — (-822,1) — 3(0,0) = +490,6 кДж
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Решение:
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
- 2C6H6(ж.) + 15O2(г.) → 12CO2(г.) + 6H2O(ж.)
- +49 0,0 -393,5 -285,8 ΔH, кДж·моль-1
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
- ΔH = 12(-393,5) + 6(-285,8) — 2(+49,0) — 15(0,0) = -6540 кДж
Следовательно, теплота сгорания 1 моля бензола должна быть равна половине этой величины, т.е. -3270 кДж·моль-1.
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
Стандартные теплоты образования и сгорания.
Закон
Гесса дает возможность рассчитать
теплоты множества реакций по минимальному
числу теплот некоторых реакций. Для
этого используются стандартные теплоты.
Стандартная
теплота образования
(Ноf,
298)
это тепловой эффект реакции образования
1 моля вещества из простых веществ,
взятых в их обычном соотношении и при
стандартных условиях : Р = 1 атм, Т = 298 К.
Считают,
что простые вещества реагируют в виде
той модификации и в том агрегатном
состоянии, которые отвечают наиболее
устойчивому состоянию элементов при
данных Р и Т. При этих условиях теплота
образования принимается равной нулю
(например, для О2,
N2,
S,
C
…). Соединения, для которых теплота
образования
Ноf,
298 положительна
эндотермические,
для которых Ноf,
298
0
экзотермические.
Зная
стандартные теплоты образования всех
участников реакции, можно рассчитать
тепловой эффект самой реакции. Следствие
из закона Гесса:
тепловой
эффект химической реакции равен сумме
стандартных теплот образования продуктов
реакции за вычетом суммы стандартных
теплот образования исходных веществ.
аA
+ bB
= cC
+ dD
(Но298)x
= c
(Ноf,
298)C
+ d
(Ноf,
298)D
a
(Ноf,
298)A
b
(Ноf,
298)B
(Но298)x
=
n
(Ноf,
298)конеч.в-в
n
(Ноf,
298)нач.в-в
Стандартные
теплоты образования табулированы.
Стандартная
теплота сгорания
(Hoc,
298)
тепловой эффект реакции взаимодействия
1 моля вещества с кислородом с образованием
при этом продуктов полного окисления
при стандартных условиях (Р = const,
Т = 298 К). Тепловой эффект реакции можно
рассчитать по теплотам сгорания исходных
и конечных веществ :
(Но298)x
=
n
(Нoc,
298)нач.в-в
n
(Нoc,
298)конеч.в-в
Теплоты
сгорания часто используются для
нахождения теплот реакций органических
соединений, которые почти никогда не
протекают однозначно и до конца. Это
объясняется двумя причинами : 1) горение
в кислороде является реакцией, общей
для всех органических веществ и идущей
при соблюдении некоторых условий до
конца, т.е. полностью и однозначно; 2)
техника сожжения органических веществ
при V
= const
достигла высокого совершенства и
позволяет определить теплоту сгорания
с точностью до
0,02% . Комбинируя теплоты сгорания, можно
вычислить теплоту любой химической
реакции между органическими веществами.
Примеры :
-
Найдем
теплоту реакции
С6Н6
(ж) = 3С2Н2
НоI
= ? (I)
Теплоты
сгорания известны :
С6Н6
+ 7
О2
= 6СО2
+ 3Н2О
(ж) ; НоII
=
780980 кал (II)
C2H2
+ 2
O2
= 2CO2
+ H2O
(ж)
;
HoIII
=
310620 кал
(III)
(I)
= (II)
3 (III) ; HoI
= HoII
3HoIII
= 150880 кал
-
Найдем
с помощью теплот сгорания теплоту
образования органического вещества :
(теплота образования кислорода равна
нулю)
С2Н2
+ 2
О2
= 2СО2
+ Н2О
; Нoc,
298 известна
Нoc,
298 = 2![]()
+
![]()
![]()
=
2![]()
+
Нoc,
298
Недостаток
расчета теплот реакций по теплотам
сгорания
(большой, но неизбежный)
уменьшение относительной точности
получаемых результатов по сравнению с
точностью исходных данных : во-первых,
идет сложение ошибок, допущенных при
измерении теплот сгорания органических
реагентов; во-вторых, теплота реакции
между реагентами почти всегда много
меньше теплот сгорания реагентов. Во
многих случаях относительная ошибка
получаемой величины равна нескольким
процентам (до нескольких десятков
процентов).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Приветствую вас, уважаемые читатели, на своем канале!
В данной статье разберем вопрос 27 – расчеты теплового эффекта (по термохимическим уравнениям).
Теорию по данному заданию можно посмотреть здесь.
Данное задание не претерпело изменений. Рассмотрим пять примеров.
Пример 1 (из демонстрационного варианта ЕГЭ 2022)
Синтез аммиака протекает в соответствии с термохимических уравнением реакции:
N2(г) + 3H2(г) = 2NH3(г) + 92 кДж.
Определите количество теплоты, которое выделится в результате образования 560 мл (н.у.) газообразного аммиака. (Запишите число с точностью до сотых.)
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
2) Переведем объем в литры – 0,56 л, количество теплоты обозначим за Q. Все эти данные подпишем над уравнением реакции:
3) Так как известен объем аммиака (NH3), то по реакции объем равен: 2*22,4:
4) Составим пропорцию и решим ее:
0,56/44,8 = Q/92
Q = 1,15 кДж.
Ответ: 1,15
Пример 2 (авторы: Е.А. Дацук и A.А. Степенин 2022)
В реакцию, термохимическое уравнение которой
C2H5OH(ж) + 3O2(г) = 2CO2(г) + 3H2O(ж) + 1374 кДж,
вступило 16,1 г этанола. Вычислите количество выделившейся при этом теплоты (в кДж). Ответ запишите с точностью до десятых.
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
2) Масса этанола (С2H5OH) равна 16,1 г; количество теплоты обозначим за Q. Все эти данные подпишем над уравнением реакции:
3) Так как известна масса этанола (С2H5OH), то по реакции масса равна: 1*46:
4) Составим пропорцию и решим ее:
16,1/46 = Q/1374
Q = 480,9 кДж.
Ответ: 480,9
Пример 3 (авторы: Е.А. Дацук и A.А. Степенин 2022)
Теплота образования оксида алюминия из простых веществ составляет 1676 кДж/моль. Вычислите объем кислорода (при н.у.), вступивший в реакцию с алюминием, если в результате получено 502,8 кДж тепла. Ответ запишите с точностью до сотых.
Решение
1) Запишем уравнение реакции и укажем тепловой эффект реакции:
Откуда взялось число 3352? В условии сказано, что для 1-го моль оксида алюминия теплота составляет 1676 кДж, соответственно, для 2-х моль – 3352 кДж.
2) Объем кислорода (O2) обозначим за V, теплота равна 502,8 кДж. Все эти данные подпишем над уравнением реакции:
3) Необходимо найти объем кислорода (O2), поэтому по реакции объем равен: 3*22,4:
4) Составим пропорцию и решим ее:
V/67,2 = 502,8/3352
V = 10,08 л.
Ответ: 10,08
Пример 4 (автор: Ю. Н. Медведев 2022)
Определите тепловой эффект реакции
2С2H2 + 5O2 = 4CO2 + 2H2O + Q,
если известно, что при сгорании 3,36 л (при н.у.) ацетилена выделяется 195,75 кДж теплоты. (Запишите число с точностью до целых.)
Решение
1) Перепишем уравнение реакции, укажем мольное соотношение и тепловой эффект по реакции:
Тепловой эффект – неизвестный параметр, который необходимо найти.
2) Известен объем ацетилена (С2H2) 3,36 л и теплота 195,75 кДж. Все эти данные подпишем над уравнением реакции:
3) Так как известен объем ацетилена (С2H2), то объем по реакции равен: 2*22,4:
4) Составим пропорцию и решим ее:
3,36/44,8 = 195,75/Q
Q = 2610 кДж.
Ответ: 2610
Пример 5 (авторы: С.И. Широкопояс и И.С. Борисов 2022)
При сгорании навески неизвестного органического вещества выделяется 560 кДж теплоты и образуется 60 л углекислого газа. Вычислите количество теплоты, выделяющееся при образовании 108 л углекислого газа в тех же условиях. (Запишите ответ с точностью до целых)
Решение
Данную задачу можно решить через пропорцию без уравнения реакции, так как даны одинаковые условия.
Составим пропорцию:
60 л – 560 кДж
108 л – Q кДж, где Q – теплота, выделяющаяся при образовании 108 л углекислого газа (CO2).
Q = 1008 кДж.
Ответ: 1008
Если есть вопросы, то пишите в комментариях.
Разборы примеров предыдущих вопросов можно посмотреть здесь:
– вопрос 1;
– вопрос 2;
– вопрос 4.
Не забываем поставить лайк этой статье и подписаться на канал!
Всем успехов в изучении химии!
Химические процессы, как правило,
сопровождаются тепловым эффектом, который
характеризуется не только абсолютной величиной,
но и знаком. Исторически сложились две системы
отсчета: термохимическая и термодинамическая. В
термохимической системе отсчета тепловой эффект
экзотермической реакции принято считать
положительным, поскольку процесс сопровождается
выделением теплоты (экзо – внешний).
Эндотермические реакции сопровождаются
отрицательным тепловым эффектом, так как теплота
поглощается системой (эндо – внутренний). В
термодинамике принята обратная система знаков:
теплота, поглощенная системой, считается
положительной; теплоте, отданной системой,
присваивается знак минус. В термодинамической
системе знаков тепловой эффект реакции
отождествляется с изменением энтальпии системы.
При записи термохимического уравнения в этой
системе тепловой эффект не включается в
уравнение реакции, а записывается рядом с ним.
Обобщения термохимических закономерностей
дает основной закон термохимии,
сформулированный в 1836 году русским ученым Г.И.
Гессом. Суть этого закона заключается в том, что
тепловой эффект химических реакций, протекающих
при постоянном объеме или при постоянном
давлении, не зависит от числа промежуточных
стадий, а определяется лишь начальным и конечным
состоянием системы. Закон Гесса можно
проиллюстрировать схемой:
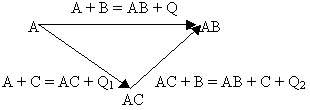
На схеме образование соединения АВ
представлено двумя путями: непосредственным
синтезом из веществ А и В (Q) и через стадию
образования промежуточного соединения АС (Q1),
которое в дальнейшем взаимодействует с
веществом В (Q2) и дает тот же конечный
продукт АВ. В соответствии с законом Гесса
тепловой эффект прямого синтеза продукта АВ
равен сумме тепловых эффектов реакций с участием
промежуточного продукта АС, то есть:
Q = Q1 + Q2.
Как следует из закона Гесса, теплота
образования вещества не зависит от способа его
получения (первое следствие из закона Гесса).
Теплота образования соединения – тепловой эффект
реакции образования одного моль соединения из
простых веществ в стандартном состоянии при
заданных температуре и давлении. В термодинамике
в качестве стандартных условий принимаются Т = 298
К; Р = 1,013.105 Па. Теплота образования
соединения в этих условиях называется
стандартной теплотой образования. При
выполнении термохимических расчетов теплоты
образования простых веществ в стандартном
состоянии условно принимаются равными нулю.
Приведу примеры классического варианта
выполнения термохимического расчета и
оформления решения задачи.
Пример № 1. Реакция горения аммиака
выражается уравнением:
4NH3(г.)+ 3O2(г.)= 2N2(г.)+ 6Н2О (ж.)+
1530,28 кДж
Вычислите теплоту образования аммиака ( г.),
если известно, что теплота образования воды (ж.)
составляет + 285,84 кДж/моль.
Решение. Прежде всего представим данное
химическое взаимодействие, как совокупность
промежуточных стадий с учетом стехиометрических
коэффициентов в уравнении реакции.
1. Разложение аммиака на простые вещества азот и
водород с учетом того, что в реакции горения
участвует 4 моль аммиака.
4 NH3 = 2 N2 + 6 H2 + Q1 (кДж)
2. Образование воды (ж.) из простых веществ:
водорода и кислорода с учетом того, что в
результате реакции горения образуется 6 моль
воды. В связи с этим фактом значение теплоты
образования воды (ж.) умножим на 6 моль
6 Н2 + 3 О2 = 6 Н2О(ж.) + 6 моль.
285,84 (кДж/моль)
Учитывая то, что теплоты образования простых
веществ условно приняты равными нулю и,
воспользовавшись законом Гесса, получим
уравнение:
1530,28 (кДж) = Q1 (кДж) + 6 моль. 285,84
(кДж/моль)
Откуда следует, что Q1 = – 184,76 (кДж).
Найденное значение Q1– тепловой эффект
реакции разложения 4 моль аммиака. Значит,
разложение одного моль аммиака будет
сопровождаться тепловым эффектом, равным
значению -184,76 (кДж)/4 моль = -46,19 (кДж/моль).
Образование аммиака – процесс, противоположный
разложению. Поэтому теплота образования аммиака
будет иметь противоположный знак плюс. Ответ:
теплота образования аммиака (г.) равна + 46,19
(кДж/моль).
Эту задачу можно было решить, воспользовавшись
вторым следствием из закона Гесса: стандартный
тепловой эффект реакции равен сумме стандартных
теплот образования продуктов реакции за вычетом
суммы стандартных теплот образования исходных
веществ с учетом стехиометрических
коэффициентов в уравнении реакции. Так как
теплоты образования простых веществ, в частности
кислорода и азота, приняты равными нулю, получим
уравнение:
+ 1530,28 (кДж) = 6 моль. 285,84 (кДж/моль) – 4 моль.Q
(кДж/моль), где Q – стандартная теплота
образования аммиака (г.). Таким образом, найдено
то же самое значение: + 46,19 (кДж/моль).
Пример № 2. Реакция горения этана
выражается уравнением:
С2Н6 (г.) + 3,5 О2 (г.) = 2 СО2 (г.)
+ 3 Н2О (ж.) + Q
Вычислите тепловой эффект этой реакции Q, если
теплоты образования углекислого газа (г.), волы
(ж.) и этана (г.) равны +393,51 (кДж/моль); + 285,84
(кДж/моль); + 84,67 (кДж/моль) соответственно.
Решение. Представим процесс горения этана, как
совокупность промежуточных стадий с учетом
стехиометрических коэффициентов в уравнении
реакции:
2 С+ 2 О2 = 2 СО2 (г.) + 2 моль. ( +393,51)
(кДж/моль)3 Н2 + 1,5 О2 = 3 Н2О (ж.) + 3
моль.(+285,84) (кДж/моль)С2Н6 (г.) = 2 С+ 3 Н2 + 1 моль.(-
84,67) (кДж/моль)
Воспользовавшись законом Гесса, получим
математическое уравнение для вычисления
теплового эффекта реакции горения этана: Q (кДж.) =
2 моль. (+393,51) (кДж/моль) + 3 моль. (+285,84)
(кДж/моль) + 1 моль. ( -84,67) (кДж/моль). Ответ: Q = +
1559,87 кДж.
Для выполнения заданий, требующих
термохимических расчетов, так же удобно
воспользоваться графическим вариантом
оформления решения на основе системы векторов, в
которой каждый из них будет иллюстрировать одну
из промежуточных стадий описываемого в задании
химического взаимодействия. Таким образом,
совокупность векторов будет эквивалентна всей
последовательности промежуточных
взаимодействий, приводящих систему из
начального состояния в конечное. Графический
способ оформления решения задачи отличается
значительно большей наглядностью и, как
следствие, сам ход решения становится более
доступным для понимания обучающихся.
Пример № 1. При стандартных условиях
теплота сгорания водорода в кислороде равна 286,2
кДж/моль, а теплота сгорания водорода в озоне
равна 333,9 кДж/моль. Чему равна теплота
образования озона из кислорода при стандартных
условиях?
С целью решения задачи, представим ее условие
графически, воспользовавшись системой векторов:
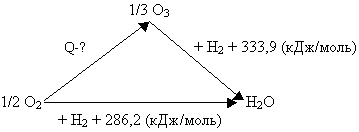
Сложение векторов даст следующее уравнение: Q +
333,9 (кДж/моль) = 286,2 (кДж/моль), откуда Q = – 47,7
кДж/моль. Найденное значение Q необходимо
умножить на три, так как расчет выполнен с учетом
образования 1/3 молекулы озона. Таким образом, 3.(-47,7)
(кДж/моль) = – 143,1 (кДж/моль).
Пример № 2. Энергии диссоциации Н2,
СI2 и тепловой эффект образования HCI
составляют соответственно -436, -243 и + 92 кДж/моль.
Чему равна энергия диссоциации HCI?
Как и в предыдущем случае, представим данные
задачи графически:
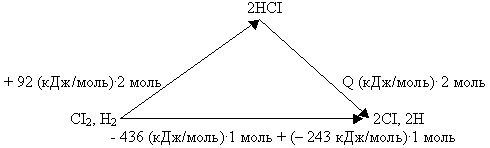
Воспользовавшись системой векторов, составим
математическое уравнение:
+ 92 (кДж/моль).2моль + Q (кДж/моль).2моль
= (-436 кДж/моль).1моль + (-243 кДж/моль).1
моль, откуда следует, что Q = – 431,5 кДж.
Как правило, выполнение термохимических
расчетов вызывает у учащихся достаточно
серьезные затруднения. Приведенный вариант
графического оформления решения более нагляден
и поэтому существенно облегчает понимание сути
происходящих процессов и, как следствие, поиск
решения задачи.
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
