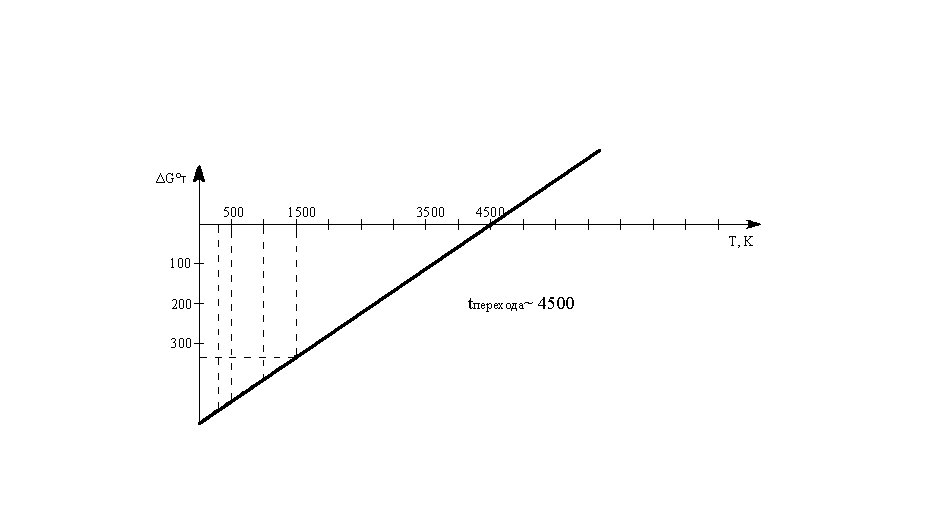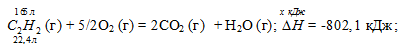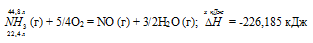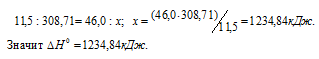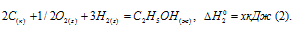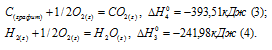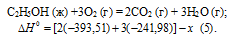Молярные теплоты сгорания и теплоты образования органических веществ
Измерение теплот сгорания, проводимое калориметрическим путем, дает возможность определить энергию образования органических соединений. Метод наиболее широко применяется для исследования углеводородов. Так, например, определив экспериментальным путем теплоту сгорания углеводорода СnН2n + 2 и вычтя из полученной величины значения теплот сгорания п атомов углерода (реакция С + О2 → СО2), п + 1 молекул Н2 (реакция Н2 + 1/2 О2 → Н2О) и количество энергии, необходимой для получения свободных атомов углерода и водорода (теплота сублимации алмаза и энергия диссоциации молекулы водорода), находят теплоту образования молекулы углеводорода из свободных атомов углерода и водорода. Определив эту величину для нескольких предельных углеводородов (по крайней мере для двух), можно вычислить энергию связей С—С и С—Н, считая, что она не изменяется при переходе от одного углеводорода
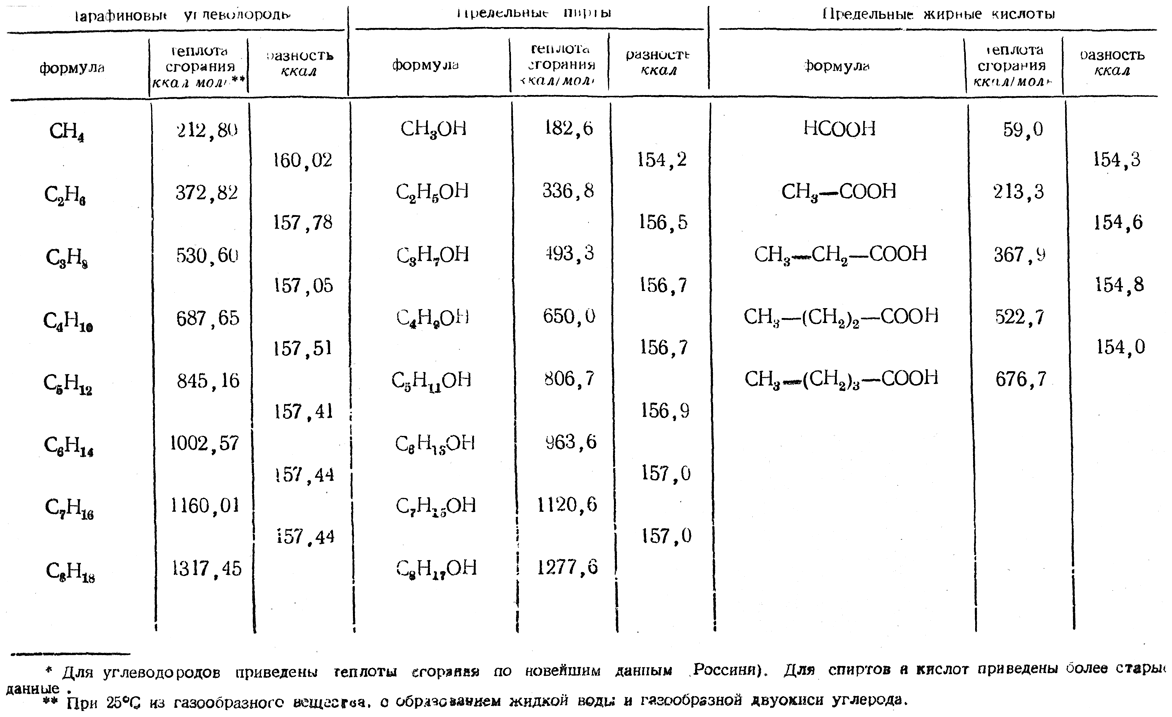
Таблица 25. Теплоты сгорания* гомологов нормального строения
к другому. Если вычислить энергию образования какого-либо другого углеводорода как сумму найденных ранее величин энергии связей С—С и С—Н, а затем определить эту энергию экспериментальным путем, получается хорошее совпадение обоих результатов. Это показывает, что энергия связей обладает свойством аддитивности. Отклонения от аддитивности, особенно часто наблюдаемые в случае молекул, содержащих сопряженные двойные связи, указывают на определенные особенности в химическом строении таких молекул. Выяснение характера этих особенностей производится путем совместного применения различных химических и физических методов исследования.
Для теплот сгорания органических веществ еще не найдено общего выражения для всех отдельных закономерностей, наблюдаемых для разных классов органических соединений, но в пределах одного гомологического ряда имеются закономерности, весьма точно подтверждающиеся результатами опытов (см., например, табл. 25 и 26).
Наиболее общая закономерность состоит в том, что разность молярных теплот сгорания для двух ближайших гомологов нормального строения, отвечающая гомологической разнице состава СН2, является величиной постоянной, в среднем равной 157,4 ккал (табл. 25).
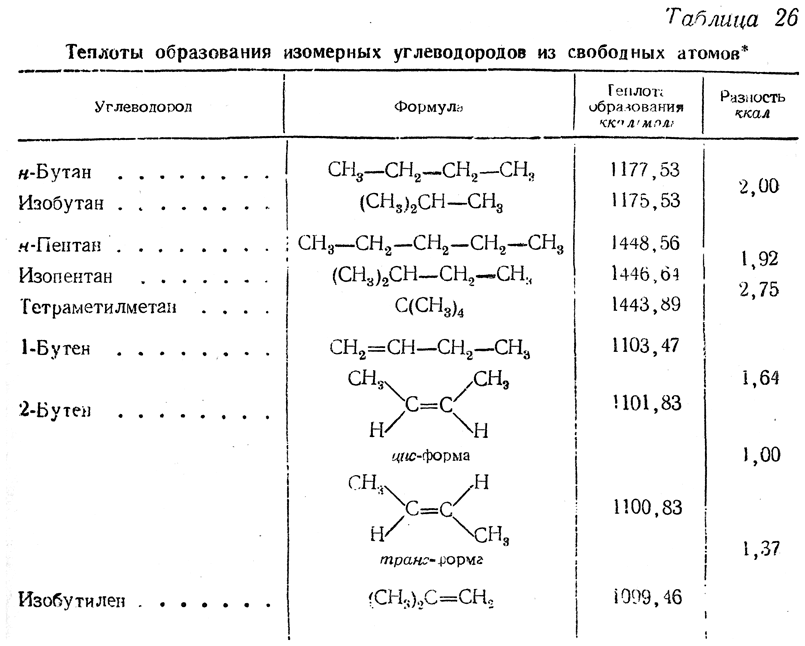
Новейшие методы позволяют определять теплоты горения с настолько большой точностью, что в настоящее время уже можно судить о разницах теплот образования многих изомерных соединений (табл. 26).
Для расчетов (конечно, приближенных) можно сделать предположение, что теплота образования сложной молекулы составляется аддитивно из теплот (или энергий) образования всех имеющихся в молекуле связей. Если, например, теплота образования метана из атомов в стандартном состоянии равна
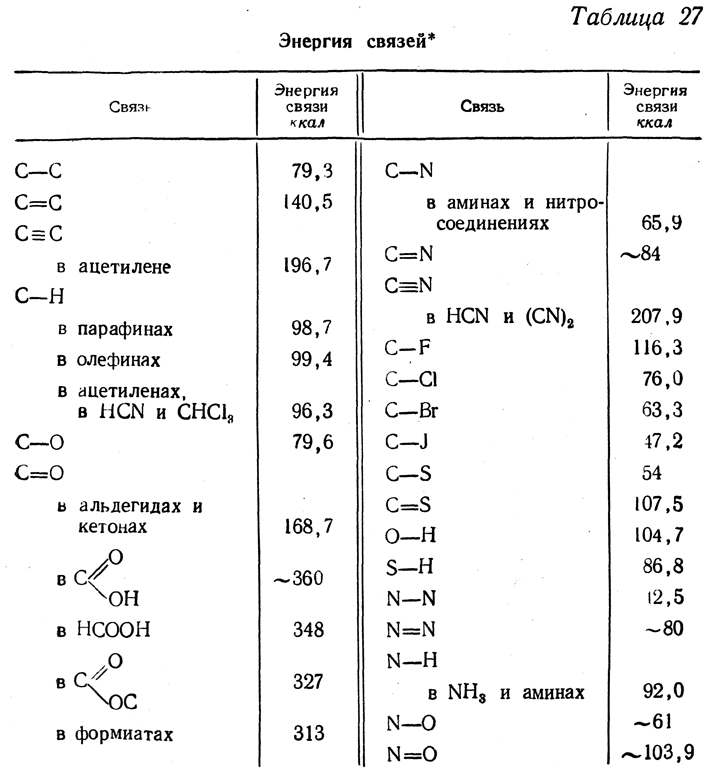
380,05 ккал/моль, средняя энергия каждой из четырех связей С—Н составит 1/4 этой величины, или 83,56 ккал. Этим путем можно подсчитать энергии ряда связей (или целых группировок связей) и, пользуясь полученными величинами, подсчитывать теплоты образования различных соединений. Расчеты теплот образования органических соединений по этим величинам дают довольно хорошие результаты, за исключением начальных членов гомологических рядов. При расчете нужно учитывать также увеличение теплот образования у более разветвленных (и более симметричных) изомеров. В табл. 27 приведены энергии различных связей.
ВЫЧИСЛЕНИЕ
СТАНДАРТНЫХ ТЕПЛОТ ОБРАЗОВАНИЯ ВЕЩЕСТВ
И ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Расчет
стандартной теплоты образования веществ
Пример.
Вычислите стандартную теплоту образования
этана, если известна теплота его сгорания:
ΔНосгор.=
–1560 кДж/моль.
Решение.
Напишем
уравнение реакции таким образом, чтобы
перед
формулой этана стехиометрический
коэффициент был равен
1:
С2Н6
+ 3,5О2
= 2СО2
+ 3Н2О
ΔНообр.
0 2·(–393)·
3·(–286)
ΔНосгор.=
ΔНор.
= (–286)·3.+ (–393)·2 – ΔНообр.
=
–1560 кДж/моль,
ΔНообр.
= 1560 – 286·3 – 393·2 = –84 кДж/моль.
Пример. Определите
стандартную теплоту образования
этилового спирта, если теплоты сгорания
углерода, водорода и этилового спирта
соответственно равны:
–393,51; –285,84; –1366,91
кДж/моль.
Решение.
Стандартная
теплота образования вещества равна
теплоте реакции образования одного
моля этого вещества из простых веществ
при стандартных условиях.
Образование
этилового спирта из простых веществ
можно представить так: 2С + 3Н2
+ 1/2О2
= С2Н5ОН.
Углерод сгорает до СО2,
водород – до Н2О,
а этиловый спирт–до СО2
и Н2О.
Следовательно, для определения стандартной
теплоты образования C2H5ОH
составим следующий цикл Гесса:
1. 2С
+ 2О2
= 2СО2
–393,51·2
2. 3Н2+
3/2О2
= 3Н2О
–285,84·3
3.
2СО2+
ЗН2О
= С2Н5ОН
+ 3О2
+1366,91
(1) + (2) + (3)
2С +
3Н2
+ 1/2О2
= С2Н5ОН
–277,6 кДж/моль
–393,51·2 –285,84·3 +
1366,91 = –277,6
Стандартная теплота
образования этилового спирта равна:
ΔНо298
= –277,6
кДж/моль.
Расчет теплового
эффекта реакции по стандартным теплотам
образования реагирующих веществ
Пример. Определите
количество теплоты, выделяющееся при
гашении
100 кг
извести водой, если стандартные теплоты
образования реагирующих веществ равны
(кДж/моль): ΔНо
(СаО(к))=
–635,1; ΔНо
(Са(ОН)2(к))=
–986,2;
ΔНо
(Н2О(ж))
=
–285,84.
Решение.
Реакция
гашения извести: СaO
+ H2О
= Са(ОН)2.
Тепловой эффект реакции равен
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔНор.
= ΔНо
(Са(ОН)2(к))
–[ΔНо
(СаО(к))+
ΔНо
(Н2О(ж))]
= –986,2+635,1 +285,84 =
–65,3 кДж/моль.
Тепловой эффект
реакции рассчитан на 1 моль СаО, т.е. на
56 г СаО. При гашении 100 кг СаО выделяется
тепловая энергия:
56 г СаО —
(–65,3) кДж
100 000
г СаО — х
кДж
х
= (100
000·(–65,3)) /56
= –1,16·105
кДж.
Расчет теплового
эффекта реакции по стандартным теплотам
сгорания реагирующих веществ
Пример. Определите
тепловой эффект реакции синтеза акриловой
кислоты:
+
СО+ Н2О(ж)
→ СН2=СН–СООН(ж),
если стандартные
теплоты сгорания ацетилена, оксида
углерода и акриловой кислоты соответственно
равны (кДж/моль): –1299,63, –282,50 и –1370,0.
Решение.
Из
закона Гесса следует, что тепловой
эффект реакции равен разности между
суммой теплот сгорания исходных веществ
и суммой теплот сгорания продуктов
реакции (ΔНосгор..н2о=0,
так как Н2О
– высший оксид);
∆Hºp
=
Σ∆Hºсгор.(исх.)
– Σ∆Hºсгор.(прод.)
ΔНо
= ΔНосгор.(СН=СН)
+ ΔНосгор.(СО)
– ΔНосгор.
(СН2=СН–СООН(ж))=
–1299,63 – 282,50 + 1370,0
= –212,13 кДж/моль.
ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ
ЭНЕРГИИ ГИББСА
Определение
возможности протекания процесса по
величине изменения энергии Гиббса.
Пример. Возможна
ли следующая реакция в стандартных
условиях:
t
SiО2
(к)
+ 2NaОH
(p)
= Na2SiО3
(к)
+ Н2О
(ж)
если
ΔGо(SiО2
(к))
= –803,75 кДж/моль; ΔGо
(Na2SiО3
(к))=
–1427,8 кДж/моль;
ΔGо
(NaОH(p))
= –419,5 кДж/моль; ΔGо
(Н2О
(ж))
= –237,5 кДж/моль?
Можно ли выпаривать
щелочь в стеклянном сосуде?
Решение.
Изменение
энергии Гиббса ΔGо298
реакции
равно:
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔGо298
=
(–1427,8 – 237,5) – (–803,75 –419,5·2)=
–22,55 кДж;
ΔGо298
= –22,55
кДж (т. е. ΔG<0),
а следовательно, данная реакция возможна.
Щелочь нельзя выпаривать в стеклянном
сосуде, так как в состав стекла входит
SiО2.
Пример. Вычислить
ΔGо
для реакции 2Н2
(г)+О2
(г) 2Н2О(г).
при 298, 500, 1000, 1500 К.
Зависимостью ΔНо
и
ΔSo
от температуры пренебречь. Построить
график зависимости ΔGо
от
температуры и найти по графику температуру,
ниже которой указанная реакция в
стандартных условиях может протекать
самопроизвольно.
Решение.
Согласно
уравнению ΔG
= ΔН
– TΔS
влияние
температуры на ΔG
определяется
знаком и величиной ΔS.
Если
пренебречь влиянием Т
на
значения ΔН
и ΔS,
то приведённая зависимость ΔG
=ƒ(T)
является уравнением прямой, наклон
которой определяется знаком ΔS.
при ΔS>0
прямая идет вниз, при ΔS<0
– вверх.
Определим
величину ΔН°298
(исходные данные берем из табл.1)
∆Hºp
=
Σ∆Hºобр.(прод.)
– Σ∆Hºобр.(исх..)
ΔН°298
= 2ΔН°обр.(H2O)
– (2ΔН°обр.(H2)
+ 2ΔН°обр.(O2)
= 2ΔН°обр.(H2O)
=
=2(-241,84)
= –483,68 (кДж) (на 2 моля
H2O)
ΔН°обр.(Н2О)
= 0,5(–483,8)
= –241,89 кДж/моль.<0
Следовательно,
реакция экзотермическая.
Определим
изменение энтропии
данной реакции в стандартных условиях
ΔS°298
(исходные
данные берем из табл.1)
ΔSо
=
ΣSопрод.
– ΣSоисх.:
ΔS°298=
2S°298.(H2O)
– [2S°298.(H2)
+ S°
298.(O2)]=
2·188,74
– (2·130.6 +
205) =
–98,6(Дж/
К) = –0,0986(кДж/ К)
< 0, ΔG
=ƒ(T)
прямая
идет вверх.
Определим
изменение энергии Гиббса ΔG°298
в
стандартных условиях (исходные
данные берем из табл.1):
ΔGо
=
ΣGопрод.
– ΣGоисх.;
ΔG°298
=
2ΔG°298.(H2O)
– [2ΔG°298(H2)
– ΔG°298(O2)]
=
2(–228,8)
=
–457,6 кДж.
Отрицательная
величина ΔG°298
свидетельствует
о том, что в стандартных
условиях реакция самопроизвольно
протекает в
прямом направлении.
ΔG°298
=
ΔН°298
–
298·ΔS0298
=
–483,68 – 298·(–0,0986) = –457,6кДж
ΔG°500
=
ΔН°298
–
500·ΔS0298
=
–483,68 – 500·(–0,0986) = –434,38кДж
ΔG°1000
=
ΔН°298
–
1000·ΔS0298
=
–483,68 – 1000·(–0,0986) = –385,08кДж
ΔG°1500
=
ΔН°298
–
1500·ΔS0298
=
–483,68 – I500·(–0,0986) = –335,78 кДж
Построим
график ΔG°Т
=f(Т):
Температура
перехода ~4500
К
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод – до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) – 2 Н2 (г) + О2 (г) – С (к) + О2 (г) =
= 2Н2О (ж) + СО2 – 2Н2О – СО2;

Отсюда
СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж);

Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда





Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
NH3 (г) + 5/4O2 = NO (г) + 3/2H2O (г)
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 –

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) – на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Для нахождения температурного изменения теплоты сгорания моля водорода с образованием жидкой воды вычтем из теплоемкости ( p)i смеси, состоящей из моля водорода и Va моля кислорода, теплоемкость (Ср)2 моля воды. Для двухатомных газов (кислород, водород) = 20,95 Дж/(К моль) [c.298]
Рассмотрим следующий пример. Допустим, требуется определить тепловой эффект реакции синтеза хлористого аммония из аммиака и хлористого водорода, если известны теплоты образования из простых веществ всех трех участников реакции. Реакцию [c.476]
Н — теплота сгорания топлива в газовой фазе (в данном случае — водорода) с образованием газообразных продуктов, кдж кг [c.167]
Теплота образования гидридов должна быть мала, при этом должна сохраняться соответствующая средняя упругость диссоциации водорода в области комнатных температур. [c.290]
Теплота образования углеводородов из графита и молекулярного водорода может быть подсчитана по формуле [c.29]
Отношение теплоты образования углерода и водорода нз метана к сумме теплотворных способностей углерода и водорода, образующихся из метана, равно [c.31]
Следовательно, теплота образования из этана графита и водорода равна [c.32]
Отношение теплоты образования из этана углерода и водорода к сумме теплотворных способностей образующихся из этана углерода и водорода равно [c.32]
Теплота образования из пропана графита и водорода [c.32]
Следовательно, отношение теплоты образования углерода и водорода из этилена к сумме теплотворных способностей, образуюш ихся из этилена углерода и водорода равно [c.33]
При составлении данного подсчета теплотворная способность горючей массы древесины принята по Дюлонгу, т. е. без учета теплоты образования горючей массы и различия в теплотворных способностях древесины и соответствующей ей по процентному составу смеси углерода, водорода, азота и влаги. [c.53]
Некоторые ориентировочные данные о способности окислов восстанавливаться под влиянием водорода можно получить при сопоставлении теплот образования окислов и водяного пара окислы, имеющие теплоту образования, меньшую, чем у водяного пара [48,4- 10 дж на 1 моль Ог (115,6 ккал на [c.139]
Процесс горения водорода с образованием водяных паров осуществляется по реакции На+—02=Н20. При сгорании 1 кг водорода выделяется 28 905 ккал теплоты. При горении серы образуется сернистый газ (3+02=502). 1 кг серы при сгорании дает 2216 ккал теплоты. [c.32]
Определение теплоты сгорания путем расчета по э л е м е и т а р-ному составу исходит из того, что, по закону Гесса, теплота сгорания органического соединения равна разности между теплота-ми сгорания углерода, водорода и серы и теплотой образования данной молекулы. [c.251]
Например, если известна теплота сгорания метана, теплота горения углерода и водорода, то можно рассчитать теплоту образования метана на основании закона Гесса [c.183]
Так как в обоих случаях исходные вещества и конечные продукты одинаковы, то 2а -Н 47 = 137, откуда а = 45 ккал. Это и будет теплота образования моля перекиси водорода из элементов. [c.365]
При сгорании водорода, содержащегося в горючем газе, образуется вода в жидком или парообразном виде. Поскольку при переходе воды из жидкого в парообразное состояние необходимо затратить определенное количество теплоты (скрытую теплоту парообразования), то при сгорании водорода с образованием воды будет выделяться больше теплоты, чем при его сгорании с образованием водяного пара. [c.12]
Теплота сгорания горючего газа при сгорании водорода с образованием воды называется высшей теплотой сгорания, а при сгорании с образованием водяного пара и превращения в пар воды, содержащейся в газе, — низшей теплотой сгорания. [c.12]
Водород практически нерастворим в жидкой и твердой сурьме fl] Большинство информации о системе Н—Sb относится к гидриду SbHg — стибину. В обычных условиях это бесцветный очень ядовитый газ, теплота образования которого составляет 144 кДж/моль. Он легко разлагается при незначительном нагреве и может даже взрываться при повышении температуры до 230 °С. [c.852]
В табл. 4 указаны теплоты образования графита и молекулярного газообразного водорода из некоторых углеводородов и приведены подсчеты отношений тенлот образования к теилотам горения соответствующих количеств углерода и молекулярного водорода. [c.29]
П = 2 ([Л1- – Хо) Д является, конечно, снова теплотой образования двух молекул ЛН в химическом смысле из одной молекулы обыкновенных пзров иода и одной молекулы обыкновенного водород ого газа. [c.469]
Расчеты по равновесию реакции диссоциации селеноводорода (Кр = PnAiVPH se), основанные на завышенных значениях теплоты образования, например 18 200 кал/моль в работах [212, 227], указывают на термодинамическую неустойчивость HgSe, который должен разлагаться на простые вещества в интервале 300—1000°К-Этот вывод находится в противоречии с прямыми измерениями равновесия жидкого селена с водородом, которые указывают на достаточную устойчивость соединения [215,2171. [c.59]
Двуокись молибдена М0О2 — порошок темно-коричневого цвета, получаемый при восстановлении трехокиси молибдена водородом при 450—470° С. Плотность М0О2 6,34, теплота образования 141 ккал/моль. [c.97]
Температура плавления ОеОа 1115° С. Выше 1250° С двуокись заметно испаряется. Теплота образования ОеОг равна 128 ккал/моль. Выше 600° С двуокись восстанавливается водородом до металла. [c.377]
Крауфорд описал эксперименты по измерению теплоты образования воды в результате сгорания водорода в кислороде. В соответствии с методикой, предложенной Пристли [101, газы поджигались с помощью электрического тока в закрытом сосуде, помещенном в водяной калориметр. В работе Крауфорда [101 приведены чертежи первого герметичного калориметра сгорания. [c.102]
КАДМИЯ СОЕДИНЕНИЯ. Кадмий принадлежит ко II группе периодич. системы и является аналогом Zn, Из окислов кадмия наиболее известна бурая окись кадмия dO, полз чаемая нагреванием на воздухе металлич. кадмия или его солей (нитратов, карбонатов), а такгке гидрата его окиси d(0H)2. dO диморфна при красном калении она из аморфного слабо ократпенного порошка превращается в кристаллич. (кубич. системы) темноб5фую массу заметно улетучивается, начиная с 700 при 1 000° сублимируется без разложения и плавления нацело “при действии угля начинает восстанавливаться при 700°. Водород восстанавливает ее до металла при 270—300° легко растворяется в минеральных к-тах, образуя соответствующие соли двувалентнох о кадмия. Поглощает из воздуха Oj, являясь сильным основанием. Теплота образования аморфной dO 57 ООО, а кристаллической — [c.283]
Имеющиеся в литературе данные по свойствам хлоридов позволяют провести приближенных термодинамический анализ реакций восстановления их водородом в газовой фазе. Энтальпии газообразных пентахлоридов были найдены нами из данных по теплотам образования [4] и сублимации [3, 5], энтропии — по данным работ [16, 17]. [c.80]
Пример. Непосредственное определение теплоты образования перекиси водорода (Н2О2) неосуществимо, но, пользуясь законом Гесса, ее можно вычислить. [c.365]
Энергия, выделяющаяся при соединении 1 кгмоля сгорающего вещества с соответствующим количеством кислорода, называется теплотой реакции горения Е (табл. 6. 2). Теплоты реакции горения элементов определяют путем калориметрических опытов. Например, теплота образования паров воды из 1 кгмоля водорода и 0,5 кгмоля кислорода равна 57 100 ккал кгмоль [c.154]
Физические свойства. Ф. при обыкновенной t°-—-газ, к-рый при понижении сна-ча,иа конденсируется в бесцветную жидкость и при дальнейшем понижении застывает в кри-сталлич. массу. (при 756,4 мм) 8,2° —126° (имеются указания и на -104° и —118°). Плотность жидкого Ф. при —20 1,461, при 0° 1,420, при -[-10° 1,398. Вес 1 л газообразного Ф. 4,41 г. Уд. в. по отношению к воздуху 3,5. Упругость наров Ф. составляет при —31,28° 126,6 лгм, при 0° 556,5 мм, при -f 12,6° 889,2 мм и при 4-27,9° 1 540 мм. Ф. плохо растворяется в воде, но очень хорошо в различных растворителях как органических, так и неорганических при нагревании их Ф. легко вновь выделяется. Многие веш ества хорошо растворяются в Ф.-. хлор при 0° 6,6% и при —15° 25,5% хлористый водород при 0° 1,9%. Ф. подвергается диссоциации на хлор и окись углерода, начиная с 200°, и полностью распадается при 800°. Диссоциирующим действием по отношению к Ф. обладают и ультрафиолетовые лучи. Теплота образования из хлора и окиси углерода (по Томсену) 26 140 al. Ф., не реагируя, смешивается с ипритом, хлорпикрином и другими О.В. Активированный уголь адсорбирует Ф. в значительных количествах. [c.67]
Теплота атомизации графита была принята при этом равной 171,7 ккал/г-атом, а водорода 52,09 ккал/г-атом. По теплоте атомизации данного изомера можно обычным путем рассчитать его теплоту образования(АЯ/,29з) и теплоту сгорания (АЯ°, 293)- В приведенных в статье примерах расхождение не превышает 0,6 ккал/моль. [c.253]
Соединения без водорода не различаются по теплотам сгорания. Энтальпия связи в соединении определяется для процесса, в котором исходное соединение в газовой фазе разлагается на исходные вещества АВ=А+В). Если соединение полностью разрушается до атомов, входящих в молекулу, то теплота называется энтальпией атомизации соединения. При возгонке твердого тела до атомарного газообразного состояния затрачивается энтальпия атомизации. Для углерода энтальпия атомизации равна 716,68 кДж/моль. [c.66]
В этих уравнениях используются еще две величины — теплоты, затрачиваемой на сублимацию одного моля графита или выделяющейся при его конденсации из газа 715,0 кДж и теплоты образования молекулярного водорода из атомов 436 кДж. Найденная величина 1661,8 кДж намного больше теплоты образования метана из элементов, что обусловлено значительно большим запасом энергии у атомов по сравнению с молекулами. Эта величина представляет собой энергию, которую надо затратить, чтобы разъединить молекулу метана на атомы (такие величины называются теплотами атомизации). Так как в метане, [c.31]
Величина может быть получена из теплоты сгорания, если использовать известные величины теплот сгорания и атомизации углерода, водорода и азота (обзор см. [32]). [c.33]
Этот раздел посвящен рассмотрению экспериментальных данных с целью получения определенных выводов о состоянии адсорбированного слоя. В уравнениях (ба) и (66) проводится различие между такими состояниями атомов, когда они неподвижно закреплены на поверхности и когда они свободно перемещаются. Последний случай хорошо описывается статистически. Хотя часто считают [II —13], что он правильно описывает действительное состояние поверхностного слоя во время реакции, тем не менее возникают серьезные сомнения в реальности модели, предусматривающей такую подвижность атомов. Свободное перемещение частиц на поверхности требует, чтобы энергия активации поверхностной диффузии была гораздо меньше НТ, и хотя их высокая подвижность при рассматриваемых здесь температурах не вызывает сомнения, условие С-/ 7 не выполняется. Так, для водорода на вольфраме 10< < 16 ккал/моль [27, 28], для водорода на никеле = 7 ккал/моль [29] и для кислорода на вольфраме = = 30 ккал/моль [30], в то время как при 1500° К ЯТ=3 ккал/моль. Хотя величины для водорода и кислорода на платине неизвестны, вполне вероятно, что они сравнимы с указанными. Даже для водорода на золоте теплота адсорбции атомов и энергия активации их диффузии не являются пренебрежимо малыми величинами [31, 32]. Следовательно, даже при самых высоких температурах, используемых при атомизации, движение адсорбированных атомов должно осуществляться в виде последовательных скачков с одного места на соседнее. Не исключено, что адсорбированные атомы проводят большую часть времени, занимая определенное место на поверхности, и вероятность нахождения их в состояния перехода с одного места на близлежащее ничтожно мала. В таком случае справедливо уравнение (6а) для константы равновесия [c.310]
В зависимости от принятых значений для теплот образования СОз, атомизации -углерода и диссоциации молекулы водорода получают различные значения теплот образования органических соединений [19, 32, 33]. В связи с этим, данные об энергиях образования не являются точно установленными величинами, но они могут быть использованы для целей сравнения. [c.83]
Приняв теплоты атомизации молекул водорода, азота [c.105]
ВОДЫ 68,3 ккал/моль и теплота диссоциации молекул водорода 102,6 ккал моль (эти значения достаточно точны). Ранее теплоту образования СО, принимали равной 94,48 ккал моль в 1944 г. было установлено, что более правильной величиной является 94,051 ккал моль [14]. Теплота атомизации углерода до настоящего времени не установлена для нее приводят значения—124,3, 125, [c.72]
Теплота атомизации, графита была принята при этом равной 171,7 ккал г-атом, а водорода 52,09 ккал г-атом. По теплоте ато-, мизации данного изомера можно обычным путем рассчитать его теплоту образования (аЯ°, гэв) и теплоту сгорания (АЯс, гэв). В при- веденных в статье примерах расхождение не превышает 0,6 кко жоль. V [c.257]
Эффект замещения атомов водорода нитрогруппами в теплотах атомизации ароматических нитросоединений [c.63]
Контрольным параметром при расчетах может служить атомная теплота о б р а 3 о в а н и я (АЯ°), находимая путем суммирования стандартной теплоты образования углеводорода (из графита и Нг) с теплотами атомизации входящих в его молекулу атомов углерода (170,9 ккал г-атом) и водорода (52,1 ккал/г-атом). Например, у метана ЛЯ° = 17,9 + 170,9 -f 52,1 4 = 397,2 ккал/моль. [c.376]
Теплота атомизации и энергия разрыва когезионных связей самая низкая у никеля и палладия (табл. 10). Под воздействием теплоты адсорбции водорода или теплоты реакции эти катализаторы формируются быстрее других и диспергируются также легко. В водных растворах кислот максимальная адсорбция непредельных соединений наблюдается в области потенциала 0,15—0,25 В (от обратимого водородного в данной среде). Из металлов п.патиновой группы самая слабая адсорбция (почти на порядок меньше) наблюдается на Рс1 (табл. 10). Хемосорбцпя при отрицательных по- енциалах очень часто сопровождается распадом (гидрогенолизом) органических соединений и их изомеризацией. Можно подобрать условия, когда эти реакции даже при комнатной температуре становятся решающими. В связи с этим необходимо проводить анализ не только содержимого в растворе, но и в газовой фазе. [c.207]
Проведенные для пропана вычисления могут быть проиллюстрированы при помощи диаграммы энергетических уровней, изображенной на рис. 15-7. Добавление 3898 кДж для атомизации графита и диссоциавдщ газообразного водорода показано как переход с нижнего энергетического уровня на верхний уровень, соответствующий изолированным атомам. Соединение этих атомов в молекулу СзН соответствует уменьщению энергии на 3994 кДж с переходом в еще более низкое энергетическое состояние. Расстояние между исходным и конечным энергетическими уровнями (исходный уровень отвечает реагентам – графиту и Н2, а конечный уровень — продукту СзНд) соответствует вычисленной теплоте образования пропана, АЯ298 = – 96 кДж. [c.29]
Овермарс и Блиндер показали, что, игнорируя различие в состояниях атомов углерода и водорода и определяя средние энергии связей С—С и С—Н по данным о ДЯа для алканов, можно определить средние инкременты этих связей, вполне пригодные для приближенных расчетов АЯ . гэз. Принимая теплоты атомизации графита и водорода равными 170,886 и 52,102 ккал/моль, эти авторы определили средние инкременты связей С—С и С—Н равными соответственно 81,276 и 99,298 ккал/моль. При расчете по этим значениям инкрементов АЯ .298 для тех м е 52 алканов средняя ошибка составила 1,11 ккал/моль, при максимальном расхождении 2,69 ккал/моль для 2,2-диметилпентана. Конечно, средняя ощибка недостаточно характеризует надежность того или другого метода расчета, если нет возможности судить, когда можно ожидать максимальной ошибки и не может ли быть для других алканов ошибки еще, большей. Тем более что из 40 алканов, составляющих все изомеры первых членов ряда до СаН включительно, для 20 алканов ошибка (в ту или другую сторону) превышает 1 ккал/моль, в том числе для 9 алканов она превышает [c.227]
Скиннер и Пильчер применив эти значения к 30 алканам и считая теплоту атомизации графита и водорода равными соответственно 170,9 и 52,09 ккал/г-атом, нашли, что среднее отклонение рассчитанных таким путем значений АН от экспериментальных равно 1,19, а максимальное 5,59 ккал/моль (для рассмотренных ими изомеров). [c.254]
Овермарс и Блиндер описали дальнейшее развитие этого метода. Рассчитав указанные инкременты методом наименьших квадратов по всем данным для (ЛЯр. гэа) различных алканов, приведенным в работе и принимая теплоты атомизации графита и водорода равными соответственно 170,866 ккал/г-атом и 52,102 ккал/моль, они нашли следующие значения инкрементов (в ккал/моль) [c.254]
Приведем в качестве примера определение теплоты образования метилена Используем энергию атомизации, рассчитанную по методу ММ1Ю (полная и электронная энергии дпя атомов одинаковы) дпя углерода и двух атомов водорода агом=- полнСН2 С 2 Е( =-120,500606 эВ, а -119,06276 эВ (энергии атомов в приближении М>ШО) Таким образом, Е = 151,586368 – 120,500606 – 23,812552 = 17,27321 эВ = = 167,72 ккал/моль [c.324]
При использовании теплот атомизации этилена, тетрахлорэтилена и тетрафторэтилена, а также энергий углерод-водород-ной, хлор-углеродной и фтор-углеродной связей (полученных из теплот атомизации соответствующих гомозамещенных метанов) оказывается, что энергии связей С = С в этилене и тетрахлорэтилене составляют 140 ккал или несколько более, тогда как в тетрафторэтилене эта величина равна приблизительно 105 ккал . Интересно, что в таком виде данное рассуждение не свободно от возражений. При переходе от метана к этилену происходит изменение характера простых связей, обусловленное переходом от sp – к 5р2-гибридизации. Это изменение сопровождается значительным укорочением длины углерод-водородной или хлор-углеродной связей. [c.356]
Затрата энергии на атомизацию графита и водорода в количествах, необходимых для образования 1 моля С,Н2 (кДж) на атомизацию двух г-атомов С — 718,5 X 2 = = —1437, на атомизацию двух г-атомов Н —218,0 X 2 = —436. В общем и целом, теплота образования СгН, равна алгебраической сумме теплот атомизации С (графита) и Н (газа Н ), а также атомной теплоты образования ацетилена С2Н2) [c.158]
Слабо связанный водород, максимум которого на I, ф-кривой появляется при 0,12 в, по-видимому, представляет собой молекулярный водород, адсорбированный на смешанных — Zn-цeнт-рах поверхности, где вследствие небольшой теплоты адсорбции его атомизация затруднена. Уменьшение теплоты адсорбции водорода в присутствии сернокислого цинка и кадмия показано нами расчетным путем. [c.340]
В табл. 5 сопоставляются эффекты замещения водорода нитрогруппой в нитроароматических соединениях. Эффект замещения водорода нитрогруппой в теплоте атомизации нитробензола составляет АР = 184,8 ккал/моль (разность между теплотами атомизации нитробензола и бензола). В 0-, м- и /г-динитробензолах соответствующие величины равны 359,6, 367,0 и 367,9 ккал/моль. Эти значения меньше, чем 2АР на 10,0, 2,6 и 1,7 ккал/моль (назовем эти величины б). Эффект замещения в нитробензоле такой же, как в мононитросоединениях (см. главу IV). Энергия взаимодействия нитрогрупп в случае ж-динитробензола 2,6 ккал/моль близка к энергии дальнего взаимодействия 1,3-нитрогрупп в алифатических нитросоединениях (2,8 ккал/моль). [c.61]
Назин, Манелис и Дубовицкий [108] оценивали энергии связей С—N в динитрометане и тринитрометане аддитивным уменьшением энергии диссоциации, по аналогии с хлор- и бромпроизводными метана [104]. Для теплот атомизации нитрометанов нами была найдена неаддитивная зависимость при последовательном введении нитрогрупп. Эффект замещения водорода на нитрогруппу в молекуле нитрометана [c.123]
Теплоты атомизации были оценены с привлечением значений теплот атомизации углерода (—170,9), водорода (—52,1), кислорода (—59,2) и азота (—113,0 ккал/г-атом) Исходя из того, что теплоты атомизации равны сумме энергий связей, были найдены величины энергии связи С = N. При этом для учета вклада арильного ядра и возможных взаимодействий между ядром и метиленовой группой принималось, что теплота атомизации ксилильного радикала в диизоцианатах и ксилолах одинакова. Теплота атомизации м- и п-ксило-лов равна в среднем —1892,4 ккал энергия связи СбН4(СНз)СН2—Н—77 ккал – . Следовательно, вклад ксн-лильного радикала в теплоту атомизации равен—1738,4 ккал. Разность между теплотой атомизации 1,3-ксилилендиизоцианата и этой величиной составит сумму энергий двух связей = N, двух связей = N и двух связей С = 0. [c.19]
Весьма чистый (99,999%) элементарный бор был получен восстановлением B I3 водородом при 1200 °С. Он может быть получен также термическим разложением паров ВВгз на нагреваемой электрическим током до 1500 °С танталовой проволоке. Образующиеся очень мелкие кристаллы бора по твердости лишь немногим уступают алмазу. Они известны в четырех различных кристаллических формах (имеющих сложное внутреннее строение), обладают металлическим блеском и при обычных условиях довольно плохо проводят электрический ток, но нагревание до 800 °С вызывает повышение электропроводности приблизительно в миллион раз (причем электронный характер низкотемпературной проводимости меняется при высоких температу )ах на дырочный). Теплота плавления бора оценивается в 5,3, теплота испарения — в 129, а теплота атомизации (при 25 °С) —в 135 ккал[г-атом. [c.166]
Приведем в качестве примера определение теплоты образования метилена. Используем энергию атомизации, рассчитанную по методу ММГЮ (полная и электронная энергии дня атомов одинаковы) для угаерода и двух атомов водорода агом полнСН2 С 2 > 20,500606 эВ, а [c.324]