Алексей . Малеев
Эксперт по предмету «Физика»
Задать вопрос автору статьи
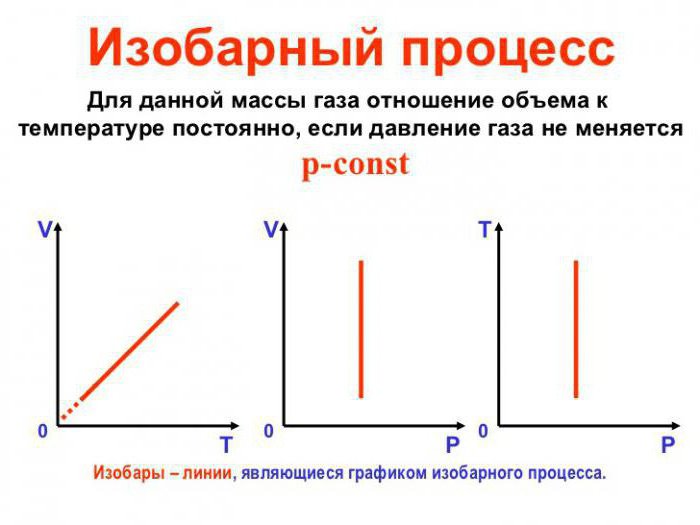
Что такое изобарический процесс
Определение
Изобарическим (или изобарным) процессом называется процесс, происходящий в неизменной массе газа при постоянном давлении.
Запишем уравнение для двух состояний идеального газа:
[pV_1=nu RT_1left(1right),]
[pV_2=nu RT_2 left(2right).]
Разделим уравнение (2) на уравнение (1), получим уравнение изобарного процесса:
[frac{V_2}{V_1}=frac{T_2}{T_1} (3)]
или
[frac{V}{T}=const left(4right).]
Уравнение (4) называют законом Гей-Люссака.
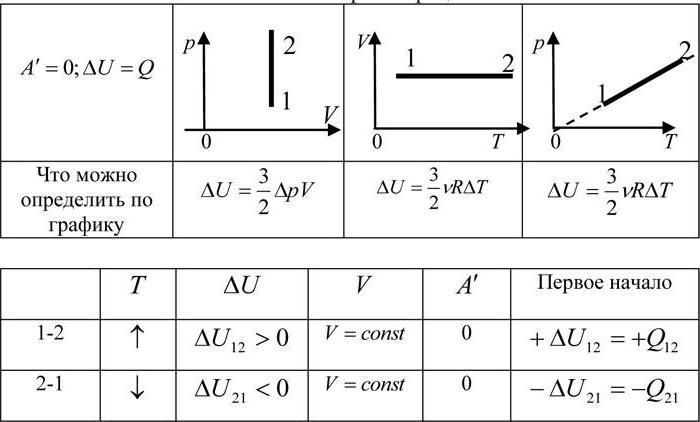
Внутренняя энергия и количество теплоты изобарического процесса
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изобарного процесса:
[delta Q=dU+dA=frac{i}{2}nu RdT+pdV, left(5right).]
[triangle Q=intlimits^{T_2}_{T_1}{dU}+intlimits^{V_2}_{V_1}{dA}(6)]
где $delta Q $- элементарное тепло, подводимое к системе, $dU$- изменение внутренней энергии газа в проводимом процессе, $dA$- элементарная работа, которую совершает газ в процессе, i-число степеней свободы молекулы газа, R — универсальная газовая постоянная, d – количество молей газа.
Сделаем домашку
с вашим ребенком за 380 ₽
Уделите время себе, а мы сделаем всю домашку с вашим ребенком в режиме online
Бесплатное пробное занятие
*количество мест ограничено
Изменение внутренней энергии газа:
[triangle U=frac{i}{2}nu R{(T}_2-T_1) (7)]
[A=pintlimits^{V_2}_{V_1}{dV}=pleft(V_2-V_1right)(8)]
Уравнение (8) определяет работу для изобарного процесса. Вычтем из (2) уравнение (1), получим еще одно уравнение для работы газа в изобарном процессе:
[p{(V}_2-V_1)=nu R{(T}_2-T_1)to A=nu R{(T}_2-T_1) (9)]
[triangle Q=frac{i}{2}нR{(T}_2-T_1)+nu R{(T}_2-T_1)=c_{mu p}nu triangle T (10),]
где $c_{mu p}$ — молярная теплоёмкость газа при изобарном процессе. Уравнение (10) определяет количество теплоты, сообщаемое газу массы m в изобарном процессе при увеличении температуры на $triangle T.$
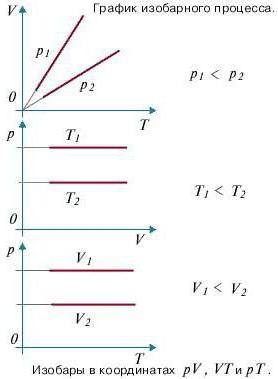
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изобарический процесс, называется изобарой (рис.1).
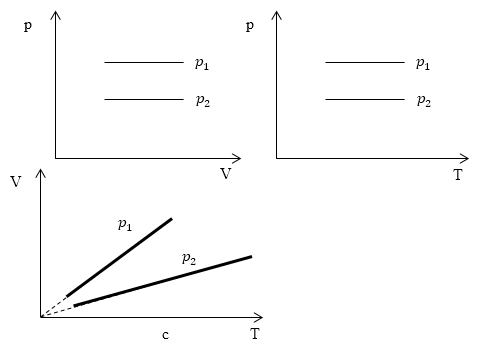
Рис. 1
Пример 1
Задание: Определите, как соотносятся давления $p_1$ и $p_2$ на диаграмме V(T) рис 1с.
Решение:
Проведем изотерму $T_1$
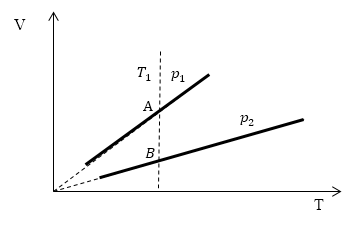
Рис. 2
В точках А и В температуры одинаковы, следовательно, газ подчиняется закону Бойля — Мариотта:
[p_AV_A=p_BV_B (1.2)]
[V_A > V_Bto p_A Ответ: Давления $p_1 > p_2$.
«Изобарический процесс» 👇
Пример 2
Задание: При неизменном давлении p=3$cdot {10}^5$Па газ расширился от объема $V_1=2л$ до $V_2=4л.$ Найти работу, совершаемую газом.
Решение:
За основу решения задачи примем формулу работы при расширении газа в изобарном процессе:
[A=pintlimits^{V_2}_{V_1}{dV}=pleft(V_2-V_1right)left(2.1right).]
Переведем данные объемы в СИ: $V_1=2л=2{cdot 10}^{-3}м^3$, $V_2=4л=4{•10}^{-3}м^3$
Проведем вычисления:
[A=3cdot {10}^5left(4-2right){•10}^{-3}=600(Дж)]
Ответ: Работа газа в изобарном процессе 600 Дж.
Пример 3
Задание: Сравните работу газа в процессе ABC и работу над газом в процессе CDA рис 3.
Решение:
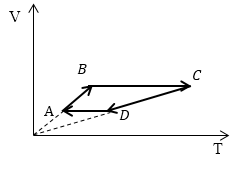
Рис. 3
За основу решения примем формулу, определяющую работу газа:
[A=intlimits^{V_2}_{V_1}{pdV}(3.1)]
Из геометрического смысла определенного интеграла известно, что работа — есть площадь фигуры, которая ограничена функцией подынтегрального выражения, осью абсцисс, и изохорами в точках $V_1 и V_2$ (оси p(V)). Переведем графики процессов в оси p(V).
Рассмотрим каждый отрезок графиков процессов изображенных на рисунке (3).
АВ: Изохорный процесс (p=const), $Vuparrow left( Объем растетright), Tuparrow $;
ВС: Изохорный процесс (V =const), $Tuparrow $ (из графика), p$uparrow $, из закона для изохорного процесса ($frac{p}{T}=const$);
CD: (p=const), $Vdownarrow , Tdownarrow ;$
DA: (V =const), $Tdownarrow , pdownarrow .$
Изобразим графики процессов в осях p(V) (рис.4):
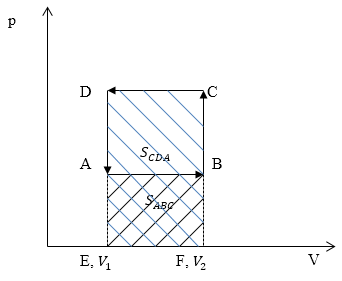
Рис. 4
Работа газа $A_{ABC}=S_{ABC}$ ($S_{ABC}$ — площадь прямоугольника ABFE) (рис. 3). Работа над газом $A_{CDA}=S_{CDA}$ ($S_{CDA}$)$ -площадь прямоугольника $EFCD.Очевидно, что $A_{CDA}>A_{ABC}.$
Ответ: $A_{CDA}>A_{ABC}.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Изобарный процесс, связанные с ним уравнения и вывод формулы работы
Изобарный процесс (также называемый изобарическим процессом) является одним из термодинамических процессов, которые происходят при постоянном показателе давления. Масса газа системы при этом также остается постоянной. Наглядное представление о графике, демонстрирующем изобарный процесс, дает термодинамическая диаграмма в соответствующей системе координат.
Примеры
Наиболее простым примером изобарического процесса можно назвать нагревание некоторого объема воды в открытом сосуде. В качестве еще одного примера можно привести расширение идеального газа в цилиндрическом объеме, где поршень имеет свободный ход. В каждом из этих случаев давление будет постоянным. Оно равно обыкновенному атмосферному давлению, что вполне очевидно.
Обратимость
Изобарный процесс можно считать обратимым в том случае, если давление в системе совпадает с внешним давлением и равно во все моменты времени процесса (то есть оно постоянно по своему значению), а температура изменяется очень медленно. Таким образом, термодинамическое равновесие в системе сохраняется в каждый момент времени. Именно совокупность вышеперечисленных факторов дает нам возможность считать изобарный процесс обратимым.
Чтобы осуществить в системе изобарический процесс, теплоту к ней нужно или подводить, или отводить. При этом теплота должна расходоваться на работу расширения идеального газа и на изменение его внутренней энергии. Формулу, демонстрирующую зависимость величин друг от друга при изобарном процессе, называют законом Гей-Люссака. Она показывает, что объем пропорционален температуре. Давайте выведем эту формулу на основании поверхностных знаний.
Вывод закона Гей-Люссака (первичное понимание)
Человек, хотя бы немного разбирающийся в молекулярной физике, знает, что многие задачи связаны с определенными параметрами. Имя им – давление газа, объем газа и температура газа. В тех или иных случаях в ход идут молекулярная и молярная масса, количество вещества, универсальная газовая постоянная и другие показатели. И здесь есть определенная связь. Давайте поговорим об универсальной газовой постоянной подробнее. На тот случай, если кто-то не знает, каким образом ее получили.
Получение универсальной газовой постоянной

Эту константу (постоянное число с определенной размерностью) принято также называть постоянной Менделеева. Она присутствует также в уравнении Менделеева-Клапейрона для идеального газа. Как же получил наш знаменитый физик эту константу?
Как мы знаем, уравнение идеального газа имеет следующую форму: PV/T (что озвучивается так: “произведение давления на объем, деленное на температуру”). По отношению к универсальной газовой постоянной применим так называемый закон Авогадро. Он гласит о том, что если мы возьмем любой газ, то одинаковое его количество молей при одинаковой температуре и одинаковом давлении займет одинаковый объем.
По сути дела, это есть словесная формулировка уравнения состояния идеального газа, которое было записано в виде формулы немного ранее. Если мы возьмем нормальные условия (а это когда температура газа равна 273,15 Кельвинов, давление равно 1 атмосфере, соответственно, 101325 Паскалей, а объем моля газа равен 22,4 литра) и подставим их в уравнение, все перемножим и разделим, то получим, что совокупность подобных действий дает нам численный показатель, равный 8,31. Размерность дается в Джоулях, деленных на произведение моля на Кельвин (Дж/моль*К).
Уравнение Менделеева-Клапейрона
Давайте возьмем уравнение состояния идеального газа и перепишем его в новом виде. Изначальное уравнение, напомним, имеет вид PV/T=R. А теперь умножим обе части на температурный показатель. Получим формулу PV(м)=RT. То есть произведение давления на объем равно произведению универсальной газовой постоянной на температуру.
Теперь умножим обе части уравнения на то или иное количество молей. Обозначим их количество буквой, скажем, X. Таким образом, получим следующую формулу: PV(м)X=XRT. Но ведь мы знаем, что произведение V с индексом “м” дает нам в результате просто объем V, а число молей X раскрывается в виде деления частной массы на молярную массу, то есть имеет вид m/M.
Таким образом, конечная формула будет выглядеть следующим образом: PV=MRT/m. Это и есть то самое уравнение Менделеева-Клапейрона, к которому пришли оба физика практически одновременно. Мы можем умножить правую часть уравнения (и в то же время разделить) на число Авогадро. Тогда получим: PV = XN(a)RT/N(a). Но ведь произведение количества молей на число Авогадро, то есть XN(a), дает нам не что иное, как общее число молекул газа, обозначаемое буквой N.
В то же время частное от универсальной газовой постоянной и числа Авогадро – R/N(a) даст постоянную Больцмана (обозначается k). В итоге мы получим еще одну формулу, но уже в несколько другом виде. Вот она: PV=NkT. Можно раскрыть эту формулу и получить следующий результат: NkT/V=P.
Работа газа при изобарном процессе
Как мы выяснили ранее, изобарным процессом называется термодинамический процесс, при котором давление остается величиной постоянной. А чтобы выяснить, как будет определяться работа при изобарном процессе, нам придется обратиться к первому началу термодинамики. Общая формула выглядит следующим образом: dQ = dU + dA, где dQ – это количество теплоты, dU – изменение внутренней энергии, а dA – работа, совершаемая в ходе выполнения термодинамического процесса.
Теперь рассмотрим конкретно изобарный процесс. Примем во внимание тот фактор, что давление остается постоянным. Теперь попытаемся переписать первое начало термодинамики для изобарного процесса: dQ = dU + pdV. Чтобы получить наглядное представление о процессе и работе, нужно изобразить его в системе координат. Ось абсцисс обозначим p, ось ординат V. Пускай объем будет увеличиваться. В двух отличных друг от друга точках с соответствующим значением p (конечно же, фиксированным) отметим состояния, представляющие собой V1 (первоначальный объем) и V2 (конечный объем). В этом случае график будет представлять собой прямую линию, параллельную оси абсцисс.
Найти работы в таком случае проще простого. Это будет просто площадь фигуры, ограниченная с двух сторон проекциями на ось абсцисс, а с третьей стороны – прямой линией, соединяющей точки, лежащие, соответственно, в начале и конце изобарной прямой. Попробуем вычислить значение работы при помощи интеграла.
Он будет вычисляться следующим образом: A = p (интеграл в пределах от V1 до V2) dV. Раскроем интеграл. Получим, что работа будет равна произведению давления на разность объемов. То есть выглядеть формула будет следующим образом: A = p (V2 – V1). Если мы раскроем некоторые величины, то получим еще одну формулу. Она выглядит так: A = xR (T2 – T2), где x – количество вещества.
Универсальная газовая постоянная и ее смысл

Можно сказать, что последнее выражение будет определять физический смысл R – универсальной газовой постоянной. Чтобы было понятнее, давайте обратимся к конкретным числам. Возьмем для проверки один моль какого-либо вещества. В то же время пускай температурная разница будет составлять 1 Кельвин. В этом случае легко заметить, что работа газа будет равна универсальной газовой постоянной (или же наоборот).
Заключение
Этот факт можно подать немного в другом свете, перефразировав формулировку. Например, универсальная газовая постоянная будет численно равна работе, совершаемой при изобарном расширении одним молем идеального газа, если он нагревается на один Кельвин. Вычислить работу при других изопроцессах будет несколько сложнее, но главное – при этом применять логику. Тогда все быстро встанет на свои места, и вывод формулы окажется проще, чем вы думаете.
Изобарический процесс
Вы будете перенаправлены на Автор24
Что такое изобарический процесс
Изобарическим (или изобарным) процессом называется процесс, происходящий в неизменной массе газа при постоянном давлении.
Запишем уравнение для двух состояний идеального газа:
[pV_1=nu RT_1left(1right),] [pV_2=nu RT_2 left(2right).]
Разделим уравнение (2) на уравнение (1), получим уравнение изобарного процесса:
Уравнение (4) называют законом Гей-Люссака.
Внутренняя энергия и количество теплоты изобарического процесса
Этот процесс происходит с подводом тепла, если объем увеличивается, или его отводом, чтобы уменьшать объем. Запишем первое начало термодинамики, последовательно получим выражения для работы, внутренней энергии и количества теплоты изобарного процесса:
где $delta Q $- элементарное тепло, подводимое к системе, $dU$- изменение внутренней энергии газа в проводимом процессе, $dA$- элементарная работа, которую совершает газ в процессе, i-число степеней свободы молекулы газа, R — универсальная газовая постоянная, d – количество молей газа.
Изменение внутренней энергии газа:
Уравнение (8) определяет работу для изобарного процесса. Вычтем из (2) уравнение (1), получим еще одно уравнение для работы газа в изобарном процессе:
[p<(V>_2-V_1)=nu R<(T>_2-T_1)to A=nu R<(T>_2-T_1) (9)] [triangle Q=frac<2>нR<(T>_2-T_1)+nu R<(T>_2-T_1)=c_<mu p>nu triangle T (10),]
где $c_<mu p>$ — молярная теплоёмкость газа при изобарном процессе. Уравнение (10) определяет количество теплоты, сообщаемое газу массы m в изобарном процессе при увеличении температуры на $triangle T.$
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изобарический процесс, называется изобарой (рис.1).

Задание: Определите, как соотносятся давления $p_1$ и $p_2$ на диаграмме V(T) рис 1с.
Проведем изотерму $T_1$

В точках А и В температуры одинаковы, следовательно, газ подчиняется закону Бойля — Мариотта:
[p_AV_A=p_BV_B (1.2)] [V_A > V_Bto p_A Ответ: Давления $p_1 > p_2$.
Готовые работы на аналогичную тему
Задание: При неизменном давлении p=3$cdot <10>^5$Па газ расширился от объема $V_1=2л$ до $V_2=4л.$ Найти работу, совершаемую газом.
За основу решения задачи примем формулу работы при расширении газа в изобарном процессе:
Переведем данные объемы в СИ: $V_1=2л=2<cdot 10>^<-3>м^3$, $V_2=4л=4<•10>^<-3>м^3$
Ответ: Работа газа в изобарном процессе 600 Дж.
Задание: Сравните работу газа в процессе ABC и работу над газом в процессе CDA рис 3.

За основу решения примем формулу, определяющую работу газа:
Из геометрического смысла определенного интеграла известно, что работа — есть площадь фигуры, которая ограничена функцией подынтегрального выражения, осью абсцисс, и изохорами в точках $V_1 и V_2$ (оси p(V)). Переведем графики процессов в оси p(V).
Рассмотрим каждый отрезок графиков процессов изображенных на рисунке (3).
АВ: Изохорный процесс (p=const), $Vuparrow left( Объем растетright), Tuparrow $;
ВС: Изохорный процесс (V =const), $Tuparrow $ (из графика), p$uparrow $, из закона для изохорного процесса ($frac
=const$);
CD: (p=const), $Vdownarrow , Tdownarrow ;$
DA: (V =const), $Tdownarrow , pdownarrow .$
Изобразим графики процессов в осях p(V) (рис.4):

Работа газа $A_=S_$ ($S_$ — площадь прямоугольника ABFE) (рис. 3). Работа над газом $A_=S_$ ($S_$)$ -площадь прямоугольника $EFCD.Очевидно, что $A_>A_.$
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 18 12 2021
Первый закон термодинамики – формулы и определение с примерами
Содержание:
Первый закон термодинамики:
При изучении физики в 9 классе вы узнали, что полная механическая энергия замкнутой системы тел сохраняется только при отсутствии трения, а при наличии трения она уменьшается. Куда девается механическая энергия? Если бутылку, заполненную до половины водой при комнатной температуре, встряхивать в течение нескольких минут, то окажется, что вода нагрелась на 1—2 °С. Каким образом нагрелась вода?
В середине XIX века известный английский физик Дж. Джоуль (1818— 1889), проведя многочисленные опыты, показал, что совершённая при перемешивании воды механическая работа практически равна увеличению её внутренней энергии. Опыты Джоуля, а также исследования немецкого врача и естествоиспытателя Р. Майера (1814—1878), немецкого профессора физиологии и одного из самых знаменитых физиков второй половины XIX века Г. Гельмгольца (1821 —1894) позволили сформулировать закон сохранения и превращения энергии, распространив его на все явления природы. Согласно этому закону при любых взаимодействиях материальных объектов энергия не исчезает и не возникает из ничего, она только передаётся от одних объектов к другим или превращается из одной формы в другую.
Для термодинамических систем (в термодинамике обычно рассматривают макроскопически неподвижные системы) закон сохранения и превращения энергии называют первым законом термодинамики. Согласно первому закону термодинамики, приращение внутренней энергии термодинамической системы при переходе из одного состояния в другое равно алгебраической сумме работы, совершённой внешними силами, и количества теплоты, полученного или отданного системой при взаимодействии с внешними телами:
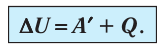
Поскольку работа внешних сил равна работе, совершаемой термодинамической системой, взятой с противоположным знаком (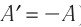
Если система представляет собой действующее устройство, периодически возвращающееся в исходное состояние, то при этом AU-0 и A-Q. Механизм, который мог бы совершать работу без изменения состояния составляющих его тел и без теплопередачи от внешних тел, называют «вечным двигателем первого рода». Поэтому первый закон термодинамики можно сформулировать и следующим образом: невозможен вечный двигатель первого рода, т. е. такой двигатель, который при неизменном значении собственной внутренней энергии совершал бы работу большую, чем энергия, получаемая им извне.
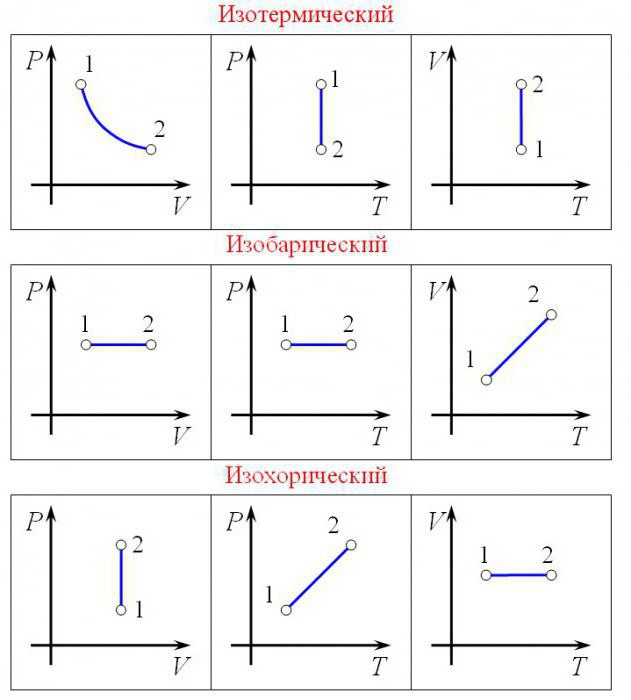
Применим первый закон термодинамики к различным изопроцессам, происходящим с идеальным одноатомным газом.
Изохорный процесс
Пусть идеальный одноатомный газ находится в цилиндрическом сосуде, закрытом неподвижным поршнем (V = const). Нагреем сосуд с газом. Объём газа остаётся практически постоянным (тепловым расширением сосуда пренебрегаем) (рис. 60), следовательно, работа силы давления газа А= 0. Тогда первый закон термодинамики примет вид 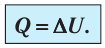 (11.З)
(11.З)
Это означает, что всё передаваемое газу количество теплоты идёт на увеличение его внутренней энергии. При этом приращение внутренней энергии газа 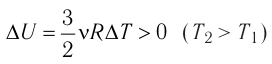 (рис. 61, а). А если газ при изохорном
(рис. 61, а). А если газ при изохорном
процессе отдаёт количество теплоты, то его внутренняя энергия убывает:
 (рис. 61, б).
(рис. 61, б).
Изотермический процесс
Пусть цилиндрический сосуд с газом под поршнем находится в термостате — устройстве, в котором поддерживается постоянная температура. В этом случае внутренняя энергия идеального одноатомного газа  остаётся постоянной, а её изменение
остаётся постоянной, а её изменение  Тогда первый закон термодинамики примет вид
Тогда первый закон термодинамики примет вид 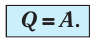 (11.4)
(11.4)
Какие выводы следуют из этого? Если с помощью внешнего устройства медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался (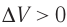 , поскольку
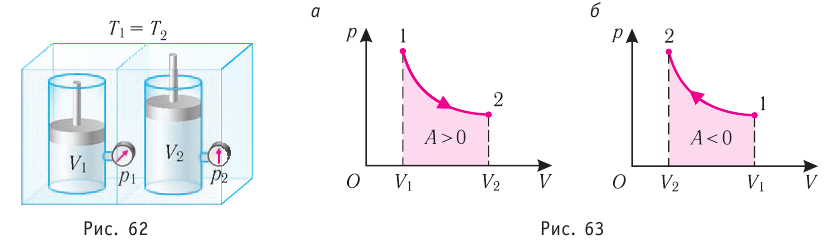
, поскольку 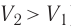 ) (рис. 62), то работа силы давления расширяющегося газа А > 0 (рис. 63, а). При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выравняться, а реально происходящий процесс близок к изотермическому процессу, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.
) (рис. 62), то работа силы давления расширяющегося газа А > 0 (рис. 63, а). При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выравняться, а реально происходящий процесс близок к изотермическому процессу, при котором расширяющийся газ получает некоторое количество теплоты (Q > 0) от термостата.
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде (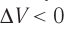 , так как
, так как 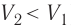 ), то работа силы давления при сжатии газа А 0.
), то работа силы давления при сжатии газа А 0.
Изобарный процесс
Пусть газ находится в цилиндрическом сосуде, закрытом поршнем, который может свободно или под постоянной нагрузкой перемещаться (рис. 64). Нагреем газ, передав ему некоторое количество теплоты (Q > 0). Согласно первому закону термодинамики (11.2) переданное газу количество теплоты частично расходуется на увеличение внутренней энергии 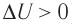 ) системы и частично идёт на совершение работы силой давления газа при его расширении (A>0)(рис. 65, a):
) системы и частично идёт на совершение работы силой давления газа при его расширении (A>0)(рис. 65, a):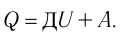
При изобарном процессе работа расширения (сжатия) газа , и первый закон термодинамики принимает вид
(11.5)
При изобарном сжатии газа внешние силы совершают работу А’ > 0. Чтобы давление газа при этом оставалось постоянным, газ необходимо охлаждать, т. е. он должен отдавать в окружающую среду некоторое количество теплоты (Q
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
[spoiler title=”источники:”]
http://spravochnick.ru/fizika/molekulyarnaya_fizika/izobaricheskiy_process/
http://www.evkova.org/pervyij-zakon-termodinamiki
[/spoiler]
Изобарический процесс — процесс, протекающий в идеальном газе, при котором p=const.
Процесс протекания описывается законом Гей-Люссака: при постоянном давлении отношение объема газа к его температуре постоянно ((frac VT=const))
Внутренняя энергия и количество теплоты изобарического процесса
Системе передается определенное количество теплоты. Оно идет на изменение внутренней энергии и совершение работы над веществом:
(Q=A’+triangle U)
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
где Q — количество теплоты, Дж
(А) — работа, совершаемая при расширении или сжатии газа, Дж
(triangle U) — внутренняя энергия, Дж
Работа над газом определяется по формулам:
(А’=p(V_2-V_1)=ptriangle V)
где (А) — работа, Дж
(p) — давление, (Н/м^2)
(V_1) — начальный объем газа, (м^3)
(V_2) — конечный объем газа, (м^3)
(А=frac mMR(Т_2-Т_1))
(m) — масса, г
(M) — молярная масса, г/моль
(R) — универсальная газовая постоянная, ≈ 8,314 Дж/(моль⋅К)
T — температура газа, К
Примечание
Условие протекания изобарического процесса: неизменное значение давления ((triangle p=0))
График изобарного процесса в идеальном газе
Изопроцессы очень часто изображают на термодинамических диаграммах. Так, линия, изображающая на такой диаграмме изобарический процесс, называется изобарой.
Зависимости параметров:
Каким законом описывается изобарный процесс, уравнение
Согласно закону Гей-Люссака объем пропорционален температуре. Выполняется соотношение:
(frac{V_1}{T_1}=frac{V_2}{T_2})
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 декабря 2018 года; проверки требуют 14 правок.
| Статья является частью одноименной серии. |
| Тепловые процессы |
|---|
 |
|
| См. также «Физический портал» |
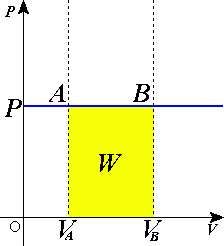
График изобарического расширения газа от объёма 


Изобари́ческий или изоба́рный проце́сс (др.-греч. ἴσος «одинаковый» + βάρος «тяжесть») — термодинамический изопроцесс, происходящий в физической системе при постоянном внешнем давлении[1].
Согласно закону Гей-Люссака, в идеальном газе при изобарном процессе отношение объёма к температуре постоянно: 
Если использовать уравнение Клапейрона — Менделеева, то работа, совершаемая газом при расширении или сжатии газа, равна 
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: 
Теплоёмкость[править | править код]
Молярная теплоёмкость при постоянном давлении обозначается как 

Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной R:
- для одноатомных газов
, то есть около 20,8 Дж/(моль·К);
- для двухатомных газов
, то есть около 29,1 Дж/(моль·К);
- для многоатомных газов
, то есть около 33,2 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Изменение энтропии[править | править код]
Изменение энтропии при квазистатическом изобарном процессе равно 




См. также[править | править код]
- Молекулярно-кинетическая теория
- Изотермический процесс
- Изохорный процесс
- Адиабатический процесс
Примечания[править | править код]
- ↑ Изобарный процесс // Излучение плазмы — Исламский фронт спасения. — М. : Большая российская энциклопедия, 2008. — С. 18. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 11). — ISBN 978-5-85270-342-2.
Литература[править | править код]
- Сивухин Д. В. Общий курс физики. — М., 2008. — Т. II. Термодинамика и молекулярная физика.
- Изобарный процесс // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)
Изобарными
называются процессы, протекающие при
постоянном давлении. Кривые процессов
называются изобарами (рис. 4.4, 4.5).
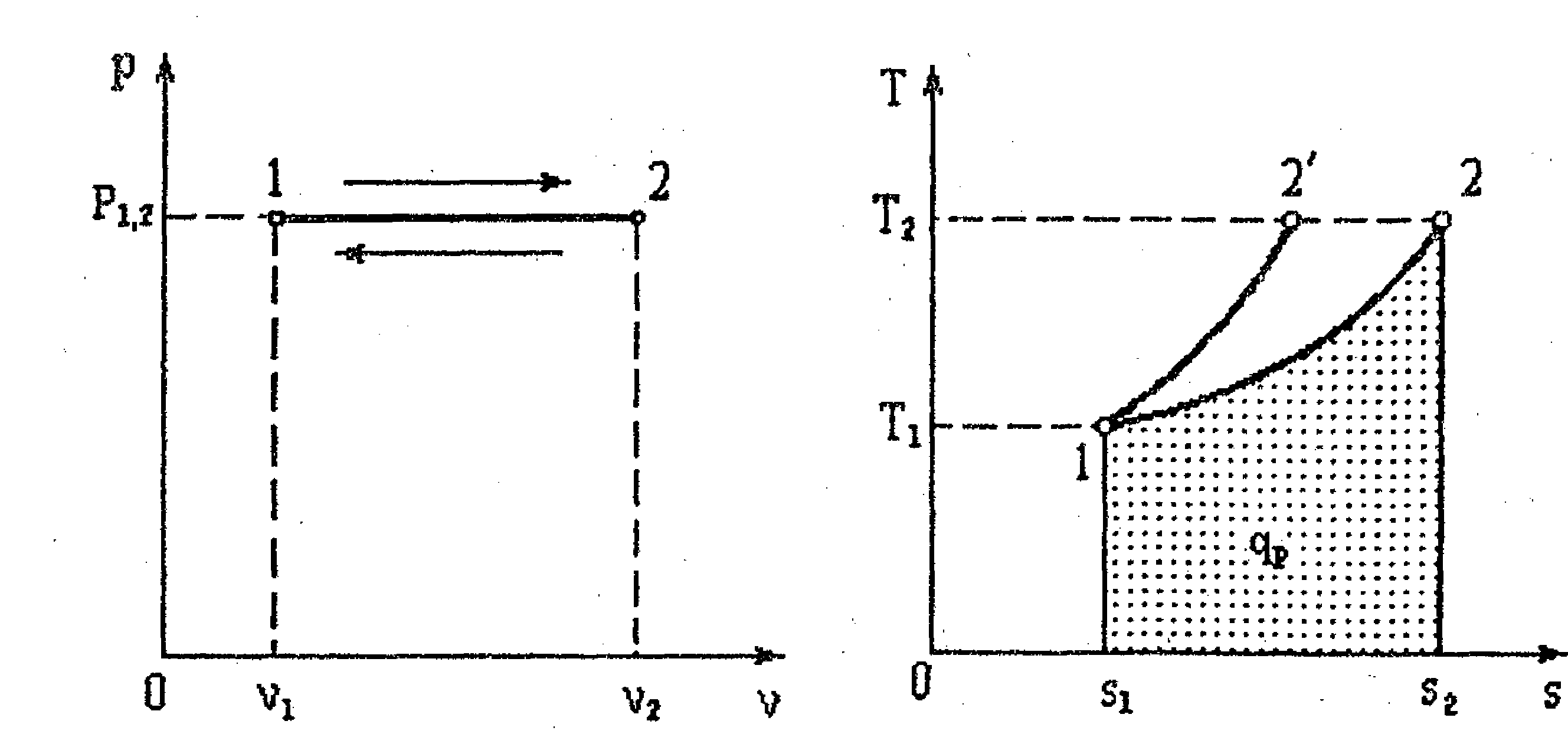
Рис.
4.4.
Рис. 4.5
1. Уравнение процесса
p=const или
dp=0.
2. Соотношение
параметров. Для процесса 1-2 запишем
уравнение состояния в точках 1 и 2
![]()
Разделив первое
уравнение на второе получим известный
закон Гей-Люссака
![]()
3. Изменение
внутренней энергии. Уравнение первого
закона термодинамики для изобарного
процесса имеет вид
![]()
Таким образом, в
изобарном процессе часть теплоты,
подведенной к рабочему телу расходуется
на изменение внутренней энергии, а
оставшаяся часть идет на совершение
внешней работы. Для определения долей
теплоты, затрачиваемой на изменение
внутренней энергии и на совершение
работа, разделим уравнение (4,8) на dqp
![]()
Отсюда
![]()
Если принять
k=1,4, что соответствует
двухатомным газам, то
![]()
Следовательно,
23,5% всей подведенной к рабочему телу
теплоты в изо”
барком процессе
для двухатомного газа расходуется
на совершение внешней работы, а 71,5% »
на изменение внутренней энергии.
Запишем уравнение
первого закона термодинамики через
энтальпию
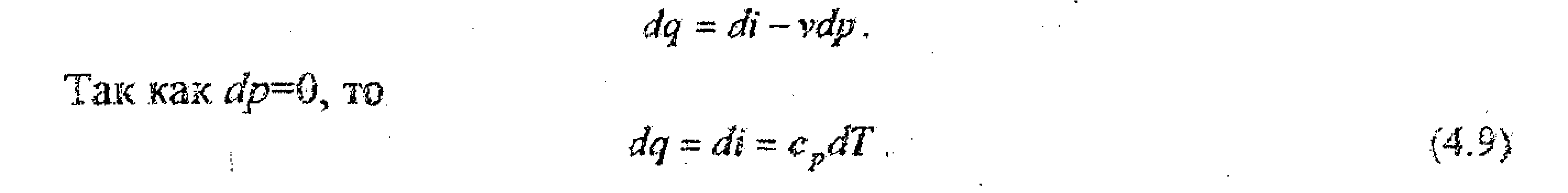
Или
q=i2-i1
=cp
(Т2
–T1)
при cp=const.
Следовательно, в изобарном процессе
теплота, подведенная
к рабочему телу, идет на увеличение
энтальпии. Количество теплоты,
подведенное к рабочему телу в изобарном
процессе, измеряется площадью под
кривой процесса (рис, 4.5),
4. Работа в изобарном
процессе будет dl=
pdv, или
![]()
Располагаемая
работа lo
= -vdp =0 т.к. dp=0
5. Удельное количество
теплоты определяется по уравнениям
(4.8)у (4.9),
6. Изменение
удельной: энтропии найдем из формулы
(4.7), используя соотношение параметров
изобарного процесса v2/v1
=T2 / Т1
![]()
Так как по
уравнению Майера сp
= сv + R,
то s2 – s1
= cp
ln(T2/T1)
Подкасательная к
кривой 1-2 (рис. 4.6) в любой ее точке (для
точки 2 – линия АВ) в соответствующем
масштабе численно равна истинной
теплоемкости сp
Все изобары являются
экзвдистантными кривыми, имеющими при
одной и той же температуре одинаковые
угловые коэффициенты.
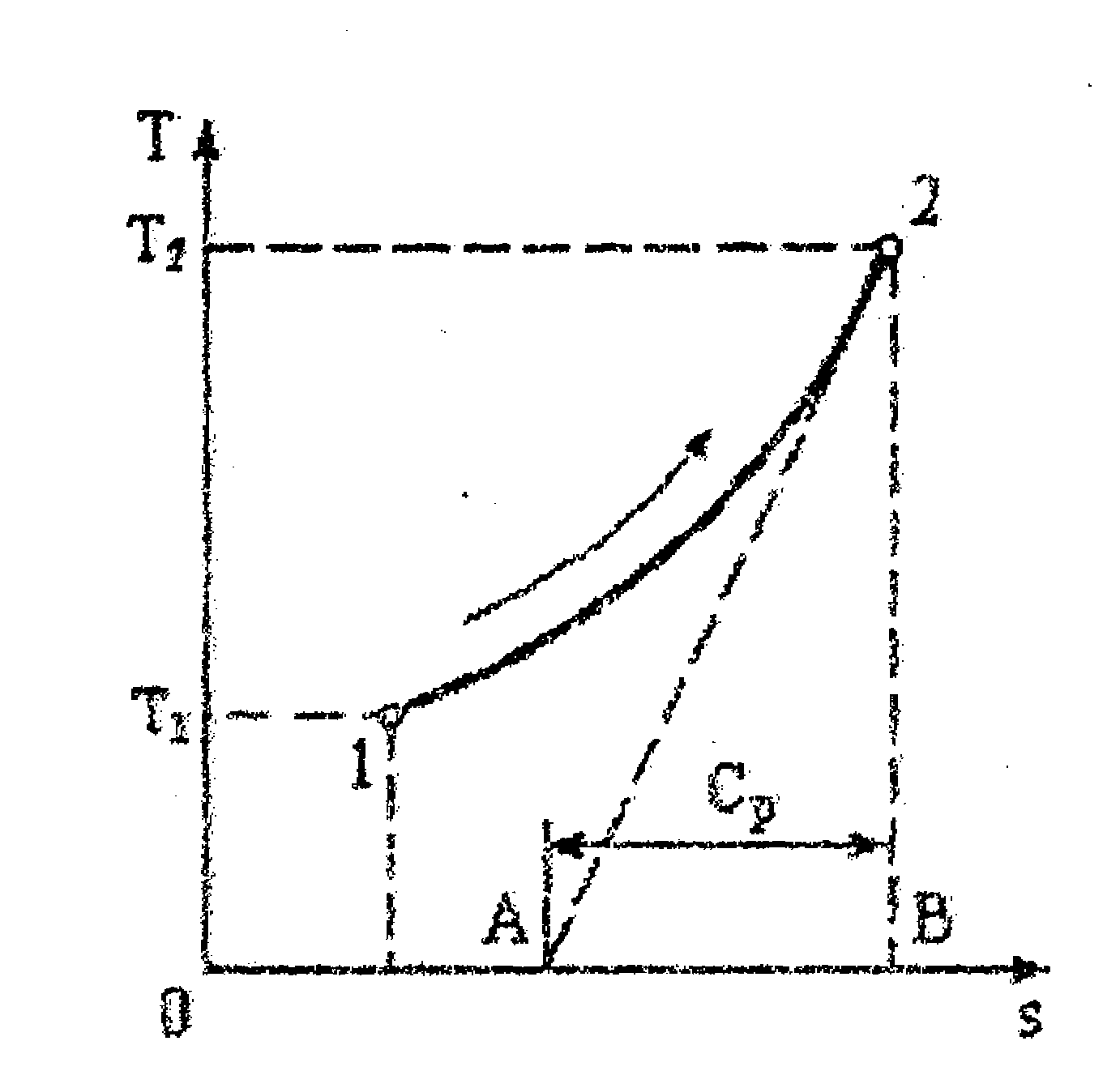
Из уравнения
Майера R= сv
-cp
следует, что сp >
cv .
Поэтому изменение энтропии при
изобарном процессе будет больше, чем
при изохорном.
![]()
Из сопоставления
рис. (4.3) и (4.6) следует что изобара
1-2 (рис. 4.5) при одинаковых температурах
T1 и Т2
более пологая кривая, чем
изохора 1-2′.
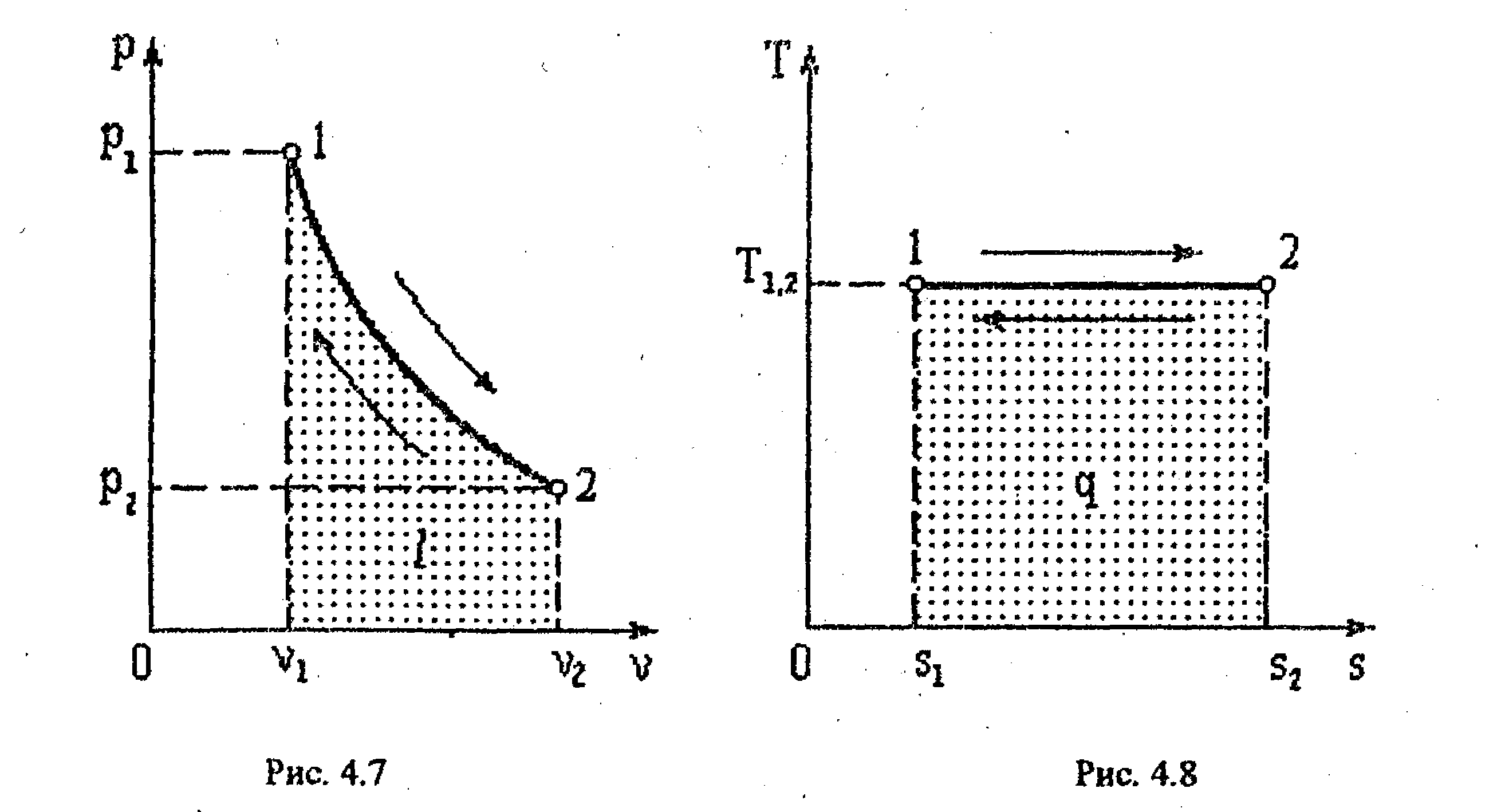
4.4. Изотермический процесс
Изотермическим
называется процесс, протекающий при
постоянной температуре. Кривая
процесса называется изотермой (рис.
4.7, 4.8),
1. Уравнение
процесса T=const
или dT=0.
2. Соотношение
параметров. Уравнение состояния
идеального газа в точках 1 и 2
изотермического процесса будет
![]()
Поделив, первое,
уравнение на второе, получим.
![]()
или
![]()
(4.1O)
Отсюда получаем
еще одно равнение изотермического
процесса
![]()
Из соотношения
(4.1O) следует, что объем
газа, изменяется обратно пропорционально
его давлению (закон Бойля – Мариотта).
3. Изменение внутренней энергии. Запишем
уравнение первого закона термодинамики
в виде dq = сv
dT +pdv.
Так
как dT=0,
то
![]()
Отсюда следует, что вся теплота,
подведенная к рабочему телу в
изотермическом процессе, идет на
совершение работы. Изменение внутренней
энергии
![]()
4. Работа в изотермическом процессе
находится по формуле (4.11). Интегрируя
это соотношение – получим
![]()
Так как из уравнения состояния идеального
газа р=РТ/v, то
![]()
или
![]()
Удельная располагаемая работа находится
по формуле
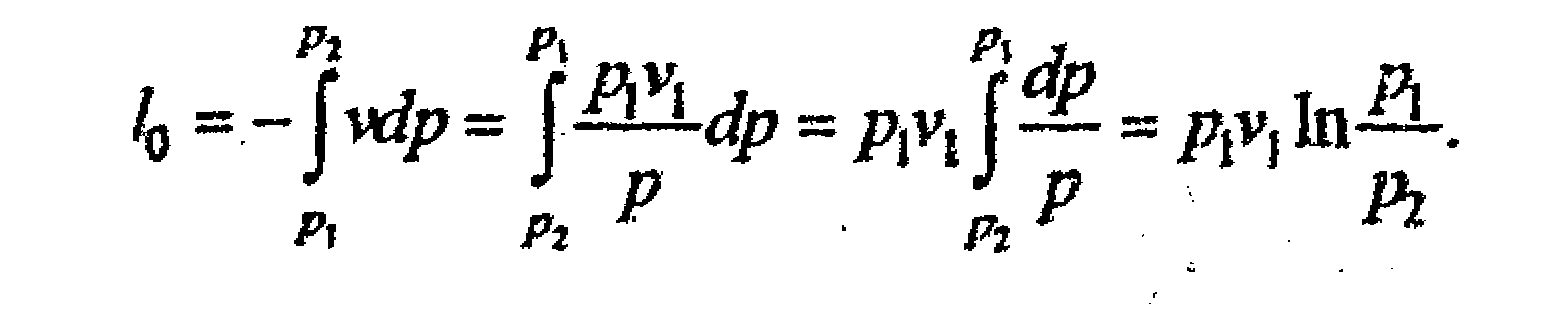
Таким образом, в
изотермическом процессе идеального
газа работа изменения объема l,
располагаемая работа lo
и удельное количество теплоты равны
между собой
![]()
Теплоемкость в
изотермическом процессе![]()
, т.к. dT=0. Отсюда следует,
что теплоемкость в изотермическом
процессе не может быть определена.
5. Удельное количество
теплоты, участвующее в изотермическом
процессе, будет dq=Tds.
Интегрируя, получим q=T(s2
–s1),
6. Изменение удельной
энтропии в изотермическом процессе
определяется отношением
ds=dq/T
. Отсюда dq = Tds
= pdv , ds
= pdv/T
, Интегрируя, получим
![]()
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

