Виды топлива
Человеку очень нужно тепло для всех процессов жизнедеятельности: например, для обогрева жилища, готовки, плавления металлов и получения других видов энергии. Чтобы получать тепло и свет, человек использует топливо. Когда люди впервые добыли огонь, без топлива тоже не обошлось — им послужила древесина.
Топливо — это любое вещество, выделяющее энергию в ходе сгорания.
Существует четыре группы видов топлива:
- твердое топливо,
- жидкое топливо,
- газообразное топливо.
На самом деле есть еще четвертая группа — ядерное топливо, но в этом случае механизм получения энергии другой. О нем мы рассказали в статье про ядерный реактор.
К твердому топливу относятся:
- древесина,
- горючие сланцы,
- уголь,
- торф.
Ископаемые твердые виды топлива, кроме сланцев, являются продуктом разложения органической массы растений. Торф — самый молодой из них, он представляет собой плотную массу, которая образовалась из перегнивших болотных растений. Уже не такие молодые (скажем, средних лет 🤣) бурые угли — это темная однородная масса, которая окисляется и рассыпается на свежем воздухе. Горючие сланцы — полезные ископаемые, дающие смолу. Каменные угли — ребята с повышенной прочностью и небольшой пористостью.
Жидкое топливо — это, например, бензин или нефть. Газообразное — это смесь, содержащая в себе водород и окись углерода.
В горючей части топлива всегда есть углерод, кислород, водород, сера и азот. Кислород в соединении с углеродом или водородом уменьшает тепло, которое выделяется в процессе горения. Азот переходит в продукты сгорания, не окисляясь. Сера — вредная примесь, при сгорании которой выделяется в 4 раза меньше теплоты, чем при сгорании углерода.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Удельная теплота сгорания топлива
Удельная теплота сгорания определяет энергетическую ценность топлива. Эта величина фигурирует в формуле количества теплоты, выделяемого при сгорании топлива.
Количество теплоты, выделяемое при сгорании топлива
Q = qm
Q — количество теплоты [Дж]
q — удельная теплота сгорания [Дж/м3]
m — масса [кг]
Удельная теплота сгорания — это табличная величина, которая показывает, какое количество энергии выделится при сгорании 1 кг топлива.
Ниже представлены таблицы с некоторыми значениями удельной теплоты сгорания.
Твердое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
|---|---|
|
Бурый уголь |
9,3 |
|
Древесный уголь |
29,7 |
|
Сухие дрова |
8,3 |
|
Древесные чурки |
15,0 |
|
Каменный уголь марки А-I |
20,5 |
|
Каменный уголь марки А-II |
30,3 |
|
Кокс |
30,3 |
|
Порох |
3,0 |
|
Торф |
15,0 |
Жидкое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
|---|---|
|
Бензин, нефть |
46,0 |
|
Дизельное топливо |
42,0 |
|
Керосин |
43,0 |
|
Мазут |
40,0 |
|
Этиловый спирт |
27,0 |
Газообразное топливо
|
Вещество |
Удельная теплота сгорания, МДж/м³ |
|---|---|
|
Водород |
120,8 |
|
Генераторный газ |
5,5 |
|
Коксовый газ |
16,4 |
|
Природный газ |
35,5 |
|
Светильный газ |
21,0 |
Решение задач
Задачка простая
В топке паровой машины сгорело 50 кг каменного угля, удельная теплота сгорания которого равна 30 МДж/кг. Какое количество теплоты выделилось в этом процессе?
Решение
В условии задачи есть все необходимые данные, поэтому переводим их в СИ и подставляем в формулу.
СИ — международная система единиц. «Перевести в СИ» означает перевести все величины в метры, секунды и другие единицы измерения без приставок. Исключение — килограмм с приставкой «кило».
Переводим удельную теплоту сгорания в СИ:
30 МДж/кг = 30 000 000 Дж/кг
Подставляем значения в формулу:
Q = qm = 30 000 000 50 = 1 500 000 000 = 1500 МДж
Ответ: в процессе сгорания выделилось 1500 МДж.
Задачка сложная
Сколько килограммов воды можно нагреть на спиртовке при температуре 30°С, если сжечь в ней 21 грамм спирта? КПД спиртовки равен 30%.
Удельная теплота сгорания спирта — 2,9·107 Дж/кг.
Удельная теплоемкость воды — 4200 Дж/(кг·°С).
Решение
кг
Ответ: можно нагреть 1,45 кг воды.
Попробуйте подготовку к ЕГЭ по физике онлайн с опытным преподавателем в Skysmart!
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 августа 2016 года; проверки требуют 24 правки.
Теплота́ сгора́ния — количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества. Измеряется в джоулях или калориях. Теплота сгорания, отнесённая к единице массы или объёма топлива, называется удельной теплотой сгорания. В системе СИ: Дж/кг. Также довольно часто используются внесистемные единицы измерения: кДж/кг, МДж/кг и ккал/кг.
Для её измерения пользуются методами калориметрии. Теплота сгорания определяется химическим составом горючего вещества. Содержащиеся в горючем веществе химические элементы обозначаются принятыми символами С, Н, О, N, S, а зола и вода — символами А и W соответственно.
Виды теплоты сгорания[править | править код]
Теплота сгорания может быть отнесена к рабочей массе горючего вещества 


Различают высшую (

Под высшей теплотой сгорания понимают то количество теплоты, которое выделяется при полном сгорании вещества, включая теплоту конденсации водяных паров при охлаждении продуктов сгорания.
где k — коэффициент, равный 25 кДж/кг (6 ккал/кг); W — количество воды в горючем веществе, % (по массе); Н — количество водорода в горючем веществе, % (по массе).
Расчёт теплоты сгорания[править | править код]
Таким образом, высшая теплота сгорания — это количество теплоты, выделившейся при полном сгорании единицы массы или объема (для газа) горючего вещества и охлаждении продуктов сгорания до температуры точки росы. В теплотехнических расчетах высшая теплота сгорания принимается как 100 %. Скрытая теплота сгорания газа — это теплота, которая выделяется при конденсации водяных паров, содержащихся в продуктах сгорания. Теоретически она может достигать 11 %.
На практике не удается охладить продукты сгорания до полной конденсации, и потому введено понятие низшей теплоты сгорания (QHp), которую получают, вычитая из высшей теплоты сгорания теплоту парообразования водяных паров как содержащихся в веществе, так и образовавшихся при его сжигании. На парообразование 1 кг водяных паров расходуется 2514 кДж/кг (600 ккал/кг). Низшая теплота сгорания для жидкого и твердого вещества определяется по формулам (кДж/кг или ккал/кг):

или

2514 — теплота парообразования при температуре 0 °C и атмосферном давлении, кДж/кг;

9 — коэффициент, показывающий, что при сгорании 1 кг водорода в соединении с кислородом образуется 9 кг воды.
Теплота сгорания является наиболее важной характеристикой топлива, так как определяет количество тепла, получаемого при сжигании 1 кг твердого или жидкого топлива или 1 м³ газообразного топлива в кДж/кг (ккал/кг). 1 ккал = 4,1868 или 4,19 кДж.
Низшая теплота сгорания определяется экспериментально для каждого вещества и является справочной величиной. Также её можно определить для твердых и жидких материалов, при известном элементарном составе, расчётным способом в соответствии с формулой Д. И. Менделеева, кДж/кг или ккал/кг:

или






Для сравнительных расчётов используется так называемое условное топливо, имеющее удельную теплоту сгорания, равную 29308 кДж/кг (7000 ккал/кг).
В России тепловые расчёты (например, расчёт тепловой нагрузки для определения категории помещения по взрывопожарной и пожарной опасности[1]) обычно ведут по низшей теплоте сгорания; в США, Великобритании, Франции — по высшей. В Великобритании и США до внедрения метрической системы мер удельная теплота сгорания измерялась в британских тепловых единицах (BTU) на фунт (lb) (1Btu/lb = 2,326 кДж/кг).
| Вещества и материалы | Низшая теплота сгорания при постоянном давлении  , МДж/кг , МДж/кг
|
|---|---|
| Бензин | 41,87[2] |
| Керосин | 42,9—43,12[3] |
| Бумага(книги, журналы) | 13,4[4] |
| Древесина (бруски W = 14%) | 13,8[4] |
| Каучук натуральный | 44,73—44,8[4] |
| Линолеум поливинилхлоридный | 14,31[4] |
| Резина | 33,52 |
| Волокно штапельное | 13,8 |
| Полиэтилен | 47,14[4] |
| Полистирол | 39[4] |
| Хлопок разрыхленный | 15,7[4] |
Самые высокие значения теплоты сгорания природных газов из различных источников[править | править код]
Данные получены Международным энергетическим агентством[5].
- Алжир: 42 000 кДж/м³
- Бангладеш: 36 000 кДж/м³
- Белоруссия: 33 000 кДж/м³
- Великобритания: 39 710 кДж/м³
- Вьетнам: 45 520 кДж/м³
- Канада: 38 200 кДж/м³
- Индонезия: 40 600 кДж/м³
- Нидерланды: 33 320 кДж/м³
- Норвегия: 39 877 кДж/м³
- Россия: 38 231 кДж/м³
- Саудовская Аравия: 38 000 кДж/м³
- США: 38 416 кДж/м³
- Узбекистан: 37 889 кДж/м³
Необходимое количество электроэнергии для работы лампочки мощностью 100 Вт в течение 1 года[править | править код]
Количество топлива, необходимого для получения указанной ниже электроэнергии, рассчитано при 100 % эффективности преобразования тепловой энергии в электрическую. Так как большинство электрогенерирующих установок и распределительных систем достигают эффективности (КПД) порядка 30—35 %, фактическое количество топлива, используемого для питания лампочки мощностью 100 Вт, будет приблизительно в три раза больше указанного количества.
- 228,5 кг древесины (при 20 % влажности)
- 88,5 кг угля (антрацит малозольный)
- 72,1 кг керосина
- 79,2 м³ природного газа (используя усредненную величину 40000 кДж/м³)
- 63 кг метана
- 26 кг водорода
- 0,04 г урана (здесь имеется в виду энергия, выделяющаяся при цепной ядерной реакции)
- 1,75*10−5 г антивещества (здесь имеется в виду энергия, выделяющаяся при аннигиляции).
Примечания[править | править код]
- ↑ НПБ 105-03
- ↑ Теплота сгорания Автоматические системы пожаротушения, установки пожаротушения, проект сигнализации, обслуживание сигнализации, оросители: спринклеры и дренчеры, монтаж пожарной сигнализации, пожарная экспертиза, огнезащитная краска, покрытия и составы, обработка огнезащитная, огнезащита конструкций, металлоконструкций, системы пожарной безопасности, пожарные категории, план эвакуации, охранно пожарная сигнализация, противопожарные ворота, двери металлические, системы пожарной сигнализации, автоматическое пожаротушение, противопожарная защита, монтаж ОПС. stopfire.ru. Дата обращения: 19 октября 2017. Архивировано 20 октября 2017 года.
- ↑ ГОСТ 10227-86. Топлива для реактивных двигателей. Топлива для реактивных двигателей. www.nge.ru. Дата обращения: 19 октября 2017. Архивировано 20 октября 2017 года.
- ↑ 1 2 3 4 5 6 7 ООО “Аудит пожарной безопасности”. pozharaudit.ru. Дата обращения: 19 октября 2017. Архивировано из оригинала 31 октября 2017 года.
- ↑ Key World Energy Statistics (2005), page 59. Дата обращения: 14 ноября 2010. Архивировано из оригинала 5 декабря 2010 года.
Литература[править | править код]
- Физический энциклопедический словарь
- Большая Советская энциклопедия
- Пособие по применению НПБ 105-95 «Определение категорий помещений и зданий по взрывопожарной и пожарной опасности»
См. также[править | править код]
- Внутренняя энергия
- Горение
- Пожар
- Экзотермическая реакция
- Удельная теплота сгорания
V.Содержание отчета
1.Краткое описание лабораторной установки, основные теоретические положения, порядок проведения работы.
2.Технические характеристики оборудования и метрологические характеристики средств измерений.
3.Результаты опытов, таблицы, рисунки, необходимые расчеты, сравнение результатов работы с табличными значениями (приложение 1).
4.Выводы по работе с пояснением о влиянии выхода летучих и характере коксового остатка на организацию и процесс горения.
I. Цель работы
Экспериментальное определение теплоты сгорания топлива по бомбе для аналитической пробы топлива, пересчет ее на низшую теплоту сгорания для рабочей массы; приобретение навыков анализа влияния теплоты сгорания на процесс горения.
II. Основные теоретические положения
Теплота сгорания − одна из основных тепловых характеристик органического топлива. Теплотой сгорания называют теплоту, которая выделяется при полном сгорании единицы массы [кг] или объема [м3] топлива. Определяется теплота сгорания двумя способами:
1) аналитически из полуэмпирического выражения, полученного Д.И. Менделеевым для твердого и жидкого топлива, кДж/кг
Qн р = 339Ср +1030Н р −109( Ор − Sл р ) − 25W р ,
где QP, НР, ОР, SЛР, Wр − процентное содержание водорода, углерода, кислорода, серы летучей и влаги в рабочей массе топлива; первые три коэффициента, умноженные на 100, − теплота сгорания углерода, водорода и серы; четвертый коэффициент, умноженный на 100, − теплота испарения воды; для газообразного топлива, МДж/м3
Qнс = 0,01( QСОСО +QН2 Н2 +QН2 S H2S +QСН4 СН4 + +QС2 Н6 С2 Н6 +K+QСn H m Cn Hm ),
где QCO ,QH 2 и т. д. − теплота сгорания каждого газа, входящего в состав
топлива; СО, Н2 и т. д. − процентное содержание соответствующего газа в 1 м3 топлива;
99
2) экспериментально путем сжигания навески топлива в калориметре. Этот способ дает наиболее достоверные результаты.
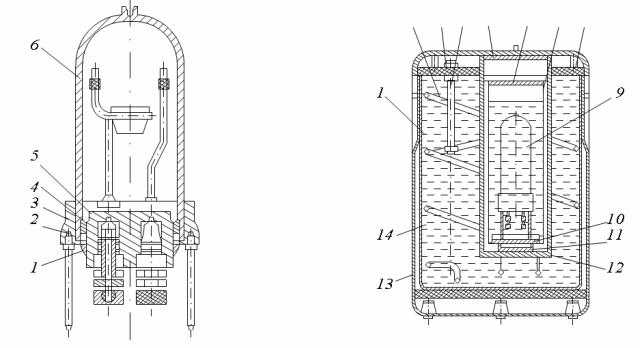
Сущность калориметрического метода определения теплоты сгорания состоит в том, что навеска испытуемого топлива сжигается в среде кислорода под давлением 29,4·105 Па (30 кгс/см2) в специальной камере − калориметрической бомбе (рис. 29), погруженной в калориметрический сосуд, заполненный дистиллированной водой. Последний устанавливают в калориметре (рис. 30). Бомба состоит из корпуса 6, крышки 5, между крышкой и корпусом вложены уплотнительные кольца: резиновое 4 и металлическое 2, поджимаемые к корпусу накидной гайкой 3 и контргайкой 1.
Калориметр представляет собой сосуд с двумя оболочками: наружной 14 и внутренней 12; внутренняя полость между оболочками заполняется водой, температура которой поддерживается постоянной при помощи нагревателя (на рис. не показан), охлаждающего змеевики 2 и мешалки 4; сверху внутренняя полость 1 изолирована текстолитовой плитой 3, с отверстиями 8 для установки термометров; калориметр помещен в декоративный кожух 13. В центре калориметра имеется гнездо, образованное внутренней оболочкой 12, куда на ножки 11 устанавливается калориметрический сосуд 7; сосуд сверху закрывается металлической крышкой 6, а гнездо − эбонитовой крышкой 5. Калориметрическая бомба 9 устанавливается внутри сосуда на специальные подставки 10.
|
Рис. 29. Разрез калори- |
Рис. 30. Разрез |
|
метрической бомбы |
калориметра |
Теплота, выделяемая при сгорании навески, через стенки бомбы передается воде калориметрического сосуда. Замерив повышение температуры воды за время опыта, из уравнения калориметрии (без учета поправок) определяется удельная теплота сгорания топлива, кДж/кг
100
C t Q = mi ,
где Сi − эффективная теплоемкость калориметра (обычно задается); t − изменение температуры сосуда калориметра при сжигании навески топлива; m – масса навески топлива.
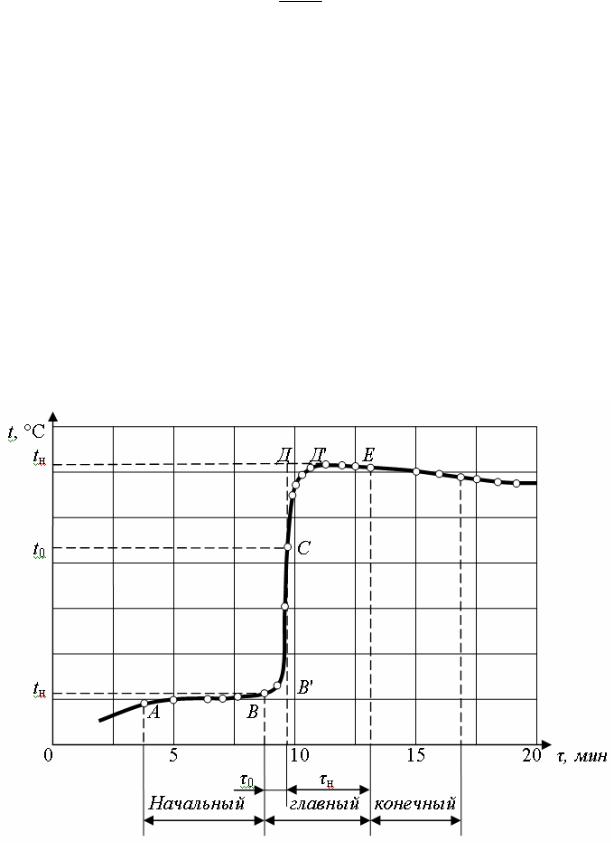
Калориметрический опыт разделяется на три периода: начальный, служащий для учета теплообмена калориметра с окружающей средой в условиях начальной температуры опыта; главный, в течение которого происходит сгорание навески топлива, сопровождающееся быстрым подъемом и выравниванием температуры в калориметрическом сосуде; конечный, служащий для учета теплообмена калориметра с окружающей средой в условиях конечной температуры опыта. Характер изменения температуры в калориметрическом сосуде показан на рис. 31. Перпендикуляр, восстановленный к оси абсцисс через (·) С (последняя точка отсчета с быстрым подъемом температуры), делит площадь ВВ’СДД’ на две равные: ВВ’С и СДД’. Эти площади показывают влияние на опыт нестационарности теплообмена бомбы с водой в калориметрическом сосуде. При правильно выбранной начальной температуре воды в калориметрическом сосуде t0 погрешность, вследствие влияния этого теплообмена, сводится к минимуму.
Рис. 31. Изменение показаний термометра Бэкмона
101

Поправку на теплообмен калориметра с окружающей средой вычисляют по формуле, °С
Ct = t1 +2 t2 rб + t2rм ,
где t1 − среднее изменение температуры за полуминутный промежуток отсчетов температуры в начальном периоде, в делениях шкалы термометра; t2 − то
же в конечном периоде; rб − число полуминутных промежутков главного периода с быстрым (0,3 °С и более за 30 с) подъемом температуры, т. е. от (·) В до
(·)С (рис. 31); rм − число полуминутных интервалов главного периода с медленным (менее 0,3 °С за 30 с) подъемом или снижением температуры, т. е. от
(·)С до (·) Е (рис. 31).
При вычислении t1 и t2 необходимо вычесть последний отcчет из первого как в начальном, так и в конечном периодах и подставить в формулу с полученным знаком. В связи c этим значение Ct может быть положительным (калориметр отдает теплоту в окружающую среду) и отрицательным (теплообмен направлен в противоположную сторону).
Измерение температуры в калориметрическом сосуде производится метастатическим термометром с ценой деления 0,01 °С; отсчет может производиться с точностью ±0,001 °С при использовании специальной лупы. Поправки к показаниям на калибр hк и hн при температурах tк и tн берутся из паспортных данных термометра (приложение ЛР 2). Цена оцифрованного деления Н = 1 при измерениях в диапазонах температур от 20 до 25 °С.
Взвешивание массы навески топлива и запальной проволоки производится на аналитических весах; погрешность весов ±0,001 г.
Погрешность эффективной теплоемкости калориметра берется из его паспортных данных.
Расчетная формула для определения теплоты сгорания в бомбе аналитической пробы топлива с учетом поправок на показания термометра и теплообмен с окружающей средой имеет вид, кДж/кг
Qба = Сi H [( tк + hк ) −( tн + hн ) + Сt ] − q1G1 , m
где G1 −масса сгоревшей части запальной проволоки, кг;
G1 = G – G2 ,
G − масса запальной проволоки до начала опыта, кг; G2 − масса остатка проволоки после опыта; q1 − теплота сгорания запальной проволоки, кДж/кг (для меди − 2510, константана − 3140, никелина − 3240, железа − 6690).
Сера, содержащаяся в топливе, сгорает в калориметрической бомбе при большем избытке кислорода, чем в топках промышленных установок, с образованием SО3, а не SO2, высший окисел, растворяясь в воде, образует серную ки-
102

слоту. Поэтому при сгорании 1 кг серы в бомбе выделяется теплоты на 9400 кДж больше, чем в топке.
В бомбе, в отличие от реальных условий сжигания топлива в топке, имеет место также некоторое тепловыделение за счет реакции образования азотной кислоты, пропорциональное теплоте сгорания Qδa; его принимают равным 0,001 Qδa для тощих углей и антрацитов и 0,0015 Qδa для остальных углей, торфа и горючих сланцев.
Высшую теплоту сгорания аналитической пробы топлива с учетом кисло-
тообразования определяют по формуле, кДж/кг
Qва = Qба −94Sба −( 0,001K0,0015 )Qба ,
где Sδa − количество серы, перешедшей при сжигании топлива в бомбе в серную кислоту (определяется в смыве бомбы (см. работу 5)).
При сжигании топлива с теплотой сгорания более 14650 кДж/кг и общим содержанием серы Sла < 4 % вместо Sδa используют Sла. При определении высшей рабочей теплоты сгорания учитывают теплоту, выделяющуюся при конденсации водяных паров, содержащихся в продуктах сгорания топлива.
Пересчет на рабочую массу выполняют по следующему выражению, кДж/кг:
Qв р = Qва 100 −W ар ,
100 −W
где Wр, Wa − влажность топлива на рабочую массу аналитической пробы соответственно, %.
При температуре уходящих дымовых газов выше температуры конденсации водяных паров, как это имеет место в реальных условиях, теплота конденсации не учитывается. В таком случае при выполнении тепловых расчетов пользуются низшей теплотой сгорания, кДж/кг
Qн р = Qв р − 25( 9Н р +W р ),
где 25 − скрытая теплота парообразования 0,01 кг водяного пара, кДж; 9 − коэффициент пересчета содержания водорода в топливе на воду. Нр определяют из таблиц (см. приложение ЛР 1) для испытуемого топлива.
Абсолютную погрешность косвенного определения теплоты сгорания топлива можно вычислить по результатам опыта из выражения, кДж/кг
|
∂Q |
2 |
∂Q |
2 |
2 |
∂Q |
2 |
|||||||
|
2 |
2 |
||||||||||||
|
Q = ± |
Ci |
+ |
t + |
m , |
|||||||||
|
∂ |
|||||||||||||
|
∂Ci |
t |
∂m |
103

где Ci , t , m − соответственно абсолютные погрешности измерения эффек-
тивной теплоемкости (из паспортных данных калориметра), температуры калориметра ( с = ±0,01 °С), массы навески топлива (см. работу 1).
Так как Q = Ci t/m, то
|
t |
2 |
2 |
2 |
2 |
2 |
t |
2 |
2 |
|||
|
Q = ± |
Ci |
+ |
Ci |
t |
+ |
Ci |
m |
. |
|||
|
m2 |
m4 |
||||||||||
|
m2 |
Относительная погрешность, %
δQ = QQ 100.
Низшая теплота сгорания рабочей массы является основным показателем энергетической ценности топлива. Для сравнения энергетической ценности топлив с различной теплотой сгорания введено понятие об условном топливе с теплотой сгорания 29300 кДж/кг. Тепловой эквивалент топлива представляет отношение
Э = Qн р .
29300
Этой характеристикой удобно пользоваться при сравнении работающих установок по экономичности и другим показателям.
Изменение теплоты сгорания QнР топлива, сжигаемого в топочном устройстве, может происходить по двум причинам: при изменении влажности и зольности топлива одной марки и при изменении марки сжигаемого топлива. Влияние изменения QнР на процесс горения для первого случая рассмотрено в работах 1 и 2. При изменении марки твердого топлива теплотворная способность может изменяться вследствие изменения содержания углерода в 1 кг топлива за счет изменения влажности и зольности (см. работы 1 и 2) или (при сохранении
тех же значений Ар и WР) за счет изменения содержания в топливе кислорода Ор и азота NP.
Уменьшение количества Ор приведет к увеличению расхода окислителя до значения, необходимого для качественного сжигания топлива; режим горения изменится незначительно, однако несколько возрастет объем продуктов горения за счет увеличения объема азота воздуха, а также тепловыделение в топке.
Увеличение QнP за счет уменьшения содержания в топливе азота также приведет к увеличению тепловыделения в топке и некоторому увеличению объема дымовых газов.
Таким образом, влияние изменения теплотворной способности топлива на процесс горения необходимо рассматривать с учетом комплекса причин, вызвавших это изменение, т. е. индивидуально для конкретных топлив.
104
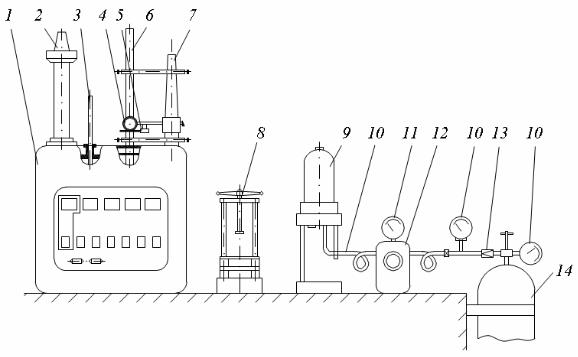
III. Описание лабораторной установки
Лабораторная установка (рис. 32) состоит из калориметра 1 с установленными на нем электроконтактным ртутным термометром 2, служащим для регулирования температуры воды в калориметре, ртутным термометром 3 для контроля температуры воды в оболочке калориметра, метастатическим термометром 6, служащим для измерения разности температур в калориметрическом сосуде, и стойкой 7, служащей для крепления термометра 6 и перемещения вдоль вертикальной оси термометра 6 оптического устройства 4 и вибратора 5. Навеска топлива изготавливается при помощи пресса 8, затем помещается в калориметрическую бомбу 9, заполняемую кислородом из баллона 14. Кислород к бомбе подается через понижающий редуктор 13 и контрольный редуктор 11 при помощи трубок 12. Контроль над давлением в системе осуществляется манометрами 10.
Рис. 32. Калориметрическая установка
IV. Порядок выполнения работы
1.Ознакомиться с устройством калориметра, бомбы, пресса и лабораторной установкой в целом.
2.Записать технические характеристики оборудования и метрологические характеристики средств измерений, используемых в работе.
3.Изготовить навеску испытуемого топлива при помощи пресса 8 (рис. 32). Порядок изготовления − по указанию преподавателя.
4.Взвесить полученный брикет топлива на аналитических весах. Масса брикета должна быть равна [(0,800…1,500) ±0,001) г].
5.Взвесить запальную проволоку из заранее известного материала с точно-
стью ±0,001 г.
105
6. Подготовить к опыту калориметрическую бомбу (см. рис. 29); для этого: а) установить тигелек и кольцо держателя на крышке бомбы; б) навесить брикет на проволоку, концы которой закрепить на электродах
крышки так, чтобы брикет свободно висел над тигельком, проволока не должна касаться его стенок;
в) налить с помощью пипетки 1 мл дистиллированной воды в канавку крышки бомбы;
г) проверить сопротивление цепи зажигания в бомбе; сопротивление цепи зажигания должно быть равно (1,0±0,1 Ом);
д) надеть на крышку бомбы последовательно резиновую прокладку и косым срезом к ней металлическое кольцо, вставить крышку в корпус бомбы и завинтить рукой накидную гайку, установить бомбу в переносную подставку.
7. Заполнить бомбу кислородом, для этого:
а) открыть входной клапан «1» и выходной клапан «2» на внешней стороне крышки бомбы на половину оборота, снять резьбовые колпачки с клапанов;
б) подсоединить к клапану «1» кислородопроводящую трубку 12 (рис. 32) от контрольного редуктора 11. При завинчивании накидной гайки трубки 12 следует удерживать клапан «1» ключом, чтобы он не закрывался;
в) открыть вентиль на баллоне 14 до установления на выходе редуктора 13 давления 3,1 МПа, плавно открыть клапан контрольного редуктора 11 до установления на его манометре давления 0,49 МПа, продуть бомбу при этом давлении в течение (2,0±0,1 мин).
г) закрыть ключом выходной клапан «2» и медленно за (1,5±0,5 мин) наполнить бомбу кислородом до давления 2,84 МПа. Закрыть клапан контрольного редуктора 11, завернуть ключом до упора входной клапан «1» бомбы;
д) отсоединить от входного клапана «1» кислородопроводящую трубку 12, завинтить рукой до упора контргайку 1 (рис. 29).
8. Подготовить к опыту калориметр, для этого:
а) присоединить к токовым выводам бомбы проводники, другие концы которых подсоединить к клеммам крышки 6 (рис. 30) калориметрического сосуда; навинтить на клапаны «1» и «2» бомбы резьбовые колпачки;
б) установить бомбу в калориметрический сосуд (рис. 30).
в) заполнить калориметрический сосуд дистиллированной водой так, чтобы она полностью покрывала бомбу, температура воды не должна быть более 24,5 °С, закрыть сосуд крышкой 6 (рис. 30);
г) установить сосуд в гнезда калориметра на подставку 11 (рис. 30), закрыть крышкой 6, подсоединить контакты цепи зажигания и разъем нагревателя к гнездам на крышке 6, проверить исправность цепи зажигания, подсоединив омметр к гнезду «Зажигание» на передней панели калориметра;
д) установить метастатический термометр 6 (рис. 32) в специальное гнездо, плавно опуская его таким образом, чтобы его нижний ртутный резервуар находился на уровне середины бомбы;
е) проверить положение ударника вибратора – (1…2 мм) от корпуса метастатического термометра;
106
ж) вставить вилку шнура с кнопкой зажигания в гнезда «Зажигание», подать питание 220 В, 50 Гц на калориметр, включить последовательно кнопки «Сеть», «Мешалка», «Осветитель термометра», «Вибратор», «Зуммер»; зуммер должен быть хорошо слышен, а вибратор слегка ударять по термометру;
з) включить кнопки «Нагреватели сосуда, оболочки», установить температуру воды: внутренней полости 1 (рис. 30) 27,5 °С, в калориметрическом сосуде 24,9 °С; при установлении показаний 1,1 деления по шкале метастатического термометра (достигается предварительной его настройкой) отключить кнопку «Нагреватель сосуда».
9.Провести эксперимент по определению удельной теплоты сгорания топлива, для этого:
а) выждать 10 мин для выравнивания температуры всех частей калоримет-
ра:
б) провести начальный период эксперимента, для этого следует отсчитать 10 показаний по шкале метастатического термометра, каждое показание считывать по третьему сигналу зуммера (или по третьему загоранию сигнальной лампы «Отсчет»); результаты данного и последующих периодов опыта занести в таблицу по форме 4;
в) провести главный период эксперимента, для этого на одиннадцатом отсчете (считая его первым отсчетом главного периода) нажать кнопку цепи зажигания; отсчитать 15 показаний по шкале метастатического термометра в том же темпе, как в п. б);
г) провести конечный период эксперимента, для этого, считая последний отсчет главного периода первым отсчетом конечного периода, отсчитать в нем 11 показаний в том же темпе, что и в п. б).
Примечание. Погрешность считывания по шкале метастатического термометра в начальном, главном (с четвертого отсчета) и в конечном периодах не должна превышать 0,1 наименьшего деления шкалы, в главном периоде погрешность первых трех отсчетов после зажигания не должна превышать двух наименьших делений шкалы.
10.Отключить питание калориметра, выключить все кнопки, извлечь и отвести в сторону метастатический термометр, снять крышку калориметра, отсоединить все провода от крышки калориметрического сосуда, извлечь сосуд из гнезда, а бомбу − из сосуда.
11.Снять колпачки с клапанов бомбы, установить бомбу на подставку, отвинтить контргайку 1 (рис. 29), открыть ключом выходной клапан и постепенно
втечение 4…5 мин выпустить газ; разобрать бомбу.
12.Осмотреть бомбу и если внутри имеются сажистые вкрапления или недогоревшее топливо, эксперимент повторить с самого начала. При отсутствии их тщательно отмыть горячей дистиллированной водой все внутренние части бомбы, включая тигелек, крышку и ее каналы, особенно выпускной. Всю промывную воду (300…350 мл) собирают вместе с содержанем тигелька в стакан. Смыв бомбы подвергают анализу в соответствии с указаниями к работе 5.
13.Собрать остатки запальной проволоки и взвесить их с погрешностью
±0,001 г.
107

14. Рассчитать значения Qба; Qвa; QвP; QнР и погрешности расчета; сравнить полученные значения со справочными данными (приложение ЛР 1).
Примечание. Работу с регистратором смотри в приложении ЛР 4.
|
Форма 4 |
||||||||||||
|
Период |
Запись отсчетов по термометру |
Данные для расчета |
||||||||||
|
номера на- |
показания по шка- |
|||||||||||
|
блюдений |
ле термометра |
|||||||||||
|
Начальный |
0 |
Температура помеще- |
||||||||||
|
1 |
||||||||||||
|
2 |
ния |
|||||||||||
|
3 |
Сi |
= 15000 |
||||||||||
|
4 |
Дж/град |
|||||||||||
|
5 |
Н = 1,000 град/дел. |
|||||||||||
|
6 |
tн = |
|||||||||||
|
7 |
hн |
= |
||||||||||
|
8 |
х0 − х10 |
|||||||||||
|
t1 = |
||||||||||||
|
9 |
||||||||||||
|
tн= |
10 |
|||||||||||
|
Главный |
10 |
|||||||||||
|
(запал) |
||||||||||||
|
11 |
rб = |
|||||||||||
|
12 |
rм = |
|||||||||||
|
13 |
tк = |
|||||||||||
|
14 |
hк = |
|||||||||||
|
15 |
х |
24 − х34 |
||||||||||
|
t 2 = |
||||||||||||
|
16 |
||||||||||||
|
10 |
||||||||||||
|
17 |
q1 = |
|||||||||||
|
18 |
G1 = |
|||||||||||
|
19 |
m = |
|||||||||||
|
20 |
Уголь марки |
|||||||||||
|
21 |
||||||||||||
|
22 |
||||||||||||
|
23 |
||||||||||||
|
24 |
||||||||||||
|
Конечный |
25 |
tк= |
Vг = |
|||||||||
|
26 |
||||||||||||
|
27 |
Wа = |
|||||||||||
|
28 |
Aa = |
|||||||||||
|
29 |
Sа = |
|||||||||||
|
30 |
Sла = |
|||||||||||
|
31 |
Нг = |
|||||||||||
|
32 |
Нр = |
|||||||||||
|
33 |
Wр = |
|||||||||||
|
34 |
108
V.Содержание отчета
1.Описание лабораторной установки, технические характеристики оборудования и метрологические характеристики средств измерений.
2.Основные теоретические положения.
3.Краткое описание методики проведения эксперимента по определению теплоты сгорания топлива.
4.Необходимые рисунки, расчеты.
5.Выводы по работе с указанием факторов, влияющих на изменение теплоты сгорания топлива и процесс горения.
Работа 5. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СЕРЫ В ТОПЛИВЕ (МЕТОД «СМЫВА БОМБЫ»)
I. Цель работы
Изучение методики определения содержания серы в твердых и жидких топливах; анализа влияния содержания серы в топливе на коррозионную агрессивность продуктов сгорания.
II. Основные теоретические положения
При сжигании сернистых топлив температура точки росы продуктов сгорания может быть намного выше точки росы, определяемой парциальным давлением водяных паров в дымовых газах. Это превышение обусловлено наличием в газах окислов серы, содержащейся в топливе, в частности сернистого SO2
исерного SO3 ангидрида. Соединяясь с парами воды, они образуют смесь кислот, которая, конденсируясь на низкотемпературных поверхностях нагрева, вызывает коррозионное разрушение металла.
Увеличение содержания серы в топливе приводит к росту содержания SO2
иSO3 в дымовых газах, повышению температуры точки росы продуктов сгорания и снижению экономичности оборудования вследствие необходимости увеличения температуры уходящих газов.
Вобласти высоких температур при соприкосновении газов с горячими по-
верхностями нагрева SO2 окисляется до SO3. Катализаторами этой реакции являются пленка окалины Fe2O3 и слой нагара. Образующиеся при этом сульфидные окислы железа разрушают защитную пленку окалины, что приводит к повреждению металла поверхностей нагрева. Особенно подвержены высокотемпературной газовой коррозии трубки пакетов пароперегревателя.
При сжигании топлива в бомбе сера, содержащаяся в нем, сгорает с обра-
зованием SO3 и, соединяясь с водой, образует H2SO4. Серная кислота в растворе диссоциирует, образуя ионы водорода и сульфат-ионы. При соединении с рас-
твором хлористого бария ВаС12 образуется сульфат бария в виде осадка по реакции
109
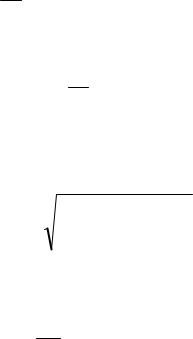
H2SO4 + ВаСl2 = 2НСl + BaSO4.
Содержание общей серы в аналитической пробе может быть найдено из выражения, %
Sa = q 0,1374 100, m
где q − масса сернокислого бария; 0,1374 − коэффициент пересчета сернокислого бария на содержание в нем серы; m − масса навески топлива.
Для оценки точности определения содержания Sa необходимо провести несколько опытов, вычислить среднее арифметическое
Sа = 1 ∑n Siа ,
n i=1
найти отклонения
Siа = Sа −Siа
и вычислить среднеквадратическое отклонение результатов измерения
|
σ |
а = ± |
1 |
∑ |
2 а . |
|
|
S |
|||||
|
n( n −1) |
Si |
||||
Вычислить доверительные границы εр, за пределы которых с заданной доверительной вероятностью P = 0,95 не выйдет за истинное значение содержания серы в аналитической пробе. Запись результата
Sа ± εр ,
где εр = σS а t р.
Коэффициент tP определяется по таблице Лапласа, исходя из условия, что распределение погрешностей подчиняется нормальному закону.
III. Описание лабораторной установки
Лабораторная установка (рис. 33) состоит из электрической муфельной печи 2 с задатчиком температуры 1; термоэлектрического термометра, состоящего из термоэлектрического преобразователя 4 и милливольтметра 5, отградуированного в градусах Цельсия, эксикатора 6, нагревательного устройства 8, тигля 3, стакана 7, аналитических весов и набора реактивов: соляной кислоты, метилоранжа, 10 %-го раствора хлористого бария (на рис. не показаны).
110
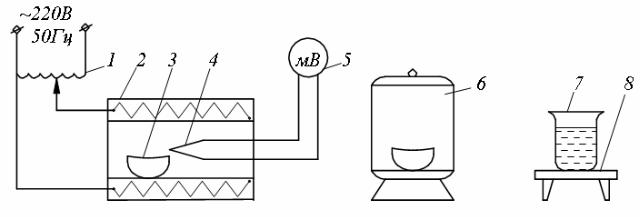
Рис. 33. Схема установки для определения содержания серы в топливе
IV. Порядок выполнения работы
1.Ознакомиться с лабораторной установкой, порядком включения муфельной печи и установления заданной температуры в ней, установки и выемки из печи тигля, работы с весами.
2.Записать технические характеристики основного оборудования и метрологические характеристики средств измерений.
3.Добавить в приготовленный смыв бомбы (см. работу 4), налитый в стакан 7 (рис. 33), небольшое количество соляной кислоты до слабокислой реакции (раствор после добавления нескольких капель метилоранжа должен покраснеть).
4.Установить стакан 7 на нагревательное устройство 8, нагреть раствор до кипения и к нему по каплям налить 10 мл 10 %-го раствора хлористого бария; в стакане выпадет осадок сернокислого бария.
5.Установить стакан с осадком в кипящую водяную баню, где держать два часа, вынуть, выдержать при комнатной температуре не менее 12 ч.
Примечание. Эту часть работы выполняют в тот же день, что и работу 4. Окончание работы переносится на другое занятие.
6.Профильтровать осадок через плотный беззольный фильтр; промыть осадок на фильтре несколько раз горячей дистиллированной водой для полного удаления соляной кислоты.
7.Взвесить пустой просушенный тигель на аналитических весах с погрешностью ±0,001 г. Результат взвешивания занести в таблицу по форме 5 (сюда же заносятся результаты остальных измерений).
111

|
Форма 5 |
||||||
|
№п/п |
Массанавески топливаm, г |
Массапустого тигляg |
тигляМассас осадком контрольногопосле взвешиванияg |
BaМасса |
Содержаниесеры в аналитическойпробе S |
Результатизмерения, % |
|
г |
г |
|||||
|
2 |
g, |
|||||
|
, |
||||||
|
г , |
4 |
|||||
|
SO |
% |
|||||
|
1 |
2 |
|||||
|
, |
||||||
|
а |
1
2
3
8.Подсушить влажный фильтр с осадком сернокислого бария, не вынимая из воронки, сложить вчетверо, поместить в тигель, слегка уплотнить осадок в тигле.
9.Установить задатчиком 1 температуру в печи 2 (775…825 °С) по прибору 5, открыть печь и поместить тигель с осадком у входа в печь; выдержать в таком положении до обугливания содержимого тигля, не давая загореться фильтру (допускается обуглить содержимое тигля на электроплитке).
10.Переместить тигель в зону максимальной температуры, закрыть печь, прокаливать до тех пор, пока остаток в тигле не станет совершенно белым.
11.Остудить тигель на воздухе в течение 5 мин., а затем в эксикаторе до комнатной температуры; взвесить тигель с остатком.
12.Вновь поместить тигель в печь, прокалить содержимое в течение (5…7) мин, повторить операции по п. 11; сравнить результаты измерений по пп. 11, 12; если разница взвешиваний превышает 0,001 г − повторить прокаливание; масса тигля с осадком после последнего (контрольного) прокаливания не должна отличаться от его массы после предыдущего прокаливания более чем на
0,001 г.
13.Вычислить массу осадка (BaSO4) как разность масс тигля после контрольного прокаливания и пустого.
14.Рассчитать содержание общей серы Sa в аналитической пробе. Массу навески топлива принять по данным работы 4.
15.Рассчитать погрешность экспериментального определения общей серы
ваналитической пробе. Результаты расчетов занести в таблицу по форме 5.
112
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Различные виды топлива (твёрдое, жидкое и газообразное) характеризуются общими и специфическими свойствами. К общим свойствам топлива относятся удельная теплота сгорания и влажность, к специфическим — зольность, сернистость (содержание серы), плотность, вязкость и другие свойства.
Удельная теплота сгорания топлива — это количество теплоты, которое выделяется при полном сгорании (1) кг твёрдого или жидкого топлива или (1) м³ газообразного топлива.
Энергетическая ценность топлива в первую очередь определяется его удельной теплотой сгорания.
Удельная теплота сгорания обозначается буквой (q). Единицей удельной теплоты сгорания является (1) Дж/кг для твёрдого и жидкого топлива и (1) Дж/м³ — для газообразного топлива.
Удельную теплоту сгорания на опыте определяют довольно сложными методами.
Таблица (2). Удельная теплота сгорания некоторых видов топлива.
Твёрдое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
| Бурый уголь |
(9,3) |
| Древесный уголь |
(29,7) |
| Дрова сухие |
(8,3) |
| Древесные чурки |
(15,0) |
|
Каменный уголь марки А-(I) |
(20,5) |
|
Каменный уголь марки А-(II) |
(30,3) |
| Кокс |
(30,3) |
| Порох |
(3,0) |
| Торф |
(15,0) |
Жидкое топливо
|
Вещество |
Удельная теплота сгорания, МДж/кг |
| Бензин, нефть |
(46,0) |
| Дизельное топливо |
(42,0) |
| Керосин |
(43,0) |
| Мазут |
(40,0) |
| Спирт этиловый |
(27,0) |
Газообразное топливо
(при нормальных условиях)
|
Вещество |
Удельная теплота сгорания, МДж/м³ |
| Водород |
(120,8) |
| Генераторный газ |
(5,5) |
| Коксовый газ |
(16,4) |
| Природный газ |
(35,5) |
| Светильный газ |
(21,0) |
Из этой таблицы видно, что наибольшей является удельная теплота сгорания водорода, она равна (120,8) МДж/м³. Это значит, что при полном сгорании водорода объёмом (1) м³ выделяется (120,8) МДж (=) (120,8)
⋅106
Дж энергии.
Водород — один из высокоэнергетических видов топлива. Кроме того, продуктом сгорания водорода является обычная вода, в отличие от других видов топлива, где продуктами сгорания являются углекислый и угарный газы, зола и топочные шлаки. Это делает водород экологически наиболее чистым топливом.
Однако газообразный водород взрывоопасен. К тому же он имеет самую малую плотность в сравнении с другими газами при равной температуре и давлении, что создаёт сложности со сжижением водорода и его транспортировкой.
Общее количество теплоты (Q), выделяемое при полном сгорании (m) кг твёрдого или жидкого топлива, вычисляется по формуле:
Общее количество теплоты (Q), выделяемое при полном сгорании (V) м³ газообразного топлива, вычисляется по формуле:
Влажность (содержание влаги) топлива снижает его теплоту сгорания, так как увеличивается расход теплоты на испарение влаги и увеличивается объём продуктов сгорания (из-за наличия водяного пара).
Зольность — это количество золы, образующейся при сгорании минеральных веществ, содержащихся в топливе. Минеральные вещества, содержащиеся в топливе, понижают его теплоту сгорания, так как уменьшается содержание горючих компонентов (основная причина) и увеличивается расход тепла на нагрев и плавление минеральной массы.
Сернистость (содержание серы) относится к отрицательному фактору топлива, так как при его сгорании образуются сернистые газы, загрязняющие атмосферу и разрушающие металл. Кроме того, сера, содержащаяся в топливе, частично переходит в выплавляемый металл, сваренную стекломассу, снижая их качество. Например, для варки хрустальных, оптических и других стёкол нельзя использовать топливо, содержащее серу, так как сера значительно понижает оптические свойства и колер стекла.
Энергия, которую тело получает или отдает при теплопередаче, называется количеством теплоты. Мы проделали не один опыт, рассмотрели как при теплообмене одни тела отдают энергию, а другие получают. Во многих опытах мы использовали горелку, чтобы сообщить телу какое-то количество теплоты. А как рассчитать это количество теплоты?
С давних времен, чтобы получить энергию, люди используют топливо. Сейчас топливо является источником энергии в промышленности, сельском хозяйстве, на транспорте и, конечно, в повседневном быту. Это нефть, природный газ, торф, уголь, дрова и др.
В данном уроке мы рассмотрим, за счет чего выделяется энергия при сгорании топлива и как ее рассчитать. Также вы узнаете новое определение (удельная теплота сгорания) и научитесь им пользоваться.
Сгорание топлива и энергия
Для начала давайте вспомним строение молекулы воды (рисунок 1). Она состоит из одного атома кислорода и двух атомов водорода.
Между атомами действуют силы притяжения. Если мы захотим разделить атомы, составляющие молекулы, придется преодолеть эти силы. В таком случае будет совершена работа, и затрачена некоторая энергия. При соединение атомов, наоборот, энергия будет выделяться.
Выделение энергии при соединении атомов — явление, на котором основано использование топлива.
В любом топливе содержатся атомы углерода. В процессе горения они соединяются с двумя атомами кислорода (рисунок 2).
В результате:
- Образуется молекула углекислого газа (оксида углерода)
- Выделяется энергия
Удельная теплота сгорания
При сгорании разных видов топлива одинаковой массы выделяется разное количество теплоты. Для того чтобы характеризовать каждый вид топлива используют такую величину, как удельная теплота сгорания. При проектировании двигателей эта величина помогает рассчитать, какое количество теплоты может выделить сжигаемое топливо.
Удельная теплота сгорания топлива — это физическая величина, показывающая, какое количество теплоты выделяется при полном сгорании топлива массой $1 space кг$.
- Обозначается буквой $q$
- Единица измерения — $1 frac{Дж}{кг}$
Величину удельной теплоты сгорания устанавливают на опыте. Мы будем использовать уже готовые результаты таких исследований, представленные в таблице 1.
| Вещество | $q, space frac{Дж}{кг}$ | Вещество | $q, space frac{Дж}{кг}$ |
| Порох | $0.38 cdot 10^7$ | Древесный уголь | $3.4 cdot 10^7$ |
| Дрова сухие | $1.0 cdot 10^7$ | Природный газ | $4.4 cdot 10^7$ |
| Торф | $1.4 cdot 10^7$ | Нефть | $4.4 cdot 10^7$ |
| Каменный уголь | $2.7 cdot 10^7$ | Бензин | $4.6 cdot 10^7$ |
| Спирт | $2.7 cdot 10^7$ | Керосин | $4.6 cdot 10^7$ |
| Антрацит | $3.0 cdot 10^7$ | Водород | $12 cdot 10^7$ |
Возьмем табличное значение удельной теплоты сгорания нефти — $4.4 cdot 10^7 frac{Дж}{кг}$. Эта величина говорит нам о том, что при полном сгорании нефти массой $1 space кг$ выделяется $4.4 cdot 10^7 frac{Дж}{кг}$ энергии.
Формула для расчета количества теплоты, выделяемого при сгорании топлива
Для расчета полного количества теплоты, выделяемого при полном сгорании топлива некоторой массы, используют формулу:
$Q = qm$,
где $Q$ — выделяемое количество теплоты,
$q$ -удельная теплота сгорания топлива,
$m$ — масса сгораемого топлива.
Упражнения
Упражнение №1
Какое количество теплоты выделится при полном сгорании керосина объемом $2 space л$ и плотностью $800 frac{кг}{м^3}$?
Дано:
$V = 2 space л$
$rho = 800 frac{кг}{м^3}$
$q = 4.6 cdot 10^7 frac{Дж}{кг}$
СИ:
$2 cdot 10^{-3} space м^3$
$Q — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Формула для расчета количества теплоты:
$Q = qm$.
Массу выразим через объем и плотность: $m = rho V$.
Рассчитаем количество теплоты:
$Q = qrho V = 4.6 cdot 10^7 frac{Дж}{кг} cdot 800 frac{кг}{м^3} cdot 2 cdot 10^{-3} space м^3 = 7360 cdot 10^4 space Дж = 73.6 cdot 10^6 space Дж = 73.6 space МДж$.
Ответ: $Q = 73.6 space МДж$.
Упражнение №2
Вычислите массу сухих дров, если при их полном сгорании выделилось $70 000 space кДж$ энергии.
Дано:
$Q = 70 000 space кДж$
$q = 1.0 cdot 10^7 frac{Дж}{кг}$
СИ:
$7 cdot 10^7 space Дж$
$m — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Из формулы $Q = qm$ выразим массу дров $m$:
$m = frac{Q}{q}$.
Рассчитаем:
$m = frac{7 cdot 10^7 space Дж}{1.0 cdot 10^7 frac{Дж}{кг}} = 7 space кг$.
Ответ: $m = 7 space кг$.
