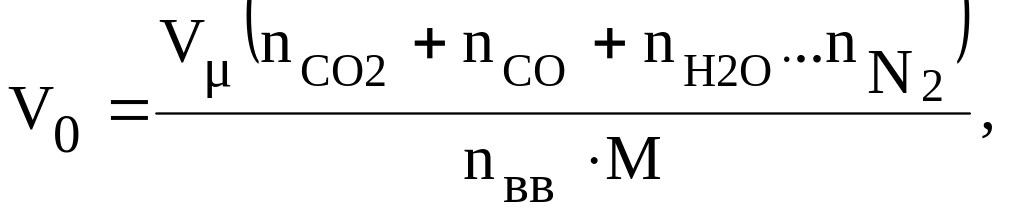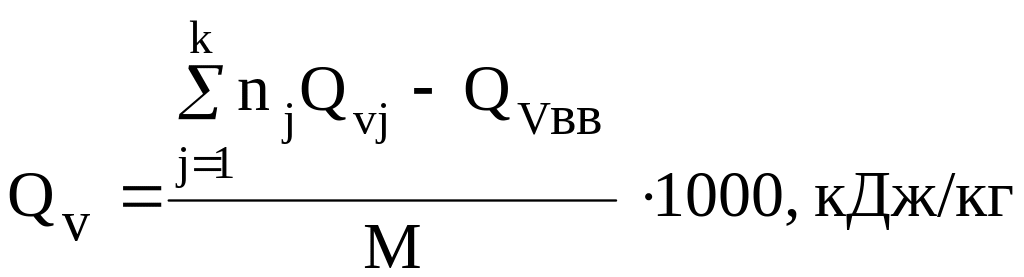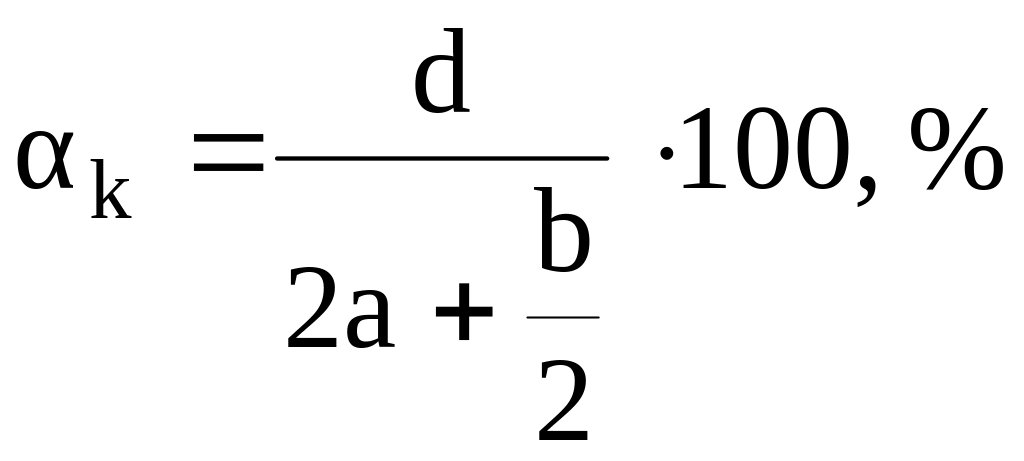Теплота взрыва (удельная энергия[1]) или теплота взрывчатого превращения[2] — количество тепла, выделяемое при взрывчатом превращении 1 моля или 1 кг взрывчатого вещества, является одной из существенных характеристик взрывчатого вещества[3]; это один из тепловых эффектов в теории взрывчатых веществ наряду с теплотой образования и теплотой сгорания взрывчатых веществ[4].
Также теплотой взрыва называют общий тепловой эффект химических реакций во фронте детонационной волны и реакций, длящихся при адиабатическом расширении продуктов взрыва по завершению реакций[3].
Единицы измерения: ккал/кг[3], кДж/кг[5], ккал/моль[3], Дж/моль[3], Дж/кг[3][6].
В формулах, как правило, обозначается Qв[6], Qвзр[3][7].
Теплота взрыва используется для определения способностей того или иного взрывчатого вещества[6].
Расчет и определение теплоты взрыва[править | править код]
Теплоту взрыва определяют:
- экспериментально в калориметрических установках;
- расчётными способами (теоретически)[3][8][9].
Показатели теплоты взрыва, определяемые опытным путём, в настоящее время достигают точности 0,1 %[8]. В качестве типовых условий используют температуры 0 ° и 18 °С, давление 10 Па[9].
Теоретический расчёт теплоты взрыва возможен в случае наличия точной информации о составе продуктов взрыва который, в свою очередь, определяется как характеристиками заряда, так и свойствами взрывчатого вещества, а также условиями взрывания[3][8][10]. Расчётный способ применяется в тех случаях, когда невозможно провести эксперимент или нужны теоретические данные ещё не синтезированного взрывчатого вещества или взрывчатой системы[8].
Встречающиеся численные значения теплот взрыва различных веществ принимаются как неизменные для каждого из них, в то же время на эти показатели влияет и характеристика заряда, и условия охлаждения, что приводит к изменению теплового эффекта реакции[11]. Таким образом теплота взрыва не постоянная величина и колеблется в определенных пределах, например, у широко применяемых взрывчатых веществ — от 1000 до 1500 ккал/кг[3][12].
Виды теоретических расчётов теплоты взрыва[править | править код]
- Уравнение Малляра — Ле Шателье и Бринкли — Вильсона
Теоретический расчёт теплоты взрыва проводится по общим правилам уравнений распада взрывчатых веществ Малляра — Ле Шателье или Бринкли — Вильсона, особенно для взрывчатых веществ с небольшим отрицательным, нулевым или положительным кислородным балансом. Для веществ с отрицательным кислородным балансом применение уравнений Малляра — Ле Шателье недопустимо, так как результат не соответствует показателям, полученным опытным путём, поэтому применяется уравнение Бринкли — Вильсона, где результат больше соответствует экспериментальным теплотам, но даже в этом случае у тротила результаты завышены[13].
- Закон Гесса
Обычно для расчёта теплоты взрыва используют закон Гесса, как основанный на первом начале термодинамики, согласно которому общий тепловой эффект определяется начальным и конечным состоянием системы[9], то есть в отношении теории взрыва теплота взрыва должна составлять разницу между теплотой образования продуктов взрыва и теплотой образования взрывчатого вещества[3][7]:
- Qвзр = Σqпв – qвв,
где Qвзр — теплота взрыва, Σqпв — теплота образования продуктов взрыва, qвв — теплота образования взрывчатых веществ[7].
- Qвзр = Q2 – Q1,
где Qвзр — теплота взрыва, Q2 — теплота образования продуктов взрыва, ккал/Дж; Q1 — теплота образования взрывчатого вещества или его составных частей, ккал/Дж[3][9].
Общая информация[править | править код]
Показатель теплоты взрыва в определённых пределах зависит от толщины и материала оболочки, куда помещен заряд, а с увеличением плотности заряда значения теплоты взрыва повышается по линейному закону[13].
Теплота взрыва разделяется на:
- теплота детонации (или малая теплота взрыва) — минимальный средний показатель теплоты, определяющий детонационный режим, выделяясь в детонационной волне и передаваясь ей полностью; её экспериментальное определение до настоящего времени затруднено. Может изменяться от давления в детонационной волне[10][13].
- фугасная теплота — теплота взрыва в массивной оболочке. Промежуточная между теплотой детонации и максимальной теплотой. Зависит от плотности заряда и толщины оболочки; изменения зависят от давления внешней среды и газодинамических условий процесса расширения продуктов взрыва[10][13].
- максимальная теплота — является константой взрывчатых веществ ввиду того, что определяется исключительно составом взрывчатого вещества, вне зависимости от начального и конечного размеров состояния продуктов взрыва. Позволяет увидеть предельные возможности взрывчатого вещества, в случае, если необходим результат полного превращения химической энергии в тепловую[10][13].
Для установления фугасной теплоты взрывчатого вещества на практике используются следующие приёмы:
- метод свинцовой бомбы;
- метод эквивалентных зарядов;
- метод баллистического маятника;
- метод баллистической мортиры;
- определение фугасной теплоты по объёму воронки выброса;
- измерение параметров воздушных ударных волн[6].
Примеры влияния на показатели теплоты взрыва[править | править код]
В случаях детонации плотных зарядов взрывчатых веществ с отрицательным кислородным балансом, которые помещены в массивную оболочку, наблюдается дополнительное выделение тепла без увеличения скорости детонации, так, при взрыве тротила, спрессованного в латунную оболочку толщиной 4 мм, выделяется на 25 % больше энергии (1080 кал/г), чем при взрыве аналогичного по весу и плотности заряда тротила в слабой слеклянной оболочке толщиной 2 мм (840 кал/г). Такой же эффект наблюдается у пикриновой кислоты, тетрина, гексогена. При этом увеличение теплоты взрыва за счет уплотнения и оболочки отслеживается только у взрывчатых веществ с отрицательным кислородным балансом, у других смесевых взрывчатых веществ с небольшим, нулевым или положительным кислородным балансом (ТЭН, глицерин) данный эффект не прослеживается[3][13].
Дополнительное выделение теплоты взрыва может зависеть от медленного протекания химических реакций генераторного газа, не усиливающих детонационную волну[3][7][13].
Росту показателя теплоты взрыва способствует приращивание, измеренного для свободных и утяжеленных зарядов, импульса детонационной волны[13].
Примечания[править | править код]
- ↑ Теория горения и взрыва, 2010, с. 154, 156.
- ↑ Теплота взрывчатого превращения // Словарь ракетных и артиллерийских терминов / Ред. В. М. Михалкин. — Москва: Военное издательство, 1988. — С. 218.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Теория горения и взрыва, 2010, с. 156.
- ↑ Станюкович, Баум, Шехтер, 2013, с. 82.
- ↑ Теория горения и взрыва, 2010, с. 156, 163.
- ↑ 1 2 3 4 Архипов, Синогина, 2007.
- ↑ 1 2 3 4 Дубнов, Бахаревич, Романов, 1988, с. 26.
- ↑ 1 2 3 4 Станюкович, Баум, Шехтер, 2013, с. 85—86.
- ↑ 1 2 3 4 Грабчак, Малышев, Комащенко, Федунец, 1997, с. 84.
- ↑ 1 2 3 4 Дубнов, Бахаревич, Романов, 1988, с. 29.
- ↑ Станюкович, Баум, Шехтер, 2013, с. 90.
- ↑ Станюкович, Баум, Шехтер, 2013, с. 94.
- ↑ 1 2 3 4 5 6 7 8 Апин, Велина, Лебедев, 1962.
Литература[править | править код]
- Апин, A. Я. О полном использовании энергии взрыва / A. Я. Апин, Н. Ф. Велина, Ю. А. Лебедев // ПМТФ: Журнал прикладной механики и технической физики. — Изд-во Наука, Сибирское от-ние, 1962. — № 5. — С. 96—106.
- Архипов, В. А. Горение и взрывы. Опасность и анализ последствий: учебное пособие. Часть II / В. А. Архипов, Е. С. Синогина. — Томск : Издательство: ТГПУ, 2007.
- Грабчак, Л. Г. Проведение горно-разведочных выработок и основы разработки месторождений полезных ископаемых / Л. Г. Грабчак, Ю. Н. Малышев, В. И. Комащенко, Б. И. Федунец. — М. : Изд-во Академии горных наук, 1997. — 578 с.
- Дубнов, Л. В. Промышленные взрывчатые вещества / Л. В. Дубнов, Н. С. Бахаревич, А. И. Романов. — 3-е издание, переработанное и дополненое. — М. : Недра, 1988. — ISBN 5-247-00285-7.
- Станюкович, К. П. Физика взрыва / К. П. Станюкович, Ф. А. Баум, Б. И. Шехтер. — Рипол классик, 2013. — 806 с. — ISBN 5458416880.
- Теория горения и взрыва. Конспект лекций. — Ульяновск : УВАУГА (И), 2010. — ISBN 978-5-7514-0169-6.
Газообразные
продукты взрыва являются тем
непосредственным агентом, при помощи
которого выделяющаяся энергия превращается
в работу. Наряду с этим знание объема и
состава газообразных продуктов взрыва
позволяет рассчитать максимальную
температуру, которая могла быть
достигнута при этом.
Объем
продуктов взрыва одного килограмма ВВ
определяется по формуле
м3/кг,
где
Vμ
= 22,4
м3/кмоль
– объем/киломоля газов (при 00С
и 101325 Па);
– число к·молей диоксида углерода,
оксида углерода, паров воды, других
газообразных компонентов продуктов
взрыва, азота и исходного ВВ в уравнении
реакции взрывчатого разложения.
Примеры
(для ВВ рассмотренных в предыдущем
разделе)
-
Определить
объем продуктов взрыва 1 кг нитроглицерина
С3Н5(ONO2)3.
Уравнение реакции взрывчатого разложения:
C3H5(ОNO2)3
= 3CО2
+ 2,5Н2O
+ 0,25О2
+ 1,5N2.
Определяем
объем:
м3/кг.
-
Рассчитать
объем газообразных продуктов взрыва
для аммонала, состоящего из аммиачной
селитры, тротила и алюминия. Уравнение
реакции:

Объем
газообразных продуктов взрыва смесевых
ВВ определяется по формуле
м3/кг,
где
l1,
l2,
… ln
– число кмолей веществ и соединений,
входящих в состав смесевого ВВ; М1,
М2,
…Mn
– молекулярные массы соответствующих
компонентов ВВ.
Определяем
объем газообразных продуктов:
.
3.
Вычислить объем газообразных продуктов
взрыва 1 кг тротила С6H2
(NO2)3CH3.
Уравнение
его взрывчатого разложения:
С6H2
(NO2)3CH3
= 2,5Н2О
+ 3,5СО + 3,5С + 1,5N2.
Определяем
объем газообразных продуктов:
Примечание:
Твердые частицы углерода в объем
газообразных продуктов не включаются.
Последовательность
определения объема газообразных
продуктов взрыва:
-
пользуясь
формулами определить или проверить
величину кислородного баланса; -
написать
уравнение реакции взрывчатого разложения
ВВ; -
определить
число к/молей газообразных продуктов
реакции; -
при
необходимости определить молекулярную
массу ВВ (М); -
определить
объем газообразных продуктов взрыва.
Чем
меньше М газообразных продуктов взрыва,
тем больше величина V0.
4.6. Теплота и температура взрыва
Механическую
работу взрыва производят расширяющиеся
газообразные продукты взрывчатого
превращения, нагретые до высокой
температуры за счет теплоты, выделившейся
при этом превращении. Теплота взрыва,
а также объем образовавшихся газов
позволяют оценить возможную
работоспособность (фугасное действие)
ВВ. Знание теплоты взрыва с учетом
плотности ВВ и скорости детонации
позволяет судить о разрушающем действии
взрыва на среду в непосредственной
близости от заряда (бризантное действие).
Для
количественной характеристики
метательного, дробящего, теплового и
других видов действия необходимо знать
теплоту взрыва, температуру и давление
его продуктов.
4.6.1.
Теплота взрыва
Теплота
(количество тепла)
– внутренняя энергия системы, которая
самопроизвольно переходит от тел более
нагретых, к телам менее нагретым путем
теплопроводности или теплоизлучения.
Теплота
взрыва –
количество тепловой энергии, выделяющейся
при взрывном превращении (горении или
детонации) определенной массы ВВ. В
технике за единицу массы при расчетах
теплоты взрыва принимают 1 кг. Размерность
теплоты взрыва кДж/кг. Для определения
теплоты взрыва применяются два метода:
расчетный и экспериментальный.
Расчет
теплоты взрыва
Теплоту
взрыва рассчитывают на основе закона
Гесса, согласно которому «тепловой
эффект химического превращения системы
зависит только от начального и конечного
ее состояния и не зависит от промежуточных
состояний, т.е. от пути перехода». На
основании этого закона выделившаяся
при взрыве теплота равна разности теплот
образования исходного вещества и
конечных продуктов:
Qv
= Q1
– Q2,
где
Q1
– сумма
теплот образования продуктов взрыва;
Q2
– теплота
образования ВВ.
Значения
теплот Q1
и Q2
приведены
в [6]. При расчетах теплоты взрыва
применяют несколько методов.
1.
Основной метод
определения теплоты взрыва индивидуальных
ВВ.
При
вычислении теплоты взрыва по этому
методу используют следующие исходные
данные:
-
теплоты
образования ВВ; -
теплоты
образования продуктов взрыва; -
уравнение
реакции взрывчатого разложения.
Теплота
взрыва 1 кг ВВ определяется по формуле
,
где
nj
– число молей j-го
продукта взрывчатого разложения в
уравнении реакции; Qvj
– теплота образования j-го
продукта взрывчатого разложения при
постоянном объеме, кДж/моль; Qvвв
– теплота образования ВВ при постоянном
объеме, кг/моль; М – масса ВВ, численно
равная его молярной массе, кг/моль.
Последовательность
расчета теплоты взрыва:
-
написать
уравнение взрывчатого разложения; -
найти
значения Qvj
и
Qvвв
по
соответствующим таблицам; -
при
необходимости произвести пересчет
теплот образования веществ Qр
(при
постоянном давлении) в Qv
(при
постоянном объеме); -
рассчитать
теплоту взрыва данного ВВ.
Пересчет
Qр
в Qv
осуществляется по формуле
Qv
= Qр
+ q = Qр
+ 0,58 · n,
ккал/моль,
где
0,58 – множитель, представляющий собой
выраженную в ккал работу расширения 1
моль газов при их нагревании от 00
до 180С,
связанного с изменением объема при
постоянном давлении равном 101325 Па; n –
число молей ВВ и газообразных продуктов
соответственно.
Пример:
Определить теплоту взрыва 1 кг тэна
С5Н8N4O12.
М = 316, теплота образования Qр
= 129,37
ккал/моль.
Пишем
уравнение реакции взрывчатого разложения:
С5Н8N4O12
= 4Н2О
+ 2СО + 3СО2
+ 2N2.
Выбираем
из таблиц величины теплот образования
продуктов разложения:
-
вода
(газ) Н2О
– 57,78ккал/моль; -
оксид
углерода СО – 26,88 ккал/моль; -
диоксид
углерода СО2
– 94,51 ккал/моль; -
азот
(газ) N2
– 0,00 ккал/моль.
Вычисляем суммарную
теплоту образования продуктов взрыва
при постоянном давлении:
Qр
= 4 · 57,78
+ 2 · 26,88 + 3 · 94,51 = 568,72 ккал/моль.
Произведем пересчет
Qр
в Qv
ВВ (тэна):
Qvвв
= Qр
+ 0,58n
= 129,37 +0,58·1 = 129,95 ккал/моль,
4,19 · 129,95 = 544,5 кДж/моль;
Qvnв
= Qр
+ 0,58n
= 568,72 + 0,58(4 + 2 + 3) = 573,94 ккал/моль,
4,19 · 573,94 = 2404,81
кДж/моль.
Примечание:
1 кал = 4,19 Дж; 1 Дж = 0,239 кал.
Рассчитываем
теплоту взрыва 1 кг тэна:
.
2.
Метод Г.А. Авакяна [11]
Данный
метод позволяет рассчитать теплоту
взрыва индивидуальных веществ, не
прибегая к написанию уравнения реакции
взрывчатого разложения. В основе метода
лежит гипотеза о том, что суммарная
теплота образования продуктов взрыва
есть однозначная функция кислородного
коэффициента ВВ:
,
где
а, b
и d
– число атомов соответственно углерода,
водорода и кислорода, входящих в ВВ
(условная формула СаНbNcOd).
Теплота
взрыва по этому методу определяется по
формулам
Qv
= К(94а +
28,7b)
– Qвв,
ккал/моль
при αк
≥ 100%;
Qv
= К(47d
+ 5,25b)
– Qвв,
ккал/моль
при αк
< 100%.
где
К = 0,32
– «коэффициент реализации», согласующий
результаты расчета с экспериментальными
данными.
Пример:
Определить теплоту взрыва 1 кг тэна
С5Н8N4O12;
М = 316;
Qр
= 129,37
ккал/моль.
Решение:
Определяем
αк
(кислородный
коэффициент):
.
Производим
пересчет QP
в QV:
QVBB
= QP
+ 0,58n
= 129,37 + 0,58 ∙ 1 = 129,95 ккал/моль.
Вычисляем
теплоту взрыва 1 моля ТЭНа:
= 0,32 ∙ 85,70,24
(47 ∙ 12 + 5,25 ∙ 8) – 129,95 =
=
0,32 ∙ 2,91 ∙ 606 – 129,95 = 564,31 – 129,95 = 434,36
ккал/моль.
Рассчитываем
теплоту взрыва 1 кг ТЭНа в размерности
СИ:
QV
= 4,19
∙
1000 = 4,19
∙
1000 = 5759,4 кДж/кг.
3.
Метод ориентировочного определения
теплоты взрыва смесевых ВВ [11].
Для
грубой оценки теплоты взрыва QV
cмесевых веществ можно воспользоваться
правилом аддитивности (значение величины
целого равно сумме величин частей),
полагая, что каждый компонент вносит
вклад в теплоту взрыва пропорционально
своему содержанию в смеси:
,
кДж/кг,
где
Vi
и QVi
– массовая доля и теплота взрыва i-го
компонента в смеси.
Пример:
Определить теплоту взрыва 1 кг смеси
тротила с гексогеном ТГ 50/50 (тротила и
гексогена по 50% по массе).
Решение.
-
Из
таблицы находим Qккал/кг
тротила 1010, гексогена 1320. -
Определяем
теплоту взрыва смеси ТГ 50/50:

-
Уточненный
метод расчета теплоты взрыва смесевых
ВВ.
Последовательность
определения:
-
составляется
условная формула 1 кг смесевого ВВ,
СаНbNсOd
с использованием соотношений:
,
где
nj
– мольная доля j-го компонента смеси;
-
составляется
уравнение реакции; -
вычисляется
молекулярная масса смеси; -
рассчитывается
кислородный коэффициент αк
(как по
методу Авакяна); -
определяется
теплота образования 1 моля смеси по
формуле
-
определяется
теплота взрыва 1 кг смесевого ВВ (по
формуле основного метода определения
теплоты взрыва индивидуальных ВВ) или
(по формуле метода Авакяна).
Как
уже было сказано, теплота взрыва тех
или иных ВВ может быть определена
экспериментально (по аналогии с
определением теплотворной способности
горючих в калориметрической бомбе
Бертло-Малера).
Сущность
метода
заключается в следующем. Бомбу наполняют
не кислородом (как обычно), а азотом или
же откачивают воздух и производят взрыв
в вакууме. Повышение температуры воды
в калориметре умноженное на теплоемкость
системы – бомба + вода + калориметрический
сосуд, дает количество тепла, выделившееся
при взрыве.
В
бомбе Бертло-Малера для вторичных и
метательных ВВ можно определить только
теплоту горения или теплоту взрыва
только инициирующих ВВ и черного пороха
(взрываются от накаленной проволочки).
Для ВВ, которые взрываются только от
капсюля-детонатора используется бомба
больших размеров (бомбы применяемые в
английских лабораториях или бомбы Апина
и Беляева).
При
оценке теплот взрыва, получаемых в
калориметрических бомбах, тепловой
эффект сильно зависит от условий, в
которых происходит взрыв. Поэтому,
полученные данные имеют лишь условное
значение.
4.6.2. Температура
продуктов взрыва
Основными
термодинамическими характеристиками
продуктов взрыва являются удельный
объем V,
температура Т и давление Р. Они связаны
общим уравнением состояния (уравнение
Менделеева-Клайперона для идеальных
газов):
ρV
= nR·T,
где
n
– количество молей газообразных
продуктов взрыва; R
– универсальная газовая постоянная, R
= 8,314 Дж/моль·К.
Температура
– один из основных термодинамических
параметров, определяющих тепловое
состояние вещества, тела, системы тел.
Согласно молекулярно-кинетической
теории, температура системы прямо
пропорциональна средней кинетической
энергии теплового движения частиц.
Передача
тепла от одного тела к другому может
происходить только при наличии разности
температур (от более нагретого к менее
нагретому).
Для
измерения температуры применяют
следующие температурные шкалы:
-
абсолютную
термодинамическую; -
международную
практическую.
Единицей
измерения по абсолютной термодинамической
шкале является кельвин (К), а по
международной практической – градус
Цельсия (0С).
Соотношение
в градусах: T
= t
+ 273, К; t
= Т – 273,0С.
Под
температурой
взрыва понимают
наибольшее значение температуры, до
которого нагреваются продукты взрывчатого
разложения. В основе вычисления этой
температуры заложено предположение,
что взрывчатое превращение – адиабатический
процесс (система не обменивается
теплотой с окружающей средой), протекающий
при постоянном объеме и, таким образом,
выделяющееся в процессе взрыва тепло
расходуется только на нагрев продуктов
взрыва. На основании изложенного теплота
взрыва при постоянном объеме определяется
по формуле
,
где
СV
– суммарная молярная теплоемкость всех
продуктов взрыва в интервале температур
от нуля до температуры взрыва,
кал/моль·град.; tnв
– температура продуктов взрыва, 0С.
Теплоемкость
СV
является функцией температуры, ее можно
определить по формуле Малляра и Ле
Шателье (для температур более 10000С):
СV
= a
+ btпв,
кал/моль·град.
Тогда
теплота взрыва определится выражением:
,
кал/моль.
Отсюда:
,
0С.
Значения
теплоемкостей 1 моля продуктов взрыва
можно определить, используя следующие
выражения, кал/моль·град:
-
для
двухатомных газов (СО, N2)
СV
= 4,8 + 4,5 ·
10–4tпв; -
для
воды СV
= 4,0 + 21,5 ·
10–4tпв; -
для
диоксида углерода СV
= 9,0 + 5,8 ·
10–4tпв; -
для
четырехатомных газов СV
= 10 + 4,5 ·
10–4tпв; -
для
пятиатомных газов СV
= 12 + 4,5 ·
10–4tпв; -
для
твердых продуктов взрыва СV
= 6,4.
Порядок определения
температуры продуктов взрыва:
-
составить
уравнение реакции взрывчатого разложения; -
определить
теплоту взрыва; -
вычислить
теплоемкость продуктов взрыва; -
подсчитать
суммарную молярную теплоемкость; -
определить
температуру продуктов взрыва.
Пример:
Определить температуру продуктов взрыва
тэна. Уравнение реакции взрыва тэна:
C5H8N4O12
= 4H2O
+ 3CO2
+ 2CO + 2N2.
Теплота
взрыва 1 моля тэна:
(см.
пример 1).
Решение.
1.
Записываем уравнения для расчета
молярных теплоемкостей продуктов
взрыва и вычисляем их суммарную
теплоемкость:
СV
= m(a
+ вtпв),
кал/моль·град;
для
Н2О:
4(4,0 + 0,00215tпв)
= 16,0 + 0,00880tпв;
для
СО2:
3(9,0 + 0,0058tпв)
= 27,0 + 0,00174tпв;
для
СО: 2(4,8 + 0,0045tпв)
= 9,6 + 0,00090tпв;
для
N2:
2(4,8 + 0,0045tпв)
= 9,6 + 0,00090tпв.
Суммарная
теплоемкость СV
= a
+ вtпв=
62,2 + 0,01234 tпв.
2.
Определить температуру продуктов взрыва
тэна:
.
Абсолютная
температура продуктов взрыва тэна:
tпв
= 4006 + 273
= 4279 К.
Расчеты
температуры взрыва, как уже говорилось,
основаны на предположении, что теплоемкость
продуктов взрыва не зависит от давления.
Это предположение можно считать
справедливым для умеренных давлений.
Однако при чрезвычайно высоких давлениях,
которые достигаются при детонации
конденсированных ВВ большой плотности
значительная доля энергии взрыва
представляет упругую часть энергии
молекул высокоплотных продуктов взрыва.
Тепловая часть существенно меньше, чем
для газов при умеренных давлениях, и
температура соответственно ниже, чем
ее значение, получаемое обычным расчетом.
А.Я.
Апин и И.М. Воскобойников экспериментально
определили температуру взрыва ряда ВВ,
используя цветовой оптический метод.
Этот метод измерения температуры основан
на том, что определяется распределение
энергии по сплошному непрерывному
спектру, характерному для детонации,
или по отношению яркостей при двух
длинах волны (метод «красно-синего»
сравнения). Краткая сущность метода
изложена в [6].

ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Указатели
Указателей нет.
Закладки
Закладок нет.
Закладки
0
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Описание документа
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульные листы
Апин А. Я., Беляев А. Ф., Соснова Г. С.
Экспериментальное определение теплоты взрыва
Беляев А. Ф.
О полной работе взрыва
Симонов Н. Н., Шляпинтох И. Я.
О законе подобия при «электрическом взрыве»
Садовский М. А., Рябинин Ю. Н., Родионов В. Н.
Исследование распространения ударных волн в каналах постоянного сечения
Коротков А. И.
Некоторые результаты измерения давления взрыва вблизи от заряда ВВ
Завриев А. С.
Методика определения максимального избыточного давления ударной волны по измеренным величинам скорости ее фронта
Курбангалина Р. Х.
Исследование влияния плотности заряда взрывчатых веществ на свойства воздушных ударных волн взрыва с помощью простых механических измерительных приборов
Тамм И. И., Рябинин Ю. Н.
О разлете продуктов взрыва цилиндрического заряда
Апин А. Я.
Роль наполнителей при детонации взрывчатых веществ и порохов
Боболев В. К.
Зависимость скорости детонации от диаметра заряда и скорость детонации вблизи предела
Беляев А. Ф., Комкова Л. Д.
О горении нитроглицерина, нитрогликоля и метилнитрата при высоких давлениях
Похил П. Ф.
О механизме горения бездымных порохов
Коротков А. И., Лейпунский О. И.
Зависимость температурного коэффициента скорости горения пороха при атмосферном давлении от температуры пороха
Аристова З. И., Лейпунский О. И.
О прогреве пороха перед воспламенением
230Содержание
231Концевая страница
231Исправления и опечатки
Теплота взрыва
-
Теплота взрыва (удельная энергия) или теплота взрывчатого превращения — количество тепла, выделяемое при взрывчатом превращении 1 моля или 1 кг взрывчатого вещества, является одной из существенных характеристик взрывчатого вещества; это один из тепловых эффектов в теории взрывчатых веществ наряду с теплотой образования и теплотой сгорания взрывчатых веществ.
Также теплотой взрыва называют общий тепловой эффект химических реакций во фронте детонационной волны и реакций, длящихся при адиабатическом расширении продуктов взрыва по завершению реакций.
Единицы измерения: ккал/кг, кДж/кг, ккал/моль, Дж/моль, Дж/кг.
В формулах, как правило, обозначается Qв, Qвзр.
Теплота взрыва используется для определения способностей того или иного взрывчатого вещества.
Источник: Википедия
Связанные понятия
Ско́рость детона́ции — скорость распространения детонационной волны по заряду взрывчатого вещества (ВВ). Скорость детонации определяется составом и состоянием заряда, условиями взрывания. При одинаковых условиях скорость детонации постоянна и её значение — максимально возможное при этих условиях. Такое свойство делает скорость детонации одной из важнейших характеристик взрывчатых веществ.
Состав продуктов взрыва — качественное и количественное содержание химических веществ, образующихся из взрывчатого вещества (ВВ) в результате взрыва.
Стаби́льность — характеристика взрывчатых веществ (ВВ), являющаяся мерой способности к сохранению физических, химических и взрывчатых свойств с течением времени.
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около…
Подробнее: Горение водорода
Компоненты (в термодинамике и химии) — независимые составляющие вещества системы, то есть индивидуальные химические вещества, которые необходимы и достаточны для составления данной термодинамической системы, допускают выделение из системы и независимое существование вне её. Изменения масс компонентов выражают все возможные изменения в химическом составе системы, а масса (количество вещества, число частиц) каждого вещества, выбранного в качестве компонента, не зависит от масс (количеств вещества…
Нитромочевина (нитрокарбамид) — белый порошок, образующийся при нитровании мочевины, взрывчатое вещество.
Моля́рный объём Vm — объём одного моля вещества (простого вещества, химического соединения или смеси) при данной температуре и давлении; величина, получающаяся от деления молярной массы M вещества на его плотность ρ: таким образом, Vm = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём.
Рефрижератор растворения — криогенное устройство, впервые предложенное Хайнцем Лондоном. В процессе охлаждения используется смесь двух изотопов гелия: 3He и 4He. При охлаждении ниже 700 мК смесь испытывает самопроизвольное разделение фаз, образуя фазы: богатую 3He и богатую 4He.
Фа́зовая диагра́мма воды — графическое отображение равновесного состояния фаз воды (жидкости, водяного пара и различных модификаций льда). Строится в системе координат температура—давление.
Теплота́ сгора́ния — количество выделившейся теплоты при полном сгорании массовой (для твердых и жидких веществ) или объёмной (для газообразных) единицы вещества. Измеряется в джоулях или калориях. Теплота сгорания, отнесённая к единице массы или объёма топлива, называется удельной теплотой сгорания. В системе СИ: Дж/кг. Также довольно часто используются внесистемные единицы измерения: кДж/кг, МДж/кг и ккал/кг.
Криохимия — раздел химии, который изучает превращения в жидкой и твёрдой фазах при низких (вплоть до 70 К) и сверхнизких (ниже 70 К) температурах. По изучаемым явлениям имеет пересечения с физикой конденсированных сред и астрохимией.
Адсорбционные свойства грунтов (от лат. ad — на, при и sorbeo — поглощаю) в инженерной геологии — особенности грунтов, характеризующие их способность поглощать (сорбировать) какие-либо вещества. В их основе лежит физико-химическое явление адсорбции — концентрирование вещества (адсорбата) из объёма фаз на поверхности раздела между ними.
Удельная поверхность — усреднённая характеристика размеров внутренних полостей (каналов, пор) пористого тела или частиц раздробленной фазы дисперсной системы.
Термогравиметрия или термогравиметрический анализ (ТГ) — метод термического анализа, при котором регистрируется изменение массы образца в зависимости от температуры.
Ио́нное распыле́ние — эмиссия атомов с поверхности твёрдого тела при его бомбардировке тяжёлыми заряженными или нейтральными частицами. В случае, когда речь идёт о бомбардировке отрицательно заряженного электрода (катода) положительными ионами, используется также термин «катодное распыление».
Анодный электролитный нагрев (электролитно-плазменная обработка) – совокупность теплофизических и электрохимических процессов на поверхности анода, связанные с локальным вскипанием жидкости за счет выделения джоулева тепла.
Ударно-волновой синтез или детонационный синтез (англ. shock wave synthesis) — метод механического ударно-волнового воздействия, представляющий собой быстро протекающий процесс, который создает динамические условия для синтеза конечного продукта и его диспергирования до порошка с нанометровым размером частиц.
Эффе́ктом Джо́уля — То́мсона называют изменение температуры газа или жидкости при стационарном адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Назван в честь открывших его Джеймса Джоуля и Уильяма Томсона. Данный эффект является одним из методов получения низких температур.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
Пло́тность во́здуха — масса газа атмосферы Земли на единицу объема или удельная масса воздуха при естественных условиях. Плотность воздуха является функцией от давления, температуры и влажности. Обычно, стандартной величиной плотности воздуха на уровне моря в соответствии с Международной стандартной атмосферой принимается значение 1,2250 кг/м³, которая соответствует плотности сухого воздуха при 15 °С и давлении 101330 Па.
Газофазный ядерный реактивный двигатель (ГЯРД) — концептуальный тип реактивного двигателя, в котором реактивная сила создаётся за счёт выброса теплоносителя (рабочего тела) из ядерного реактора, топливо в котором находится в газообразной форме или в виде плазмы. Считается, что подобные двигатели смогут достичь удельной тяги порядка 3000-5000 секунд (до 30-50 кН·с/кг, эффективные скорости истечения реактивной струи – до 30-50 км/с) и тяги, достаточной для относительно быстрых межпланетных полётов…
Экспозиционная доза — устаревшая характеристика фотонного излучения, основанная на его способности ионизировать сухой атмосферный воздух.
Фотометрическое титрование — группа методов объёмного (титриметрического) анализа, в которых конечная точка титрования определяется по изменению оптической плотности раствора в ходе химической реакции между титрантом и титруемым веществом.
Запаздывающие нейтроны — это нейтроны, испускаемые продуктами деления через некоторое время (от нескольких миллисекунд до нескольких минут) после реакции деления тяжёлых ядер, в отличие от мгновенных нейтронов, испускаемых практически мгновенно после деления составного ядра. Запаздывающие нейтроны составляют менее 1% испускаемых нейтронов деления, однако, несмотря на столь малый выход, играют огромную роль в ядерных реакторах. Благодаря большому запаздыванию такие нейтроны существенно (на 2 порядка…
«Пентабора́н» — также называемый «нонагидри́д пентабо́ра», «стабильный пентабора́н» и «Пентабора́н(9)» для того, чтобы отличать его от соединения бора B5H11 — химическое соединение, которое рассматривалось военными 1950-х годов в США и СССР, в качестве перспективного ракетного/самолетного топлива, называемого также «экзотическим горючим». Молекула состоит из пяти атомов бора и девяти атомов водорода (B5H9) и является одним из бороводородов. В обычных условиях имеет вид бесцветной жидкости с едким…
Гомоге́нная систе́ма (от др.-греч. ὁμός «равный, одинаковый» + γένω «рождать») — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путём.
Температура самовоспламене́ния — наименьшая температура горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермических объёмных реакций, приводящее к возникновению пламенного горения или взрыва.
Тиксотропия (тиксотропность) (от греч. θίξις — прикосновение и τροπή — изменение) — способность субстанции уменьшать вязкость (разжижаться) от механического воздействия и увеличивать вязкость (сгущаться) в состоянии покоя.
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Фуллери́т (англ. fullerite) — молекулярные кристаллы, продукты объемной полимеризации сферических углеродных молекул фуллеренов C60 и C70 при давлении более 90 000 атмосфер и температуре более 300 ° C. Полученный материал полностью сохраняет жесткую структуру фуллеренов, которые при полимеризации соединяются между собой прочными алмазоподобными связями. Это приводит к появлению пространственных каркасов, имеющих аномально высокую жесткость и твердость.
Фуга́сность (фр. fougasse от лат. focus «очаг, огонь») — характеристика взрывчатого вещества. Служит мерой его общей работоспособности, разрушительного, метательного и иного действия взрыва. Основное влияние на фугасность оказывает объём газообразных продуктов взрыва…
Алюмото́л — гранулированное водоустойчивое промышленное взрывчатое вещество (ВВ), состоящее из смеси тринитротолуола с алюминиевым порошком.
Флуоресценция хлорофилла — явление свечения хлорофилла при поглощении им света, происходит в результате возвращения молекулы из возбужденного в основное состояние. Широко используется как показатель фотосинтетического преобразования энергии у высших растений, водорослей и бактерий. Возбужденный хлорофилл теряет поглощенную световую энергию, растрачивая её на фотосинтез (фотохимические преобразования энергии или фотохимическое тушение), переводя её в тепло в результате нефотохимического тушения или…
Пересы́щенный пар — пар, давление которого превышает давление насыщенного пара при данной температуре. Может быть получен путём увеличения давления пара в объёме, свободном от центров конденсации (пылинок, ионов, капелек жидкости малых размеров и т. д.). Другой способ получения — охлаждение насыщенного пара при тех же условиях. В связи с последним способом получения насыщенного пара применительно к нему используется также наименование переохлаждённый пар. Кроме того, иногда в литературе встречается…
Радиус атома — расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома.
Караме́льное то́пливо — твёрдое ракетное топливо, относящееся к смесевым топливам с органической связкой. Названо так из-за внешнего вида и использования в его составе сахара или сорбита. Англоязычный термин «rocket candy» точно так же характеризует отношение к нему. Пионером использования карамельного топлива считается Билл Колбёрн, использовавший его впервые в 1948, а широкую известность в США это топливо приобрело с выходом книги Бертрана Бринли в 1960 году. Широко применяется в импровизированных…
Температура вспышки — наименьшая температура летучего конденсированного вещества, при которой пары над поверхностью вещества способны вспыхивать в воздухе под воздействием источника зажигания, однако устойчивое горение после удаления источника зажигания не возникает. Вспышка — быстрое сгорание смеси паров летучего вещества с воздухом, сопровождающееся кратковременным видимым свечением. Температуру вспышки следует отличать как от температуры воспламенения, при которой горючее вещество способно самостоятельно…
Подвижность носителей заряда — коэффициент пропорциональности между дрейфовой скоростью носителей и приложенным внешним электрическим полем. Определяет способность электронов и дырок в металлах и полупроводниках реагировать на внешнее воздействие. Размерность подвижности м2/(В·с) или см2/(В·с). Фактически подвижность численно равна средней скорости носителей заряда при напряженности электрического поля в 1 В/м. Стоит заметить, что мгновенная скорость может быть много больше дрейфовой. Понятие подвижности…
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в Международной системе единиц (СИ) и в системе СГС — моль. Без конкретизации объекта рассмотрения термин «количество вещества» не используют.
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть…
Акти́вность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Дилато́метр (от лат. dilato — расширяю и греч. μετρέω — измеряю) — измерительный прибор, предназначенный для измерения изменения размеров тела, вызванных внешним воздействием температуры, давления, электрического и магнитного полей, ионизирующих излучений или каких-либо других факторов. Наиболее важная характеристика дилатометра — его чувствительность к абсолютному изменению размеров тела.
Сверхкритическая флюидная экстракция — процесс экстракции с использованием сверхкритического флюида в качестве растворителя. Производится контактированием смеси разделяемых компонентов с газообразным экстрагентом при температуре и давлении выше критической точки. Наибольшее распространение в качестве экстрагентов (растворителей) получили СО2, этан, этилен, пропан, SF6 и др.
Химические лазеры — разновидность газовых лазеров, в которых источником энергии служат химические реакции между компонентами рабочей среды. Химические лазеры непрерывного действия могут достигать высокого уровня мощности и используются в промышленности для резки и создания отверстий.
Подробнее: Химический лазер
Аэрографит представляет собой синтетическую пену, состоящую из трубчатых волокон углерода. Плотность материала составляет 0,18 мг/см3 (0,18 кг/м3), что позволяет назвать данный материал самым легким на сегодняшний день. Аэрографит был разработан объединенной командой университета имени Христиана Альбрехта и Гамбургского технологического университета. Первое сообщение о новом материале было опубликовано в июне 2012 г.
Активность катализатора, или каталитическая активность, — характеристика катализатора, выражающая его свойство ускорять химическую реакцию. Чем выше активность катализатора, тем большей скорости химической реакции можно с помощью данного катализатора добиться.
Энергия активации в химии — эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры. Выражается в джоулях на моль. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии активации: Ea.
Диффузио́нный слой – приповерхностные объемы материала, химический состав которых изменился в результате диффузии при химико-термической обработке (ХТО). Изменение химического состава этих объемов приводит к изменению фазового состава, структуры и свойств материала диффузионного слоя.