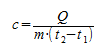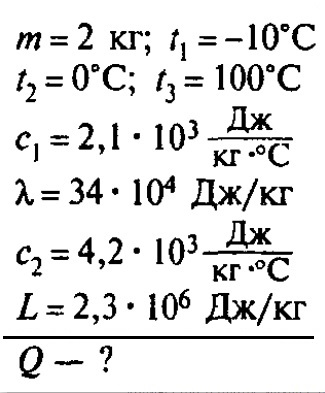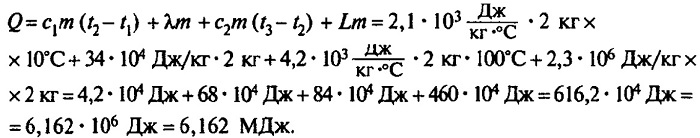На практике часто приходится проводить различные тепловые расчёты. Для увеличения эргономичности тепловой системы жилых домов измеряют количество тепловой энергии, рассеиваемой через вентиляцию, окна, расщелины.
Для расчёта количества тепловой энергии нужно измерить массу (m), разность температуры в начале и в конце процесса
Δt=tкон−tнач
, а также знать теплоёмкость (c) данного вещества.
Чтобы нагреть некоторое вещество массой (1) кг на (1°C), необходимо затратить количество теплоты, равное удельной теплоёмкости (c) данного вещества.
Количество теплоты, получаемое веществом при нагревании, прямо пропорционально удельной теплоёмкости вещества, его массе и разности температур, то есть:
Q=cmΔt
или
Данная формула даёт возможность найти и выделяемую при охлаждении вещества теплоту.
Чтобы рассчитать количество теплоты, необходимое для нагревания вещества (или выделяемое им при охлаждении), следует удельную теплоёмкость вещества умножить на его массу и на разность между конечной и начальной температурой вещества.
Так как конечная температура остывающего вещества меньше его начальной температуры:
то изменение температуры оказывается отрицательным числом:
Значит, и выделяемое веществом количество теплоты выражается отрицательным числом:
Последний факт обозначает не рост, а убыль внутренней энергии вещества.
О тепловой энергии простым языком!
Опубликовано 13 Окт 2013
Рубрика: Теплотехника | 117 комментариев

…энергию вакуума и еще существующую только в теории – темную энергию. В этой статье, первой в рубрике «Теплотехника», я попытаюсь на простом и доступном языке, используя практический пример, рассказать о важнейшем виде энергии в жизни людей — о тепловой энергии и о рождающей ее во времени тепловой мощности.
Несколько слов для понимания места теплотехники, как раздела науки о получении, передаче и применении тепловой энергии. Современная теплотехника выделилась из общей термодинамики, которая в свою очередь является одним из разделов физики. Термодинамика – это дословно «теплый» плюс «силовой». Таким образом, термодинамика – это наука об «изменении температуры» системы.
Воздействие на систему извне, при котором изменяется ее внутренняя энергия, может являться результатом теплообмена. Тепловая энергия, которая приобретается или теряется системой в результате такого взаимодействия с окружающей средой, называется количеством теплоты и измеряется в системе СИ в Джоулях.
Если вы не инженер-теплотехник, и ежедневно не занимаетесь теплотехническими вопросами, то вам, столкнувшись с ними, иногда без опыта бывает очень трудно быстро в них разобраться. Трудно без наличия опыта представить даже размерность искомых значений количества теплоты и тепловой мощности. Сколько Джоулей энергии необходимо чтобы нагреть 1000 метров кубических воздуха от температуры -37˚С до +18˚С?.. Какая нужна мощность источника тепла, чтобы сделать это за 1 час?.. На эти не самые сложные вопросы способны сегодня ответить «сходу» далеко не все инженеры. Иногда специалисты даже помнят формулы, но применить их на практике могут лишь единицы!
Прочитав до конца эту статью, вы сможете легко решать реальные производственные и бытовые задачи, связанные с нагревом и охлаждением различных материалов. Понимание физической сути процессов теплопередачи и знание простых основных формул – это главные блоки в фундаменте знаний по теплотехнике!
Количество теплоты при различных физических процессах.
Большинство известных веществ могут при разных температуре и давлении находиться в твердом, жидком, газообразном или плазменном состояниях. Переход из одного агрегатного состояния в другое происходит при постоянной температуре (при условии, что не меняются давление и другие параметры окружающей среды) и сопровождается поглощением или выделением тепловой энергии. Не смотря на то, что во Вселенной 99% вещества находится в состоянии плазмы, мы в этой статье не будем рассматривать это агрегатное состояние.
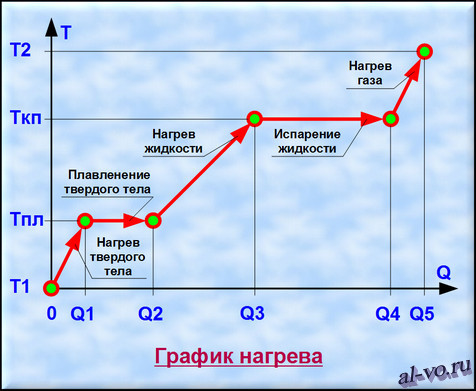
Рассмотрим график, представленный на рисунке. На нем изображена зависимость температуры вещества Т от количества теплоты Q, подведенного к некой закрытой системе, содержащей определенную массу какого-то конкретного вещества.
1. Твердое тело, имеющее температуру T1, нагреваем до температуры Tпл, затрачивая на этот процесс количество теплоты равное Q1.
2. Далее начинается процесс плавления, который происходит при постоянной температуре Тпл (температуре плавления). Для расплавления всей массы твердого тела необходимо затратить тепловой энергии в количестве Q2— Q1.
3. Далее жидкость, получившаяся в результате плавления твердого тела, нагреваем до температуры кипения (газообразования) Ткп, затрачивая на это количество теплоты равное Q3–Q2.
4. Теперь при неизменной температуре кипения Ткп жидкость кипит и испаряется, превращаясь в газ. Для перехода всей массы жидкости в газ необходимо затратить тепловую энергию в количестве Q4–Q3.
5. На последнем этапе происходит нагрев газа от температуры Ткп до некоторой температуры Т2. При этом затраты количества теплоты составят Q5–Q4. (Если нагреем газ до температуры ионизации, то газ превратится в плазму.)
Таким образом, нагревая исходное твердое тело от температуры Т1 до температуры Т2 мы затратили тепловую энергию в количестве Q5, переводя вещество через три агрегатных состояния.
Двигаясь в обратном направлении, мы отведем от вещества то же количество тепла Q5, пройдя этапы конденсации, кристаллизации и остывания от температуры Т2 до температуры Т1. Разумеется, мы рассматриваем замкнутую систему без потерь энергии во внешнюю среду.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой, а обратный ему процесс – десублимацией.
Итак, уяснили, что процессы переходов между агрегатными состояниями вещества характеризуются потреблением энергии при неизменной температуре. При нагреве вещества, находящегося в одном неизменном агрегатном состоянии, повышается температура и также расходуется тепловая энергия.
Главные формулы теплопередачи.
Формулы очень просты.
Количество теплоты Q в Дж рассчитывается по формулам:
1. Со стороны потребления тепла, то есть со стороны нагрузки:
1.1. При нагревании (охлаждении):
Q=m*c*(Т2–Т1)
Здесь и далее:
m – масса вещества в кг
с – удельная теплоемкость вещества в Дж/(кг*К)
1.2. При плавлении (замерзании):
Q=m*λ
λ – удельная теплота плавления и кристаллизации вещества в Дж/кг
1.3. При кипении, испарении (конденсации):
Q=m*r
r – удельная теплота газообразования и конденсации вещества в Дж/кг
2. Со стороны производства тепла, то есть со стороны источника:
2.1. При сгорании топлива:
Q=m*q
q – удельная теплота сгорания топлива в Дж/кг
2.2. При превращении электроэнергии в тепловую энергию (закон Джоуля — Ленца):
Q=t*I*U=t*R*I^2=(t/R)*U^2
t – время в с
I – действующее значение тока в А
U – действующее значение напряжения в В
R – сопротивление нагрузки в Ом
Делаем вывод – количество теплоты прямо пропорционально массе вещества при всех фазовых превращениях и при нагреве дополнительно прямо пропорционально разности температур. Коэффициенты пропорциональности (c, λ, r, q) для каждого вещества имеют свои значения и определены опытным путем (берутся из справочников).
Тепловая мощность N в Вт – это количество теплоты переданное системе за определенное время:
N=Q/t
Чем быстрее мы хотим нагреть тело до определенной температуры, тем большей мощности должен быть источник тепловой энергии – все логично.
В жизни бывает часто необходимо сделать быстрый оценочный расчет, чтобы понять – имеет ли смысл продолжать изучение темы, делая проект и развернутые точные трудоемкие расчеты. Сделав за несколько минут расчет даже с точностью ±30%, можно принять важное управленческое решение, которое будет в 100 раз более дешевым и в 1000 раз более оперативным и в итоге в 100000 раз более эффективным, чем выполнение точного расчета в течение недели, а то и месяца, группой дорогостоящих специалистов…
Условия задачи:
В помещение цеха подготовки металлопроката размерами 24м х 15м х 7м завозим со склада на улице металлопрокат в количестве 3т. На металлопрокате есть лед общей массой 20кг. На улице -37˚С. Какое количество теплоты необходимо, чтобы нагреть металл до +18˚С; нагреть лед, растопить его и нагреть воду до +18˚С; нагреть весь объем воздуха в помещении, если предположить, что до этого отопление было полностью отключено? Какую мощность должна иметь система отопления, если все вышесказанное необходимо выполнить за 1час? (Очень жесткие и почти не реальные условия – особенно касающиеся воздуха!)
Расчет выполним в программе MS Excel или в программе OOo Calc.
С цветовым форматированием ячеек и шрифтов ознакомьтесь на странице «О блоге».
Исходные данные:
1. Названия веществ пишем:
в ячейку D3: Сталь
в ячейку E3: Лед
в ячейку F3: Лед/вода
в ячейку G3: Вода
в ячейку G3: Воздух
2. Названия процессов заносим:
в ячейки D4, E4, G4, G4: нагрев
в ячейку F4: таяние
3. Удельную теплоемкость веществ c в Дж/(кг*К) пишем для стали, льда, воды и воздуха соответственно
в ячейку D5: 460
в ячейку E5: 2110
в ячейку G5: 4190
в ячейку H5: 1005
4. Удельную теплоту плавления льда λ в Дж/кг вписываем
в ячейку F6: 330000
5. Массу веществ m в кг вписываем соответственно для стали и льда
в ячейку D7: 3000
в ячейку E7: 20
Так как при превращении льда в воду масса не изменяется, то
в ячейках F7 и G7: =E7=20
Массу воздуха находим произведением объема помещения на удельный вес
в ячейке H7: =24*15*7*1,23=3100
6. Время процессов t в мин пишем только один раз для стали
в ячейку D8: 60
Значения времени для нагрева льда, его плавления и нагрева получившейся воды рассчитываются из условия, что все эти три процесса должны уложиться в сумме за такое же время, какое отведено на нагрев металла. Считываем соответственно
в ячейке E8: =E12/(($E$12+$F$12+$G$12)/D8)=9,7
в ячейке F8: =F12/(($E$12+$F$12+$G$12)/D8)=41,0
в ячейке G8: =G12/(($E$12+$F$12+$G$12)/D8)=9,4
Воздух также должен прогреться за это же самое отведенное время, читаем
в ячейке H8: =D8=60,0
7. Начальную температуру всех веществ T1 в ˚C заносим
в ячейку D9: -37
в ячейку E9: -37
в ячейку F9: 0
в ячейку G9: 0
в ячейку H9: -37
8. Конечную температуру всех веществ T2 в ˚C заносим
в ячейку D10: 18
в ячейку E10: 0
в ячейку F10: 0
в ячейку G10: 18
в ячейку H10: 18
Думаю, вопросов по п.7 и п.8 быть недолжно.
Результаты расчетов:
9. Количество теплоты Q в КДж, необходимое для каждого из процессов рассчитываем
для нагрева стали в ячейке D12: =D7*D5*(D10-D9)/1000=75900
для нагрева льда в ячейке E12: =E7*E5*(E10-E9)/1000= 1561
для плавления льда в ячейке F12: =F7*F6/1000= 6600
для нагрева воды в ячейке G12: =G7*G5*(G10-G9)/1000= 1508
для нагрева воздуха в ячейке H12: =H7*H5*(H10-H9)/1000= 171330
Общее количество необходимой для всех процессов тепловой энергии считываем
в объединенной ячейке D13E13F13G13H13: =СУММ(D12:H12) = 256900
В ячейках D14, E14, F14, G14, H14, и объединенной ячейке D15E15F15G15H15 количество теплоты приведено в дугой единице измерения – в ГКал (в гигакалориях).
10. Тепловая мощность N в КВт, необходимая для каждого из процессов рассчитывается
для нагрева стали в ячейке D16: =D12/(D8*60)=21,083
для нагрева льда в ячейке E16: =E12/(E8*60)= 2,686
для плавления льда в ячейке F16: =F12/(F8*60)= 2,686
для нагрева воды в ячейке G16: =G12/(G8*60)= 2,686
для нагрева воздуха в ячейке H16: =H12/(H8*60)= 47,592
Суммарная тепловая мощность необходимая для выполнения всех процессов за время t рассчитывается
в объединенной ячейке D17E17F17G17H17: =D13/(D8*60) = 71,361
В ячейках D18, E18, F18, G18, H18, и объединенной ячейке D19E19F19G19H19 тепловая мощность приведена в дугой единице измерения – в Гкал/час.
На этом расчет в Excel завершен.
Выводы:
Обратите внимание, что для нагрева воздуха необходимо более чем в два раза больше затратить энергии, чем для нагрева такой же массы стали.
При нагреве воды затраты энергии в два раза больше, чем при нагреве льда. Процесс плавления многократно больше потребляет энергии, чем процесс нагрева (при небольшой разности температур).
Нагрев воды в десять раз затрачивает больше тепловой энергии, чем нагрев стали и в четыре раза больше, чем нагрев воздуха.
Мы вспомнили понятия «количество теплоты» и «тепловая мощность», рассмотрели фундаментальные формулы теплопередачи, разобрали практический пример. Надеюсь, что мой язык был прост и понятен.
Ссылка на скачивание файла: raschet-teplovoy-moshchnosti (xls 19,5KB).
Другие статьи автора блога
На главную
Статьи с близкой тематикой
Отзывы
Содержание:
- Определение и формула количества теплоты
- Формула расчета теплоты при изменении температуры
- Формула количества теплоты при фазовых переходах
- Единицы измерения количества теплоты
- Примеры решения задач
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$delta Q=c m d T=nu c_{mu} d T(2)$$
где $c=frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{mu}=c cdot mu$ – молярная теплоемкость,
$mu$ – молярная масса вещества,
$nu=frac{m}{mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($Delta Q$), которое получает тело при увеличении его температуры на величину
$Delta t = t_2 – t_1$ можно вычислить как:
$$Delta Q=c m Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($delta Q$) равное:
$$delta Q=lambda d m$$
где $lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 –
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2– количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
begin{array}{l}
mathrm{cmt}=mathrm{cm}_{1} t_{1}+mathrm{~cm}_{2} t_{2} rightarrow mathrm{mt}=mathrm{m}_{1} t_{1}+mathrm{~m}_{2} t_{2} rightarrow \
rightarrow rho mathrm{Vt}=rho V_{1} t_{1}+rho mathrm{V}_{2} t_{2} rightarrow mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
left{begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \
V=V_{1}+V_{2}
end{array}right.
$$
Решив ее получим:
$$
begin{array}{l}
V_{1}=frac{left(t_{2}-tright)}{t_{2}-t_{1}} V \
V_{2}=frac{left(t-t_{1}right)}{t_{2}-t_{1}} V
end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
begin{array}{l}
V_{1}=frac{(60-40)}{60-10} 200=80 text { (л) } \
V_{2}=frac{(40-10)}{60-10} 200=120 text { (л) }
end{array}
$$
Ответ. V1=80 л, V2=120 л.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 396 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
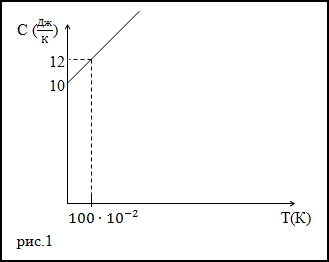
Пример
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} leq T leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К.
Решение. Исследуя график функции теплоемкости (C(T)) (рис.1) запишем его аналитическое выражение, оно получится:
$C(T)=10+2 cdot 10^{-2} T$ (Дж/К)
Основой для решения задачи послужит формула для количества теплоты в виде:
$$delta Q=C d T(2.2)$$
Подставим полученное выражение для теплоемкости (2.1) в формулу (2.2) поведем интегрирование в заданном интервале температур:
$$
begin{array}{c}
Delta Q=int_{300}^{400}left(10+2 cdot 10^{-2} Tright) d T=left.left(10 cdot T+10^{-2} T^{2}right)right|_{300} ^{400}= \
=left(10 cdot 400+10^{-2} cdot(400)^{2}right)-left(10 cdot 300+10^{-2} cdot(300)^{2}right)=1700left(mathrm{~A}^{*}right)
end{array}
$$
Ответ. $Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
Физика под удельной теплоемкостью понимает количество теплоты, которое термодинамическое вещество или система способно поглотить до повышения температуры.
Определение из учебника говорит, что это количество тепла, необходимое для создания температуры при нагревании.
Количество теплоты
Единица измерения – джоуль. Другой распространенной формой измерения является использование калорий.
Обозначается латинской буквой Q.
Удельная теплоемкость вещества
Это физическая величина, выражающая количество тепла, необходимое веществу на единицу массы для повышения температуры на одну единицу.
Таким образом, удельная теплоёмкость является свойством вещества, поскольку его значение является репрезентативным для каждого вещества, каждое из которых, в свою очередь, имеет различные значения в зависимости от того, в каком состоянии оно находится (жидкое, твердое или газообразное).
Удельная теплоёмкость обозначается маленькой буквой c и измеряется в Дж/кг∗°С, представляет собой коэффициент повышения температуры в одной единице всей системы или всей массы вещества.
Кроме того, удельная теплоёмкость меняется в зависимости от физического состояния вещества, особенно в случае твердых частиц и газов, поскольку его молекулярная структура влияет на теплопередачу в системе частиц. То же самое относится и к условиям атмосферного давления: чем выше давление, тем ниже удельное тепло.
Основной состав удельной теплоты вещества должен быть с = С/m, т. е. удельная теплота равна соотношению калорийности и массы. Однако когда это применяется к данному изменению температуры, говорят о средней удельной теплоемкости, которая рассчитывается на основе следующей формулы:
где:
Q – передача тепловой энергии между системой и средой (Дж);
m – масса системы (кг);
Δt или (t2 – t1) – повышение температуры, которой она подвергается (°C).
Формула для нахождения количества теплоты Q:
Q = c∗m(t2 – t1)
Чем выше удельная теплоёмкость вещества, тем больше тепловой энергии потребуется, чтобы его температура повысилась. Например, для нагрева воды (своды = 4200 Дж/кг∗°С) потребуется больше тепловой энергии, чем для нагрева свинца (ссвинца = 140 Дж/кг∗°С).
Уравнение теплового баланса:
Q отданное + Q полученное = 0.
Ниже представлена таблица значений удельной теплоёмкости некоторых веществ:
Примеры решения задач
Следующие задачи покажут примеры расчета необходимого количества теплоты.
Задача №1
Сколько теплоты нужно, чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С?
Решение:
Ответ: чтобы изо льда массой 2 кг, взятого при температуре -10°С, получить пар при 100°С, нужно взять 6,162 мегаджоулей теплоты.
Задача №2
В железный котёл массой 5 кг налита вода массой 10 кг. Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100°С?
Начнем решение и отметим, что нагреваться будет и котёл, и вода. Разница температур составит 1000С — 100С = 900С. Т. е. и температура котла изменится на 90 градусов, и температура воды также изменится на 90 градусов.
Количества теплоты, которые получили оба объекта (Q1
– для котла и Q2 — для воды), не будут одинаковыми. Мы найдем общее количество теплоты по формуле теплового баланса Q = Q1 + Q2.
На
прошлых уроках мы с вами познакомились с понятием «внутренняя энергия тела» и
узнали, что изменить её можно двумя способами: либо путём совершения
механической работы, либо теплопередачей.
Также
мы с вами выяснили, что мерой изменения внутренней энергии тела при
теплопередаче является количество теплоты. Давайте вспомним, что количество
теплоты — это скалярная физическая величина, равная изменению внутренней
энергии тела в процессе теплопередачи без совершения механической работы.
А
ещё мы получили уравнение, по которому можно рассчитать количество теплоты,
которое необходимо подвести к телу для его нагревания, или выделяемое телом,
при его охлаждении:
Q
= cm(t
– t0).
Из
формулы видно, что количество теплоты зависит от массы тела, разности
температур в конечном и начальном состояниях, а также от удельной теплоёмкости
вещества, из которого это тело изготовлено.
Чтобы
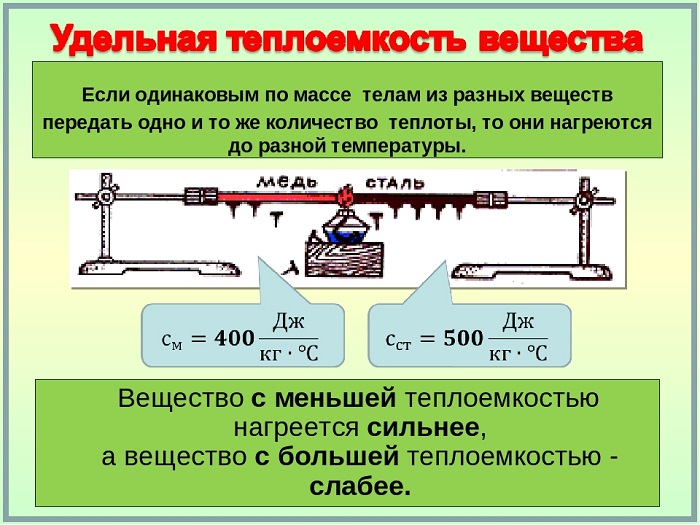
вспомнить, же что же такое теплоёмкость, рассмотрим решение следующей задачи.
Задача
1.
В сосуд с горячей водой опустили алюминиевую и латунную болванки одинаковой
массы и температуры. Одинаковым ли будет изменение их температур?
В
жизненных ситуациях довольно часто возникает необходимость в тепловых расчётах.
Например, при строительстве жилых домов необходимо знать, какое количество
теплоты должна отдавать зданию система отопления. Или нужно определить
температуру после смешивания горячей и холодной воды. И на этом уроке мы
разберёмся, как проводятся такие расчёты.
Последовательность
действий при решении задач на расчёт теплообменных процессов:
Задача
2.
Для купания ребёнка температура воды в ванночке не должна превышать 38 оС.
Для этого родители смешали 40 кг холодной воды при температуре 12 оС
и 20 кг горячей воды при температуре 90 оС. Если потерями тепла
можно пренебречь, то какое количество теплоты получили холодная вода при
нагревании и отдала горячая вода при охлаждении?
Мы
получили, что количество теплоты, отданное горячей водой, равно количеству
теплоты, полученному водой холодной. И это не случайно. Вспомните: если
между телами происходит теплообмен, то внутренняя энергия всех нагревающихся
тел увеличивается ровно на столько, на сколько уменьшается внутренняя энергия
остывающих тел.
Конечно
в реальных условиях количество теплоты, отданное горячей водой, всегда будет
больше чем-то количество теплоты, которое получит холодная вода. Это
объясняется тем, что часть энергии идёт на нагревание сосуда, в котором
находилась вода, а ещё часть теряется на нагревание окружающего воздуха.
Теперь
мы можем внести дополнительный пункт в нашу последовательность действий при
решении задач — пункт о необходимости составления уравнения теплового
баланса.
Количество
теплоты, отданное или полученное телом, можно измерить с помощью прибора,
который называется калориметр.
Школьный калориметр
Школьный
калориметр состоит из двух стаканов, вставленных один в другой. Воздушная
прослойка и подставка между ними уменьшают теплопередачу между содержимым
внутреннего стакана и окружающим воздухом.
Задача
3.
Калориметр содержит 3 л воды при температуре 80 оС. В воду опускают
нагретый на плитке кирпич массой 1,5 кг. Определите начальную температуру
кирпича, если в результате теплообмена температура воды повысилась до 9 оС.
Теплопередачей калориметру и окружающему воздуху можно пренебречь.
Обратите
внимание на то, что в некоторых задачах теплоёмкостью калориметра пренебрегать
нельзя. В этом случае необходимо учитывать, что и вода, и калориметр будут
нагреваться или охлаждаться вместе. А их температуры можно считать одинаковыми.