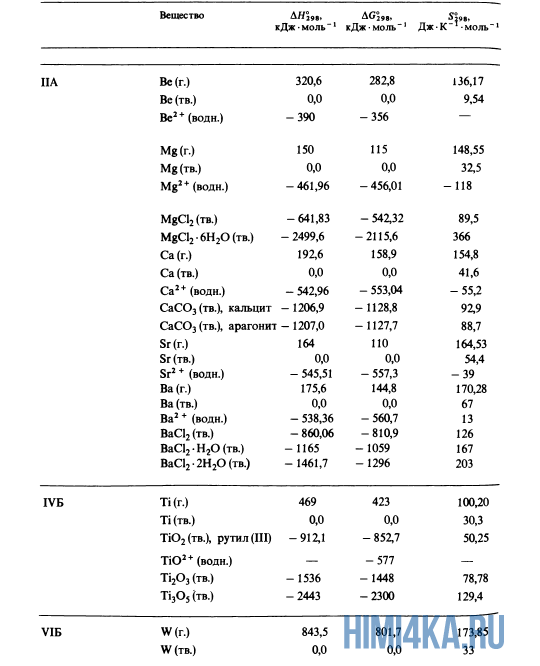
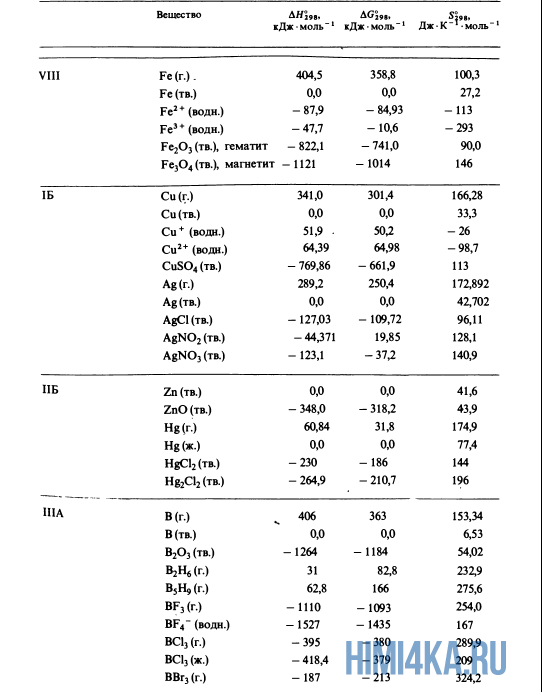
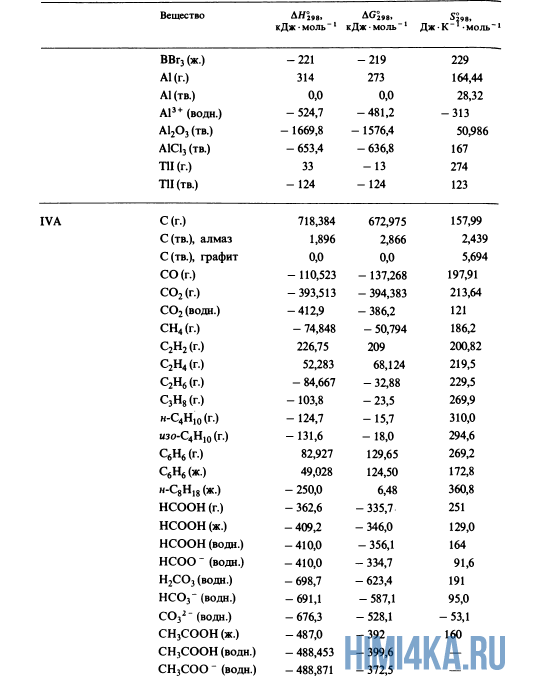
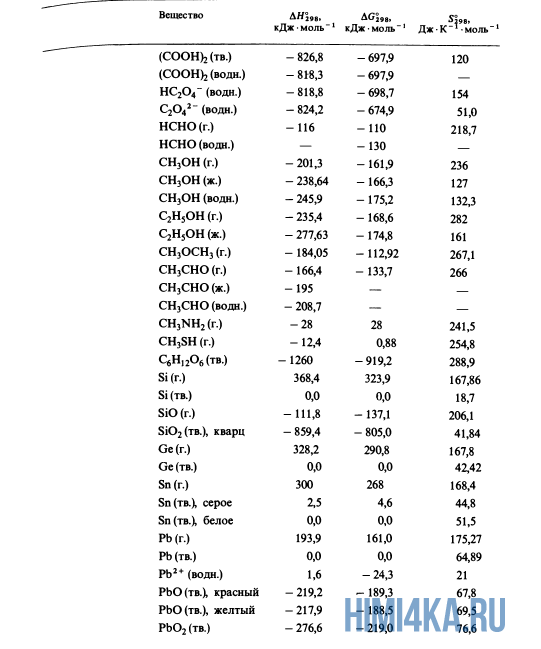
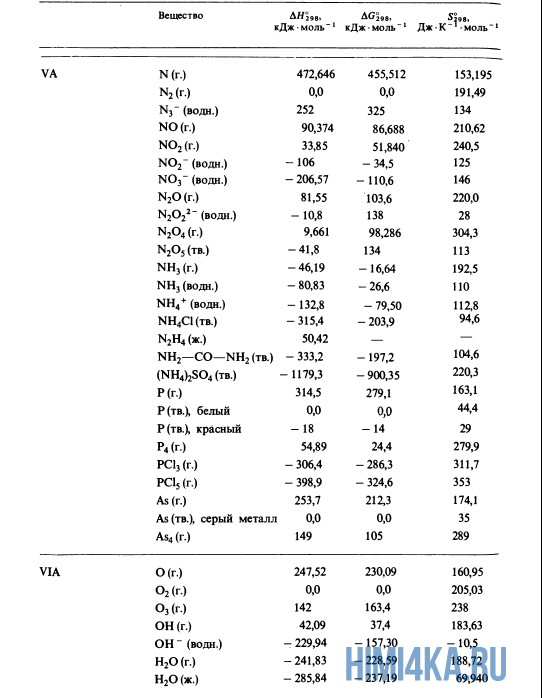
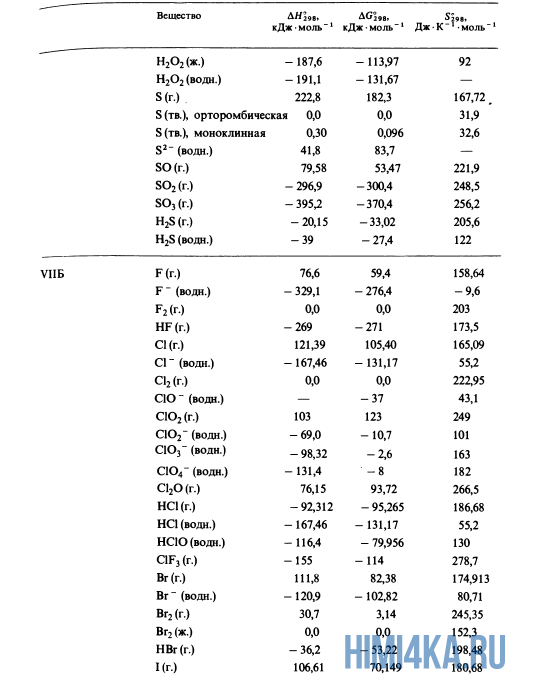
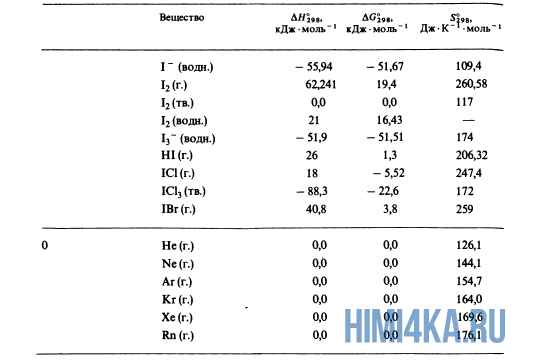
Для расчетов
тепловых эффектов используют величину,
называемую энтальпией.
Энтальпией
(теплотой) образования химического
соединения ∆ HT
называется изменение энтальпии
в процессе получения 1 моля этого
соединения из простых веществ (элементов)
при постоянном давлении.
Так, например,
энтальпией образования этилового спирта
C2H5OHназывается изменение энтальпии при
реакции углерода, кислорода и водорода
при постоянном давлении
2C
+ 3H2 + 1/2
O2→ CH3
– CH2 – OH
И наоборот, реакции
CH2
= CH2+H2O→CH3
– CH2
– OH
CH3
– CHO+H2→CH3
– CH2
– OH
не являются
реакциями ”образования” спирта, хотя
и приводят к синтезу этилового спирта.
Важным термодинамическим
представлением является понятие о
стандартном состоянии вещества, под
которым понимается его реальное состояние
при 298 Ки атмосферном давлении (илиp = 101 кПа).
Стандартной
энтальпией (теплотой) образования
химического соединения
называется изменение энтальпии в
процессе образования 1 моля этого
соединения, находящегося в стандартном
состоянии, из простых веществ, также
находящихся в стандартных состояниях
и термодинамически устойчивых при
данной температуре фазах и модификациях.
Стандартные
энтальпии образования простых веществ
принимают равными нулю, если их агрегатные
состояния и модификации устойчивы при
стандартных условиях.
Стандартная
энтальпия образования соединения –
мера его термодинамической устойчивости,
прочности, количественное выражение
энергетических свойств соединения.
Если стандартная энтальпия образования
отрицательна, то соединение более
устойчиво, чем элементы, из которых оно
состоит, или наоборот, если она
положительна, то соединение менее
устойчиво. Из различных молекул более
устойчивы те, энтальпии, образования
которых меньше.
Например, этан (∆
H298 = –
24,82 ккал/моль)более устойчив, чем
этилен
Термохимические
расчеты.Значения энтальпий
образования позволяет определить
изменения энтальпии, сопровождающие
реакции, не прибегая к прямым измерениям.
В основе большинства
термохимических расчетов лежит следствие
из закона Гесса:
Тепловой эффект
химической реакции равен сумме теплот
(энтальпий) образования продуктов
реакции за вычетом суммы теплот
(энтальпий) образования исходных веществ.
Так, для уравнения
вида
aA
+ bB +…= dD
+ eE +…
Тепловой эффект
∆ Hопределяется
равенством
=
При этом следует
иметь в виду, что при алгебраическом
суммировании следует учитывать
стехиометрические коэффициенты в
уравнении реакции (а, в, d,
e).
Приведенное
уравнение позволяет определять как
тепловой эффект реакции по известным
энтальпиям образования веществ,
участвующих в реакции, так и одну из
энтальпий образования, если известны
тепловой эффект реакции и все остальные
энтальпии образования.
В настоящее время
энтальпии образования известны примерно
для четырех тысяч веществ, и это позволяет
расчётным путем установить тепловые
эффекты самых разнообразных реакций.
Пример 1. Расчет
теплового эффекта реакции по стандартным
энтальпиям образования веществ.
Al2O3
(к)
+3SO3 (г)
= Al2(SO4)3
(к)
=-1675
кДж/моль;
=-395,
2 кДж/моль
=-3434
кДж/моль
Тепловой эффект
реакции
определяется по уравнению:
После подстановки
значений стандартных энтальпий
-3434-(-1675-3.395,
2)=-599 кДж/моль
Видно, что
<
0, т.е. это реакция экзотермическая.
Пример 2. Расчет
энтальпии образования химического
соединения по известному тепловому
эффекту реакции.
Определить
в реакции:
CH4
(г) + 2 H2O
(г) = CO2
(г) + 4 H2
(г)
=-241,82
кДж/моль;
=-393,51
кДж/моль;
=
+164,98 кДж
Стандартный
тепловой эффект реакции равен:
,
откуда
После подстановки
стандартных энтальпий образования
веществ:
(-1
моль∙ 393,51 кДж/моль + 2 моль ∙ – 241,82
кДж/моль – 164,98 кДж) / 1 моль = – 74,85 кДж/моль
Видно, что реакция
образования метана является экзотермической.
Пример 3. Расчет
теплового эффекта реакции, который
экспериментально определить невозможно.
Реакция 1) C
+ O2 = CO2,
= -396 кДж/моль
может быть также
осуществлена в две стадии
2)
C + 1/2 O2
= CO,
= -110, 5 кДж/моль
3)
CO + 1/2 O2
= CO2
Тепловой эффект
реакции 2) можно провести экспериментально
и определить
=-110, 5 кДж/моль.
А вот тепловой
эффект реакции 3) экспериментально
осуществить и определить невозможно,
поэтому
реакции
3) получают расчетным путем, используя
закон Гесса
– 396 – (-110, 5) = – 285,5
кДж/моль
С помощью
термохимических расчетов можно определить
энергию химических связей, энергии
кристаллических решеток, теплоты
растворения и гидратации, тепловые
эффекты фазовых превращений и т.д.
Энтальпия есть
возрастающая функция температуры,
непрерывная во всей области изменения
последней, когда существует данная
фаза. Для расчета теплового эффекта при
температурах, более высоких, чем
стандартные, используют уравнение
Кирхгофа:
где
– стандартный тепловой эффект реакции
приT = 298 К;
–
стандартный тепловой эффект реакции
при T.
разность молярных
изобарных теплоемкостей всех продуктов
реакции и молярных изобарных теплоемкостей
всех исходных веществ, т.е.
Расчеты по уравнению
Кирхгофа показывают, что в том интервале
температур, который может иметь
практическое значение, изменение
величины теплового эффекта реакции
невелико.
Так, например,
тепловой эффект процесса 1/2 N2
+ 1/2 O2
= NO (г)при
повышении температуры от298до4000Кизменяется всего лишь на2,0
кДж/моль. Еще меньше влияние давления
на тепловой эффект реакции. Так, для
реакции синтеза аммиака из азота и
водорода различие между величинами
приp = 101 кПаиp
= 50 МПане превышает5 %.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
C + O2 = CO2 + Q
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
2KNO3 → 2KNO2 + O2 – Q
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
4NH3 + 3O2 → 2N2 + 6H2O + Q
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения. Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
2Аl + 3/2О2 → Аl2О3 + 1675 кДж
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
4Аl + 3О2 → 2Аl2О3 + 3350 кДж
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
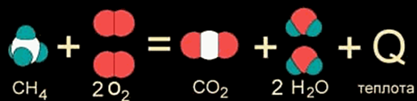
Например, при горении метана:
СН4 + 2О2 → СО2 + 2Н2О + 802 кДж
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
N2 + O2 → 2NО – 180 кДж
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
2H2(г) + O2(г) = 2H2O(г) + 484 кДж,
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
m (H2O)=108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
S(ромб) + O2(г) = SO2(г) + 296 кДж,
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Q = 740 кДж.
Ответ: выделится 740 кДж теплоты.
ЭЛЕМЕНТЫ ТЕРМОХИМИИ
Термохимия – раздел химии, в котором рассматриваются тепловые явления, происходящие в процессе химических реакций.
Нужен репетитор по химии? Записывайтесь на занятия в каталоге TutorOnline!
Все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты эндотермические. Критерием таких процессов является тепловой эффект реакции.
Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана
СН4 + 2O2 = СО2 + 2Н2О + Q (1)
а к эндотермическим реакциям – реакции разложения. Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+ Q) или поглощается (- Q):
СаCO3 = СаO + CO2 -Q (2)
При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др.
Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку, например, оксид кальция (СаО) при взаимодействии с водой образует гидроксид кальция (Са(ОН)2). Процесс сопровождается выделением большого количества теплоты:
СаО + Н2О = Са(ОН) + 108 кДж (3)
А реакция разложения гидроксида кальция (Са(ОН)2) осуществляется с поглощением такого же количества теплоты извне
Са(ОН)2 = СаО + Н2О – 108 кДж (4)
Если тепловой эффект реакции определяется при постоянном давлении, температуре, то он будет соответствовать стандартной энтальпии реакции, обозначаемой ∆Н, которая противоположна по знаку величине теплового эффекта реакции. Например, если в процессе экзотермической реакции во взаимодействие вступают алюминий (Аl) и оксид железа (Fe2O3), то в конце уравнения это обозначится следующим образом:
2Аl + Fe2O3 = 2Fe + Al2O3 (+Q) или (-∆Н) (5)
А в случае эндотермической реакции значения этих тепловых величин будут иметь противоположные знаки:
С + СО2 = 2СО (-Q) или (+∆Н) (6)
Это объясняется тем, что выделяющаяся в процессе экзотермической реакции теплота как энергия, теряется системой (-∆Н), а при эндотермических процессах, наоборот – приобретается (+∆Н). Величина (Н) называется энтальпией системы. Часто её называют так же теплосодержанием или теплотой образования ∆Н данного вещества. В расчётах применяют справочные значения тепловых эффектов образования (или сгорания) одного моля вещества, отнесённые к 298К (250С) и Р = 101,325 кПа (1 атм). Эти условия считаются стандартными и поэтому используемые значения тепловых эффектов называют стандартными теплотами образования(или сгорания) вещества и обозначают как ∆Н0298. Например, тепловой эффект реакции взаимодействия графита с кислородом, выраженный через изменение энтальпии, следует записать как ∆Н0298 = – 393,6 кДж, а так как при этом из простых веществ образуется 1 моль СО2, то данный тепловой эффект является теплотой образования СО2, выраженной в кДж/моль. Главной характеристикой топлив являются их теплоты сгорания. Тепловой эффект реакции горения одного моля вещества называется теплотой сгорания данного вещества. Следовательно, исходя из вышеприведённых положений, теплота сгорания одного моля графита (12 г) составляет 393,6 кДж/моль.
Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением.
На практике это имеет большое значение. При строительстве тепловых трасс, доменных печей, котельных и т.п. теплотопотребляющих промышленных объектов, необходимо предусмотреть или приток энергии для поддержания процессов, или наоборот, отвод избытка теплоты, чтобы не было перегрева вплоть до взрыв
Расчёт теплового эффекта реакции между простыми веществами не предоставляется затруднительным. Например, для реакции образования хлористого водорода:
Н2 + Cl2 = 2НCl (7)
Энергия затрачивается на разрыв двух химических связей Н–Н и Cl – Cl. При этом энергия выделяется при образовании двух химических связей Н- Cl. Значения энергий этих связей можно найти в справочных таблицах и по разности между ними определить тепловой эффект (Q) реакции (7):
ЕН–Н = 436 кДж/моль, ЕCl–Cl = 240 кДж/моль,
ЕН–Cl = 240 кДж/моль,
Q = 2 х 430 – ( 1 х 436 – 1 х 240 ) = 184 кДж.
Приведённая в качестве примера термохимическая реакция (7) является экзотермической. Теплоты образования простых веществ при стандартных условиях приняты равными нулю.
Термохимические уравнения имеют особую форму записи. Они отличаются от обычных уравнений тем, что:
1). В термохимических уравнениях обязательно указывают агрегатные состояния веществ (жидкое, твёрдое, газообразное) Это связано с тем, что одна и та же реакция может иметь различный тепловой эффект в зависимости от фазового состояния вещества
2). Коэффициенты в термохимическом уравнении равны количеству веществ ( в молях), вступивших в реакцию. Например, дана реакция сгорания ацетилена:
2С2Н2(г) + 5О2(г) = 4СО2(г) + 2Н2О (+Q) (8)
При сгорании одного моль ацетилена С2Н2 выделяется 1257кДж теплоты. Поэтому, относительно одного моль С2Н2 необходимо все коэффициенты перед реагентами поделить на 2, тогда получим следующую запись термохимического уравнения:
С2Н2 + 5/2О2 = 2СО2 + Н2О + 1257 кДж (9)
Или другая тождественная запись:
С2Н2 + 2,5О2 = 2СО2 + Н2О + 1257 кДж (10)
Например, дано термохимическое уравнение сгорания метана:
СН4 + 2О2 = СО2 + 2Н2О + 802 кДж (11)
Необходимо вычислить, какое количество теплоты выделится при сгорании 20 г метана?
Поскольку 1 моль метана имеет массу 16 г, а 20 г метана соответственно составляют
n = m/Mr = 20:12 = 1,25 моль,
то, составив пропорцию: при сгорании
1 моль СН4 выделяется 802 кДж теплоты
1,25 СН4 ——–«——-Х кДж теплоты
Определим, что на сгорание 20г метана потребуется
Х = 1,25 х 802 / 1 = 1002,5 кДж
Приведём другой пример . Дано уравнение реакции сгорания оксида азота(+4):
4NО2(г) + O2(г) + 2H2O(г) = 4НNО3(ж) + 448 кДж (12)
Необходимо составить термохимическое уравнение относительно сгорания одного моль оксида азота. Определить: какой объём оксида азота потребуется на образование 4258 кДж теплоты в процессе данной реакции?
Для составления термохимического уравнения относительно одного моль оксида азота(+4) необходимо все коэффициенты, стоящие перед реагентами, разделить на коэффициент, стоящий перед NО2, т.е. на «4», тогда уравнение примет вид:
NО2(г) + 1/4O2(г) + 1/2H2O(г) = НNО3(ж) +112 кДж (13)
В уравнении изменится количество выделяющейся теплоты, оно станет равным 112, т.е. в четыре раза меньше, чем в приведённом уравнении. В соответствии с уравнением (13) 1 моль оксида азота(NО2) или 22,4 л в данной реакции образует 112 кДж теплоты, а Х л соответственно 4258 кДж:
22,4 моль NО2 при сгорании образуют 112 кДж теплоты.
Х л —————-«————-4258 кДж теплоты.
Хг = 22,4 х 4258 / 112 = 851,6 кДж
Важнейшим законом термохимии является закон Г.И.Гесса (1840): тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. При помощи закона Гесса можно рассчитывать такие тепловые эффекты реакции, которые измерить трудно или невозможно. Например, теплоту образования угарного газа(СО) можно вычислить, если полное сгорание углерода
С (графит) + О2 = СО2 (∆Н1) (14)
разбить на стадии:
С (графит) + 0,5О2 = СО (∆Н2) (15)
СО + 0,5О2 = СО2 (∆Н3) (16)
Зная, что ∆Н1 = -393,6 кДж/моль и ∆Н3 = – 283,1 кДж/моль, из равенства ∆Н1 = ∆Н2 + ∆Н3
находим, что ∆Н2 = – 110,5 кДж/моль.
В качестве другого примера можно привести образование сульфата алюминия при сгорании алюминия и серы ромбической согласно реакции:
2Al(к) + 3S(ромб) + 6О2(г) = Al2(SO4)3(к) (17)
∆Н может быть найдена по тепловым эффектам отдельных стадий:
2Al + 1,5О2 = Al2O3 ∆Н1= -1670,2 кДж/моль (18)
3S + 1,5О2 = SO3 ∆Н2= -395,3 кДж/моль (19)
Al2O3 + 3SO3 = Al2(SO4)3 ∆Н3= -579,7 кДж/моль (20)
Тогда ∆Н = ∆Н1 + 3∆Н2 + ∆Н3 = (- 1670,2) – 3х (-395,3) – (579,7) = – 3435,8 кДж/моль.
На основании закона Гесса термохимические уравнения можно разбивать на отдельные стадии независимо от того, осуществимы они на практике или нет. Из закона Гесса вытекает важное следствие: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходный веществ:
∆Н = ∑ (𝘮 ∆Н) продукты – ∑ (𝘯 ∆Н) реагенты,
где 𝘮 и 𝘯 – число молей каждого вещества в уравнении реакции. Например, теплоту сгорания ацетилена (10) можно рассчитать, зная теплоты образования С2Н2 , СО2 и Н2О (∆Н002 = 0), как ∆Н0 = 2 ∆Н СО2 + ∆НН2О – ∆НС2Н2 = -2 х 393,6 – 281 – (+226,8) = -1295 кДж/моль.
НАЧАЛА ТЕРМОДИНАМИКИ
Среди многообразия химических реакций, термохимические занимают особое положение. Если рассуждать с точки зрения эволюции жизни на Земле, то в конечном итоге, действительно, от этих процессов зависит жизнь на нашей планете. А что касается человеческой цивилизации в целом, то здесь мы имеем прямую зависимость её развития от термохимических явлений. Ведь благодаря именно данным процессам произошёл отрыв человечества в развитии от всех других видов живых организмов, населяющих нашу планету. С древнейших времён, начиная от пассивного использования огня в качестве средства для согревания и приготовления примитивной пищи, человечество пришло к активному использованию этого явления (изготовление гончарных изделий – плавка меди, железа и других металлов – паровые двигатели – двигатели внутреннего сгорания – управление ядерными реакциями)
Если можно было бы предложить создать проект монумента человеческому прогрессу, то на его фронтоне надо было бы начертать уравнение химической реакции
С + О2 = СО2
Именно со сгорания дров, угля, торфа начался отсчёт человеческой цивилизации. В настоящее время наше с вами существование просто немыслимо без тепловых процесов. Но кроме приведённой выше реакции существует великое множество других термодинамических процессов. Почему именно углероду дано такое предпочтение? Может быть его собрату по IV-й группе – кремнию более выгоден данный процесс?
Si + О2 = SiО2
Тем более, что кремний по массе составляет 27,6% земной коры. Это несравненно больше, чем запасы древесины и её ископаемых на нашей планете. Чего же проще? Кидай в топку кремнезём! Его ведь целая планета! Правда надо оговорить тот факт, что чистого кремния в природе не существует. В наличии только его оксид – SiО2. Но на то и химики, чтобы придумать что-нибудь? А может быть для более сильного окислителя, чем кислород – фтору окисление углерода более выгодно термодинамически?
C + 2F2 = СF4
Как во всём этом разобраться? И возможно ли вообще предсказать осуществления того или иного процесса, ведь на бумаге можно написать уравнение любой химической реакции, а возможна ли она практически? Придётся начинать всё по порядку.
Одним из самых важных и очевидных законов природы является закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, она только переходит из одной формы в другую. Аналогичным является закон сохранения массы вещества: массы веществ вступивших в реакцию равны массам веществ, образовавшихся в процессе данной реакции.
Поэтому и при экзотермической и при эндотермической обратимых реакциях одного и того же процесса как количество затрачиваемой и расходуемой энергии равны, но противоположны по знаку, так и массы веществ распадающихся и вновь образующихся равны:
СаО + Н2О = Са(ОН)2 + 108 кДж
Mr=56 Mr=18 Mr=74
Са(ОН)2 = СаО + Н2О – 108 кДж
Mr=74 Mr=56 Mr=18
Но всё дело в том, что в приведённых выше двух реакциях уже указано, какая из них экзотермическая, а какая эндотермическая. А можно ли так, как говорится «на вскидку» по одному только уравнению реакции определить: какая это реакция? В принципе, в большинстве случаев, возможно. К экзотермическим реакциям, в основном, относятся реакции соединения и как их разновидность – реакции окисления.(8,11,12,14). А к реакциям эндотермическим, соответственно – реакции разложения (2,4). Ещё раз уточним: в большинстве случаев. Поскольку реакция окисления:
0,5N2 + 0,5O2 = NО – 90 кДж
требует расхода энергии и является эндотермической, а реакция разложения нитрата натрия
2NaNO3 = 2NaNO2 + O2 (+Q)
осуществляется с выделением большого количества теплоты и является экзотермической.
Значит, принцип «на вскидку» не годится. Но каким же принципом тогда следует руководствоваться в определении реакций данного типа? В приводимых выше примерах (10), (14-20) указывалось, что стандартные теплоты образования веществ (∆Н) являются справочными данными. Такие данные скрупулёзно составлялись на протяжении десятилетий для многочисленных термодинамических реакций. С этой целью использовался прибор калориметр. Именно по этим данным в настоящее время мы можем установить, какой является та или иная реакция: экзотермической или эндотермической.
Теперь попробуем заглянуть как бы внутрь термохимической реакции. Как она начинается? Что способствует её осуществлению? В качестве примера приведём ещё раз две реакции (14) и (2):
С(графит) + О2 = СО2 + 393,3 кДж
СаСО3 = СаО + СО2 (-Q)
Представим себе, что химическими символами (С) и (О2) будут обозначаться не элемент «углерод» и простое вещество «кислород», а дрова (или уголь, торф) и воздух (атмосфера). А в качестве соединения СаСО3 – не карбонат кальция, а известное всем вещество: мел (или известняк). Первую реакцию будем проводить для того, чтобы нагреть печь и вскипятить чайник, а вторую – чтобы получить негашёную известь (СаО) в дальнейшем используемую для побелки садовых деревьев. Для разжигания печи приготовим щепки и, поместив сверху них дрова, зажжём огонь спичками.
Во втором случае, поместим в металлическое ведро мелко накрошенный мел, поставим на плиту и такими же действиями, как в случае разжигания огня в печи, разведём костёр под ведром.
Стоп! Тут что-то не так! Ведь мы установили, что первая реакция экзотермическая, протекает с выделением теплоты, а вторая реакция – эндотермическая, протекает с поглощением теплоты. А мы в обоих случаях разводим огонь, т.е. передаём этим процессам извне тепловую энергию. Значит, обе реакции эндотермические – идут с поглощением теплоты! Да, идут с поглощением теплоты, но это только на первом этапе. Некоторым экзотермическим реакциям требуется небольшой «толчок» – первоначальная подача энергии, а спустя некоторое время, когда загорятся дрова, процесс будет сопровождаться с выделением энергии в окружающую среду и во многие сотни, тысячи раз превзойдёт по величине первоначальное значение этой энергии. А второй процесс ка был так и останется эндотермическим. Ведь с прекращением подачи тепловой энергии мел перестанет разлагаться: реакция остановится. И всё-таки, почему в одних случаях процесс окисления (горения) является экзотермическим, а в других – эндотермическим процессом? И что является движущей силой эндотермических реакций, в ходе которых тепловая энергия поступает из окружающей среды? Ни у кого не вызывает удивление такое явление, как остывание со временем горячего чайника. Это нормально. А почему бы этому же чайнику, уже остывшему, холодному, взять, да и нагреться самому по себе? Вот это уже вызовет удивление.
Так вот, эта самая сила связана со стремлением любой системы к наиболее вероятному состоянию, характеризующимся максимальным беспорядком, называемым энтропией. Это одно из важнейших понятий в термодинамике. Энтропия обозначается символом «S». К примеру, при экзотермических реакциях, при проведении процессов плавления, кипения, переходов из жидкостей к газообразному состоянию, энтропия приобретает максимальное значение, поскольку при тепловых явлениях кинетическая энергия атомов, молекул, ионов возрастает, усиливаются беспорядочные колебания этих частиц. И наоборот, самый большой порядок в химических системах – в идеальном кристалле при температуре абсолютного нуля. Энтропия в данном случае равна нулю
Энтропия имеет численные значения, единицей её измерения является Дж/(моль . К); К примеру энтропия алмаза равна 2,4 Дж/(моль . К), пропана – 269,9 Дж/(моль . К). Энтропия газов значительно превышает энтропию жидких и тем более твёрдых тел. Поскольку в газообразных веществах постоянно происходит беспорядочное распределение молекул по всему объёму.
Существуют экспериментальные и теоретические методы определения энтропий различных химических соединений. Используя их, можно количественно рассчитать изменения энтропии при протекании конкретной реакции аналогично тому, как это делается для теплового эффекта реакции. Составлены специальные справочные данные, которые включают сравнительную характеристику этих величин с учётом температуры.
Подтянуть знания по химии можно записавшись на урок к онлайн-репетиторам TutorOnline
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
В уроке 21 «Теплота образования» из курса «Химия для чайников» рассмотрим что такое теплоты образования и откуда их брать; выясним, какие условия считаются стандартными, а также различия простых и сложных веществ; для закрепления полученных знаний решим пару задач, где используются теплоты образования и закон аддитивности теплот реакций. Будет неплохо, если перед прочтением данного урока, вы изучите материал про изменение энтальпии, а также про теплоты сгорания.
Благодаря закону Гесса (закону аддитивности теплот реакций) нам совсем не нужно считать теплоты всех реакций; достаточно иметь сведения о теплОтах лишь того минимума реакций, из которых можно получить все остальные. Подобный минимум, принятый всеми учеными и инженерами, представляет собой теплоты образования соединений из входящих в них чистых элементов в стандартных состояниях. А что же такое: стандартные состояния?
Стандартное состояние вещества
Для кристаллических и жидких веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25°С (298 К*) и внешнем давлении 1 атмосфера (атм); стандартное состояние газов определяется аналогичным образом, но при парциальном** давлении 1 атм. Вот например, стандартным состоянием углерода считается графит, а не алмаз.
* Кельвин (обозначение «К») – еще один показатель измерения температуры, наряду с Цельсия. Пока вам просто следует запомнить, что 0°С = 273 К, соответственно 1°С = 274 К, -1°С = 272 К, а -273°С = 0 К. Самой низкой температурой считается 0 К и называется абсолютным нулем.
** Парциальное давление — это давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Простые и сложные вещества
Все вещества можно разделить на две обширные группы — простые и сложные вещества.
Простые вещества — это вещества, образованные из атомов одного элемента. Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Сложные вещества (химические соединения) — это вещества, образованные атомами разных элементов. Так, оксид меди CuO образован атомами элементов меди Cu и кислорода O, вода H2O — атомами элементов водорода H и кислорода O.
Теперь вы понимаете различия простых веществ от сложных. Так вот, теплота образования простых веществ всегда равна нулю. Это, пожалуйста, запомните.
Стандартные теплоты образования
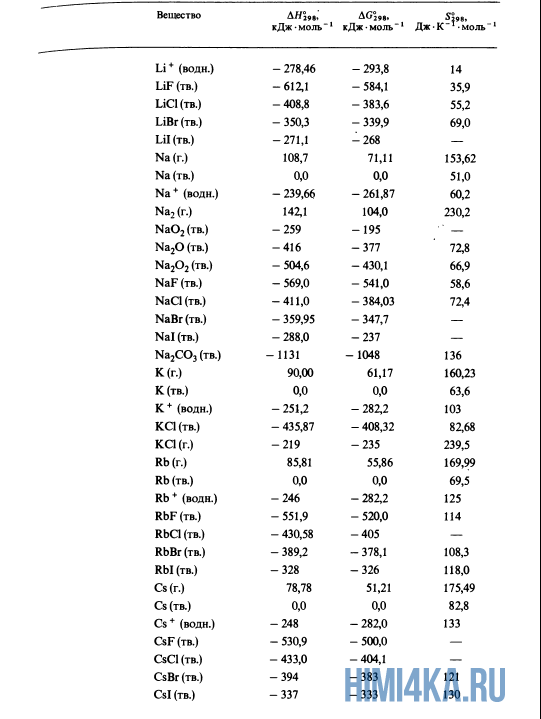
Вспомним прошлый урок, где мы пытались синтезировать алмаз. Теплоты образования всех веществ, участвующих в этом синтезе таковы:
- C(графит) + 2H2(г.) → CH4(г.) ΔH = -74,8 кДж (1)
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- H2(г.) + ½O2(г.) → H2O(ж.) ΔH = -285,8 кДж (3)
Как уже было отмечено выше, O2 относится к простым веществам, поэтому его теплота образования равна нулю. Таблицы стандартных теплот образования ΔH°298 соединений из чистых элементов приведена ниже под спойлером. В этой таблице нижний индекс 298 обозначает комнатную температуру (298 К = 25°С), а верхний индекс (знак градуса) означает, что реагенты и продукты находятся в своих стандартных состояниях. Однако не обязательно пользоваться записью ΔH°298, достаточно лишь написать ΔH.
Сейчас, на примере старой и доброй реакции (4) получения алмаза путем окисления метана, я покажу вам, как по теплотам образования веществ можно определить теплоту общей реакции. Это уравнение можно получить суммированием уравнения (2) с удвоенным уравнением (3) и обращенным уравнением (1):
- C(графит) → C(алмаз) ΔH = +1,9 кДж (2)
- 2H2(г.) + O2(г.) → 2H2O(ж.) ΔH = -571,6 кДж 2×(3)
- CH4(г.) → C(графит) + 2H2(г.) ΔH = +74,8 кДж -(1)
В итоге получаем:
- CH4(г.) + O2(г.) → C(алмаз) + 2H2O(ж.) ΔH = -494,9 кДж (4)
Теплота реакции вычисляется точно таким же способом, просто из теплот образования продуктов реакции вычитаем теплоты образования реагентов, учитывая все коэффициенты:
- ΔH = (+1,9) + 2(-285,8) — (-74,8) = -494,9 кДж
У кого возник вопрос, почему же мы не вычитаем теплоту образования кислорода, ответ ищите в таблице теплот образования.
Очевидно, что при таких вычислениях следует быть очень внимательным к знакам и коэффициентам. Чтобы не допустить ошибки, настоятельно рекомендую вам выписывать отдельно каждое уравнение с соответствующей теплотой реакции в таком виде, чтобы сумма всех индивидуальных уравнений давала требуемую реакцию. Если все коэффициенты какого-либо уравнения умножены на произвольное число n, на это же число n должна быть умножена соответствующая теплота образования, а если используется обращенное уравнение реакции образования, то следует изменить свой знак перед табличной величиной ΔH. Когда индивидуальные уравнения суммируются для получения требуемой реакции, сумма индивидуальных теплот образования дает искомую теплоту реакции. А теперь закрепим полученные знания примерами.
Пример 1. Чему равна стандартная теплота реакции восстановления оксида трехвалентного железа Fe2O3 углеродом С до железа Fe и моноксида углерода O, протекающей в доменной печи?
Решение:
Запишем уравнение реакции, указав под каждым веществом его стандартную теплоту образования:
- Fe2O3(тв.) + 3C(графит) → 2Fe(тв.) + 3CO(г.)
- -822,1 0,0 0,0 -110,5 ΔH, кДж·моль-1
Стандартная теплота образования простых элементов (С и Fe) по определению равна нулю. Стандартная теплота рассматриваемой реакции равна:
- ΔH° = 2(0,0) + 3(-110,5) — (-822,1) — 3(0,0) = +490,6 кДж
Как видите, изменение энтальпии положительно, а значит реакция эндотермическая (поглощается тепло). Полученный результат согласуется с известным фактом, что при восстановлении железной руды до свободного железа необходимо подводить к реакционной системе большое количество теплоты. Отметим, однако, что 490,6 кДж — это теплота, которая поглощалось бы, если бы реакция проводилась при 298 К, а не при 1800 К, как это происходит в доменной печи. Получается, что наше решение неверно? Нет, оно абсолютно верно, просто тепловой эффект (+490,6 кДж) следует рассматривать как телоту, поглощаемую при нагревании оксида железа (III) и углерода от 298 до 1800 К, последующей реакции между ними и охлаждением снова до комнатной температуры 298 К. Изменение энтальпии, или теплота реакции, зависит только от исходного и конечного состояний участников реакции, а нет от того, остается ли температура постоянной или поднимается до уровня, достигаемого в доменной печи, и затем опускается снова. Важно лишь то, что в конце процесса, как и в его начале, температура имеет значение 298 К. Еще раз повторяю, ибо это очень важный момент: Когда мы ссылаемся на теплоты реакции и утверждаем, что полученные значения относятся к процессу, проводимой «при давлении 1 атм и 298 К», требуется только, чтобы реакция начиналась при этих условиях и продукты были приведены к этим условиям (1 атм и 298 К).
Пример 2. Определите теплоту сгорания жидкого бензола.
Решение:
Запишем полное уравнение реакции с указанием теплот образования всех участвующих в нем веществ:
- 2C6H6(ж.) + 15O2(г.) → 12CO2(г.) + 6H2O(ж.)
- +49 0,0 -393,5 -285,8 ΔH, кДж·моль-1
Теплота этой реакции, как она записана (с 2 молями бензола), равна:
- ΔH = 12(-393,5) + 6(-285,8) — 2(+49,0) — 15(0,0) = -6540 кДж
Следовательно, теплота сгорания 1 моля бензола должна быть равна половине этой величины, т.е. -3270 кДж·моль-1.
Надеюсь урок 21 «Теплота образования» был не скучным. Если у вас возникли вопросы, пишите их в комментарии.
Тепловой эффект химической реакции — изменение внутренней энергии 

- единственно возможной работой при этом является работа против внешнего давления,
- как исходные вещества, так и продукты реакции имеют одинаковую температуру[2][3].
Теплота термохимического процесса и тепловой эффект химической реакции[править | править код]
Поясним приведённое выше определение теплового эффекта химической реакции[K 1]. Для этого запишем фундаментальные уравнения Гиббса для внутренней энергии и энтальпии простой[10] открытой однородной термодинамической системы[11][12]:

|
(Фундаментальное уравнение Гиббса для внутренней энергии) |

|
(Фундаментальное уравнение Гиббса для энтальпии) |
Здесь 






Для бесконечно малого[13] квазистатического изохорного процесса (

|
(Изменение внутренней энергии в бесконечно малом квазистатическом изохорном процессе) |
для бесконечно малого квазистатического изобарного процесса (

|
(Изменение энтальпии в бесконечно малом квазистатическом изобарном процессе) |
Важно понимать, что представление о теплоте химической реакции при сохранении исторически сложившегося названия (восходящего ко временам, когда любое изменение температуры связывали с поглощением или выделением теплоты) уже не имеет прямого отношения к общефизическому понятию количества теплоты. Действительно, при химической реакции в изолированной системе (например, инициируемом электрической искрой взрыве гремучего газа в герметически закрытом термосе) может иметь место изменение температуры (за счёт выделения теплоты), но не происходит обмена с окружающей средой(так как попросту это термос — изолированная система), ни изменения внутренней энергии системы. Наконец, традиционная трактовка теплоты, основанная на представлении об адиабатической изоляции системы от окружающей среды[14] (см. Неоднозначность понятий «теплота» и «работа») к открытым системам не применима, и для них теплоту 

|
(Дефиниция теплоты для любого бесконечно малого квазистатического процесса) |
Таким образом, теплота бесконечно малого квазистатического изохорного процесса 

|
(Теплота бесконечно малого квазистатического изохорного процесса) |
а теплота бесконечно малого квазистатического изобарного процесса 

|
(Теплота бесконечно малого квазистатического изобарного процесса) |
Для закрытых систем изменение энергии системы за счёт изменения масс составляющих систему веществ (химическую работу[17][18][19][20][21], работу перераспределения масс составляющих систему веществ[22]) 

|
(Теплота бесконечно малого квазистатического изохорного процесса в простой закрытой системе) |

|
(Теплота бесконечно малого квазистатического изобарного процесса в простой закрытой системе) |
Из сказанного ясно, почему в дефиниции теплового эффекта химической реакции фигурируют внутренняя энергия, энтальпия и запрет на любые виды работ в системе, кроме работы расширения/сжатия. Уточним, что в понятии «химическая работа» термин «работа» не имеет отношения к понятию «термодинамическая работа» и использован просто как синоним словосочетания «изменение энергии». Наконец, подчеркнём, что когда речь идёт о тепловом эффекте химической реакции, то, как и во многих других случаях, касающихся термохимии, подразумевается, что речь идёт о закрытой системе и полномасштабное применение мощного, но громоздкого математического аппарата термодинамики систем переменного состава не требуется[23][24][25].
Энергетический эффект химической реакции всегда рассматривают применительно к конкретному термохимическому уравнению, которое может не иметь отношения к реальному химическому процессу. Термохимическое уравнение лишь показывает, какие наборы начальных и конечных индивидуальных веществ, находящихся в определённых состояниях и количественных соотношениях, исчезают и образуются. В начальном состоянии должны присутствовать только исходные вещества (реактанты), а в конечном — только продукты химической реакции. Единственным условием при записи термохимического уравнения является соблюдение материального и зарядового баланса. Вещества в растворённом или адсорбированном состоянии тоже считаются индивидуальными соединениями; если растворитель или адсорбент не участвует непосредственно в химической реакции и не реагирует с растворённым веществом, то он рассматривается просто как фактор, влияющий на термодинамические свойства рассматриваемого вещества. Наконец, в термохимическом уравнении могут фигурировать частицы, не способные к самостоятельному существованию (электроны, протоны, ионы, радикалы, атомарные простые вещества)[26].
Энергетический эффект реального процесса с химической реакцией зависит от условий проведения процесса и не может служить стандартной характеристикой конкретной химической реакции[3]. Химическая же термодинамика нуждается в показателе, связанном с энергетикой химической реакции, но не зависящем от условий её проведения. Покажем, как может быть получен интересующий нас показатель. Для этого рассмотрим следующий мысленный эксперимент. Возьмем чистые индивидуальные исходные вещества в мольных количествах, соответствующих стехиометрическим коэффициентам интересующего нас термохимического уравнения, и находящиеся при определённых температуре и давлении. Если привести эти вещества в контакт, то энтальпия образовавшейся неравновесной системы в начальный момент времени будет равна сумме энтальпий исходных веществ. Теперь рассмотрим конечное состояние изучаемой системы в предположении, что реактанты прореагировали полностью[27] и продукты реакции находятся при той же температуре и том же давлении, что и реактанты. Энтальпия системы (в общем случае неравновесной) из продуктов химической реакции будет равна сумме энтальпий этих веществ. Поскольку энтальпия — функция состояния, то разность энтальпий 
Часто тепловой эффект химической реакции относят к 1 молю одного из продуктов реакции[30].
Резюмируем сказанное: теплота процесса, связанного с фактическим протеканием химической реакции, и энергетический эффект химической реакции отнюдь не одно и то же, а дефиниция теплового эффекта химической реакции вообще не предполагает действительного осуществления реакции, соответствующей рассматриваемому термохимическому уравнению[31].
И внутренняя энергия, и энтальпия представляют собой функции состояния, поэтому тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, то есть от числа и характера промежуточных стадий (закон Гесса)[32][33][34][35].
Тепловой эффект химической реакции, протекающей при постоянном давлении, и равный изменению энтальпии системы в процессе, соответствующем термохимическому уравнению, называется изобарным тепловым эффектом или энтальпией химической реакции. Тепловой эффект химической реакции, протекающей при постоянном объёме, и равный изменению внутренней энергии системы в процессе, соответствующем термохимическому уравнению, называют изохорным тепловым эффектом[2].
Для отдельных типов химических реакций вместо общего термина «тепловой эффект химической реакции» используют специальные (сокращённые) термины: теплота образования, теплота сгорания и т. п.[1]
Дефиниции тепловых эффектов должны быть дополнены указанием на начальные точки отсчёта значений энергии и энтальпии. Для сравнения тепловых эффектов и упрощения термодинамических расчётов все величины тепловых эффектов реакций относят к стандартным условиям (все вещества находятся в стандартных состояниях)[1]. Если реакцию — реально или гипотетически — проводят при стандартных условиях (T = 298,15 К = 25 °С и P = 1 бар = 100 кПа)[36], то тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHo
r.
Химические реакции, сопровождающиеся повышением температуры, называют экзотермическими, понижением температуры — эндотермическими. В термодинамической системе знаков тепловой эффект экзотермической реакции (



Тепловые эффекты химических реакций важны для теоретической химии и необходимы при расчётах равновесных составов смесей, выхода продуктов реакций, удельной тяги топлив реактивных двигателей и для решения многих других прикладных задач[1].
Изучение тепловых эффектов химических реакций составляет важнейшую задачу термохимии[3]. Для расчёта стандартных тепловых эффектов химических реакций используют таблицы стандартных теплот образования или сгорания[37].
Стандартная энтальпия образования (стандартная теплота образования)[править | править код]
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моля метана из углерода и водорода равна тепловому эффекту реакции:
-
-
- С(тв) + 2H2(г) = CH4(г) + 74,9 кДж/моль.
-
Стандартная энтальпия образования обозначается ΔHo
f. Здесь индекс f означает formation (образование), а знак «O» в верхнем индексе указывает, что величина относится к стандартному состоянию вещества: один моль индивидуального химического соединения, взятого в чистом виде при стандартных условиях в том агрегатном состоянии, которое устойчиво в этих условиях (если нет специальной оговорки)[38]. Иногда для обозначения стандартного состояния используют перечёркнутый символ «O» в верхнем индексе; согласно рекомендациям ИЮПАК по использованию обозначений в физической химии[39], перечёркнутый и неперечёркнутый символ «O», используемые для обозначения стандартного состояния, одинаково приемлемы. В литературе часто встречается другое обозначение стандартной энтальпии — ΔHo
298,15, где знак «O» указывает на равенство давления одной атмосфере[40] (или, несколько более точно, на стандартные условия[41]), а 298,15 — температура. Иногда индекс «O» используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество[42]. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298,15 K. Например, для иода в кристаллическом состоянии ΔHo(I2, тв) = 0 кДж/моль, а для жидкого иода ΔHo(I2, ж) = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
- ΔHoреакции = ΣΔHo
f (продукты) — ΣΔHo
f (реагенты).
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеся выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Температурная зависимость теплового эффекта (энтальпии) реакции[править | править код]
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):

Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:
где ΔCp(T1, Tφ) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; 
Стандартная энтальпия сгорания[править | править код]
Стандартная энтальпия сгорания — ΔHо
гор., тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Стандартная энтальпия растворения[править | править код]
Стандартная энтальпия растворения — ΔHо
раств., тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Складывается из теплоты разрушения кристаллической решётки и теплоты гидратации (или теплоты сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава — гидратов (сольватов). Разрушение кристаллической решетки, как правило, эндотермический процесс — ΔHреш. > 0, а гидратация ионов — экзотермический, ΔHгидр. < 0. В зависимости от соотношения значений ΔHреш. и ΔHгидр. энтальпия растворения может иметь как положительное, так и отрицательное значение. Так растворение кристаллического гидроксида калия сопровождается выделением тепла:
-
-
- ΔHо
раств.KOH = ΔHо
реш. + ΔHо
гидр.К+ + ΔHо
гидр.OH− = −59 кДж/моль.
- ΔHо
-
Под энтальпией гидратации ΔHгидр. понимается теплота, которая выделяется при переходе 1 моля ионов из вакуума в раствор.
Стандартная энтальпия нейтрализации[править | править код]
Стандартная энтальпия нейтрализации ΔHо
нейтр. — энтальпия реакции взаимодействия сильных кислот и оснований с образованием 1 моля воды при стандартных условиях:
-
-
- HCl + NaOH = NaCl + H2O
- H+ + OH− = H2O, ΔHо
нейтр. = −55,9 кДж/моль
-
Стандартная энтальпия нейтрализации для концентрированных растворов сильных электролитов зависит от концентрации ионов, вследствие изменения значения ΔHо
гидратации ионов при разбавлении.
См. также[править | править код]
- Термохимия
- Химическая термодинамика
Комментарии[править | править код]
- ↑ В общем случае, когда не выполняются условия, перечисленные в дефиниции теплового эффекта химической реакции, говорят об энергетическом эффекте химической реакции[4][5][6][7], который при выполнении упомянутых выше условий сводится к выделению/поглощению системой теплоты, то есть именно к тепловому эффекту. В соответствии со сложившейся в термохимии традицией термины «энергетический эффект химической реакции» и «тепловой эффект химической реакции» до сих пор иногда рассматривают как синонимы[8][9].
Примечания[править | править код]
- ↑ 1 2 3 4 БСЭ, 3-е изд., т. 25, 1976, с. 450.
- ↑ 1 2 Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин, 1984, с. 16.
- ↑ 1 2 3 Химическая энциклопедия, т. 4, 1995, с. 522—523.
- ↑ Александров Н. Е. и др., Основы теории тепловых процессов и машин, ч. 2, 2015, с. 290.
- ↑ Морачевский А. Г., Фирсова Е. Г., Физическая химия. Термодинамика химических реакций, 2015, с. 21.
- ↑ Карякин Н. В., Основы химической термодинамики, 2003, с. 17, 63.
- ↑ Шмидт Э., Введение в техническую термодинамику, 1965, с. 311.
- ↑ Александров Н. Е. и др., Основы теории тепловых процессов и машин, ч. 2, 2015, с. 174.
- ↑ Нараев В. Н., Физическая химия, ч. 1, 2007, с. 6.
- ↑ Состояние простой термодинамической системы (газы и изотропные жидкости в ситуации, когда поверхностными эффектами и наличием внешних силовых полей можно пренебречь) полностью задано её объёмом, давлением в системе и массами составляющих систему веществ.
- ↑ Кубо Р., Термодинамика, 1970, с. 143.
- ↑ Мюнстер А., Химическая термодинамика, 1971, с. 103.
- ↑ Бесконечно малым (элементарным, инфинитезимальным) называют процесс, для которого разница между начальным и конечным состояниями системы бесконечно мала.
- ↑ Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин, 1984, с. 8.
- ↑ Базаров И. П., Термодинамика, 2010, с. 114.
- ↑ Залевски К., Феноменологическая и статистическая термодинамика, 1973, с. 54.
- ↑ Lebon G. e. a., Understanding Non-equilibrium Thermodynamics, 2008, p. 14.
- ↑ Жариков В. А., Основы физической геохимии, 2005, с. 31.
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1985, p. 36.
- ↑ Сычёв В. В., Сложные термодинамические системы, 2009, с. 257.
- ↑ Путилов К. А., Термодинамика, 1971, с. 125.
- ↑ Тамм М. Е., Третьяков Ю. Д., Физико-химические основы неорганической химии, 2004, с. 11.
- ↑ 1 2 Степановских Е. И. и др., Химическая термодинамика в вопросах и ответах, 2014, с. 87.
- ↑ 1 2 Бурдаков В. П. и др., Термодинамика, ч. 2, 2009, с. 10.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 127.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 128.
- ↑ То, что конечное состояние может оказаться недостижимым в действительности, применительно к данному рассмотрению не имеет значения.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 130.
- ↑ Морачевский А. Г., Кохацкая М. С., Прикладная химическая термодинамика, 2008, с. 24.
- ↑ Никольский Б. П. и др., Физическая химия, 1987, с. 17.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 131.
- ↑ Ляшков В. И., Теоретические основы теплотехники, 2015, с. 102.
- ↑ Морачевский А. Г., Кохацкая М. С., Прикладная химическая термодинамика, 2008, с. 23.
- ↑ Кнорре Д.Г. и др., Физическая химия, 1990, с. 245.
- ↑ Никольский Б. П. и др., Физическая химия, 1987, с. 18.
- ↑ До 1982 года ИЮПАК принимал в качестве стандартного давления 1 атм = 101325 Па; это следует учитывать при использовании данных из литературы, изданной ранее.
- ↑ 1 2 Химический энциклопедический словарь, 1983, с. 563.
- ↑ Курс физической химии // Под ред. Я. И. Герасимова. М.-Л.: Химия, 1964. — Т. 1. — С. 55.
- ↑ International Union of Pure and Applied Chemistry (1993). Quantities, Units and Symbols in Physical Chemistry, 2nd edition, Oxford: Blackwell Science. ISBN 0-632-03583-8. p. 49. Electronic version.
- ↑ Жуховицкий А. А., Шварцман Л. А. Физическая химия. — М.: Металлургия, 1976. — 544 с.
- ↑ Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим.-технол. спец. вузов / Под ред. А. Г. Стромберга. — 2-е изд. — М.: Высш. шк., 1988. — 496 с.
- ↑ Пригожин И., Дефэй Р. Химическая термодинамика = Chemical Thermodynamics / Перевод с англ. под ред. В. А. Михайлова. — Новосибирск: Наука, 1966. — 502 с.
Литература[править | править код]
- Callen H. B. Thermodynamics and an Introduction to Thermostatistics. — 2nd ed. — N. Y. e. a.: John Wiley, 1985. — XVI + 493 p. — ISBN 0471862568, 9780471862567.
- Lebon G., Jou D., Casas-Vázquez J. Understanding Non-equilibrium Thermodynamics: Foundations, Applications, Frontiers. — Berlin — Heidelberg: Springer, 2008. — XIII + 325 p. — ISBN 978-3-540-74251-7, 978-3-540-74252-4. — doi:10.1007/978-3-540-74252-4.
- Александров Н. Е., Богданов А. И., Костин К. И. и др. Основы теории тепловых процессов и машин. Часть II / Под ред. Н. И. Прокопенко. — 5-е изд. (электронное). — М.: Бином. Лаборатория знаний, 2015. — 572 с. — ISBN 978-5-9963-2613-6. (недоступная ссылка)
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Большая Советская Энциклопедия / Гл. ред. А. М. Прохоров. — 3-е изд. — М.: Советская Энциклопедия, 1976. — Т. 25: Струнино — Тихорецк. — 600 с. Архивная копия от 5 августа 2017 на Wayback Machine
- Борщевский А. Я. Физическая химия. Том 1 online. Общая и химическая термодинамика. — М.: Инфра-М, 2017. — 868 с. — ISBN 978-5-16-104227-4.
- Бурдаков В. П., Дзюбенко Б. В., Меснянкин С. Ю., Михайлова Т. В. Термодинамика. Часть 2. Специальный курс. — М.: Дрофа, 2009. — 362 с. — (Высшее образование. Современный учебник). — ISBN 978-5-358-06140-8.
- Жариков В. А. Основы физической геохимии. — М.: Наука; Изд-во МГУ, 2005. — 656 с. — (Классический университетский учебник). — ISBN 5-211-04849-0, 5-02-035302-7.
- Залевски К. Феноменологическая и статистическая термодинамика: Краткий курс лекций / Пер. с польск. под. ред. Л. А. Серафимова. — М.: Мир, 1973. — 168 с.
- Карякин Н. В. Основы химической термодинамики. — М.: Академия, 2003. — 463 с. — (Высшее профессиональное образование). — ISBN 5-7695-1596-1. (недоступная ссылка)
- Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия. — 2. — М.: Высшая школа, 1990. — 416 с. — ISBN 5-06-000655-7.
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с.
- Ляшков В. И. Теоретические основы теплотехники. — М.: Курс; Инфра-М, 2015. — 328 с. — ISBN 978-5-905554-85-8, 978-5-16-0І0639-7.
- Морачевский А. Г., Кохацкая М. С. Прикладная химическая термодинамика. — СПб.: Изд-во Политехн. ун-та, 2008. — 254 с. — ISBN 978-5-7422-2006-0.
- Морачевский А. Г., Фирсова Е. Г. Физическая химия. Термодинамика химических реакций. — 2-е изд., испр. — СПб.: Лань, 2015. — 101 с. — (Учебники
для вузов. Специальная литература). — ISBN 978-5-8114-1858-9. (недоступная ссылка)
- Мюнстер А. Химическая термодинамика / Пер. с нем. под. ред. чл.-корр. АН СССР Я. И. Герасимова. — М.: Мир, 1971. — 296 с.
- Нараев В. Н. Физическая химия. Часть 1. Химическая термодинамика. Фазовые равновесия и учение о растворах. Электрохимия. — СПб.: Санкт-Петербургский государственный технологический институт (Технический университет), 2007. — 262 с. (недоступная ссылка)
- Никольский Б. П., Смирнова Н. А., Панов М. Ю. и др. Физическая химия. Теоретическое и практическое руководство / Под ред. Б. П. Никольского. — 2-е изд., перераб. и доп. — Л.: Химия, 1987. — 880 с. — (Для высшей школы).
- Путилов К. А. Термодинамика / Отв. ред. М. Х. Карапетьянц. — М.: Наука, 1971. — 376 с.
- Степановских Е. И., Брусницына Л. А., Маскаева Л. Н. Химическая термодинамика в вопросах и ответах. — Екатеринбург: УИПЦ, 2014. — 221 с. — ISBN 978-5-4430-0061-9.
- Сычёв В. В. Сложные термодинамические системы. — 5-е изд., перераб. и доп. — М.: Издательский дом МЭИ, 2009. — 296 с. — ISBN 978-5-383-00418-0.
- Тамм М. Е., Третьяков Ю. Д. Неорганическая химия. Том 1. Физико-химические основы неорганической химии / Под. ред. акад. Ю. Д. Третьякова. — М.: Академия, 2004. — 240 с. — (Высшее профессиональное образование). — ISBN 5-7695-1446-9.
- Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
- Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Пол — Три. — 640 с. — ISBN 5-85270-092-4.
- Химический энциклопедический словарь / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — 792 с.
- Шмидт Э. Введение в техническую термодинамику / Пер. с нем. — М.—Л.: Энергия, 1965. — 392 с.
- Эткинс П. Физическая химия. — М.: Мир, 1980.