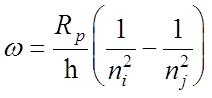Роман Алексеевич Лалетин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Символ терма включает информацию о таких квантовых числах как: полный спиновый угловой момент (полное спиновое квантовое число) ($S$), полный орбитальный угловой момент атома (полное орбитальное квантовое число) ($L$), полный момент количества движения атома ($J$). Напомним, что
Векторам $overrightarrow{J},overrightarrow{L},overrightarrow{S}$ соответствуют квантовые числа $J,L,S$. $overrightarrow{S}=sum{{overrightarrow{s}}_i}, overrightarrow{L}=sum{{overrightarrow{l}}_i}.$
Символ терма записывают как:
где величина $2S+1$ указывает спиновую мультиплетность состояния, $L$ — квантовое число орбитального момента, которое записывается при помощи обозначений буквами $(S,P,D…)$, $J$ — квантовое число полного углового момента, который вызван взаимодействием спинового и углового орбитальных моментов. Для атомов, которые имеют несколько электронов числа $L$ и $S$ являются приближенными, причем, чем больше атомный номер элемента, тем хуже приближение. Эти квантовые числа не являются измеряемыми напрямую. Единственной наблюдаемой величиной является полный угловой момент $J$. Если электронная конфигурация атома задана, то символ терма, который индивидуализирован, соответствует состоянию с определенной энергией.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Значения $J$ определяют, разделяя два вида схемы связи. В том случае, если взаимодействием спинового и орбитального моментов можно пренебречь в сравнении с отталкиванием электронов (например, у атомов легких элементов) ($L-S$ взаимодействие), то:
- находят полный орбитальный момент, используя формулу ($overrightarrow{L}=sum{{overrightarrow{l}}_i})$ и орбитальные моменты отдельных электронов;
- вычисляют полные значения $overrightarrow{S}=sum{{overrightarrow{s}}_i}$ по одноэлектронным спиновым моментам;
- затем полное значение $J$ находят как сумму $overrightarrow{J}=overrightarrow{L}+overrightarrow{S}.$
Для атомов тяжелых элементов применяется схема $j-j$ взаимодействия. В данном случае спин-орбитальным взаимодействием пренебречь нельзя. В таком случае, используя значения $l и s$ для каждого отдельного электрона, вычисляют величину $j$. После этого проводят суммирование всех $$ и получают $J$. .
Относительная устойчивость термов
Правило Гунда
Данное правило позволяет определять относительную устойчивость разных термов, которые возникают при заданной электронной конфигурации. В соответствии с этим правилом самым устойчивым состоянием, которое может возникнуть из заданной конфигурации является то, которое имеет максимальную спиновую мультиплетность.
«Основные термы атомов» 👇
Правило для орбитального момента ($L$) и полного углового момента ($J$)
Данные правила выполняются только для основного состояния атомов. При заданной величине $S$ основное состояние всегда характеризуется максимальным значением $L.$
Значение квантового числа $J$ для основного состояния зависит от заселенности незамкнутой оболочки. Если имеется только одна незамкнутая оболочка, и она заполнена менее чем на половину, самому низшему энергетическому состоянию соответствует минимальное значение $J$. В том случае, если исследуемая оболочка заполнена более чем на половину, о низшее по энергии состояние характеризуется максимальным значением $J$. Если оболочка имеет заполнение ровно $frac{1}{2}$, то $L=0$. В таком случае, если $L=0, S=S_{max}$, то $J$ имеет единственно возможное значение. Правило, которое определяет значение $J$, выполняется не всегда, если незамкнутых оболочек больше, чем одна.
Энергии основных термов
Для конкретной конфигурации электронов можно иногда можно построить ряд атомных термов, которые имеют разную энергию. Терм может расщепляться на мультиплет, образовывая тонкую структуру. Часто требуется выделить основной терм и основное состояние.
Для основного состояния атомов существуют эмпирические правила, которые называют правилами Хунда:
- Если задана электронная конфигурация, то минимальную энергию имеет терм, полный спин ($S$) которого является самым большим (мультиплетность максимальна).
- Если имеется несколько термов с одинаковой мультиплетностью, то самым низким является тот терм, у которого самое большое значение полного орбитального момента ($L$).
Правила Хунда объясняют тем, что при максимальных величинах $S$ и $L$ электроны (в среднем) располагаются дальше друг от друга. Значит, энергия отталкивания минимизируется.
Так, рассмотрим электронную конфигурацию $d^2.$ Можно определить каким является основной терм для такой конфигурации не находя полный набор термов. Для того, чтобы выполнялось первое правило Хунда и S было равно максимальному значению, то есть единице необходимо, чтобы имеющиеся два электрона в приведенной конфигурации имели одинаковую проекцию спинов (либо $+frac{1}{2}, либо-frac{1}{2} $). При этом состояния электронов должны быть таковы, что полный орбитальный момент был максимальным. Так как значение $L=4$ было бы не совместно с требованием $S=1$ (электроны были бы спаренными), значит $L=3$. Получаем, что основным будет терм ${}^3F$.
Для выявления основного состояния в терме применяют правило Ланде (иногда оно включено в правила Хунда):
если подоболочка атома заселена меньше, чем на $frac{1}{2}$, то минимальной энергией обладает нормальный мультиплет (состояние, которое имеет минимальное значение $J$); ели подоболочка заполнена более, чем на 50%, то минимальную энергию имеет состояние с максимальным $J$ (обращенный мультиплет).
Пример 1
Задание: Определите основной терм атома азота.
Решение:
Атом азота имеет электронную конфигурацию:
[1s^22s^22p^3.]
Пусть спины всех внешних электронов (их количество равно трем) направлены в одну сторону. Следовательно, получим:
[S_{max}=frac{3}{2},]
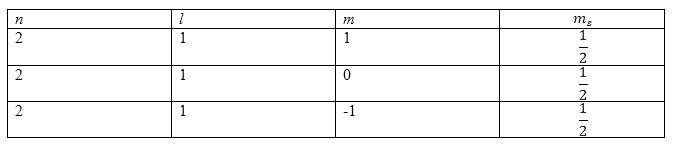
что означает, что у нас имеется квартетный терм. Составим таблицу из квантовых чисел:
Рисунок 1.
Для того, чтобы все спины имели одинаковые направления необходимо использовать все величины магнитного квантового числа ($m$). Получим, что:
[L_{max}=0.]
Ответ: Можно сделать вывод о том, что основным термом является терм ${}^4S$, а основное состояние – ${{}^4S}_{frac{3}{2}}.$
Пример 2
Задание: Каким будет основной терм атома кислорода?
Решение:
Атом кислорода имеет электронную конфигурацию:
[1s^22s^22p^4.]
Составим таблицу из квантовых чисел:
Рисунок 2.
Для атома кислорода нельзя направить все спины в одну сторону. В результате видно, что получаем два некомпенсированных спина. Значит, основной терм будет триплетом. Помимо этого результирующий орбитальный момент равен:
[L=1.]
В качестве основного терма имеем:
[{}^3{P.}]
Применим правило Ланде, учтем, что p — подоболочка заселена более чем на $frac{1}{2}$, получим основное состояние:
[{{}^3P}_2.]
Ответ: Основной терм кислорода – ${}^3{P,} $основное состояние – ${{}^3P}_2.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
ОБОЛОЧЕЧНАЯ МОДЕЛЬ АТОМА И АТОМНЫЕ
ТЕРМЫ
Одной из главных проблем локального
подхода к построению структурной модели
атома является установление явного
вида одноэлектронных орбиталей,
описывающих отдельные электроны атома.
Среди множества подходов к решению этой
задачи выделяется один наиболее простой
и наглядный. В его основе лежит
использование системы стационарных
состояний атома водорода (одноэлектронного
атома) в качестве модели многоэлектронного
атома. Так, модель атома, содержащего N
электронов, получается простым наложением
(суперпозицией) N
атомов водорода:
Достаточно очевидно, что получаемая
таким способом модель является весьма
грубой. Ее главный недостаток заключается
в полном пренебрежении взаимодействиями
электронов друг с другом, как
электромагнитной природы, так и
специфическими квантовыми, связанными
с фермионной природой электронов
(принципом Паули).
С другой стороны, данная модель позволяет
полностью перенести на многоэлектронный
атом все характеристики атома водорода:
-
наблюдаемые электрона, такие как
энергия Е, модули векторов механических
моментов — орбитального |L|,
спинового |S|
и полного |J|,
и их проекции — Lz,
Sz,
Jz
, -
квантовые числа, имеющие тот же
смысл, что и в атоме водорода:
{ n,
l, ml,
s, ms,
j, mj
}
Влияние межэлектронных взаимодействий
может быть до некоторой степени учтено
задним числом, путем введения определенных
поправок. Так, фермионный характер
электронов и особенности их статистики
в электронной оболочке атома учитываются
посредством введения принципа запрета
(Паули), согласно которому все электроны
должны иметь различные состояния.
В результате получается стройная
картина: ядро создает вокруг себя набор
виртуальных орбиталей, которые
последовательно заселяются электронами
в соответствии с принципом запрета
Паули.
Поскольку виртуальных состояний
(орбиталей) бесконечно много, то и
способов их заселения N
электронами также много. Каждый такой
способ называется электронной
конфигурацией атома. Существующие
закономерности в изменении квантовых
чисел Н-АО позволяют в каждой электронной
конфигурации выделить группы электронов,
состояния которых характеризуются
определенными значениями квантовых
чисел. Среди таких групп можно выделить:
-
слои (оболочки), внутри которых
главное квантовое число n
поддерживается постоянным (слои
обозначаются прописными латинскими
буквами K, L,
M, N, O,
P и т.д.), -
подоболочки, внутри которых
орбитальное квантовое число имеет одно
и то же значение (подоболочки обозначаются
строчными латинскими буквами s,
p, d,
f, g,
h и т.д.).
Не следует путать оболочки и подоболочки
с энергетическими уровнями.
Классификация проводится не по величине
энергии, а по значению квантового числа.
Энергии же электронов внутри оболочки
и подоболочки могут существенно
отличаться вследствие наличия
межэлектронных взаимодействий.
Оболочки и подоболочки могут быть
охарактеризованы двумя важными
параметрами: заселенностью
(конкретное число электронов в составе)
и емкостью max
(максимально возможное число электронов).
Емкость слоя определяется главным
квантовым числом ( max
= 2n2 ), а емкость
подоболочки — орбитальным квантовым
числом ( max
= 4l + 2 ). Среди слоев и
оболочек полезно различать заполненные
( = max
) и незаполненные (
< max
).
Электронную конфигурацию можно описать
с помощью электронной формулы,
состоящей из списка подоболочек и их
заселенностей.
. . . (nili)i
. . .
Например, формула атома углерода имеет
вид: (1s)2(2s)2(2p)2
.
Одним из полезных приложений оболочечной
модели является возможность нахождения
атомных термов. Под термом обычно
понимается совокупность состояний
атома, обладающих одной и той же энергией,
т.е. другими словами, энергетический
уровень.
Заметим, что полная энергия атома зависит
от ряда параметров:
1) от орбитальных энергий и распределения
электронов по атомным орбиталям
(электронной конфигурации);
2) от кулоновских межэлектронных
взаимодействий (межэлектронного
отталкивания);
3) от магнитного спин-орбитального
взаимодействия, обусловленного взаимным
влиянием магнитных моментов атома —
орбитального и спинового.
В результате, энергия атома зависит от
величин глобальных механических моментов
( |L|, |S|,
|J| ) или, что то же
самое, от значений соответствующих
квантовых чисел L, S
и J. Поэтому для всех
состояний, входящих в один и тот же
атомный терм, квантовые числа L,
S и J
должны быть определенными и общими.
Если мы сможем установить возможные
значения этих квантовых чисел, то мы,
соответственно, сможем решить задачу
о совокупности энергетических уровней
атома.
Рассмотрим эту задачу на примере
конкретного атома углерода. Его
электронная формула (1s)2(2s)2(2p)2.
Из трех -подоболочек
атома две (1s2 и
2s2) являются
заполненными, а одна (2р2) —
незаполненной.
Атом углерода относится к легким атомам
и для него допустимо применение
LS-приближения, в рамках
которого магнитные числа орбитального
и спинового моментов подчиняются правилу
аддитивности:
ML
=
(ml)i
и
MS
=
(ms)i
Легко видеть, что для заполненных
подоболочек выполняются строгие
равенства:
ML
= 0 и MS
= 0
что говорит о равенстве нулю и самих
моментов.
Ненулевой вклад в глобальные механические
моменты атома могут вносить только
электроны незаполненной подоболочки
2р. Каждый из этих двух электронов
характеризуется одним из трех возможных
значений магнитного орбитального числа
( +1, 0, -1 ) и одним из двух допустимых
значений магнитного спинового квантового
числа ( +1/2 , -1/2 ). Следовательно, каждый
электрон может находиться в одном из 6
допустимых состояний, которые можно
наглядно изобразить ячеечной схемой:
В соответствии с принципом запрета
Паули, возможны только такие конфигурации,
когда в каждой ячейке-состоянии
расположено не более 1 электрона. Общее
число таких конфигураций легко подсчитать
как число сочетаний:
Для каждого случая легко рассчитать
сумму магнитных чисел обоих видов. В
соответствии с полученными значениями
конфигурации можно сгруппировать в
следующей таблице:
Теперь следует обратить внимание на
то, что наличие у атома двух моментов L
и S с определенными
длинами и числами проекций (2L
+ 1) и (2S + 1), порождает
(2L + 1)(2S
+ 1) состояние, которые удобно записать
в виде аналогичной таблицы. Ясно, что
эта таблица будет прямоугольной с (2S
+ 1) столбцами и (2L + 1)
строкой. Кроме того, каждая клеточка
такой таблицы будет соответствовать
только одному состоянию. Ясно, что
полученная нами таблица для атома
углерода имеет неидеальный вид и в
действительности представляет собой
наложение трех идеальных таблиц.
По числу строк и столбцов каждой таблицы
легко определить квантовые числа L
и S, которыми определяются
длины векторов орбитального и спинового
моментов атома.
1) L = 2 S
= 0 , что соответствует терму 1D
( 5 состояний )
2) L = 1 S
= 1, что соответствует терму 3P
( 9 состояний )
3) L = 0 S
= 0 , что соответствует терму 1S
( 1 состояние )
Таким образом, 15 состояний, возможных
для атома углерода, разбиваются на три
подмножества-терма.
Все состояния, принадлежащие одному
терму, характеризуются одними и теми
же значениями орбитального и спинового
квантовых чисел L и
S, и, следовательно,
им соответствует одна и та же
пространственная форма электронного
облака. В результате и энергия
межэлектронного отталкивания будет
одинакова для всех таких состояний.
Напротив, состояния, принадлежащие
различным термам, соответствуют
электронным облакам разной пространственной
формы, что приводит к различиям в энергиях
межэлектронного отталкивания.
Таким образом, зная принадлежность
состояний к определенным термам, можно
предсказать их распределение по
энергетической шкале. Для этого имеются
специальные правила Хунда:
1 правило: минимальной энергией
обладает терм с максимальной
мультиплетностью (значением квантового
числа S).
2 правило: при равных мультиплетностях
минимальной энергией обладает терм с
максимальным квантовым числом L
Так, для атома углерода минимальной
энергией будут обладать 9 состояний
терма 3P (1-е
правило Хунда), а максимальной — 1
состояние терма 1S (2-е правило
Хунда).
Учет спин-орбитального взаимодействия.
Если учесть спин-орбитальное взаимодействие
между векторами L и
S, то полная энергия
атома будет зависеть от их взаимной
ориентации, или, что то же самое, от длины
вектора полного механического момента,
которая описывается значением квантового
числа J. Возможные
значения этого квантового числа
определяются вариантами сложения
квантовых чисел L и
S:
J = L
+ S, L
+ S – 1,
… | L – S
|.
Так, для рассмотренного примера с атомом
углерода получим такие варианты:
1) терм 1S
: L = 0
S = 0,
J = 0
2) терм 3P : L
= 1 S = 1, J
= 1 + 1 = 2, J = 1 + 0 = 1, и
J = 1 – 1 = 0
3) терм 1D
: L = 2
S = 0 ,
J = 2 + 0
= 2
В результате в составе терма появляются
более мелкие группы состояний (подтермы),
внутри которых все состояния характеризуются
одинаковой длиной вектора полного
механического момента:
1) терм 1S (1
состояние) переходит в подтерм 1S0
(1 состояние) без расщепления, так как
в данном случае спин-орбитального
взаимодействия нет,
2) терм 3P
(9 состояний) расщепляется на три подтерма:
3P2 (5
состояний) 3P1
(3 состояний) 3P0
(1 состояние),
3) терм 1D (5
состояний) переходит в подтерм 1D2
(5 состояний) без расщепления, так как
здесь, так же как и в первом случае,
спин-орбитального взаимодействия нет.
Относительные энергии подтермов
определяются 3-м правилом Хунда:
а) если подоболочка заполнена наполовину
и менее (
2l + 1), то минимальная
энергия соответствует подтерму с
минимальным значением квантового числа
J,
а) если подоболочка заполнена более чем
наполовину ( > 2l
+ 1), то минимальная энергия соответствует
подтерму с максимальным значением
квантового числа J.
Для атома углерода выполняется первое
условие, и следовательно, энергии
подтермов соотносятся следующим образом:
3P2
> 3P1
> 3P0
Число состояний в подтерме равно 2J
+ 1 и определяется числом возможных
ориентаций вектора J.
Все состояния подтерма имеют одинаковую
энергию. Однако подтерм также можно
расщепить, если наложить внешнее
магнитное поле. В этом случае энергия
будет зависеть от ориентации вектора
полного момента относительно внешнего
поля.
Суммарная картина расщепления атомных
состояний углерода по энергии имеет
вид:
Соседние файлы в папке семинары (текст)
- #
- #
- #
- #
- #
- #
- #
- #
Спектры атомов. Термы атомов
Страницы работы
Содержание работы
Лекция
4
Термы атомов
Энергия
атома определяется:
квантовыми
числами отдельных электронов n и (взаимодействие электронов с «ядром» с эффективным
зарядом);
полным
орбитальным моментом L и спином S атома (электростатическое взаимодействие
электронов между собой, не учтенное в приближении центрально симметричного поля
(Собельман, 38));
полным моментом атома J (спин-орбитальное
взаимодействие).
Как
определить L, S и J при известных из одноэлектронного приближения
? Это
квантовомеханическая задача сложения моментов, которую удобнее и нагляднее
решать методом сложения проекций и
.
проекция
спина +1/2 обозначим стрелкой вверх, -1/2 – стрелкой вниз.
отрицательные
значения проекций полных орбитального и спинового моментов ML
и MS опускаем
учитываем
принцип Паули
составляем
таблицу
Таблица 5.
Для
незаполненной подоболочки np2
|
|
|
|||||
|
+1 |
|
|
|
|
|
|
|
0 |
|
|
|
|||
|
-1 |
|
|
||||
|
Ms |
1 |
1 |
0 |
0 |
0 |
0 |
|
ML |
1 |
0 |
1 |
0 |
2 |
0 |
1S, 1D и 3P термы (сокращенно 1S D 3P)
Для
незаполненной подоболочки np3
|
me |
ms |
||||||
|
+1 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
-1 |
|
|
|
|
|
||
|
Ms |
3/2 |
1/2 |
1/2 |
1/2 |
1/2 |
1/2 |
1/2 |
|
ML |
0 |
0 |
0 |
0 |
2 |
1 |
1 |
2P,
2D, и 4S
термы
Очевидно, что полностью заполненная подоболочка имеет L = 0
и S = 0 .
Энергетическое
распределение термов регламентируется правилом Хунда:
1.
Наименьшей энергией обладает
терм с максимальным значением спина S при данной электронной конфигурации
и максимально возможным при этом Smax значении L.
2.
Для основного (нормального)
терма: J = , если подоболочка заполнена менее чем наполовину, и J = L + S
в остальных случаях.
Следовательно,
имеем следующую последовательность термов: при nр2: 3P0,
1D2, 1S0; при np3:
4S3/2 , 2D5/2, 3/2 , 2P3/2,
1/2 .
· Физические основы правила Хунда легко понять, если
представить, например, два электрона на одной орбите. Электростатическое
отталкивание будет стремиться заставить их вращаться в одном направлении. Если
они вращаются навстречу, то будут часто встречаться, т.е. средняя
электростатическая энергия будет больше. Таким образом, стремление к максимуму L можно понять из простейшей
классической аналогии.
· Причины сильного взаимодействия спинов имеют чисто квантовый характер и не имеют
классической аналогии. Действительно, прямое взаимодействие спиновых магнитных
моментов слишком мало. Дело заключается в том, что полная волновая функция
должна иметь определенную симметрию, а именно,
должна быть антисимметрична. Изменение полного спина влечет за собой изменение
симметрии спиновой волновой функции и, как следствие, требует изменения симметрии
координатной части волновой функции, т.е. изменения электронной конфигурации
атома, а, следовательно, и изменения электростатического потенциала атома.
Именно в этом смысле говорится об электростатическом взаимодействии спинов
электронов.
 Спектры
Спектры
атомов с одним электроном на верхней подоболочке
Взаимодействие излучения с
веществом
.
Переход называется разрешенным, если в величине Vij
отличен от нуля дипольный член разложения. В этом случае вероятности перехода
максимальны Vij ~ dij . Если дипольный момент
перехода dij равен нулю, то переход называют запрещенным.
Правила отбора
 Для атомов с LS
Для атомов с LS
связью условия отличия от нуля дипольного момента перехода сводятся к
следующим:
,
кроме
случая J1 = 0 и J 2 = 0.
Спектр атома водорода
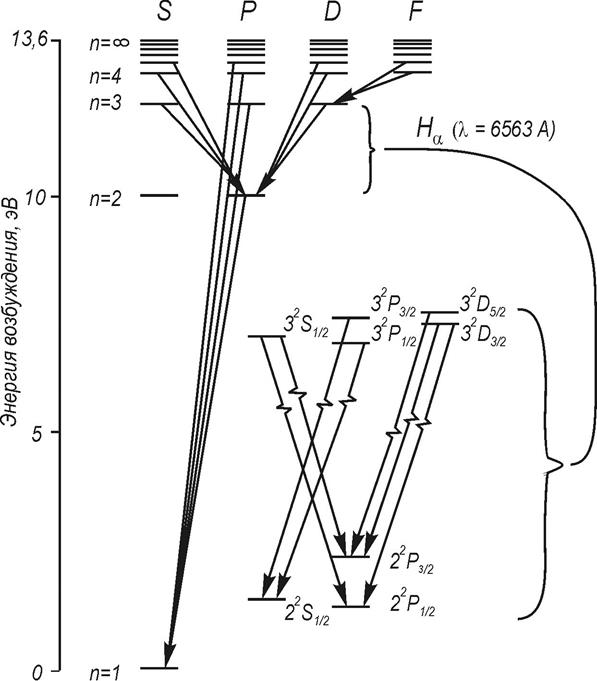
На
рис. 3 показаны энергетические уровни и разрешенные переходы в атоме водорода.
Частота перехода (без учета тонкой структуры)
Частота
перехода (без учета тонкой структуры):
Правила отбора:
(кроме
J1=0 и J2=0).
1.
Ультрафиолетовая серия Лаймана:
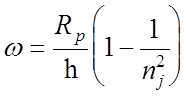
3…
2.
Серия Бальмера (видимая область спектра):
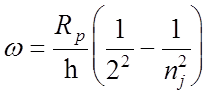
4, 5…
= 6563
(nj = 3),
= 4861
(nj = 4),
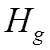
(nj = 5).
3.
Инфракрасная серия Пашена:
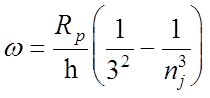
1 = 18751
, (nj = 4)
Более
подробно (на рис. 3) представлены уровни энергии с n = 3.
Учет тонкой структуры и лэмбовского сдвига приводит к формированию семи линий
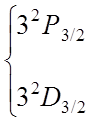
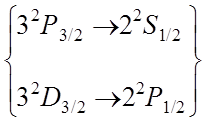
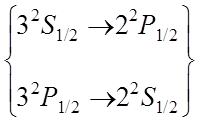
Фигурной
скобкой объединены термы, энергия которых отличается только на малую величину
лембовского сдвига.
Спектры щелочных металлов
один 1s-электрон в верхней подоболочке, спектр существенно
отличаются от спектра водорода (см. диаграмму):
снято вырождение
по орбитальному моменту внешнего электрона.
энергия уровня зависит от
настолько
сильно, что нельзя уже говорить о расщеплении уровня с данным n. Скорее,
уровни с заданным описываются водородоподобно (см. раздел 1.1) с эффективным квантовым
числом n*.
Похожие материалы
- Структура молекул. Гибридизация (Раздел 2.5. учебного пособия)
- Уширение спектральных линий (Глава 1 учебного пособия)
- Уширение спектральных линий (Раздел 3.2. учебного пособия)
Информация о работе
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание – внизу страницы.