Роман Алексеевич Лалетин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Символ терма включает информацию о таких квантовых числах как: полный спиновый угловой момент (полное спиновое квантовое число) ($S$), полный орбитальный угловой момент атома (полное орбитальное квантовое число) ($L$), полный момент количества движения атома ($J$). Напомним, что
Векторам $overrightarrow{J},overrightarrow{L},overrightarrow{S}$ соответствуют квантовые числа $J,L,S$. $overrightarrow{S}=sum{{overrightarrow{s}}_i}, overrightarrow{L}=sum{{overrightarrow{l}}_i}.$
Символ терма записывают как:
где величина $2S+1$ указывает спиновую мультиплетность состояния, $L$ — квантовое число орбитального момента, которое записывается при помощи обозначений буквами $(S,P,D…)$, $J$ — квантовое число полного углового момента, который вызван взаимодействием спинового и углового орбитальных моментов. Для атомов, которые имеют несколько электронов числа $L$ и $S$ являются приближенными, причем, чем больше атомный номер элемента, тем хуже приближение. Эти квантовые числа не являются измеряемыми напрямую. Единственной наблюдаемой величиной является полный угловой момент $J$. Если электронная конфигурация атома задана, то символ терма, который индивидуализирован, соответствует состоянию с определенной энергией.

Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Значения $J$ определяют, разделяя два вида схемы связи. В том случае, если взаимодействием спинового и орбитального моментов можно пренебречь в сравнении с отталкиванием электронов (например, у атомов легких элементов) ($L-S$ взаимодействие), то:
- находят полный орбитальный момент, используя формулу ($overrightarrow{L}=sum{{overrightarrow{l}}_i})$ и орбитальные моменты отдельных электронов;
- вычисляют полные значения $overrightarrow{S}=sum{{overrightarrow{s}}_i}$ по одноэлектронным спиновым моментам;
- затем полное значение $J$ находят как сумму $overrightarrow{J}=overrightarrow{L}+overrightarrow{S}.$
Для атомов тяжелых элементов применяется схема $j-j$ взаимодействия. В данном случае спин-орбитальным взаимодействием пренебречь нельзя. В таком случае, используя значения $l и s$ для каждого отдельного электрона, вычисляют величину $j$. После этого проводят суммирование всех $$ и получают $J$. .
Относительная устойчивость термов
Правило Гунда
Данное правило позволяет определять относительную устойчивость разных термов, которые возникают при заданной электронной конфигурации. В соответствии с этим правилом самым устойчивым состоянием, которое может возникнуть из заданной конфигурации является то, которое имеет максимальную спиновую мультиплетность.
«Основные термы атомов» 👇
Правило для орбитального момента ($L$) и полного углового момента ($J$)
Данные правила выполняются только для основного состояния атомов. При заданной величине $S$ основное состояние всегда характеризуется максимальным значением $L.$
Значение квантового числа $J$ для основного состояния зависит от заселенности незамкнутой оболочки. Если имеется только одна незамкнутая оболочка, и она заполнена менее чем на половину, самому низшему энергетическому состоянию соответствует минимальное значение $J$. В том случае, если исследуемая оболочка заполнена более чем на половину, о низшее по энергии состояние характеризуется максимальным значением $J$. Если оболочка имеет заполнение ровно $frac{1}{2}$, то $L=0$. В таком случае, если $L=0, S=S_{max}$, то $J$ имеет единственно возможное значение. Правило, которое определяет значение $J$, выполняется не всегда, если незамкнутых оболочек больше, чем одна.
Энергии основных термов
Для конкретной конфигурации электронов можно иногда можно построить ряд атомных термов, которые имеют разную энергию. Терм может расщепляться на мультиплет, образовывая тонкую структуру. Часто требуется выделить основной терм и основное состояние.
Для основного состояния атомов существуют эмпирические правила, которые называют правилами Хунда:
- Если задана электронная конфигурация, то минимальную энергию имеет терм, полный спин ($S$) которого является самым большим (мультиплетность максимальна).
- Если имеется несколько термов с одинаковой мультиплетностью, то самым низким является тот терм, у которого самое большое значение полного орбитального момента ($L$).
Правила Хунда объясняют тем, что при максимальных величинах $S$ и $L$ электроны (в среднем) располагаются дальше друг от друга. Значит, энергия отталкивания минимизируется.
Так, рассмотрим электронную конфигурацию $d^2.$ Можно определить каким является основной терм для такой конфигурации не находя полный набор термов. Для того, чтобы выполнялось первое правило Хунда и S было равно максимальному значению, то есть единице необходимо, чтобы имеющиеся два электрона в приведенной конфигурации имели одинаковую проекцию спинов (либо $+frac{1}{2}, либо-frac{1}{2} $). При этом состояния электронов должны быть таковы, что полный орбитальный момент был максимальным. Так как значение $L=4$ было бы не совместно с требованием $S=1$ (электроны были бы спаренными), значит $L=3$. Получаем, что основным будет терм ${}^3F$.
Для выявления основного состояния в терме применяют правило Ланде (иногда оно включено в правила Хунда):
если подоболочка атома заселена меньше, чем на $frac{1}{2}$, то минимальной энергией обладает нормальный мультиплет (состояние, которое имеет минимальное значение $J$); ели подоболочка заполнена более, чем на 50%, то минимальную энергию имеет состояние с максимальным $J$ (обращенный мультиплет).
Пример 1
Задание: Определите основной терм атома азота.
Решение:
Атом азота имеет электронную конфигурацию:
[1s^22s^22p^3.]
Пусть спины всех внешних электронов (их количество равно трем) направлены в одну сторону. Следовательно, получим:
[S_{max}=frac{3}{2},]
что означает, что у нас имеется квартетный терм. Составим таблицу из квантовых чисел:
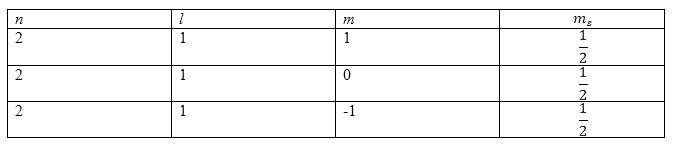
Рисунок 1.
Для того, чтобы все спины имели одинаковые направления необходимо использовать все величины магнитного квантового числа ($m$). Получим, что:
[L_{max}=0.]
Ответ: Можно сделать вывод о том, что основным термом является терм ${}^4S$, а основное состояние – ${{}^4S}_{frac{3}{2}}.$
Пример 2
Задание: Каким будет основной терм атома кислорода?
Решение:
Атом кислорода имеет электронную конфигурацию:
[1s^22s^22p^4.]
Составим таблицу из квантовых чисел:

Рисунок 2.
Для атома кислорода нельзя направить все спины в одну сторону. В результате видно, что получаем два некомпенсированных спина. Значит, основной терм будет триплетом. Помимо этого результирующий орбитальный момент равен:
[L=1.]
В качестве основного терма имеем:
[{}^3{P.}]
Применим правило Ланде, учтем, что p — подоболочка заселена более чем на $frac{1}{2}$, получим основное состояние:
[{{}^3P}_2.]
Ответ: Основной терм кислорода – ${}^3{P,} $основное состояние – ${{}^3P}_2.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Электронная конфигурация атома
Электронная конфигурация атома – это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может
превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов – 16й элемент периодической
системы. Золото имеет 79 протонов – 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются
квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин “орбиталь”, орбиталь – это волновая функция электрона,
грубо – это область, в которой электрон проводит 90% времени.
N – уровень
L – оболочка
Ml – номер орбитали
Ms – первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число – это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.

На s-оболочке одна орбиталь (L=0) – два электрона
На p-оболочке три орбитали (L=1) – шесть электронов
На d-оболочке пять орбиталей (L=2) – десять электронов
На f-оболочке семь орбиталей (L=3) – четырнадцать электронов
Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали “-1”, “0” и “1”.
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять
электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0,
Ml=1,Ml=2.
Спиновое квантовое число ms
Спин – это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число
имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с
противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число – это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона

Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0,
магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни
и цветом разделены подуровни:
| 1 | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
| 8 | |||||||||||||||||||
| Таблица 1. Распределение электронов по энергетическим уровням |
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у
24Cr,
29Cu,
41Nb,
42Mo,
44Ru,
45Rh,
46Pd,
47Ag,
78Pt,
79Au
Элементы
Проверьте себя, составьте электронную конфигурацию для элементов #5, #12 и #16, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов |
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье
«как написать электронную конфигурацию»
Квантовые числа электронов в атомах
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
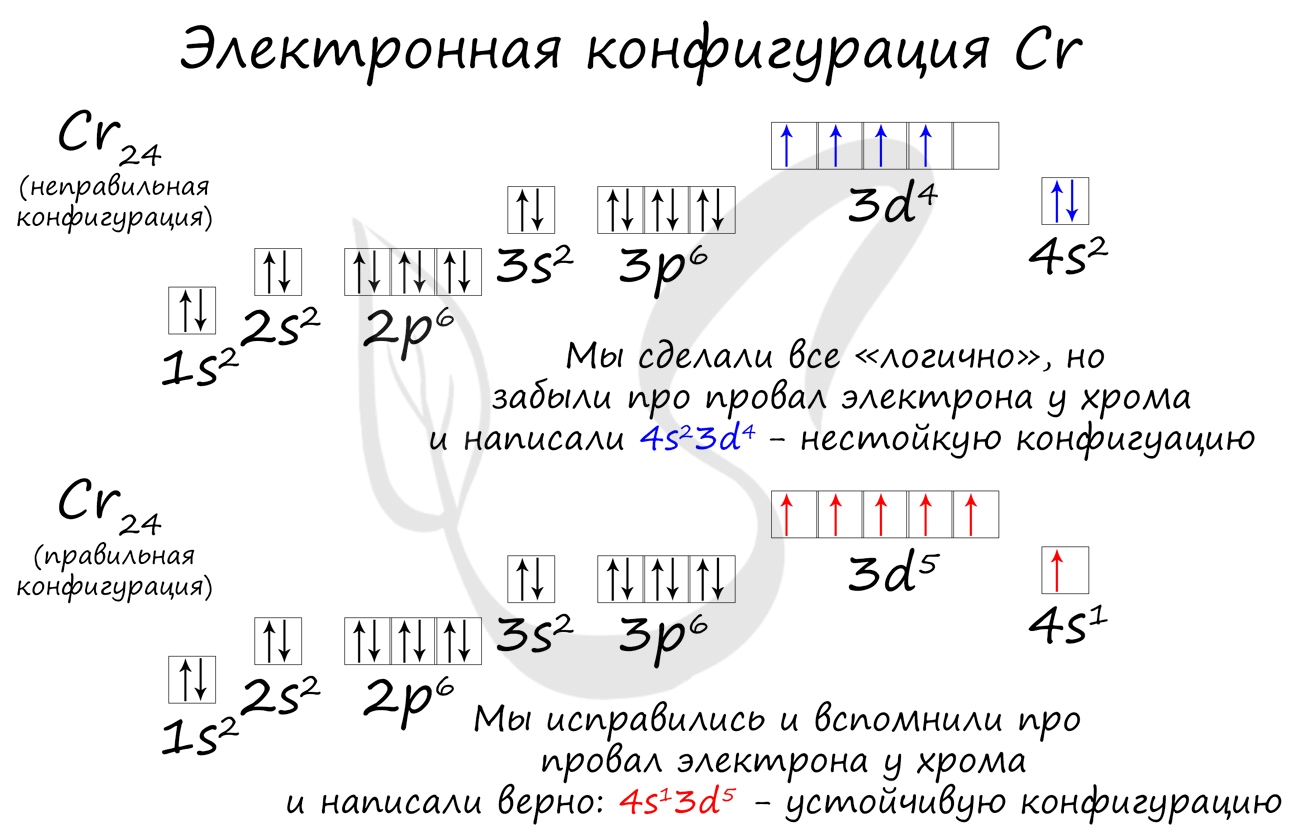
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
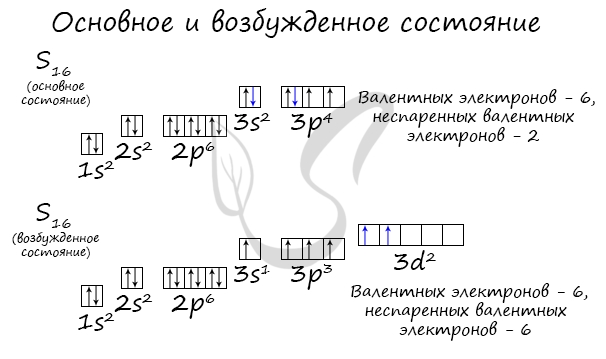
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Имеем электронную конфигурацию npn’ p (здесь n ≠ n’ ). Для того, что определить термы этой конфигурации мыдолжны определить возможные значения полного орбитального и полного спиновогомомента совокупности электронов. В рассматриваемом случае по правилам сложениямомента имеем: L = 0,1,2 и S = 0,1 , т.е. реализуются следующие термы1S , 1 P, 1D,(11.20)S , 3 P, 3 D.Полученный результат можно записать короче: 1 SPD, 3 SPD , или так 1,3 SPD . Итак, врассматриваемой конфигурации существует шесть термов, характеризующихся различными значениями энергии.Случай двух эквивалентных электронов – конфигурация np 2 . Казалось бы, можно действовать как раньше, и написать тот же ответ.
Однако, необходимо помнить пропринцип Паули: оба электрона не могут иметь совпадающие наборы квантовых чисел. Вслучае неэквивалентных электронов главные квантовые числа принимают различныезначения. Поэтому при определении возможных значений L и S принцип Паули автоматически соблюдается. Сейчас ситуация другая – квантовые числа n и l обоих электронов совпадают. Значит, при построении термов необходимо учесть невозможностьсовпадения квантовых чисел ml и m s обоих атомных электронов.
Это приводит к тому,что часть термов, которые мы нашли в конфигурации npn’ p , не реализуется в конфигурации np 2 . Оказывается из шести термов (11.20) реализуются только три 1 S , 1 D, 3 P .Остальные, в конечном счете, противоречат принципу Паули, или принципу тождественности микрочастиц. Более подробно этот вопрос рассмотрен в Приложении 7. Там жерассматривается построение волновых функций термов конфигураций из двух эквивалентных и двух неэквивалентных p электронов.3Тонкая структура терма.
Состояния.Вспомним теперь о спин – орбитальном взаимодействии в атоме. Это взаимодействие приводит к появлению тонкой структуры терма: терм расщепляется на группу состояний – мультиплет, число компонентов которого определяется числом возможных147148rrориентаций векторов L и S в пространстве, то есть числом возможных значений квантового числа J , задающего величину механического момента всей электронной оболочки атома.
Таким образом, терм в заданной конфигурации – это совокупность состояний сзаданными значениями L и S . Для обозначения состояния многоэлектронного атомапринято следующее обозначение2 S +1LJ .Например, в конфигурации npn’ p возможны следующие состояния1S 0 , 1 P1 , 1D2 , 3 S1 , 3 P0,1, 2 , 3 D1, 2,3 .(11.21)Полное число состояний, принадлежащих конфигурации, оказалось равно десяти.Легко видеть, что число состояний в терме есть min ((2 S + 1), (2 L + 1) ) . В случаеL ≥ S их 2 S + 1 , то есть мультиплетность указывает число компонент мультиплета, например, термы 3 P и 3 D действительно состоят из трех компонент. В противоположномслучае L ≤ S число компонент терма равно 2 L + 1 и не совпадает с мультиплетностью.Например, терм 3 S , хотя и называется триплетным, но состоит всего из одной компоненты.
Что касается синглетных термов, то они всегда состоят из единственной компоненты, то есть для них понятия терма и состояния совпадают.Иногда введенные нами обозначения состояний многоэлектронного атома используют и для атома водорода и других одноэлектронных атомов (например, атомовщелочных металлов), указывая еще и значение главного квантового числа. Например,основное состояние атома водорода можно обозначить так: 12 S1 2 . Следует отметить, чтотакое обозначение несет избыточную информацию: мультиплетность одноэлектроннойсистемы всегда равна двум.Правило интервалов Ланде.Рассмотрим теперь тонкую структуру терма чуть более подробно. По аналогии сатомом водорода оператор спин – орбитального взаимодействия можно записать в видеrˆ rˆVˆ = A( LS ) ,(11.22)LSгде A – константа связи, являющаяся на самом деле некоторым оператором в пространстве радиальных волновых функций многоэлектронного атома.
Используя теорему косинусов, перепишем оператор (11.22) в видеA ˆ 2 ˆ2 ˆ 2VˆLS =J −L −S .2Учитывая, что квантовые числа L , S и J задают точно определенные значения орбитального спинового и полного механического момента атома, то вычисляя матричныйэлемент от оператора спин – орбитального взаимодействия получимAE J = (J ( J + 1) − L( L + 1) − S ( S + 1) ) .(11.23)2Тогда расстояние между соседними компонентами мультиплета определяется какδE J = E J − E J −1 = AJ .(11.24)5Последнее соотношение называют правилом интервалов Ланде , а сам мультиплет нормальным (если A > 0 ) и обращенным (при A < 0 ).В качестве примера рассмотрим тонкую структуру терма 3 P , состоящего из трехсостояний ( J = 0,1,2 ).
С учетом правила Ланде получаем ( E 2 − E1 ) ( E1 − E 0 ) = 2 1 . Сама(5A.Lande (1888-1975) – немецкий физик – теоретик.)148149картина расщепления для нормального и обращенного мультиплетов, показывающая положение состояний относительно несмещенного терма, приведена на рис.11.4. Экспериментальные данные по мультиплетному расщеплению могут быть использованы для определения константы связи в энергии спин – орбитального взаимодействия6.Приближения LS и jj связей.До сих пор мы предполагали, что электростатическое взаимодействие электроновв атоме значительно больше спин-орбитального взаимодействия. Именно возможностьне учитывать спин – орбитальное взаимодействие позволило ввести термы, в которыхвеличины квадратов орбитального и спинового моментовсовокупности атомных электронов могут быть определены точно.
Эти орбитальный и спиновый моменты совокупности атомных электронов определяются какrrrrL = ∑ l i , S = ∑ si .iiОднако такая схема построения атомных термов(ее называют приближением LS- связи7) реализуется невсегда. Для того чтобы убедиться в этом, сравним по порядку величины энергии электростатического и спин –орбитального взаимодействия электронов в атоме. Действительно, при расчете энергии электростатического взаимодействия электронов в атомегелия мы видели, что эта величинаE ee ~ ZRy .(11.25)Линейная зависимость от заряда ядра связана с тем, что с увеличением Z радиусы электронных орбит уменьшаются, т.е.
электроны оказываются ближе друг к другу. С другойстороны, при вычислении энергии спин – орбитального взаимодействия в атоме мы получилиE LS ~ Z 4 α 2 Ry .(11.26)Сравнивая (11.25) и (11.26), находим, что приZ ≥ Z * ≅ α −2 3 ≅ 27энергия спин – орбитального взаимодействия уже больше, чем энергия электростатического взаимодействия. Значит, в таком случае при изучении строения электронной оболочки атома надо сначала учитывать спин – орбитальное взаимодействие, а уже затем –электростатическое. Сделанная нами оценка справедлива для гелиеподобного иона, содержащего всего два электрона. В многоэлектронных системах за счет частичной экранировки ядра электронами внутренних оболочек энергия спин – орбитального взаимодействия оказывается меньше оцененной нами величины.
Однако, можно утверждать,что и в тяжелых многоэлектронных атомах спин – орбитальным взаимодействие уженельзя рассматривать как малую поправку к атомному гамильтониану.Рассмотрим поэтому другой способ построения атомных термов, который реализуется при E LS >> E ee . В этом случае энергией электростатического взаимодействия6Следует иметь в виду, что задача о вычислении энергии спин – орбитального взаимодействия на самомделе является значительно более сложной.
Помимо собственно энергии взаимодействия спинового и орбитального моментов электронов надо принять учитывать также взаимодействия типа «спин – спин» и«спин – чужая орбита». Соответствующие этим взаимодейтсвиям операторы должны быть добавлены квырпажению (11.22). Эти слагаемые, оказывается, наиболее существенны для легких атомов.
Более подробно см. И.И.Собельмпн, «Введение в телорию атомных спектров», М. Наука, (1977), §19.7Говорят также о нормальной связи, или о связи Рессела – Саундерса.149150атомных электронов можно пренебречь. Тогда состояние каждого из электронов конфигурации характеризуется квантовыми числами j, m j . В случае если заданы значенияквантового числа j всей совокупности атомных электронов в заданной конфигурации( j = 1,…, N ), то говорят, что задан атомный терм в приближении jj – связи. Этот термпринято обозначать так{ j1 ,.., j N }.Последующий учет электростатического взаимодействия электронов ведет к расщеплению терма на группу состояний, число которых определяется количеством значенийквантового числа J , задающего возможные значения полного механического моментаэлектронной оболочки атомаrrJ = ∑ ji .iСостояние в приближении jj – связи принято обозначать так{ j1 ,.., j N }J .В качестве примера определения возможных термов и состояний в схеме jj – связи рассмотрим следующие конфигурации.Пусть имеется гелиеподобный ион, электронная конфигурация которогоесть 1snp .
В приближении LS – связи (как мы видели это приближение справедливо дляне слишком больших Z ) в этой конфигурации имеются термы1P , 3Pи состояния13P1 ,P0,1, 2 .Триплетный терм состоит из трех состояний, для синглета понятия терма и состояниятождественны.В случае тяжелых систем (например, гелиеподобный ион урана U 90+ ) расчетэнергий и волновых функций системы в той же конфигурации 1snp должен проводитьсяв приближении jj связи.
Вычисляя моменты j каждого их электронов, найдем j1 = 1 2 ,j 2 = 1 2 ,3 2 . Поэтому имеем в этом приближении следующие термы⎧1 1 ⎫ ⎧1 3 ⎫⎨ , ⎬, ⎨ , ⎬⎩2 2⎭ ⎩2 2⎭и состояния⎧1 1 ⎫⎧1 3 ⎫⎨ , ⎬ , ⎨ , ⎬ .⎩ 2 2 ⎭ 0,1 ⎩ 2 2 ⎭1, 2Как видно, полное число состояний в конфигурации не зависит от вида используемогоприближения.Рассмотрим еще один пример. Пусть имеется конфигурация из двух неэквивалентных p – электронов. Требуется определить термы и состояния в приближении jj связи. Для решения этой задачи поступим следующим образом. Определим возможныезначения полных механических моментов каждого из электронов: j1 = 1 2 , 3 2 ,j 2 = 1 2 , 3 2 . Поэтому получаем следующие термы⎧1 1 ⎫ ⎧1 3 ⎫ ⎧3 1 ⎫ ⎧3 3⎫⎨ , ⎬, ⎨ , ⎬, ⎨ , ⎬, ⎨ , ⎬.⎩2 2⎭ ⎩2 2⎭ ⎩2 2⎭ ⎩2 2⎭Этим термам соответствуют следующие состояния150151⎧1 1 ⎫⎧1 3 ⎫⎧3 1⎫⎧3 3⎫.⎨ , ⎬ ,⎨ , ⎬ ,⎨ , ⎬ ,⎨ , ⎬⎩ 2 2 ⎭ 0,1 ⎩ 2 2 ⎭1, 2 ⎩ 2 2 ⎭1, 2 ⎩ 2 2 ⎭ 0,1, 2,3Полное число состояний в конфигурации равно десяти и не зависит от схемы построения термов (см.
