Как определить тип химической связи?
Домашние заданияХимические связи
Анонимный вопрос
23 декабря 2018 · 237,3 K
Люблю простые слова для вещей, toki pona. · 8 февр 2019
Алгоритм такой: смотрим на атомы вещества, если они одинаковы, далее два варианта, если элемент, образующий вещество — металл (Na, Al), связь металлическая, если — неметалл, ковалентная неполярная (O2, J2).
Если атомы вещества различны, то выбор будет между ионной связью (когда электроотрицательность элементов очень далека друг от друга (>= 1,7), например, металл и неметалл, NaCl) и ковалентной полярной (когда электроотрицательность элементов близка (HCl).
Кроме того атомы водорода одой молекулы могут образовывать связь с неподелённой парой электронов другой молекулы, если эта пара принадлежит весьма электроотрицательному элементу (H-F, H20). Кстати, именно из-за этой связи, вода плотнее льда и зимой насквозь реки не промерзают.
136,4 K
не понятно что ты понаписал тут
Комментировать ответ…Комментировать…
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас активно… · 7 февр 2019
Типов всего три – ионная – металл и неметалл, неполярная (атомы одного неметалла) и полярная (атомы разных неметаллов) ковалентные связи, при определении можно пользоваться простой таблицей Читать далее
43,3 K
Комментировать ответ…Комментировать…
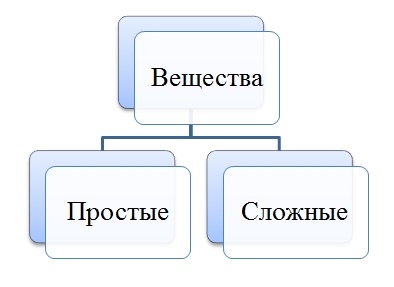
Как определять простые и сложные вещества
Задания на классификацию простых и сложных веществ имеют место быть не только в курсе химии, но и в школьной программе по природоведению. Помимо этого, такие вопросы иногда могут задавать дети даже младшего школьного возраста, которым приходится давать доступный для их восприятия ответ.
Инструкция
Вещество – это то, из чего состоит физическое тело. То есть, например, мел состоит из известняка, золотое кольцо имеет в составе золото, а гвоздь сделан из металла – железа. Все вещества разделяются на сложные и простые, которые достаточно легко классифицировать по химической формуле.
Каждое соединение имеет собственную формулу, которая состоит из химических символов и индексов. Индексы показывают число атомов данного элемента, входящего в состав простого или сложного соединения. Некоторые вещества состоят из одного вида атомов и не имеют индексов, например натрий Na, сера S, кремний Si. Другие вещества – напротив, состоят из нескольких разных элементов, причем их число, определяемое с помощью индексов, может быть различным. Например, карбонат кальция CaСO3, нитрат меди Cu(NO3)2, сульфат алюминия Al2(SO4)3.
Чтобы распознать, какое вещество – простое или сложное, необходимо проанализировать его химическую формулу. Если она состоит только из одного вида атомов какого-либо химического элемента, то это вещество простое. Количество атомов может быть различным. Например, вещества, состоящие из одного вида химического элемента и имеющие один атом (индексы отсутствуют) – это литий Li, натрий Na, кальций Ca, железо Fe, марганец Mn. К соединениям, имеющим в своем составе один вид химического элемента, но несколько его атомов (справа стоит индекс, показывающий это число), можно отнести азот N2, кислород O2, озон O3, водород H2, хлор Cl2.
Сложными называются вещества, которые состоят из нескольких видов химических элементов. Причем у некоторых соединений нет индексов, например у таких как, бромоводородная кислота HBr, хлорид натрия (поваренная соль) NaCl, оксид бария BaO. У других сложных соединений имеются разные индексы. К ним можно отнести: азотную кислоту HNO3, гидроксид меди Cu(OН)2, ортофосфат калия K3PO4 и подавляющее большинство веществ в природе.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С – алмаз, графит, карбин, фуллерен.
- O – кислород, озон.
- S – ромбическая, моноклинная, пластическая.
- P – белый, красный, чёрный.
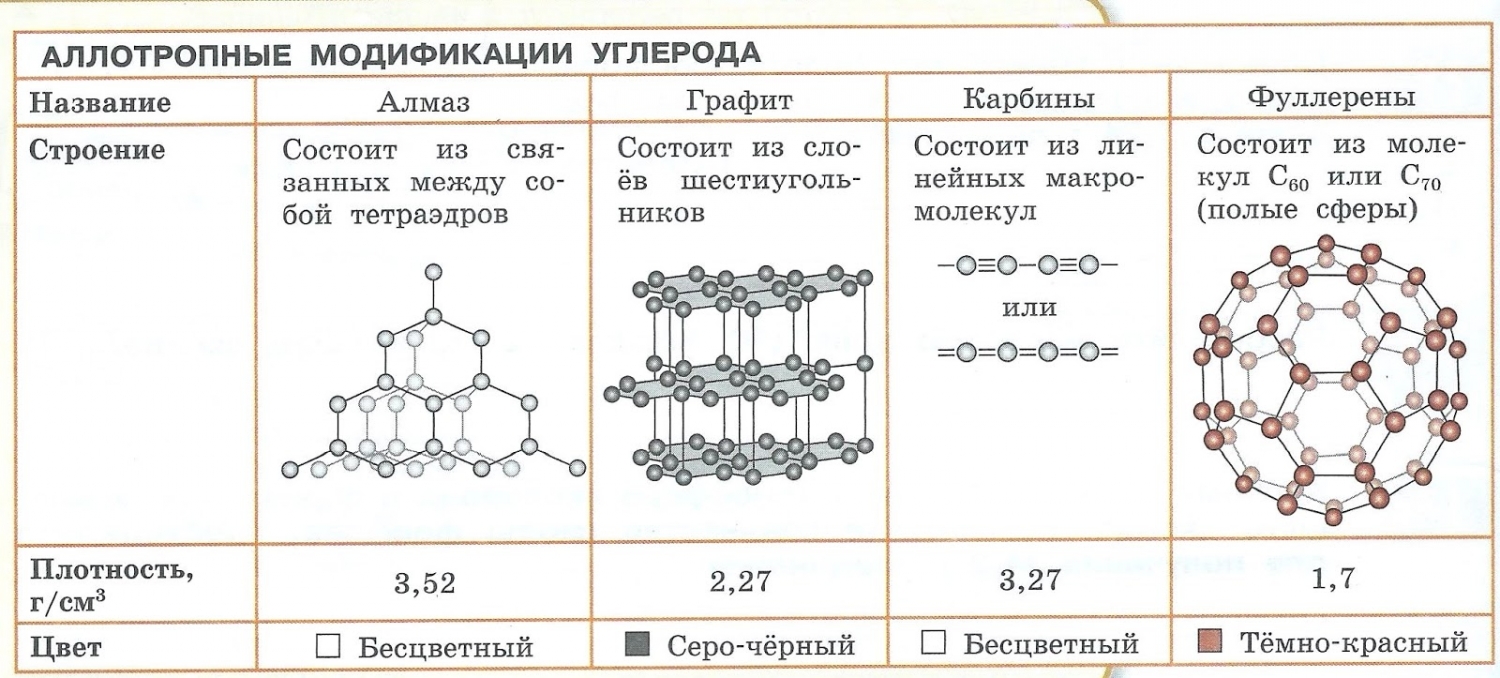
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
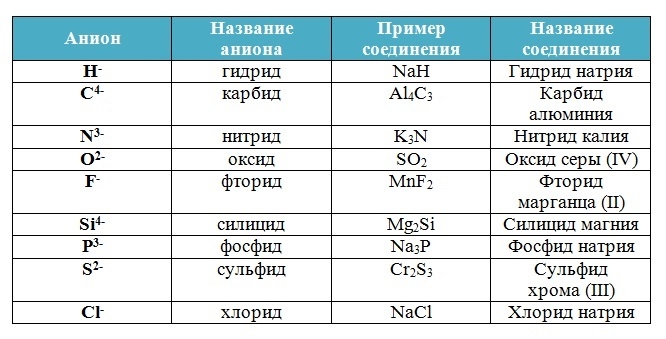
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
BH3 — боран
B2H6 — диборан
CH4 — метан
SiH4 — силан
NH3 — аммиак
PH3 — фосфин
AsH3 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — H2SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — H2CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
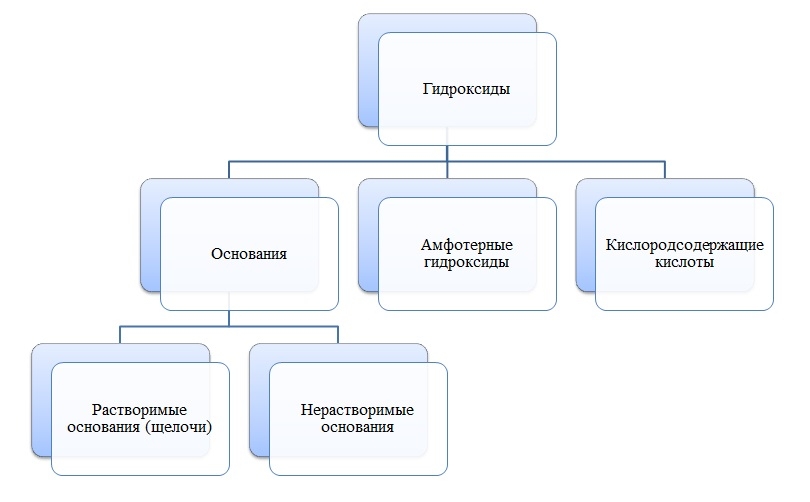
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
- Me – металл
- Ac – кислотный остаток
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
|
Соляная (хлороводородная) |
HCl | Хлорид | Cl(-) |
|
Плавиковая (фтороводородная) |
HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S |
Сульфид Гидросульфид |
S(2-) HS(-) |
| Сернистая | H2SO3 |
Сульфит Гидросульфит |
SO3(2-) HSO3(-) |
| Серная | H2SO4 |
Сульфат Гидросульфат |
SO4(2-) HSO4(-) |
| Угольная | H2CO3 |
Карбонат Гидрокарбонат |
СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
3.3. Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная).
Классификация органических веществ
В зависимости от типа строения углеродной цепи органические вещества подразделяют на:
- ациклические и циклические.
- предельные (насыщенные) и непредельные (ненасыщенные).
- карбоциклические и гетероциклические.
- алициклические и ароматические.

Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы и все атомы углерода соединены друг с другом в прямые или разветвленные открытые цепи.
В свою очередь среди ациклических соединений выделяют предельные (или насыщенные), которые содержат в углеродном скелете только одинарные углерод-углеродные (С-С) связи и непредельные (или ненасыщенные), содержащие кратные — двойные (С=С) или тройные (С≡С) связи.
Циклические соединения — химические соединения, в которых присутствует три или более связанных атомов, образующие кольцо.
В зависимости от того, какими атомами образованы циклы различают карбоциклические соединения и гетероциклические соединения.
Карбоциклические соединения (или изоциклические) содержат в своих циклах только атомы углерода. Эти соединения в свою очередь делятся на алициклические соединения (алифатические циклические) и ароматические соединения.
Гетероциклические соединения содержат в составе углеводородного цикла один или несколько гетероатомов, чаще всего которыми являются атомы кислорода, азота или серы.
Простейшим классом органических веществ являются углеводороды – соединения, которые образованы исключительно атомами углерода и водорода, т.е. формально не имеют функциональных групп.
Поскольку углеводороды, не имеют функциональных групп для них возможна только классификация по типу углеродного скелета. Углеводороды в зависимости от типа их углеродного скелета делят на подклассы:
1) Предельные ациклические углеводороды носят название алканы. Общая молекулярная формула алканов записывается как CnH2n+2, где n — количество атомов углерода в молекуле углеводорода. Данные соединения не имеют межклассовых изомеров.
2) Ациклические непредельные углеводороды делятся на:
а) алкены — в них присутствует только одна кратная, а именно одна двойная C=C связь, общая формула алкенов CnH2n,
б) алкины – в молекулах алкинов также присутствует только одна кратная, а именно тройная С≡С связь. Общая молекулярная формула алкинов CnH2n-2
в) алкадиены – в молекулах алкадиенов присутствуют две двойные С=С связи. Общая молекулярная формула алкадиенов CnH2n-2
3) Циклические предельные углеводороды называются циклоалканы и имеют общую молекулярную формулу CnH2n.
Остальные органические вещества в органической химии рассматривают как производные углеводородов, образуемые при введении в молекулы углеводородов так называемых функциональных групп, которые содержат другие химические элементы.
Таким образом, формулу соединений с одной функциональной группой можно записать как R-X, где R – углеводородный радикал, а Х – функциональная группа. Углеводородным радикалом называют фрагмент молекулы какого-либо углеводорода без одного или нескольких атомов водорода.
По наличию тех или иных функциональных групп соединения подразделяют на классы. Основные функциональные группы и классы соединений, в состав которых они входят, представлены в таблице:

Таким образом, различные комбинации типов углеродных скелетов с разными функциональными группами дают большое разнообразие вариантов органических соединений.
Галогенпроизводные углеводородов
Галогенпроизводными углеводородов называют соединения, получаемые при замене одного или нескольких атомов водорода в молекуле какого-либо исходного углеводорода на один или несколько атомов какого-либо галогена соответственно.
Пусть некоторый углеводород имеет формулу CnHm, тогда при замене в его молекуле X атомов водорода на X атомов галогена формула галогенпроизводного будет иметь вид CnHm-XHalX. Таким образом, монохлорпроизводные алканов имеют формулу CnH2n+1Cl, дихлорпроизводные CnH2nCl2 и т.д.
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Альдегиды и кетоны
Альдегидами называют производные углеводородов, у которых при первичном атоме углерода два атома водорода заменены на один атом кислорода, т.е. производные углеводородов в структуре которых имеется альдегидная группа –СН=О. Общую формулу альдегидов можно записать как R-CH=O. Например:
Кетонами называют производные углеводородов, у которых при вторичном атоме углерода два атома водорода заменены на атом кислорода, т.е. соединения, в структуре которых есть карбонильная группа –C(O)-.
Общая формула кетонов может быть записана как R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными.
Например:
Как можно заметить, альдегиды и кетоны весьма схожи по строению, однако их все-таки их различают как классы, поскольку они имеют существенные различия в химических свойствах.
Общая молекулярная формула предельных кетонов и альдегидов одинакова и имеет вид CnH2nO
Карбоновые кислоты
Карбоновыми кислотами называют производные углеводородов, в которых есть карбоксильная группа –COOH.
Если кислота имеет две карбоксильные группы, такую кислоту называют дикарбоновой кислотой.
Предельные монокарбоновые кислоты (с одной группой -COOH) имеют общую молекулярную формулу вида CnH2nO2
Ароматические монокарбоновые кислоты имеют общую формулу CnH2n-8O2
Простые эфиры
Простые эфиры – органические соединения, в которых два углеводородных радикала опосредованно соединены через атом кислорода, т.е. имеют формулу вида R-O-R’. При этом радикалы R и R’ могут быть как одинаковыми, так и разными.
Например:
| CH3-O-CH3 | CH3-O-C2H5 |
| диметиловый эфир | метилэтиловый эфир |
Общая формула предельных простых эфиров такая же, как у предельных одноатомных спиртов, т.е. CnH2n+1OH или CnH2n+2О.
Сложные эфиры
Сложные эфиры – класс соединений на основе органических карбоновых кислот, у которых атом водорода в гидроксильной группе замещен на углеводородный радикал R. Фомулу сложных эфиров в общем виде можно записать как:
Например:
Нитросоединения
Нитросоединения – производные углеводородов, у которых один или несколько атомов водорода заменены на нитрогруппу –NO2.
Предельные нитросоединения с одной нитрогруппой имеют общую молекулярную формулу CnH2n+1NO2
Аминокислоты
Соединения, имеющие в своей структуре одновременно две функциональные группы – амино NH2 и карбоксильную – COOH. Например,
NH2-CH2-COOH
Предельные аминокислоты с одной карбоксильной и одной аминогруппой изомерны соответствующим предельными нитросоединениям т.е. как и они имеют общую молекулярную формулу CnH2n+1NO2
В заданиях ЕГЭ на классификацию органических веществ важно уметь записывать общие молекулярные формулы гомологических рядов разных типов соединений, зная особенности строения углеродного скелета и наличия тех или иных функциональных групп. Для того, чтобы научиться определять общие молекулярные формулы органических соединений разных классов, будет полезен материал по этой теме.
Номенклатура органических соединений
Особенности строения и химических свойств соединений находят отражение в номенклатуре. Основными типами номенклатуры считаются систематическая и тривиальная.
Систематическая номенклатура фактически прописывает алгоритмы, в соответствии с которыми то или иное название составляется в строгом соответствии с особенностями строения молекулы органического вещества или, грубо говоря, его структурной формулы.
Рассмотрим правила составления названий органических соединений по систематической номенклатуре.
При составлении названий органических веществ по систематической номенклатуре наиболее важным является правильно определить число атомов углерода в наиболее длинной углеродной цепи или посчитать число атомов углерода в цикле.
В зависимости от количества атомов углерода в основной углеродной цепи, соединения, будут иметь в своем названии различный корень:
|
Количество атомов С в главной углеродной цепи |
Корень названия |
|
1 |
мет- |
|
2 |
эт- |
|
3 |
проп- |
|
4 |
бут- |
|
5 |
пент- |
|
6 |
гекс- |
|
7 |
гепт- |
|
8 |
окт- |
|
9 |
нон- |
|
10 |
дек(ц)- |
Вторая важная составляющая, учитываемая при составлении названий, — наличие/отсутствие кратных связей или функциональной группы, которые перечислены в таблице выше.
Попробуем дать название веществу, имеющему структурную формулу:
1. В главной (и единственной) углеродной цепи данной молекулы содержится 4 атома углерода, поэтому название будет содержать корень бут-;
2. В углеродном скелете отсутствуют кратные связи, следовательно, суффикс, который нужно использовать после корня слова будет -ан, как и у соответствующих предельных ациклических углеводородов (алканов);
3. Наличие функциональной группы –OH при условии, что нет более старших функциональных групп добавляет после корня и суффикса из п.2. еще один суффикс – «ол»;
4. В молекулах содержащих кратные связи или функциональные группы, нумерация атомов углерода главной цепи начинается с той стороны молекулы, к которой они ближе.
Рассмотрим еще один пример:
Наличие в главной углеродной цепи четырех атомов углерода говорит нам о том, что основой названия является корень «бут-», а отсутствие кратных связей говорит о суффиксе «-ан», который будет следовать сразу после корня. Старшая группа в данном соединении – карбоксильная, она и определяет принадлежность этого вещества к классу карбоновых кислот. Следовательно, окончание у названия будет «-овая кислота». При втором атоме углерода находится аминогруппа NH2—, поэтому данное вещество относится к аминокислотам. Также при третьем атоме углерода мы видим углеводородный радикал метил (CH3—). Поэтому по систематической номенклатуре данное соединение называется 2-амино-3-метилбутановая кислота.
Тривиальная номенклатура, в отличие от систематической, как правило, не имеет связи со строением вещества, а обусловлена по большей части его происхождением, а также химическими или физическими свойствами.
| Формула | Название по систематической номенклатуре | Тривиальное название |
| Углеводороды | ||
| CH4 | метан | болотный газ |
| CH2=CH2 | этен | этилен |
| CH2=CH-CH3 | пропен | пропилен |
| CH≡CH | этин | ацетилен |
| CH2=CH-CH= CH2 | бутадиен-1,3 | дивинил |
| 2-метилбутадиен-1,3 | изопрен | |
| метилбензол | толуол | |
| 1,2-диметилбензол | орто-ксилол (о-ксилол) |
|
| 1,3-диметилбензол | мета-ксилол (м-ксилол) |
|
| 1,4-диметилбензол | пара-ксилол (п-ксилол) |
|
| винилбензол | стирол | |
| Спирты | ||
| CH3OH | метанол | метиловый спирт, древесный спирт |
| CH3CH2OH | этанол | этиловый спирт |
| CH2=CH-CH2-OH | пропен-2-ол-1 | аллиловый спирт |
| этандиол-1,2 | этиленгликоль | |
| пропантриол-1,2,3 | глицерин | |
| фенол (гидроксибензол) |
карболовая кислота | |
| 1-гидрокси-2-метилбензол | орто-крезол (о-крезол) |
|
| 1-гидрокси-3-метилбензол | мета-крезол (м-крезол) |
|
| 1-гидрокси-4-метилбензол | пара-крезол (п-крезол) |
|
| фенилметанол | бензиловый спирт | |
| Альдегиды и кетоны | ||
| метаналь | формальдегид | |
| этаналь | уксусный альдегид, ацетальдегид | |
| пропеналь | акриловый альдегид, акролеин | |
| бензальдегид | бензойный альдегид | |
| пропанон | ацетон | |
| Карбоновые кислоты | ||
| метановая кислота | муравьиная кислота (соли и сложные эфиры — формиаты) |
|
| этановая кислота | уксусная кислота
(соли и сложные эфиры — ацетаты) |
|
| пропановая кислота | пропионовая кислота (соли и сложные эфиры — пропионаты) |
|
| C15H31COOH | гексадекановая кислота | пальмитиновая кислота (соли и сложные эфиры — пальмитаты) |
| C17H35COOH | октадекановая кислота | стеариновая кислота (соли и сложные эфиры — стеараты) |
| пропеновая кислота | акриловая кислота (соли и сложные эфиры — акрилаты) |
|
| HOOC-COOH | этандиовая кислота | щавелевая кислота (соли и сложные эфиры — оксалаты) |
| 1,4-бензолдикарбоновая кислота | терефталевая кислота | |
| Сложные эфиры | ||
| HCOOCH3 | метилметаноат | метилформиат, метиловый эфир мурвьиной кислоты |
| CH3COOCH3 | метилэтаноат | метилацетат, метиловый эфир уксусной кислоты |
| CH3COOC2H5 | этилэтаноат | этилацетат, этиловый эфир уксусной кислоты |
| CH2=CH-COOCH3 | метилпропеноат | метилакрилат, метиловый эфир акриловый кислоты |
| Азотсодержащие соединения | ||
| аминобензол, фениламин |
анилин | |
| NH2-CH2-COOH | аминоэтановая кислота | глицин, аминоуксусная кислота |
| 2-аминопропионовая кислота | аланин |
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
Химические вещества можно разделить на две группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к какой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 31, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.


Основные классы сложных веществ — это оксиды, гидроксиды, соли.

Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Солеобразующим оксидам соответствуют гидроксиды:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.

Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.

Взаимосвязь оксидов и гидроксидов:

Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и разлагающиеся в воде.

К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).

Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из водорода H+ и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы: одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.

По содержанию атомов кислорода кислоты бывают бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).

Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3 — распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4]Cl2).

Помимо основных классов неорганических соединений, существуют и другие.
Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.

Тренировочный тест «Классификация неорганических веществ» 10 вопросов, при каждом прохождении новые.
238
Создан на
02 февраля, 2022 От Admin

Классификация неорганика
1 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) одноосновной кислоте,
Б) амфотерному оксиду,
В) щёлочи.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
2 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) солеобразующего оксида;
Б) двойной соли;
В) нерастворимого основания.

Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
3 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) нерастворимой соли,
В) одноосновной кислоте.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
4 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) нерастворимой соли,
В) одноосновной кислоте.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
5 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) средней соли,
Б) кислотному оксиду,
В) двухосновной кислоте.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
6 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) средней соли,
В) амфотерному гидроксиду.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
7 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) сильной кислоты;
Б) оксида;
В) основной соли.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
8 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) основного оксида;
Б) соли;
В) щёлочи.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
9 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) кислой соли,
В) амфотерному гидроксиду.

Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
10 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) кислотного оксида;
Б) кислой соли;
В) двухкислотного основания.

Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Ваша оценка
The average score is 57%
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)

