Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.

Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.

Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:

Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:

Титр связан и с массовой долей растворенного вещества:

Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?

Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.

Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.

Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.

Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?

Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?

Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.

Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

![]() Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
Концентрацию
растворов, применяемых в титриметрии,
выражают не только через моль-экв/л
(нормальность), но и через титр раствора
(![]()
)
и титр по определяемому веществу
(![]()
).
Эти концентрации более удобны, так как
непосредственно позволяют вычислять
массу определяемого компонента по
результатам титрования. Формулы,
приведенные в стандартных методиках
титриметрического анализа, предназначенных
для большого числа однотипных измерений,
содержат значение титра по определяемому
веществу
![]()
.
Титр вещества
![]()
или простой
Титр вещества
показывает содержание компонента
А, выраженное в граммах, в 1
мл его раствора и вычисляется по
формуле:
![]()
=
![]()
(4.8)
где
![]()
– масса вещества А (г) в растворе с
объемом
![]()
(мл),
– его титр в г/мл.
Иногда титр для
удобства в расчетах выражают в мг/мл.
Через простой титр легко рассчитать
молярную концентрацию (молярность) или
молярную концентрацию эквивалента
(нормальность) раствора, подставив туда
выражение массы вещества через титр.
![]()
и
![]()
(4.9)
Пример. Пусть
в растворе соли, объемом 250 см3
содержится 0,5 г
![]()
.
Определить титр и нормальность такого
раствора.
Исходя из формул
(4.8) и (4.9), Т(Na2CO3)
= 0,005/250 =
![]()
(г/мл),
а нормальность:
![]()
=
![]()
1000/53
=
![]()
(моль-экв/л), где 53 – молярная масса
эквивалента
(г-экв/моль).
Титр по
определяемому веществу
![]()
(условный)
Титр по определяемому
веществу
или условный показывает какое
количество вещества А (г)
эквивалентно массе титранта В,
которая содержится в 1 мл раствора
титранта В. Так как масса
титруемого вещества А и объем раствора
В относятся к разным веществам, то
размерность такого титра не указывается.
Титр по определяемому веществу
(условный) позволяет вычислить какое
количество вещества А в
граммах титруется 1-м миллилитром
титранта В.
=
![]()
(4.10)
Между титрами Т(В)
и
существует простая связь, вытекающая
из закона эквивалентов. Ее легко получить,
учитывая, что
m(В)
=
![]()
и m(А) =![]()
,
где V(B)
в мл – объем раствора В, пошедший
на реакцию (титрование) с веществом А;
m(В) – масса вещества
реагента В (титранта), m(А)
– масса вещества А, эквивалентная
массе реагента В в его растворе
объемом V(B).
![]()
или
![]()
(4.11)
Тогда молярная
концентрация эквивалента (нормальность)
раствора В через значение
может быть определена как:
![]()
(4.12)
Если для рабочего
раствора В известно значение
,
то масса определяемого компонента А
(г) в пробе объемом
![]()
легко вычисляется по объему раствора
титранта
![]()
,
израсходованному на титрование аликвоты
:
![]()
(4.13)
4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
В титриметрии
используют растворы, концентрация
которых установлена каким-либо способом
с высокой степенью точности. Такие
растворы называют стандартными
титрованными или просто
титрованными. Растворы
классифицируют по назначению и по
способу установления их концентрации.
По назначению
их условно делят на рабочие растворы
и растворы стандартов (первичные
и вторичные).
Рабочими
называют растворы, которые используются
непосредственно в анализе при определении
содержания вещества. Если рабочий
раствор не относится к стандартным, то
его необходимо отстандартизировать
непосредственно перед выполнением
анализа, так как концентрация в
процессе хранения могла существенно
измениться. Точную концентрацию рабочего
раствора находят путем титрования
стандартного раствора или установочных
веществ (метод точных навесок). Это
касается, например, таких рабочих
растворов, как: NaOH,
Na2S2O35H2O.
Под стандартным
раствором понимают такой титрованный
раствор, который устойчиво сохраняет
свою концентрацию при длительном
хранении. Основное назначение
стандартных растворов
определение точной концентрации рабочих
и иных растворов, применяемых в титровании.
Процесс установления
точной концентрации раствора путем его
титрования по стандарту называется
стандартизацией.
По способу
определения концентрации различают
первичные стандарты или
растворы с приготовленным титром и
стандартизированные растворы.
Стандартизированные
растворы это
такие растворы, концентрация которых
устанавливается по стандарту и заранее
не может быть точно определена. К ним
относятся растворы кислот, щелочей,
гидролизующихся и гигроскопичных солей,
а также веществ, которые могут реагировать
с атмосферным кислородом и углекислотой.
Известно множество способов
приготовления стандартизированных
растворов. Наиболее часто для этой цели
применяют: приготовление по приближенной
навеске (щелочи, соли), методы разбавления
или смешения растворов (кислоты, соли),
методы ионного обмена (растворы солей).
Стандартные
растворы классифицируют по
способу определения их концентрации.
Различают: первичные стандарты
или растворы с приготовленным титром
и вторичные стандарты
растворы с установленным титром.
Первичные
стандарты это
растворы, которые готовят либо по
точной навеске вещества (рис. 4.10),
либо путем разведения специально
приготовленных стандартизированных
реагентов – фиксаналов (рис. 4.11).
Фиксанал представляет собой стеклянную
запаянную ампулу, выпускаемую
промышленностью и содержащую строго
нормированное количество реагента,
обычно рассчитанного на 1 л 0,1 н. раствора.
Приготовление
раствора по точной навеске
начинают с расчета ее массы по заданной
концентрации (титру или нормальности)
и объему колбы. Навеску стандартного
вещества взвешивают на аналитических
весах с точностью до 1104
г и количественно переносят в мерную
колбу, где ее растворяют при перемешивании
(рис. 4.10).
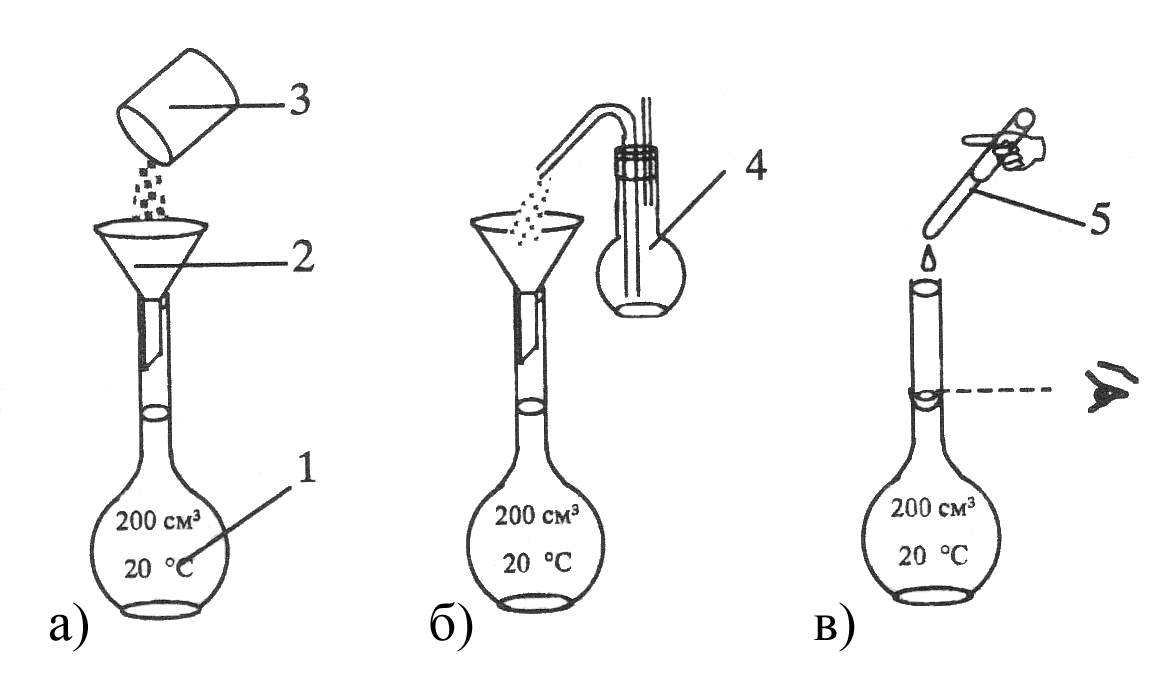
Рисунок 4.10 –
Порядок операций при приготовлении
раствора первичного
стандарта по точной
навеске: 1 – мерная колба Мора; 2 –
воронка;
3 – бюкс с навеской
вещества; 4 – промывалка с дистиллированной
водой;
5 – пипетка или
капельница.
а – перенос навески
вещества в мерную колбу; б – ополаскивание
воронки;
в – доведение
объема раствора стандарта до метки.
Этим методом обычно
готовят растворы солей, таких как бура
(Na2B4O710H2O),
K2Cr2O7.
Количество вещества в растворе находят
или по значению точно взятой массы
навески (при ее переносе необходимо
тщательно промыть бюкс), или рассчитывают
методом разности, определяя точную
массу бюкса сначала с навеской, а затем
– пустого, уже после переноса вещества
в колбу. В случае необходимости
концентрацию раствора заново пересчитывают
с учетом фактически взятой массы навески.
Порядок приготовления
раствора методом разведения из
фиксанала показан на рисунке 4.11. Чтобы
стандарт, полученный этим методом, был
качественным и отвечал всем требованиям,
необходимо исключить потери вещества
при вскрытии ампулы и переносе его в
колбу, а также следить, чтобы осколки
ампулы не попали в раствор. Это во многом
зависит от правильности обращения с
ампулой.
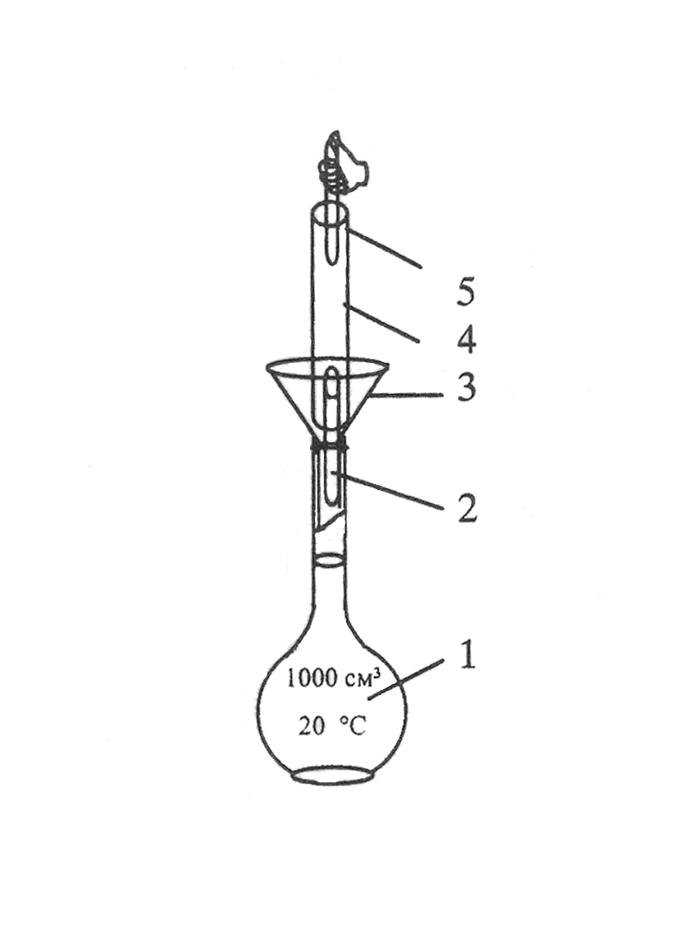
Рисунок 4.11 – Способ
приготовления растворов первичного
стандарта
методом разведения
из фиксанала: 1 – мерная колба Мора на
1л;
2 – нижний боек; 3
– воронка; 4 – ампула фиксанала; 5 –
верхний боек.
Перед использованием,
ампулу следует ополоснуть дистиллированной
водой и только затем ее вскрывать
специальным бойком. Сразу же после
переноса вещества в колбу, нужно тщательно
промыть ампулу дистиллированной водой,
не менее, чем 6-ти кратным ее объемом.
Этот метод приготовления первичного
стандарта проще, чем по точным навескам,
но уступает ему в точности. Его используют
не только для получения растворов солей,
но и различных кислот.
Так как для
приготовления раствора первичного
стандарта пригодны только точная
мерная посуда и аналитические весы,
то и к веществам, применяемым для этой
цели, предъявляют ряд обязательных
требований. В качестве первичного
стандарта можно использовать только
такие реактивы, которые характеризуются:
-
высокой чистотой
(обычно не хуже, чем 99,99 – 99,999%
квалификации ч.д.а. и о.с.ч.); -
точным соответствием
формульному составу и относительно
высокой молекулярной массой; -
устойчивостью
при хранении как в твердом виде,
так и в растворе (отсутствие процессов
гидратации, гидролиза, окисления и
карбонизации); -
простотой в
приготовлении и хорошей растворимостью; -
необратимостью
реакции при стандартизации, селективностью; -
возможностью
точной фиксации Т. Э. каким-либо методом.
Вторичным
стандартом называют такие
стандартизированные растворы,
которые устойчивы при хранении и могут
быть использованы для стандартизации
других растворов.
Вторичные стандарты
готовят как растворы приблизительной
концентрации любым известным методом,
а перед употреблением
определяют их точную концентрацию
путем стандартизации по
первичному стандарту. Поэтому при
приготовлении вторичных стандартов не
требуется высокая точность измерения
массы вещества или объема раствора, как
в случае первичных стандартов. Для этой
цели вполне пригодны технохимические
весы и неточная мерная посуда
(цилиндры, мензурки, градуированные
пробирки).
Примером раствора,
обладающего свойствами вторичного
стандарта, является соляная
кислота. Ее разбавленные растворы
могут храниться длительное время, до
1-го месяца и более, без заметного
изменения концентрации. Бура,
используемая в протолитометрии для
стандартизации HCl, относится
к первичным стандартам и готовится
по точной навеске. Тогда, как рабочий
раствор NaOH –
свойствами стандарта не обладает вообще
и его концентрацию приходится
устанавливать заново при каждом
использовании.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Вычисление молярной, нормальной концентрации и титра раствора вещества
Задача 107.
Из Nа2СО3 массой 5,3000 г приготовили 1 дм3 раствора. Вычислите молярную, нормальную концентрации и титр раствора.
Решение:
V(p-pa) = 1 дм3 = 1000 cм3;
М(Nа2СО3) = 106 г/моль;
m(Nа2СО3) = 5,3000 г;
Э(Nа2СО3) = 53 г/моль; ;
СМ(Nа2СО3) = ?
СН(Nа2СО3) = ?
Т(р-ра) = ?
Определяемое вещество (А) – Nа2СО3
1. Рассчитаем титр раствора
ТА = m(Nа2СО3)/V(p-pa) = 5,3000/1000 = 0,005300 г/см3.
2. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Nа2СО3) = (ТA · 1000)/М(Nа2СО3) = (0,005300 · 1000)/106 = 0,05 моль/дм3.
3. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Nа2СО3) = (ТA · 1000)/Э(Nа2СО3) = (0,005300 · 1000)/53 = 0,10 моль/дм3.
Ответ: 0,05 моль/дм3; 0,10 моль/дм3; 0,005300 г/см3.
Задача 108.
Вычислите молярную и нормальную концентрации раствора Н2SО4 с титром 0,004900 г/см3.
Решение:
М(Н2SО4) = 98 г/моль;
ТА = 0,004900 г/см3;
Э(Н2SО4) = 49 г/моль;
СМ(Н2SО4) = ?
СН(Н2SО4) = ?
Определяемое вещество (А) –Н2SО4
1. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Н2SО4) = (ТA · 1000)/М(Н2SО4) = (0,004900 · 1000)/98 = 0,05 моль/дм3.
2. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Н2SО4) = (ТA · 1000)/Э(Н2SО4) = (0,004900 · 1000)/49 = 0,10 моль/дм3.
Ответ: СМ = 0,05 моль/дм3; СН = 0,10 моль/дм3.
Задача 109.
Вычислите нормальную концентрацию раствора NаОН, если Т(NаОН/СаО) равен 0,002914 г/см3.
Решение:
Т(NаОН/СаО) = 0,002914 г/см3;
Э(NаОН) = 40 г/моль;
Э(СаО) = 28 г/моль;
СН(NаОН) = ?
Определяемое вещество (А) – NаОН
1. Расчет титра раствора NаОН
Титр раствора NаОН определим, используя формулу:
Т(А/B) = [ТА · Э(B)]/Э(A), где
А – определяемое вещество; В – стандартное вещество; Э – масса эквивалента; ТА – титр раствора.
Тогда
Т(NаОН) = [Т(NаОН/СаО) · Э(NаОН)]/Э(CaO) = (0,002914 · 40)/28 = 0,004163.
2. Расчет нормальной концентрации раствора
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (ТA · 1000)/Э(в-ва)
Тогда
СН(NаОН) = [(Т(NаОН) · 1000)/Э(NаОН)] = (0,004163 · 1000)/40 = 0,1041 моль/дм3.
Ответ: СН(NаОН) = 0,1041 моль/дм3.
