Определение титра раствора, молярной и нормальной концентрации вещества
Задача 110.
Определите Т(Н2SО4), если Т(Н2SО4)/KOH) составляет 0,005643 г/см3.
Решение:
Т(Н2SО4)/KOH) = 0,005643 г/см3;
Э(Н2SО4) = 49 г/моль;
Э(KOH) = 28 г/моль;
Т(Н2SО4) = ?
Определяемое вещество (А) – Н2SО4
1. Расчет титра раствора Н2SО4
Титр раствора Н2SО4 определим, используя формулу:
Т(А/B) = [Т(А) · Э(B)]/Э(A), где
А – определяемое вещество; В – стандартное вещество; Э – масса эквивалента; Т(А) – титр раствора.
Тогда
Т(Н2SО4) = [Т(Н2SО4)/KOH) · Э(Н2SО4)]/Э(KOH) = (0,005643 · 49)/28 = 0,004938
Ответ: 0,004938 г/см3.
Задача 111.
Определите молярную, нормальную концентрации и Т(Н2SО4)/CaO), если Т(Н2SО4) равен 0,004852 г/см3.
Решение:
Т(Н2SО4) = 0,004852 г/см3;
Э(Н2SО4) = 49 г/моль;
Э(СаО) = 28 г/моль;
Т(Н2SО4)/СаО) = ?
СМ(Н2SО4) = ?
СН(Н2SО4) = ?
Определяемое вещество (А) – Н2SО4
1. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ = [Т(А) · 1000)]/M(A)
Тогда
СМ(Н2SО4) = [Т(Н2SО4) · 1000)/М(Н2SО4] = (0,004852 · 1000)/98 = 0,0495 моль/дм3.
2. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН = [Т(A) · 1000]/Э(A)
Тогда
СН(Н2SО4) = (Т(Н2SО4) · 1000)/Э(Н2SО4) = (0,004852 · 1000)/49 = 0,0990 моль/дм3.
3. Расчет Т(Н2SО4)/CaO)
Титр раствора Н2SО4 определим, используя формулу:
Т(А/B) = [Т(А) · Э(B)]/Э(A), где
А – определяемое вещество; В – стандартное вещество; Э – масса эквивалента; Т(А) – титр раствора.
Тогда
Т(Н2SО4)/CaO) = [Т(Н2SО4) · Э(СаО)]/Э(Н2SО4) = (0,004852 · 28)/49 = 0,002773
Ответ: 0,0495 моль/дм3; 0,0990 моль/дм3; 0,002773 г/см3.
Задача 112.
К 550 см3 0,1925 М раствора HCl прибавили 50,00 см3 раствора HCl с титром 0,023700 г/см3. Вычислите нормальную концентрацию и титр полученного раствора.
Решение:
M(HCl) = Э(HCl) = 36,46 г/моль;
V1(p-pa) = 550 см3;
V2(p-pa) = 50 см3;
T2(HCl) = 0,023700 г/см3;
CM1(HCl) = 0,1925 М;
CH(HCl) = ?
T(p-pa) = ?
1. Расчет массы кислоты в первом растворе
Массу кислоты рассчитаем по формуле:
m(А) = [V(p-pa) · CM(А)]/[M(A) · 1000]
Тогда
m1(HCl) = [V1(p-pa) · CM1(HCl)· M(HCl)]/1000 = (550 · 0,1925 · 36,46)/1000 = 3,8602 г.
2. Расчет массы кислоты во втором растворе
Массу кислоты рассчитаем по формуле:
Т(А) = m(A)/V(p-pa), где
Т(А) – титр раствора; m(A) – масса вещества; V(p-pa) – объем исследуемого раствора.
Тогда
m2(HCl) = T2(HCl) · V2(p-pa) = 0,023700 · 50 = 1,185 г.
3. Общая масса кислоты составляет 5,0452 г [m(HCl) = m1(HCl) + m2(HCl)] = 3,8602 г + 1,185 г = 5,0452 г).
4. Общий объем раствора составляет 600 см3 [V(p-pa) = V1(p-pa) + V2(p-pa) = 550 + 50 = 600 cм3].
5. Вычисление титра полученного раствора
T(p-pa) = m(HCl)/V(p-pa) = 5,0452/600 = 0,008408 г/см3.
6. Вычисление нормальной концентрации полученного раствора
Нормальность раствора определим по формуле:
СН = [Т(А) · Э(А)]/1000
Тогда
CH(HCl) = [T(p-pa) · 1000]/Э(HCl) = (0,008408 · 1000)/36,46 = 0,2306 моль/дм3
Ответ: 0,2306 моль/дм3; 0,008408 г/см3.
Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
Титр связан и с массовой долей растворенного вещества:
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.
Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.
Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?
Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.
Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Как рассчитать титр
Титр – это выражение концентрации раствора вещества, используется в аналитической химии. Обозначает массу растворённого вещества в единице объёма раствора. Определить титр раствора в аналитической химии можно титриметрическим методом.

Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор;
- – Периодическая система химических элементов (таблица Менделеева).
Инструкция
При упомянутом методе измеряются объёмы двух вступивших между собой в реакцию растворов, один из которых – анализируемый, а второй – титрант или титрованный раствор – с известной концентрацией. Для титранта существует понятие условного титра или титра по определяемому веществу. Это количество анализируемого вещества, оттитрованного 1 мл раствора. В учебном курсе химии существуют несколько типов задач на расчет титра раствора.
В первом типе задач вам потребуется перевести концентрацию раствора из других единиц в титр. Концентрация – это отношение величины растворенного вещества, заданной массой, количеством молей, объёмом, к величине раствора или растворителя. При решении опирайтесь на то, что для определения титра из исходных данных надо получить массу растворенного вещества и величину объёма раствора, в котором оно находится.
Пример 1: определите титр 15% раствора серной кислоты. Плотность раствора 1,10 г/мл. Концентрация раствора выражена в массовой доле вещества. Массовая доля – это отношение масс растворенного вещества и раствора. Рассчитайте массу одного литра раствора – 1100 грамм. Определите массовое содержание серной кислоты в нём: 1100*0,15=165г. Вычислите титр раствора: 165 г/1000 мл=0,165 г/мл.
Пример 2: требуется найти титр 0,15 н. раствора серной кислоты. Нормальность раствора – это количество эквивалента растворенного вещества на литр раствора, единица – моль-экв/л. Эквивалент – это количество вещества эквивалентное 1 молю ионов водорода в химических реакциях. Один литр раствора содержит 0,15 моль эквивалента серной кислоты.
Пользуясь таблицей Менделеева, найдите молярную массу H2SO4 – 98 г/моль. Эквивалент серной кислоты – 1/2. Вычислите молярную массу эквивалента H2SO4: 98/2=49 г/моль. Найдите, сколько весят 0.15 моль эквивалента серной кислоты: 0,15*49=7,35 г. Определите титр раствора: 7,36 г/1000мл=0,00736 г/мл.
Во втором типе задач необходимо найти условный титр. Для решения вычислите из исходных величин массу растворенного вещества и объём раствора, с которым оно прореагировало.
Пример 3: вычислите титр раствора 0,1 н. раствора AgNO3 по NaCl. Эквиваленты AgNO3 и NaCl равны единице. Найдите молярную массу NaCl — 58,5г/моль. Найдите количество нитрата серебра в 1 мл раствора — 0,0001 моль. Следовательно, количество хлорида натрия, реагирующего с 1 мл раствора — 0,0001 моль. Умножьте молярную массу NaCl на количество вещества и получите условный титр раствора нитрата серебра — 0,000585 г/мл — масса NaCl, реагирующая с 1мл раствора AgNO3.
Третий тип задач – на вычисление титра раствора из значений, полученных титриметрическим методом. Для их решения опирайтесь на уравнение реакции анализа. Из него найдите, в какой пропорции вещества взаимодействуют друг с другом.
Пример 4: определите титр раствора HCl, если на нейтрализацию 20 мл кислоты потребовалось 18 мл 0,13 н. раствора NaOH. Эквиваленты HCl и NaOH равны единице. Найдите количество хлорида натрия в 18 мл: 0,13*0,018=0,00234 моль. Следовательно, количество прореагировавшей соляной кислоты тоже будет 0,00234 моль. Вычислите молярную массу HCl – 36,5 г/моль. Найдите массу полученного количества соляной кислоты: 0,00234*36,5=0,08541 г. Эта масса вещества содержится в 20 мл раствора. Найдите титр раствора: 0,08541/20=0,0042705 г/мл.
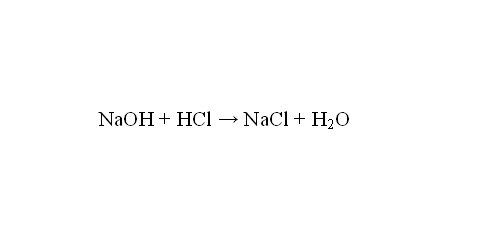
Источники:
- как рассчитать химическое количество
Пример
1. В какой
массе эфира надо растворить 3,04 г анилина
C6H5NH2
, чтобы
получить раствор, моляльность которого
равна 0,3 моль/кг.
Решение: Моляльность
раствора Сm
(моль/кг) показывает количество
растворенного вещества, находящегося
в 1 кг растворителя:
где mр-ля
– масса растворителя, кг;
n
(А) – количество растворенного вещества,
моль.
M
(C6H5NH2
) – 93,0 г/моль.
Масса растворителя
(эфира) равна:
Тогда
Пример
2. Определите
титр 0,01 н. КОН.
Решение: Титр
раствора показывает массу (г) растворенного
вещества, содержащегося в 1 мл раствора.
В 1 л 0,01 н. КОН содержится 0,564 г КОН. Титр
этого раствора равен:
ТКОН=
0,561/1000=0,000561 г/мл.
Пример
3. Рассчитайте
молярные доли глюкозы C6H12O6
и воды в растворе с массовой долей
глюкозы 36 %.
Решение: Мольная
доля NАвещества
в растворе равна отношению количества
данного вещества nА
к общему
количеству всех веществ, содержащихся
в растворе:
где ()
количество всех веществ, содержащихся
в растворе.
В 100 г раствора с
массовой долей глюкозы, равной 36 %,
содержится 36 г глюкозы и 64 г воды:
n(C6H12O6)
=36/180=0,20 моль;
n
(H2O)=
64/18= 3,56 моль;
n
(C6H12O6)
+ nH2O=
0,20 + 3,56 =3,76 моль;
N
(C6H12O6)=
0,20/3,76= 0,053;
N
(H2O)=
3,56/3,76= 0,947.
Сумма молярных
долей всех компонентов раствора равна
1.
Пример 4. Вычислите
молярную концентрацию эквивалента,
молярную концентрацию и моляльность
раствора, в котором массовая доля CuSO4
равна 10 %. Плотность раствора 1107 кг/м3.
Решение: Определим
молярную массу и молярную массу
эквивалента CuSO4:
M
(CuSO4)=
159,61 г/моль; M(ЭCuSO4)=
В 100 г раствора с
ωCuSO4=10
% содержится 10,0 г CuSO4
и 90 г H2O.
Следовательно,
моляльность раствора CuSO4
равна
Сm(CuSO4/H2O)=10/(159,61∙0,09)=0,696
моль/кг.
Молярная концентрация
и молярная концентрация эквивалента
относятся к 1л раствора:
mр-ра=
ρV=
1107·10-3=1,107
кг.
В этой массе
раствора содержится 1,107·0,1=0,1107 кг CuSO4,
что составляет
110,7/159,61=0,693 моль, или 0,693·2=1,386 экв.
Молярная концентрация
и молярная концентрация эквивалента
данного раствора соответственно равны
0,693 и 1,386 моль/л.
1 Плотность раствора
серной кислоты, в 1 л которого содержится
577 г Н2SO4,равна
1,335 г/мл. Вычислить процентную концентрацию
раствора, а также его нормальность,
молярность, моляльность и мольные доли
Н2SО4
и Н2O.
Ответ: 43,22%; 11,76н.; 5,88М; 7,76 моль/кг;
0,123; 0,877.
2 Определите
нормальность, моляльность, процентную
концентрацию и титр 0,8М Fe2(SO4)3,
если плотность
раствора равна 1 г/мл. Ответ: 4,8н.; 1,18
моль/кг; 32%; 0,3199 г/мл.
3 Вычислить
процентную концентрацию и моляльность
8н. HNO3,
плотность которой равна 1,246 г/мл. Каковы
мольные доли HNO3
и Н2О
в этом растворе? Ответ: 40,5%;10,8 моль/кг;
0,162; 0,838.
4 Вычислите
грамм-эквивалент двухосновной кислоты,
37%-ный раствор которой 12,5н. и имеет
плотность 1,664 г/мл. Какая это кислота?
Чему равны молярная, моляльная концентрации
и титр раствора этой кислоты? Ответ:
49,2 г; 6,25М; 5,94 моль/кг; 0,6156 г/мл.
5 B
1кг воды растворено 666 г КОН, плотность
раствора равна 1,395 г/мл. Найти: массовую
долю; молярность; моляльность раствора;
мольные доли щелочи и воды. Ответ: 40%;
9,95 моль/л; 11,9 моль/кг; 0,176 и 0,824;
6 Плотность 15%-ного
(по массе) раствора H2SO4
равна 1,105 г/мл. Вычислить: нормальность,
молярность, моляльность раствора. Ответ:
3,38н.; 1,69 моль/л; 1,80 моль/кг.
7 Плотность 9%-ного
(по массе) раствора сахарозы C12H22O11
равна 1,035 г/мл. Вычислить концентрацию
сахарозы в г/л; молярность; моляльность
раствора. Ответ: 93,2 г/л; 0,27 моль/л; 0,29
моль/кг.
8 Найти массу воды,
необходимую для приготовления 1,5
моляльного раствора хлорида натрия,
если имеется 10 г NaCl.
Ответ: 144г.
9 Титр раствора
серной кислоты 0,0245 г/мл. Определить
молярную концентрацию раствора. Ответ:
0,25М.
10 Имеется 0,25н.
раствор гидроксида натрия. Определить
его титр. Ответ: 0,01 г/мл.
11 Рассчитать титр
0,15н. раствора: а) азотной кислоты; б)
фосфорной кислоты; в) соляной кислоты.
Ответ: а) 0,0095 г/мл; б) 0,0049 г/мл;
в) 0, 0055 г/мл.
12
Вычислите
молярность, нормальность и моляльность
раствора 20%-ной Н2SO4
плотностью 1,14 г/см3.
Ответ: 2,3 моль /л;
4,6н.; 2,55 моль/кг.
13 Вычислить
молярность и нормальность раствора КI,
титр которого равен 0,0017 г/мл. Ответ:
0,01М; 0,01н.
14 До какого объема
нужно довести раствор при растворении
8,1 г FеС13,
чтобы получить 0,1н. раствор? Каков титр
раствора? Ответ: 1,5 л; 0,0054 г/мл.
15 Чему равна
моляльность раствора, приготовленного
растворением 9 г глюкозы С6Н12О6
в
500 мл воды? Ответ: 0,1 моль /кг.
16 Сколько граммов
сахарозы C12H22O11
необходимо
взять для пригововления 200 г раствора,
моляльность которого равна 0,05 моль/кг?
Ответ: 3,36 г.
17 Вычислите
моляльность и массовую долю раствора
(плотность 1,107 г/мл), содержащего 50 г
СuSO4
в 450 мл воды.
Ответ: 0,694 моль/кг;
10%.
18 Опишите, как
приготовить 1 л 1%-ного, одномолярного и
однoнормального
раствора серной кислоты.
19 Чему равен титр
растворов: а) 0,1н. НС1; б) 1н. КОН; в) 0,5н.
HNO3?
Выразить титры в г/мл и в мг/мл.
20 Вычислите титр
растворов: а) 0,1н. Н2SO4;
б) 0,02н. Н3РO4;
в) 0,02н. NаОН;
г) 0,004н. Са(ОН)2.
Выразите титры в г/мл и в мг/мл.
21 Титр раствора
серной кислоты равен 0,0049 г/мл. Какова
нормальность раствора?
22 Титр раствора
NаОН
равен 2 мг/мл. Какова нормальность
раствора?
23 На нейтрализацию
20 мл 1н. раствора гидроксида натрия пошло
20 мл раствора серной кислоты. Чему
равны нормальность и титр раствора
кислоты?
24 На нейтрализацию
40 мл 0,1н. раствора азотной кислоты пошло
4 мл раствора гидроксида натрия.
Чему равны нормальность и титр раствора
щелочи?
25 На нейтрализацию
60 мл 0,25н. Н2SO4
пошло 180 мл раствора КОН. Чему равны
нормальность и титр раствора КОН?
Ответ: 0,083л.; 4,66
мг/мл.
26 Вычислить
нормальность, моляльность, мольную долю
и титр 50%-ного раствора гидроксида
натрия.
27 Вычислите титры
(в мг/мл) растворов а) 30%-ного КОН;
б) 10%-ного НС1; в) 4%-ного NаОН.
Определите нормальность этих растворов.
28 Вычислите
моляльность и мольную долю растворов,
приведенных в задаче №27.
29 Смешали
2 л 10%-ного и 4 л 24%-ного раствора азотной
кислоты. Чему равна процентная
концентрация, моляльность и мольная
доля полученного раствора?
30 Из 10 кг 20%- ного
раствора NаС1 при охлаждении выделилось
400 г соли. Чему равна процентная
концентрация, моляльность и мольные
доли NаС1
и Н2О
охлажденного раствора?
Совет 1: Как рассчитать титр
Титр – это выражение концентрации раствора вещества, применяется в аналитической химии. Обозначает массу растворённого вещества в единице объёма раствора. Определить титр раствора в аналитической химии дозволено титриметрическим способом.
Вам понадобится
- – ручка;
- – бумага для записей;
- – калькулятор;
- – Периодическая система химических элементов (таблица Менделеева).
Инструкция
1. При упомянутом способе измеряются объёмы 2-х вступивших между собой в реакцию растворов, один из которых – анализируемый, а 2-й – титрант либо титрованный раствор – с вестимой концентрацией. Для титранта существует представление условного титра либо титра по определяемому веществу. Это число анализируемого вещества, оттитрованного 1 мл раствора. В учебном курсе химии существуют несколько типов задач на расчет титра раствора.
2. В первом типе задач вам понадобится перевести концентрацию раствора из других единиц в титр. Насыщенность – это отношение величины растворенного вещества, заданной массой, числом молей, объёмом, к величине раствора либо растворителя. При решении опирайтесь на то, что для определения титра из начальных данных нужно получить массу растворенного вещества и величину объёма раствора, в котором оно находится.
3. Пример 1: определите титр 15% раствора серной кислоты. Плотность раствора 1,10 г/мл. Насыщенность раствора выражена в массовой доле вещества. Массовая доля – это отношение масс растворенного вещества и раствора. Рассчитайте массу одного литра раствора – 1100 грамм. Определите массовое оглавление серной кислоты в нём: 1100*0,15=165г. Вычислите титр раствора: 165 г/1000 мл=0,165 г/мл.
4. Пример 2: требуется обнаружить титр 0,15 н. раствора серной кислоты. Нормальность раствора – это число эквивалента растворенного вещества на литр раствора, единица – моль-экв/л. Эквивалент – это число вещества равнозначное 1 молю ионов водорода в химических реакциях. Один литр раствора содержит 0,15 моль эквивалента серной кислоты.
5. Пользуясь таблицей Менделеева, обнаружьте молярную массу H2SO4 – 98 г/моль. Эквивалент серной кислоты – 1/2. Вычислите молярную массу эквивалента H2SO4: 98/2=49 г/моль. Обнаружьте, сколько весят 0.15 моль эквивалента серной кислоты: 0,15*49=7,35 г. Определите титр раствора: 7,36 г/1000мл=0,00736 г/мл.
6. Во втором типе задач нужно обнаружить воображаемый титр. Для решения вычислите из начальных величин массу растворенного вещества и объём раствора, с которым оно прореагировало.
7. Пример 3: вычислите титр раствора 0,1 н. раствора AgNO3 по NaCl. Эквиваленты AgNO3 и NaCl равны единице. Обнаружьте молярную массу NaCl — 58,5г/моль. Обнаружьте число нитрата серебра в 1 мл раствора — 0,0001 моль. Следственно, число хлорида натрия, реагирующего с 1 мл раствора — 0,0001 моль. Умножьте молярную массу NaCl на количество вещества и получите воображаемый титр раствора нитрата серебра — 0,000585 г/мл — масса NaCl, реагирующая с 1мл раствора AgNO3.
8. 3-й тип задач – на вычисление титра раствора из значений, полученных титриметрическим способом. Для их решения опирайтесь на уравнение реакции обзора. Из него обнаружьте, в какой пропорции вещества взаимодействуют друг с ином.
9. Пример 4: определите титр раствора HCl, если на нейтрализацию 20 мл кислоты понадобилось 18 мл 0,13 н. раствора NaOH. Эквиваленты HCl и NaOH равны единице. Обнаружьте число хлорида натрия в 18 мл: 0,13*0,018=0,00234 моль. Следственно, число прореагировавшей соляной кислоты тоже будет 0,00234 моль. Вычислите молярную массу HCl – 36,5 г/моль. Обнаружьте массу полученного числа соляной кислоты: 0,00234*36,5=0,08541 г. Эта масса вещества содержится в 20 мл раствора. Обнаружьте титр раствора: 0,08541/20=0,0042705 г/мл.
Совет 2: Как обнаружить титр раствора
Титр раствора – это один из терминов для обозначения концентрации (наравне с процентной концентрацией, молярной концентрацией и т.д.). Величина титра указывает, какое число граммов вещества содержится в одном миллилитре раствора .
Инструкция
1. Представим, дана такая задача. Имеется 20 миллилитров раствора гидроксида натрия. Для его нейтрализации потребовалось израсходовать 30 миллилитров 1М раствора соляной кислоты. Ни одно из веществ не было взято в избытке. Определить, каков титр щелочи.
2. Раньше каждого, напишите уравнение реакции. Она протекает так:NaOH + HCl = NaCl + H2O.
3. Вы видите, что в ходе этой реакции нейтрализации, согласно уравнению, число молей кислоты всецело совпадает с числом молей связанной ею щелочи. А сколько молей кислоты вступило в реакцию? Раз ее раствор одномолярный, то число молей будет во столько же раз поменьше единицы, во сколько раз 30 миллилитров поменьше 1 литра. То есть, 30/1000 = 0,03 моля.
4. Из этого следует, что щелочи также было 0,03 моля. Посчитайте, сколько это будет в граммах. Молекулярная масса резкого натра приблизительно равна 23 + 16 +1 = 40, следственно, его молярная масса составляет 40 г/моль. Умножив 40 на 0,03, получите: 1,2 грамма.
5. Ну, а дальше все дюже легко. 1,2 грамма щелочи содержится в 20 миллилитрах раствора . Поделив 1,2 на 20, получите результат: 0,06 грамм/миллилитр. Вот такой титр у раствора гидроксида натрия.
6. Усложним условие задачи. Представим, у вас имеется то же число раствора гидроксида натрия – 20 миллилитров. Для ее нейтрализации добавили те же 30 миллилитров 1М соляной кислоты. Впрочем, в различие от предыдущей задачи, оказалось, что кислота была взята в избытке, и для ее нейтрализации пришлось израсходовать 5 миллилитров 2М раствора гидроксида калия. Каков титр раствора гидроксида натрия в этом случае?
7. Начните с написания уравнения реакции кислоты с резким кали:HCl + KOH = KCl + H2O.
8. Рассуждая подобно вышеприведенному примеру и произведя расчеты, вы увидите: во-первых, первоначально соляной кислоты было 0,03 моля, а во-вторых, в реакцию с кислотой вступило 2х0,005 = 0,01 моля резкого кали. Эта щелочь, соответственно, связала 0,01 моля соляной кислоты. Следственно, на первую реакцию с иной щелочью – резким натром – ушло 0,03 – 0,01 = 0,02 моля соляной кислоты. Из чего становится ясно, что и резкого натра в растворе содержалось 0,02 моля, то есть, 40х0,02 = 0,8 грамм.
9. А дальше определить титр этого раствора – проще некуда, в одно действие. Поделив 0,8 на 20, получите результат: 0,04 грамма/миллилитр. Решение задачи заняло чуть огромнее времени, но и тут не было ничего трудного.














