Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 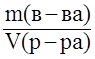 ; (г/мл).
; (г/мл).
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 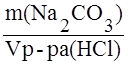 ; г/мл.
; г/мл.
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 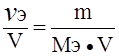 ; моль/л; Сэ = N =
; моль/л; Сэ = N = 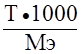 ;
;
См = 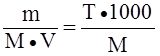 ; моль/л
; моль/л
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ – e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 – 2e – ® 2H+ + O2 ® Мэ(H2O2) = ![]() М(H2O2) = 17,01 г/моль.
М(H2O2) = 17,01 г/моль.
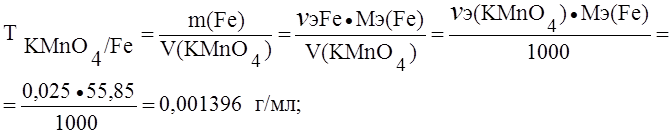
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
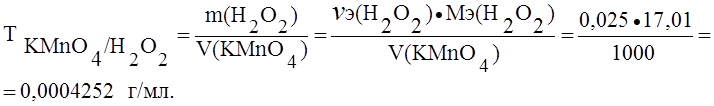
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) = 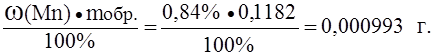
® Т NaAsO2/Mn = 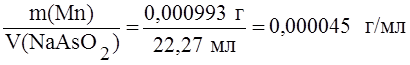 .
.
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e – ® NO + 2H2O.
Решение.
Сэ = 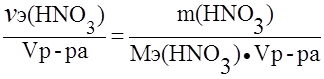 ;
;
M(HNO3) = 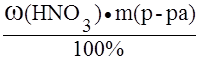 ; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;
; если масса раствора равна 100 г, то m(HNO3) = w(HNO3) = 30,1 г;
Vр-ра=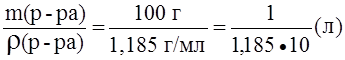 ;
;
Мэ(HNO3) = ![]() М(HNO3) =
М(HNO3) = ![]() · 63 г/моль = 21,01 г/моль;
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) = 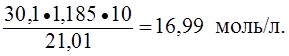
Вычисление молярной, нормальной концентрации и титра раствора вещества
Задача 107.
Из Nа2СО3 массой 5,3000 г приготовили 1 дм3 раствора. Вычислите молярную, нормальную концентрации и титр раствора.
Решение:
V(p-pa) = 1 дм3 = 1000 cм3;
М(Nа2СО3) = 106 г/моль;
m(Nа2СО3) = 5,3000 г;
Э(Nа2СО3) = 53 г/моль; ;
СМ(Nа2СО3) = ?
СН(Nа2СО3) = ?
Т(р-ра) = ?
Определяемое вещество (А) – Nа2СО3
1. Рассчитаем титр раствора
ТА = m(Nа2СО3)/V(p-pa) = 5,3000/1000 = 0,005300 г/см3.
2. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Nа2СО3) = (ТA · 1000)/М(Nа2СО3) = (0,005300 · 1000)/106 = 0,05 моль/дм3.
3. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Nа2СО3) = (ТA · 1000)/Э(Nа2СО3) = (0,005300 · 1000)/53 = 0,10 моль/дм3.
Ответ: 0,05 моль/дм3; 0,10 моль/дм3; 0,005300 г/см3.
Задача 108.
Вычислите молярную и нормальную концентрации раствора Н2SО4 с титром 0,004900 г/см3.
Решение:
М(Н2SО4) = 98 г/моль;
ТА = 0,004900 г/см3;
Э(Н2SО4) = 49 г/моль;
СМ(Н2SО4) = ?
СН(Н2SО4) = ?
Определяемое вещество (А) –Н2SО4
1. Расчет молярной концентрации (молярность)
Молярную концентрацию (СМ) можно определить по формуле:
СМ(в-ва) = (Т · 1000)/M(в-ва)
Тогда
СМ(Н2SО4) = (ТA · 1000)/М(Н2SО4) = (0,004900 · 1000)/98 = 0,05 моль/дм3.
2. Расчет нормальной концентрации (нормальность)
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (Т · 1000)/Э(в-ва)
Тогда
СН(Н2SО4) = (ТA · 1000)/Э(Н2SО4) = (0,004900 · 1000)/49 = 0,10 моль/дм3.
Ответ: СМ = 0,05 моль/дм3; СН = 0,10 моль/дм3.
Задача 109.
Вычислите нормальную концентрацию раствора NаОН, если Т(NаОН/СаО) равен 0,002914 г/см3.
Решение:
Т(NаОН/СаО) = 0,002914 г/см3;
Э(NаОН) = 40 г/моль;
Э(СаО) = 28 г/моль;
СН(NаОН) = ?
Определяемое вещество (А) – NаОН
1. Расчет титра раствора NаОН
Титр раствора NаОН определим, используя формулу:
Т(А/B) = [ТА · Э(B)]/Э(A), где
А – определяемое вещество; В – стандартное вещество; Э – масса эквивалента; ТА – титр раствора.
Тогда
Т(NаОН) = [Т(NаОН/СаО) · Э(NаОН)]/Э(CaO) = (0,002914 · 40)/28 = 0,004163.
2. Расчет нормальной концентрации раствора
Для определения нормальной концентрации (СН) воспользуемся формулой:
СН(в-ва) = (ТA · 1000)/Э(в-ва)
Тогда
СН(NаОН) = [(Т(NаОН) · 1000)/Э(NаОН)] = (0,004163 · 1000)/40 = 0,1041 моль/дм3.
Ответ: СН(NаОН) = 0,1041 моль/дм3.
Примеры решения типовых задач
-
Расчет фактора
эквивалентности, молярной массы
эквивалента, титра титранта по
определяемому веществу
Фактор
эквивалентности (f)
– число,
показывающее, какая доля реальной части
вещества эквивалентна одному иону
водорода или гидроксильных групп в
кислотно-основной реакции или одному
электрону в окислительно-восстановительной
реакции. Фактор эквивалентности
рассчитывают на основании стехиометрии
данной реакции, которая должна быть
обязательно указана. Фактор эквивалентности
величина безразмерная.
Молярная масса
эквивалента вещества (Mf)
– масса
одного моля эквивалента вещества, равная
произведению фактора эквивалентности
на молярную массу (M)
вещества:
Mf
= M´
f
(1)
Титр титранта
по определяемому веществу – это
выраженная в граммах масса определяемого
вещества, эквивалентная одному миллилитру
данного титранта. Титр по определяемому
веществу вычисляют, исходя из молярности
или титра титранта с учетом стехиометрических
коэффициентов уравнения химической
реакции, протекающей при титровании, и
молярных масс, реагирующих веществ
(г/мл).
Ттитранта/опр.вещ-во
![]() =
=
(2), где
С титранта
– концентрация титранта (моль/л).
Пример 1.
Рассчитайте молярную массу эквивалента
и титр титранта для кальция хлорида
при количественном определении методом
аргентометрии с использованием 0,05
моль/л раствора серебра нитрата.
Решение.
-
Записываем
уравнение химической реакции, лежащей
в основе метода количественного
определения, и уравниваем его.
СаСI2
+ 2AgNO3
→ 2AgCI↓ + Са(NO3)2
-
Из уравнения
химической реакции находим стехиометрические
коэффициенты лекарственного вещества
и титранта КСаСI2
= 1, КAgNO3
= 2. -
Находим молярную
массу лекарственного вещества расчетным
путем, по нормативной документации,
учебнику, справочной литературе.
М.м. (СаСI2·6Н2О)
= 219,0 г/моль
-
Молярную массу
эквивалента рассчитываем по формуле
(1):
Mf
(СаСI2)
=![]() =
=
109,5 г/моль
-
Титр титранта
рассчитываем по формуле (2):
Т = ![]() =
=
0,005475 г/мл
Пример 2.
Рассчитайте молярную массу эквивалента
и титр титранта для пероксида водорода
при количественном определении методом
заместительной йодиметрии с использованием
0,1 моль/л раствора натрия тиосульфата.
Решение.
-
Записываем
уравнения химических реакций, лежащих
в основе метода количественного
определения и уравниваем их.
2KI + H2O2
+ H2SO4
→ I2
+ К2SO4
+ 2H2O
I2
+
2 Na2S2O3
→ 2KI + 2 Na2S4O6
-
Из уравнения
химической реакции видно, что вещество
не реагирует на прямую с титрантом. В
таких случаях необходимо составить
схему, связывающую оба уравнения
реакции.
1(H2O2)
→1 (I2)
т.о.
1(H2O2)
→2 (Na2S2O3)
1 (I2)
→2 (Na2S2O3)
стехиометрические
коэффициенты лекарственного вещества
и титранта К H2O2=
1, К Na2S2O3=
2.
-
Находим молярную
массу лекарственного вещества расчетным
путем. М.м.(H2O2)
= 34,02 г/моль. -
Молярную массу
эквивалента рассчитываем по формуле
(1):
Mf
H2O2=
![]() =
=
17,01 г/моль
-
Титр титранта
рассчитываем по формуле (2):
Т = ![]() = 0,001701 г/мл.
= 0,001701 г/мл.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
 государственное
государственное
автономное профессиональное образовательное учреждение Чувашской Республики
«Межрегиональный центр компетенций –
Чебоксарский
электромеханический колледж»
Министерства
образования и молодежной политики Чувашской Республики
МЕТОДИЧЕСКОЕ ПОСОБИЕ
«Решение задач по теме «Растворы».
Автор: Хлебникова Л.А. – преподаватель
ГАПОУ ЧР МЦК ЧЭМК
г.
Чебоксары 2016г.
Содержание
Введение
I.
Теоретические вопросы
II.
Практическая
часть
2.1. Массовая
доля (w%), процентная концентрация (С%)
2.2. Молярная
концентрация раствора (См)
2.3. Нормальная
концентрация или эквивалентная (Сн, Сэ, СN)
2.4. Моляльная
концентрация (Сm)
2.5. Переходы
концентраций
2.6. Способы
вычисления при приготовлении разбавленных растворов из концентрированных.
2.7. Способы вычисления
при смешивании растворов
2.8. Расчет массы
воды, которая прибавляется к раствору для разбавления его
2.9. Упаривание
раствора
2.10. Смешивание
растворов разных концентраций.
2.11. Приготовление
растворов и навески кристаллогидрата
2.12. Концентрирование
растворов
Приложения
Литература
Введение
В условиях сокращения количества часов на
изучение химии необходимо отметить нехватку времени на отработку навыков
решения расчетных задач, что сказывается на результатах контрольных,
практических и лабораторных работах, олимпиад, ЕГЭ и ГИА.
Решение расчетных задач — способ
реализации межпредметных связей практического применения теоретических знаний и
развития логического мышления студентов.
Одну и ту же расчетную задачу можно
решить разными способами. В данном методическом пособии рассматривается способ
решения задач по теме «Растворы», который позволяет увидеть, что многие
химические задачи знакомы студентам из курса математики и нужно лишь умело
применять полученные на других уроках знания.
Пособие состоит из 2 разделов:
- Теоретические вопросы;
- Практическая часть
В практической части подробно
рассматривается решение задач, приведены задачи для самостоятельной работы.
Преподаватели химии могут использовать
данное пособие не только для подготовки студентов к итоговой аттестации, но и
на уроках, факультативных, элективных занятиях, в индивидуальной работе по
подготовке студентов предметным олимпиадам по химии и математике.
I.
Теоретические вопросы
Растворы.
Растворами называют однородные системы
переменного состава. Химический состав и физические свойства одного раствора во
всех частях его объёма одинаковы.
В отличие от простого смешивания
веществ, при растворении происходит взаимодействие между частицами,
образующими раствор.
Часто для определения раствора используют
понятия гомогенной и гетерогенной системы.
Гомогенная система (от греч. όμός — равный, одинаковый; γένω —
рождать) — однородная система, химический состав и физические свойства которой
во всех частях одинаковы или меняются непрерывно, без скачков (между частями
системы нет поверхностей раздела).
В гомогенной системе из двух и более химических компонентов каждый
компонент распределен в массе другого в виде молекул, атомов, ионов. Составные
части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система (от греч. έτερος — разный; γένω — рождать) —
неоднородная система, состоящая из однородных частей (фаз), разделённых
поверхностью раздела.
Растворы могут существовать в трёх агрегатных состояниях –
твёрдом, жидком и газообразном (парообразном). Примерами твёрдых растворов
могут служить некоторые сплавы металлов, например сплав золота и меди,
газообразных – воздух.
Наиболее важный вид растворов – жидкие растворы.
Растворы имеют чрезвычайно важное значение в жизни человека. Так,
процессы усвоения пищи человеком и животными связаны с переводом питательных
веществ в раствор. Растворами являются все важнейшие физиологические жидкости
(кровь, лимфа и т.д.).
Всякий раствор состоит из растворённых веществ и растворителя, т.е.
среды, в которой эти вещества равномерно распределены в виде молекул и ионов.
Обычно растворителем считают тот компонент, который в чистом
виде существует в том же агрегатном состоянии, что и полученный раствор.
Например, в случае водного раствора соли растворителем является вода.
Если же оба компонента до растворения находились в одинаковом
агрегатном состоянии (например, спирт и вода), то растворителем считается
компонент, находящийся в большем количестве.
Растворимость – способность вещества образовывать с другими
веществами однородные системы – растворы, в которых оно находится в виде
отдельных атомов, ионов, молекул или частиц. А концентрация – это мера
растворимости. Следовательно, растворимость является способностью веществ
распределяться равномерно в виде элементарных частиц по всему объему растворителя.
Концентрация и способы ее выражения
Концентрацией раствора называется
количество растворённого вещества, содержащееся в определённом количестве
раствора или растворителя.
Растворы с большой концентрацией растворённого вещества называются концентрированными,
с малой – разбавленными.
Она бывает следующих видов:
Массовая
доля (w%), процентная
концентрация (С%)
1.
Концентрация процентная (выражается в %) – она говорит о том, сколько содержится граммов
растворенного вещества в 100 граммах раствора.
Массовая доля (ω)-показывает
число единиц массы растворенного вещества, содержащееся в 100 единицах массы
раствора.
Определить
массовую долю растворенного вещества можно, найдя отношение массы растворенного
вещества к общей массе раствора, т.е.
ω=(m/m1)100%.
где ω – массовая доля растворенного вещества; m – масса
растворенного вещества; m1 – масса раствора.
Массовую долю вещества обычно выражают в долях единицы или в
процентах.
2.
Концентрация молярная – это число грамм-молей, приходящихся на 1
литр раствора. Показывает, сколько содержится грамм-молекул в 1 литре раствора
вещества.
Молярная концентрация (СМ) – показывает количество молей растворенного вещества,
содержащихся в 1 л раствора.
Молярная концентрация – это отношение количества
растворенного вещества (m/M) к объему его раствора (V):
CM= m/(MV), моль/л,
где m – масса растворенного вещества, г; М –
молярная масса растворенного вещества, г/моль; V – объем раствора, л.
В том случае, когда объем раствора выражается в
миллилитрах, выражение для молярной концентрации примет вид
СМ = m·1000/(MV).
Если 1
л раствора содержит 1 моль растворенного вещества, раствор называется
одномолярным и обозначается 1М, если 0,1 моль – децимолярным (0,1М), 0,01 моль
– сантимолярным (0,01М) и т.д.
Так, одномолярный раствор NaOH – это такой
раствор, в 1 л которого содержится 1 моль NaOH, т.е. 40
г.
Молярная концентрация эквивалента (нормальная
или эквивалентная) концентрация (СН) – это число молей эквивалента растворенного
вещества в 1 л раствора.
3. Концентрация нормальная – это число
грамм-эквивалентов, приходящихся на 1
литр раствора. Показывает, сколько содержится грамм-эквивалентов растворенного
вещества в 1 литре раствора.
3. Нормальная
концентрация – это
отношение количества эквивалентов растворенного вещества к объему раствора:
СН = m/(mЭV), моль/л,
где m – масса
растворенного вещества, г; mЭ – молярная масса эквивалента растворенного
вещества, г/моль; V – объем раствора, л.
Если 1 л раствора содержит 1 моль эквивалента
растворенного вещества, раствор называется однонормальным и обозначается 1н,
если 0,1 моль эквивалента – децинормальным (0,1н), 0,01 моль эквивалента –
сантинормальным (0,01н) и т.д.
Использование эквивалентных концентраций
растворов значительно упрощает расчеты. Пользуясь растворами, концентрация
которых выражена нормальностью, легко рассчитать, в каких объемных отношениях
они должны быть смешаны, чтобы растворенные вещества прореагировали без
остатка.
Пусть V1
л раствора вещества 1 с нормальностью СН1 реагирует с V2 л раствора вещества 2 с нормальностью СН2. Это
означает, что в реакцию вступило СН1V1эквивалентов вещества 1 и СН2V2 эквивалентов вещества 2. Вещества
взаимодействуют друг с другом в эквивалентных количествах, следовательно,
СН1V1= СН2V2
или V1 : V2 = СН2 : СН1,
т.е. объемы растворов реагирующих веществ обратно пропорциональны их
эквивалентным концентрациям.
4. Концентрация моляльная показывает,
сколько растворенного вещества в молях приходится на 1
килограмм растворителя.
Моляльная концентрация (Сm) показывает число молей растворенного вещества в 1
кг растворителя. Так, 2m H2SO4 означает раствор серной кислоты, в котором на 1000
г воды приходится 2 моля H2SO4.
В математической форме она выражается так;
Cm = m·1000/(M·m1), где Сm – моляльная концентрация раствора, m – масса
растворенного вещества, М – молярная масса растворенного вещества, m1 – масса растворителя.
Мольная доля (Ni) – это отношение числа молей данного компонента к сумме молей
всех компонентов раствора. Обычно обозначают мольную долю растворителя – N1, а
для растворенных веществ – N2, N3 и т.д. В случае раствора одного вещества в
другом мольная доля растворенного вещества N2 равна
N2 = n2/(n1 n2), где n1 и n2 – числа молей растворителя и растворенного
вещества.
5. Титр определяет содержание (в граммах)
вещества, которое растворено в 1 миллилитре раствора.
Титр (Т) показывает число граммов растворенного вещества,
содержащегося в 1 см3 (мл) раствора.
Титр – отношение массы растворенного вещества к
объему раствора:
Т = m/V, где m – масса растворенного вещества
в г, V – объем раствора в мл.
II. Практическая
часть
2.1. Массовая доля
(w%),
процентная концентрация (С%) – показывает сколько единиц массы
вещества растворено в 100 единицах массы раствора (количество грамм
растворенного вещества в 100 граммах раствора).
![]() %
%![]()
![]()
![]()
m (растворителя) = m(раствора)– m (растворенного вещества)
![]() ,
,
где
V – объем
раствора, P– плотность
раствора.
Нахождение массы растворенного вещества:
![]()
Примеры:
- 5% раствор поваренной соли.
Это значит, что в 100
г этого раствора содержится 5 г поваренной соли и 95
г воды.
- Какова массовая доля соли в растворе,
если в 200 г воды растворили 50 г соли?
|
Дано |
Решение |
|
m (соли) = 50 m (воды) = 200 |
1. 2. Ответ: 20 % раствор |
|
Найти: |
1.
Задачи на определение массы веществ в растворе (1-ый тип):
Пример: какую массу соли и объем
воды необходимо взять для приготовления 50
г 0,5 %-ного раствора (ответ: 0,25 г, H2O – 49,75 мл);
Решение
задачи:
|
m (р-ра)
|
m (соли) = 50 г · 0,005 = 0,25 г соли |
|
m (соли) = ? |
Реши
самостоятельно:
1. 60 г 1 %-ного раствора (ответ: 0,6 г, H2O
– 59,4 мл);
2. 70 г 2 %-ного раствора (ответ: 1,4 г, H2O
– 68,6 мл);
3. 40 г 0,4 %-ного раствора (ответ: 0,16 г,
H2O – 39,84 мл);
4. 80 г 0,2 %-ного раствора (ответ: 0,16 г,
H2O – 79,84 мл);
5. 90г раствора с массовой долей соли
0,001 (ответ: 0,09 г, H2O – 89,91мл);
2. Задачи
на определение массы веществ, необходимой для получения раствора нужной
концентрации (2-ой тип):
Примеры:
- Какой объем воды надо прилить
к 0,5 г сахара, чтобы получить 1 %-ный раствор? Ответ: 45,5 мл; - Какую массу соли надо добавить
к 200 мл воды, чтобы получить 3 %-ный раствор? Ответ: 6,2 г;
Решение
1-ой задачи:
|
1) m V(Н2О) = ? |
1) m |
Решение
2-ой задачи:
|
V(Н2О) m (соли) = ? |
1) 3 |
Реши
самостоятельно:
1.Какой объем воды надо прилить к 8 г
соли, чтобы получить 2 %-ный раствор?
Ответ: 392 мл;
2. Какую массу соли надо добавить к 120 мл
воды, чтобы получить 1 %-ный раствор? Ответ: 1,21 г;
3. Какую массу соли надо добавить к 320 мл
воды, чтобы получить 2 %-ный раствор? Ответ: 1,21 г;
4. Какой объем воды надо прилить к 10 г
соли, чтобы получить 1 %-ный раствор?
5. Какую массу соли
надо добавить к 100 мл воды, чтобы получить 0,5 %-ный раствор? Ответ: 1,21 г;
3. Задачи
на определение массовой доли веществ в растворе (3-ий тип):
- Смешали 0,4 г соли и 200 мл
воды. Какова массовая доля соли в полученном растворе? Ответ: 0,002.; - Смешали гидроксид натрия NaOH
в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в
полученном растворе? Ответ: 0,038;
Примеры:
Решение
1-ой задачи:
|
m (с) = 0,4
|
m (H2O) |
Решение 2-ой
задачи:
|
n(NaOH)
|
m(NaOH) |
Реши
самостоятельно:
1.Смешали 20 г сахара и 250 мл воды.
Какова массовая доля сахара в полученном растворе? Ответ: 0,074.;
2. Смешали 5 г сахара и 150 мл воды. Какова
массовая доля сахара в полученном растворе? Ответ: 0,032.;
3. Смешали 2 г соли и 140 мл воды. Какова
массовая доля соли в полученном растворе? Ответ: 0,014.;
4.Смешали 0,5 г соли и 300 мл воды. Какова
массовая доля соли в полученном растворе? Ответ: 0,00166.;
5. Смешали нитрат натрия NaNO3 в
количестве 0,1 моль с 0,5 л воды. Какова массовая доля нитрата натрия в
полученном растворе? Ответ: 0,0167.
4. Задачи на
определение процентного содержания веществ в растворе (4-ый тип):
Примеры:
1.К 150 г 20 %-ного раствора соляной
кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во
вновь полученном растворе? Ответ: 0,086 (8,6 %).;
2. К 120 г 1 %-ного раствора сахара
прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном
растворе? Ответ: 0,042 (4,2 %).;
Примеры:
Решение
1-ой задачи:
|
m (p.
|
m (HCl) |
Решение 2-ой
задачи:
|
m (p.
|
m(сахара) |
Реши
самостоятельно:
1. К 200 г 40 %-ного раствора серной
кислоты прилили 80 мл воды. Каково процентное содержание серной кислоты во
вновь полученном растворе? Ответ: 0,286 (28,6 %).;
2. К 90 г 6 %-ного раствора
поваренной соли прилили 200 мл воды. Каково процентное содержание поваренной
соли во вновь полученном растворе? Ответ: 0,0186 (1,86 %).;
3. К 140 г 15 %-ного раствора
сахара долили 160 мл воды. Каково процентное содержание сахара во вновь
полученном растворе? Ответ:0,07(7 %).;
4. К 200 г 40 %-ного раствора
уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной
кислоты во вновь полученном растворе? Ответ: 0,16 (16 %).;
5. К 80 г 30 %-ного раствора щелочи
долили 420 мл воды. Каково процентное содержание щелочи во вновь полученном
растворе? Ответ: 0,048 (4,8 %).;
2.2. Молярная концентрация раствора (См) –
количество вещества, растворенного в 1000 мл раствора (1 л), (выражается
числом молей в одном литре раствора).
1м одномолярный раствор = 1 моль/л
2 м двумолярный раствор =2 моль/л
0,1 м децимолярный раствор
0,2 м двудецимолярный раствор
0,01 м сантимолярный раствор
0,001 м милимолярный раствор
![]() (м),
(м),
где
М – молярная масса растворенного вещества, V – объем полученного раствора
или
![]() (моль/л)
(моль/л)![]()
Нахождение массы растворенного вещества:
![]()
Примеры:
- Приготовить децимолярный раствор
сульфата натрия.
См=0,1 м
М (Na2SО4)=142
г/моль
m(Na2SО4)=142![]() 0,1=14,2 г
0,1=14,2 г
Отвешиваем
14,2 г сульфата натрия, высыпаем в мерную колбу и доливаем воды до 1 литра.
2. Приготовить
600 мл 2 м раствора карбоната натрия.
|
Дано |
Решение |
|
V = 600 См Найти m |
М Na2СО3= 106 m= Отвесить |
Реши самостоятельно:
1.
Сколько
грамм тиосульфата натрия Na2S2O3![]() 5Н2О нужно для
5Н2О нужно для
приготовления 250 мл 0,1 м раствора.
2.
66,8
г серной кислоты растворили в 133 г воды. Определите молярную концентрацию
если раствор с плотностью 1,25 гр/см3.
3.
Вычислите
молярность раствора, приготовленного в мерной колбе на 500 мл из 4,98 г КI.
4.
Рассчитайте
массу вещества Na2СО3,
содержащегося в 200 мл 0,24 М раствора.
5.
Определите
молярную концентрацию вещества в растворе CuSO4,
приготовленном в мерной колбе на 500 мл из 11,25 г кристаллогидрата CuSO4![]() 5Н2О.
5Н2О.
2.3. Нормальная
концентрация или эквивалентная (Сн, Сэ, СN) –выражается
числом эквивалентов растворенного вещества в 1 л раствора.
![]()
![]() (н),
(н),
где
Э – эквивалент растворенного вещества, V – объем
или
![]() (экв/л)
(экв/л)
Нахождение массы растворенного вещества:
![]()
Эквивалент –
реальная или условная частица вещества, которая химически равноценна одному
иону водорода (для обменных реакций) или одному электрону (для окислительно –
восстановительных реакций). Фактически это частица, обладающая одной единицей
валентности или оперирующая одним электроном.
Эквиваленты сложных веществ находятся:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Примеры:
- Приготовить 400 мл сантинормального
раствора сульфата натрия.
Сн=0,01 н ![]()
V=400 мл
М(Na2SO4)=142
г/моль преобразуем формулу
Э(Na2SO4)=71 ![]()
m(Na2SO4)=0,01![]() 71
71![]() 400
400![]() 1000=0,284 г
1000=0,284 г
2. Определить
нормальную концентрацию раствора содержащего 30 г хлорида алюминия в 500 мл
раствора.
|
Дано |
Решение |
|
m (AlCl3)=30 г V=500 мл Найти Сн-? |
Э (AlCl3)= Э (AlCl3)=133,5:3=44,5 Сн= |
Реши самостоятельно:
- Сколько грамм азотной кислоты
содержится в 2 л ее 0,1 н раствора? - Сколько гр. ортофосфорной кислоты
нужно для приготовления 10 мл 0,02 н раствора? - Какой объём 0,5 н раствора можно
приготовить из 24,44 г кристаллогидрата хлорида бария ВаСl2 2 H2O?
2 H2O? - Для нейтрализации 25 мл раствора
серной кислоты потребовалось 40 мл 0,1 н раствора гидроксида натрия.
Определите Сн раствора кислоты. - Какую реакцию имеет раствор,
полученный при смешивании 100 мл 0,1 н раствора серной кислоты с 50 мл 0,5
н раствора гидроксида калия? Сколько грамм образуется сульфата калия?
2.4.Моляльная
концентрация (Сm) – выражается
числом молей растворенного вещества в 1000 г растворителя
![]() =
=![]()
2.5. Переходы
концентраций.
1. Переход от процентной концентрации к
молярной концентрации:
![]() или
или ![]()
2. Переход от процентной концентрации к
нормальной концентрации:
![]() или
или
![]()
3. Переход от молярной концентрации к
процентной концентрации:
![]()
4. Переход от нормальной концентрации к
процентной концентрации:
![]()
Примеры:
1. Определить
нормальную концентрацию 20 % – ного раствора серной кислоты , если ρ=1,14 г/см3.
|
Дано |
Решение |
|
С%=20 % ρ (H2SO4) = 1,14 Найти Сн-? |
Э (H2SO4) = Сн Ответ: |
Реши
самостоятельно:
1. Найти молярную
концентрацию 60 % – ного раствора азотной кислоты, если плотность раствора
равна 1,373 г/см3.
2. Определить С%
двунормального раствора серной кислоты с плотностью 1,063 г/см3.
66,8 г серной
кислоты плотностью = 1,25 г/см3 растворили в 133,2 г воды.
Определите С%, См, Сн .
3. Какой объём 68%
– ного раствора азотной кислоты плотностью 1,4 г/см3 требуется для
приготовления 50 мл 2 н раствора?
4. Найдите
молярную концентрацию вещества Na2SO4 в 12% –
ном растворе с плотностью 1,11 г/мл.
5. 2 л хлора при
(н.у.) растворены в 5 л воды. Определите процентную и молярную концентрации
полученного раствора, если объем раствора принять равным объему воды.
2.6. Способы вычисления при приготовлении
разбавленных растворов из концентрированных.
1)
 ;
;
2)

Пример:
Для получения суперфосфата применяют
65%-ный раствор серной кислоты. Сколько 92%-ного раствора серной кислоты и воды
потребуется для приготовления 1 т этого раствора?
|
Дано |
Решение |
|
С1 =65% С2 = 92% m1 =1 т Найти: массу Н2SO4 (m2), и |
m (H2O)=1000-706=294 Ответ: |
Реши самостоятельно:
1. Какие объемы 37 % раствора НСl (ρ=1,19
г/см3) и воды нужны для приготовления 1 л 10 % раствора (ρ=1,049
г/см3).
2.Какие объёмы 95% раствора серной кислоты
(ρ=1835 г/л) и воды нужно для приготовления 1 л 25% раствора (ρ=1180 г/л).
3.Сколько 65% -ного раствора азотной
кислоты и воды нужно взять для приготовления 500г 15%-ного раствора этой
кислоты?
4.Какие объемы 30% ортофосфорной кислоты
(ρ=1,18 г/см3) и воды нужны для приготовления 100 л 8% раствора
(ρ=1,04 г/см3).
5.Сколько 22 н. раствора плавиковой
кислоты (ρ=1123 г/л) и 10 н. раствора плавиковой кислоты (ρ=1036 г/л)
потребуется для приготовления 20 н. раствора?
2.7. Способы
вычисления при смешивании растворов.
Метод «креста», диагональная схема,
правило смешивания, «Андреевский крест».
Используется для решения задач для двух
компонентов смеси при условии, что свойство компонентов поддаются аддитивному
сложению.
А- m, масса, объем или количество
первого компонента;
В – m, масса, объем или количество
второго компонента;
А+В , m, масса, объем или количество
смеси;
Х1– свойство первого
компонента;
Х2– свойство второго
компонента;
Х – свойство смеси.
Свойства: плотность твердого вещества,
относительная плотность, относительно атомная масса, относительно молекулярная
масса, молярная масса, концентрации (С%, Сн, См, Сm),
стехиометрический множитель.
 ,
,
отношение компонентов обратно
пропорционально разности величин свойств (концентраций) компонентов и смеси
диагональная схема
![]()
![]()
х1 х-х2
Х
![]() х2
х2
х1-х
Правило смешения не применимо к
расчету объемов растворов, концентрация которых выражается через отношение к
объему (кроме, слабо разбавленных).
Пример:
В каком отношении
должны быть взяты объемы 0,5 н. раствора и 0,1 раствора, чтобы получить 0,2 н.
раствор?
|
Дано |
Решение |
|
А- V 0,5 н В – V 0,1 н Х – 0,2 Х1 Х2 Найти |
Составляем
0,1
Ответ. 2
|
Реши
самостоятельно:
- Вычислите массовую долю раствора
полученного смешиванием 1000 т 60% раствора с 250 т 96% раствора. - Сколько грамм воды и 87% раствора
серной кислоты необходимо взять для приготовления 600 г 55% раствора? - Сколько граммов 8% и 75% растворов
необходимо взять для приготовления 400 г 42 % раствора? - Уксусная эссенция – 80% раствор
уксусной кислоты (СН3СООН). Сколько граммов этой эссенции и
воды необходимо взять для приготовления 200 мл 3 % раствора уксуса
применяемого как приправа к пище? Плотность эссенции можно принять равной
1 г/см3. - Сколько грамм нужно взять 20% и 32,1
% растворов соляной кислоты, чтобы приготовить 242 г 26,7% раствора
соляной кислоты?
2.8. Расчет
массы воды, которая прибавляется к раствору для разбавления его.
![]() , или
, или
![]() , где
, где
С1
– исходная концентрация, С – получившаяся концентрация, m – масса
раствора, V – объем
раствора.
Преобразованная формула нахождения
концентрации C=![]()
Расчет концентрации раствора при добавлении
к раствору вещества.
![]()
![]()
Пример:
К 327,5 г 50% – ного раствора вещества
добавили 140 г воды. Массовая доля вещества в конечном растворе равна?
|
Дано |
Решение |
|
m раствора =327,5 г
m (воды) = 140 г Найти: |
140= 140х=16375-327,5х 140х+327,5х=16375 467,5х=16375 х=35% Ответ: Р.S. можно
|
Реши самостоятельно:
1.
К
400 г раствора, массовая доля гидроксида калия в котором 0,45, добавлено 100 г
воды. Какова массовая доля щелочи в получившемся растворе?
2.
В
200 г 2%-ного раствора поваренной соли растворили 20 г хлорида натрия. Какова
массовая доля хлорида натрия в полученном растворе?
3.
К
450 г 15 %-ного раствора гидроксида кальция добавили 60 г того же вещества.
Массовая доля в конечном растворе равна?
4.
Какую
массу воды надо добавить к 200 г 70%-ного раствора уксусной кислоты, чтобы
получить 9%-ный раствор?
5.
К
300 г 10%-ного раствора сахарозы добавили 150 мл воды. Какова массовая доля
сахарозы в полученном растворе?
2.9. Упаривание раствора.
Задача
№ 1. Вычислите массу воды, которую надо выпарить из 1 кг 3%- ного раствора
сульфата меди для получения 5% – ного раствора.
Решение: для решения данной задачи так же
возможно применение рассмотренного выше способа.
Проанализировав условие, составим схему:
0,03 0
0,05
– =
исходный
вода полученный
раствор
раствор
Составим и решим
уравнение:
1· 0,03 – х · 0 =
(1 – х) · 0,05
0,03 = 0,05 – 0,5х
0,05х = 0,02
х = 0,4
Ответ: масса воды составит 0,4 кг или 400
г.
Задача
№ 2. Вычислите массовую долю хлорида натрия в растворе, если из 30г 10 %
раствора соли при нагревании испаряется 10 мл воды.
Решение: определим
массу испарившейся воды, зная, что плотность воды равна 1г/мл.
m
(H2
O)
= 10 мл · 1г/мл = 10г
Составим схему к
задаче:
0,1 0 х
–
=
исходный
вода полученный
раствор раствор
На основании
схемы составим уравнение:
30 · 0,1 – 10 · 0
= ( 30 -10) · х
3 = 20 х
х = 0,15 = 15%
Ответ: массовая доля соли в полученном
растворе 15%
Задача
№ 3. Раствор соли объемом 80 мл, имевший плотность 1,1 г/мл выпарили, получив 12
г сухого остатка. Определите массовую долю соли в исходном растворе.
Решение: определим массу исходного
раствора по формуле m = V·ρ
m
(раствора) = 80 мл · 1,1г/мл = 88 г
Составим схему к
задаче:
х 0
1%
– =
исходный вода
сухой
раствор
остаток
Составим уравнение:
88 · х = 12 · 1
88х = 12
х = 12 : 88
х
= 0,136 = 13,6%
Ответ: массовая доля соли в исходном
растворе составляла 13,6 %
Реши самостоятельно:
1. Из 170 г 9%
раствора выпарили 50 г растворителя. Определите массовую долю соли в
полученном растворе.
2. Определите
массу воды, которую нужно выпарить из 340 г раствора хлорида цинка с массовой
долей соли 4% чтобы массовая доля соли в полученном растворе увеличилась на
1,5%.
3. Раствор соли
объемом 60 мл, имевший плотность 1,3 г/мл, с массовой долей соли 3% нагрели. В
результате испарилось 10 мл воды. Определите массовую долю соли в полученном
растворе.
4. Вычислите
массовую долю хлорида натрия в растворе, если из 50г 10 % раствора соли при
нагревании испаряется 20 мл воды.
5. Вычислите массу воды, которую надо
выпарить из 2 кг 5%- ного раствора сульфата натрия для получения 7% – ного
раствора.
2.10. Смешивание
растворов разных концентраций.
Задача № 1. Вычислить
массовую долю гидроксида натрия в растворе, полученном при сливании 10 мл 40%
раствора (плотность 1, 52 г/ мл) и 10 мл 10% раствора (плотность 1,1 г/мл).
Решение: определим
массы исходных растворов.
m1
= 10· 1,52 г/мл =15,2 г
m2
= 10 · 1,1 г/ мл = 11 г
Согласно условию задачи составим схему:
0,4 0,1 х
+
=
раствор 1 раствор
2 полученный
раствор
Составим уравнение:
15,2 · 0,4 + 11 ·
0,1 = (15,2 + 11) · х
6,08 + 1,10 = 26,2
х
7,18 = 26,2х
х = 7,18 : 26,2
х = 0,274 = 27,4%
Ответ: массовая доля гидроксида натрия в
полученном растворе составляет 27,4%.
Задача
№ 2. Смешали два раствора: один массой 90 г и с массовой долей соли 5%, другой
массой 125 г и с массовой долей этой же соли 4%. Вычислите массу соли в
образовавшемся растворе.
Решение: определим массовую долю соли в
получившемся растворе. Для этого составим схему:
0,05 0,04 х
+
=
раствор 1
раствор 2 полученный
раствор
Используя данную
схему, составим уравнение:
90 · 0,05 + 125 ·
0,04 = (90 + 125) · х
4,5 + 5 = 215х
9,5 = 215х
х = 9,5 : 215
х =0,044 = 4,4%
Далее, применив
формулу для вычисления массовой доли вещества в растворе, рассчитаем массу
соли.
m
(соли) = 4,4% · 215г : 100% = 9,46 г
Ответ: масса соли
составляет 9,46 г
Задача
№ 3. Сколько граммов 75% раствора кислоты надо добавить к 30 г 15% раствора
кислоты, чтобы получить 50% раствор?
Решение: составим
схему
0,75 0,15 0,5
+
=
На основании
данной схемы составим и решим уравнение:
0,75 · х + 30 ·
0,15 = (х + 30) ·0,5
0,75х + 4,5 = 0,5
х + 15
0,25х = 10,50
х = 10,50 : 0,25
х = 42 г
Ответ: необходимо добавить 42 г 75%
раствора кислоты.
Задача
№ 4. Какой объем раствора с массовой долей серной кислоты 60% (плотность 1,5
г/мл) и раствора с массовой долей серной кислоты 30% (плотность 1,2 г/мл) надо
взять для приготовления раствора массой 240 г с массовой долей кислоты 50%?
Решение: Обозначим
массу 1-го раствора – х г, тогда масса 2-го раствора – (240 – х) г.
На основании этих
данных составим схему:
0,6 0,3 0,5
+ =
Составим
уравнение:
0,6 · х + (240 –
х) · 0,3 = 240 · 0,5
0,6х + 72 – 0,3х
= 120
0,3х = 120 – 72
0,3х = 48
х = 160г – масса
1-го раствора
масса 2-го
раствора = 240 – 160 = 80 г
Найдем объем
растворов:
V1
= m
/ ρ
= 160 : 1,5 = 106,7 мл
V2
= m
/ ρ
= 80 : 1,2 = 66,7 мл
Ответ Объемы
растворов равны 106,7 мл и 66,7 мл
Задача № 5. В лаборатории имеется 2 кг
раствора кислоты одной концентрации и 6кг раствора кислоты другой концентрации.
Если растворы смешать, то получится раствор, концентрация которого составляет
36%. Если же смешать равные массы этих растворов, то получится раствор,
содержащий 32% кислоты. Какова концентрация каждого из двух имеющихся
растворов?
Составим схемы.
Схема №1:
х у 0,36
+ =
Схема № 2
х у 0,32
+
=
Составим и решим
систему уравнений:
![]() 2х
2х
+ 6у = 8 · 0,36
mх + mу = 0,64m
![]() 2х
2х
+ 6у = 2,88
х + у = 0,64
![]()
2х + 6у = 2,88
х = 0,64 – у
![]() 2·
2·
(0,64 – у) + 6у = 2,88
х = 0,64 – у
![]() 1,28
1,28
– 2у + 6у = 2,88
х = 0,64 – у
4у=
1,6 у= 0,4 = 40%
х = 0, 64 – у
; х = 0,24 = 24%
Ответ:
концентрации растворов 24% и 40%
Задачи для закрепления:
1. В лаборатории имеются растворы с
массовой долей хлорида натрия 10 и 20%. Какую массу каждого раствора надо взять
для получения раствора с массовой долей соли 12% массой 300 г?
2. Смешали 250 г 10% и 750 г 15% растворов
глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
3. Какова будет массовая доля азотной
кислоты в растворе, если к 40 мл 96% раствора HNO3
(плотность 1,5 г/мл) прилить 30 мл 48% раствора HNO3
(плотность 1,3 г/мл)?
4. Смешали 30% раствор соляной кислоты с
10% и получили 600 г 15% раствора. Сколько граммов каждого раствора было взято?
5. Кусок сплава меди и цинка массой 36 кг
содержит 45% меди. Какую массу меди нужно добавить к этому куску, чтобы
полученный новый сплав содержал 60% меди?
2.11.
Приготовление растворов из навески кристаллогидрата.
Задача № 1. Сколько граммов
кристаллогидрата Na2SO4
· 10 H2O
необходимо добавить к 50 мл 8% раствора сульфата натрия (плотность 1,07 г/ мл),
чтобы увеличить массовую долю вещества в растворе в 3 раза?
Решение: решая данную задачу, учтем, что
кристаллогидрат это вещество, в кристаллической решетке которого содержатся
молекулы воды. Поэтому вычислим массовую долю безводной соли в составе
данного кристаллогидрата.
Мr
(Na2SO4 · 10 H2O) = Аr
(Na) · 2 + Аr (S) · 1 + Аr
(О) · 4 + Мr
(H2O) · 10 = 23 · 2 + 32 · 1 + 16 · 4 + 10 · 1 · 2 + 10 · 16 =
322
Мr
(Na2SO4)
= 142
w
(Na2SO4)
= 142 : 322 = 0,44
2. Вычислим массу
раствора сульфата натрия: m
= V·
ρ = 50 · 1, 07 = 53,5 г
3. Составим схему
к задаче:
0,08 0, 44 0,08 · 3
+
=
раствор Na2SO4
· 10 H2O
полученный раствор
Na2SO4
Используя данную
схему, составим и решим уравнение:
53,5 · 0,08 + х ·
0,44 = (53,5 + х) · 0,24
4,28 + 0,44 х =
12,84 + 0,24 х
0,2 х = 8,56
х = 42,8 г
Ответ: масса Na2SO4
· 10 H2O
составит 42,8 г
Реши самостоятельно:
1. Сколько граммов кристаллогидрата Na2SO4
· 10 H2O
необходимо добавить к 100 мл 8% раствора сульфата натрия (плотность 1,07 г/
мл), чтобы удвоить массовую долю вещества в растворе?
2. Кристаллогидрат сульфата меди
(кристаллизуется с 5 молекулами воды) массой 5г растворили в воде количеством 5
моль. Рассчитайте массовую долю соли в полученном растворе.
3. Какую массу медного купороса CuSO4
· 5H2O
необходимо взять для приготовления 40 кг 2 % раствора сульфата меди?
4. Из 500 г 40% раствора сульфата железа (II)
при охлаждении выпало 100 г его кристаллогидрата (кристаллизуется с 7
молекулами воды). Какова массовая доля вещества в оставшемся растворе?
5. Вычислите массу MgSO4
· 7H2O
и воды необходимых для приготовления 120 мл раствора сульфата магния (плотность
1,0623 г /мл) с массовой долей соли 6,2%.
2.12. Концентрирование растворов.
Задача № 1. Какую массу сухой соли нужно
добавить к 15г 5% раствора хлорида натрия, чтобы получить 8% раствор соли.
Решение:
При решении подобных задач необходимо
учесть, что к раствору добавляется чистое вещество, а значит, его массовая доля
составляет 100% или 1.
Используя данные условия, составим схему:
0,05
1 0,08
+ =
исходный NaCl
полученный
раствор
раствор
По схеме составим
уравнение:
15 · 0,05 + х · 1
= (15 + х) · 0,08
0,75 + х = 1,2 +
0,08 х
0,08 х = 1,2 –
0,75
0,08 х = 0,45
х = 0,45 : 0,08
х = 5,62 г
Ответ: масса сухой
соли составляет 5,62 г
Реши самостоятельно:
1. К раствору
хлорида бария массой 120 г с массовой долей соли 2% добавили 1,6 г этой же
соли. Вычислите массовую долю соли в полученном растворе.
2. Через 1 л
раствора аммиака с массовой долей, равной 10% (плотность 0,96 г/мл), пропустили
10 л аммиака (н.у.). Вычислите массовую долю аммиака в образовавшемся
растворе.
3. К 15 мл 48 %
раствора азотной кислоты (плотность 1,3 г/мл), добавили 5 мл
концентрированной кислоты (плотность 1,5 г/мл). Определите массовую долю
кислоты в полученном растворе.
4. Вычислите массу
хлорида натрия, которую необходимо добавить к 15 г 3% раствора для увеличения
массовой доли соли в 2 раза.
Литература:
1.
Хомченко Г.П., Хомченко И.Г. «Сборник задач по химии для поступающих в ВУЗы»
Москва. Новая волна – 2008г.
2.
И.Г. Хомченко «Сборник задач и упражнений по химии для средней школы»
Москва. Новая волна – 2008г.
3.
Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и
поступающих в ВУЗы» Дрофа 1999г.
4.
И.М. Акилова, С.Г. Самохвалова, Д.Г. Шевко « Математика. Методические указания
к
решению задач по математике для учащихся вечернего лицея и слушателей
подготовительных курсов» Благовещенск АМГУ 2007 г.
5.
ЕГЭ – Химия 2011 под редакцией А.А. Ковериной. Москва Национальное образование
2011 г.



