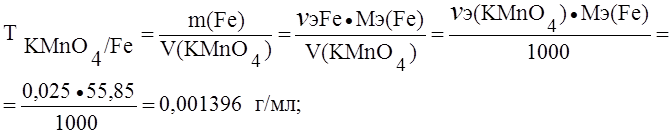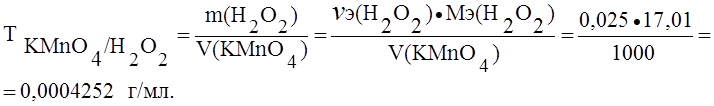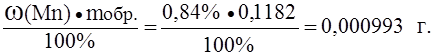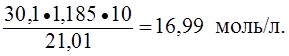Как вычислить титр
Очень часто в химическом анализе вместо массовой концентрации используется титр раствора, который показывает содержание любого вещества в одном миллилитре раствора. Для записи титра принято условное обозначение в виде заглавной латинской буквы t. А единицей его измерения является г/мл .

Вам понадобится
- – бумага;
- – ручка;
- – калькулятор.
Инструкция
Для нахождения титра по растворенному веществу (простой титр) воспользуйтесь формулой:T = m/V,где T – титр; m – масса вещества, растворенного в жидкости, V – объем раствора в миллилитрах или кубических сантиметрах.
Кроме этого, титр вы сможете вычислить по определяемому веществу. Эту величину еще называют условным титром. Для этого понадобится формула: T (a/b) = mb/ Va,где Т (a/b) – титр раствора вещества a по веществу b; mb – масса вещества b(в граммах), которое взаимодействует с данным раствором; Va – объем раствора вещества a (в миллилитрах).
Например, нужно найти титр раствора фосфорной кислоты массой 18 г, полученного при растворении Н3РО4 в 282 миллилитрах воды. Плотность раствора равна 1,031 г/мл. Для начала найдите массу, приготовленного раствора, учитывая при этом, что 282 мл воды будут равны 282 г: 28+282 = 300 (г). Затем, посчитайте его объем: 300/ 1,031 = 291 (мл). Теперь подставьте в формулу и найдите титр: 18/291 = 0,0619(г/мл).
Помимо выше описанных методов, вы также можете вычислить титр, зная эквивалентную массу и нормальность (эквивалентную концентрацию).T = Сн*Mэкв/1000,где T – титр, Cн – нормальность, Mэкв – эквивалентная масса.
Нередко вы столкнетесь с задачами, в которых потребуется выразить титр одного вещества через другое. Например, дано условие: на титрование 20 мл раствора соляной кислоты с титром 0,0035 г/мл было потрачено 25 мл раствора гидроксида натрия. Надо вычислить титр NaOH по HCl.
Сначала запишите уравнение реакции: NaOH + HCl = NaCl + H2O. Затем вычислите титр раствора щелочи по формуле: T (NaOH) =T(HCl)*V(HCl)*M(NaOH) / M(HCl)*V(NaOH). Подставив цифровые значения, получите титр гидроксида натрия равный 0,0031 г/мл. Осталось вычислить необходимое для решения задачи значение:T (NaOH/HCl) = T(NaOH)* Мэкв(HCl) / Мэкв(NaOH) =0,0028 г/мл
Полезный совет
Не смотря на одинаковые единицы измерения, никогда не путайте титр раствора с его плотностью. Ведь величина плотности показывает массу одного кубического сантиметра раствора, а не массу растворенного вещества в нем.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 

См = 
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ – e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 – 2e – ® 2H+ + O2 ® Мэ(H2O2) = М(H2O2) = 17,01 г/моль.
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) =
® Т NaAsO2/Mn = 
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e – ® NO + 2H2O.
Решение.
Сэ = 
M(HNO3) = 

Мэ(HNO3) = М(HNO3) =
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) =
Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
Титр связан и с массовой долей растворенного вещества:
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.
Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.
Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?
Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.
Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
В
основе метода лежит реакция, которую в
общем виде можно представить как Н+
+ ОН–
= Н2О.
Этим методом определяют концентрации
кислот, щелочей, а также солей,
подвергающихся гидролизу. Рабочими
растворами из кислот являются соляная
и серная, из щелочей – гидроксиды натрия
и калия. Концентрации кислот устанавливают
по карбонату натрия (Na2CO3)
или тетраборату натрия (Na2B4O7.10H2O).
Концентрации щелочей – по щавелевой
(Н2С2О4.2Н2О)
или янтарной (Н2С4О4Н4)
кислотам.
В
процессе титрования изменяется рН
раствора и на этом основано определение
точки эквивалентности. Для ее фиксирования
используют кислотно-основные индикаторы.
Каждый индикатор меняет свою окраску
в некотором узком интервале значений
рН, близком к рН в точке эквивалентности.
Значение рН, при котором заканчивают
титрование с данным индикатором,
называется показателем титрования
(рТ). Так, для метилового оранжевого
область перехода окраски составляет
3,1–4,4 (рТ = 4), для метилового красного –
4,4–6,2 (рТ = 5,5), для лакмуса – 5,0–8,0 (рТ
= 7) и для фенолфталеина – 8,0–10,0 (рТ
= 9).
Лабораторная работа 7 Приготовление и стандартизация раствора соляной кислоты
Соляная
кислота не относится к тем веществам,
из которых можно приготовить раствор
точно концентрации по навеске. Поэтому
сначала готовится раствор кислоты
приблизительной концентрации, а точная
концентрация устанавливается путем
титрования по Na2CO3
или по Na2B4O7.10H2O.
-
Приготовление
раствора соляной кислоты
По
формуле С(HCl) =
рассчитывается
масса хлороводорода, необходимая для
приготовления 1 л раствора кислоты с
молярной концентрацией эквивалента
0,1 моль/л.
m(HCl)
= C(HCl)
. Mэ(HCl)
.V(р-ра),
где
Mэ(HCl) = 36,5 г/моль;
m(HCl)
= 0,1. 36,5
. 1
= 3,65 г.
Поскольку
раствор соляной кислоты готовится из
концентрированной, необходимо с помощью
ареометра измерить ее плотность и по
справочнику найти, какому процентному
содержанию соответствует кислота такой
плотности. Например, плотность ()
= 1,19 г/мл,
= 37 %, тогда
m(р-ра)
=
г;
V(р-ра)
= m(р-ра)/
= 9,85/1,19 = 8 мл.
Таким
образом, для приготовления 1 л раствора
HCl, C(HCl) = 0,1 моль/л, отмеривают при помощи
цилиндра (объемом 10 – 25 мл) или
градуированной пробирки около 8 мл
соляной кислоты (
= 1,19 г/мл), переносят ее в склянку с
дистиллированной водой и доводят раствор
до метки. Приготовленный таким образом
раствор HCl имеет приблизительную
концентрацию (
0,1 моль/л).
2.
Приготовление
стандартного раствора карбоната натрия
Рассчитывается
навеска карбоната натрия, необходимая
для приготовления 100,0 мл раствора с
молярной концентрацией эквивалента
0,1 моль/л.
m(Na2CO3)
= Cэ(Na2CO3).
Mэ(Na2CO3).
V(р-ра),
где
Mэ(Na2CO3)
= M(Na2CO3)/2
= 106/2 = 53 г/моль;
m(Na2CO3)
= 0,1.53.0,1
= 0,53 г.
Предварительно
на технических весах взвешивают 0,5–0,6
г Na2CO3.
Переносят навеску на часовое стекло,
заранее взвешенное на аналитических
весах, и точно взвешивают стекло с
навеской. Навеску переносят через
воронку в мерную колбу на 100 мл, добавляют
приблизительно до 2/3 объема дистиллированной
воды. Содержимое колбы перемешивают
осторожными вращательными движениями
до полного растворения навески, после
чего доводят раствор до метки.
3.
Стандартизация раствора соляной кислоты
Для
установления точной концентрации
соляной кислоты используется приготовленный
раствор Na2CO3
точной концентрации. Водный раствор
карбоната натрия вследствие гидролиза
имеет щелочную реакцию среды:
Na2CO3
+ 2H2O
= 2NaOH + H2CO3
(реакция
гидролиза);
2NaOH
+ 2HCl = 2NaCl + 2H2O;
___________________________________________________
Na2CO3
+ 2HCl = 2NaCl + H2CO3
(реакция
титрования).
Из
суммарного уравнения видно, что в
результате реакции в растворе накапливается
слабая угольная кислота, определяющая
рН в точке эквивалентности:
рН
= 1/2 рК1(Н2СО3)– 1/2 lgС(H2CO3)
= 1/2 .
6,35 – 1/2lg 0,1 = 3,675.
Для
титрования лучше всего подходит метиловый
оранжевый.
Бюретку
ополаскивают приготовленным раствором
HCl и наполняют ее почти доверху раствором
соляной кислоты. Затем, подставив под
бюретку стакан и приоткрыв зажим,
заполняют нижний конец бюретки так,
чтобы в ней не оставалось пузырьков
воздуха, нижний мениск раствора HCl в
бюретке должен находиться на нулевом
делении. При отсчете по бюретке (и
пипетке) глаз должен быть на уровне
мениска.
Ход
определения.
В колбу для титрования пипеткой отбирают
10,00 мл приготовленного раствора Na2CO3,
добавляют 1–2 капли метилового оранжевого
и титруют раствором HCl до изменения
цвета из желтого в оранжево-розовый.
Опыт повторяют несколько раз, полученные
результаты заносят в таблицу 4, находят
средний объем соляной кислоты и
рассчитывают ее молярную концентрацию
эквивалента, титр и титр по определяемому
веществу.
Таблица
4
|
№ опыта |
V |
V |
|
1 |
10 |
|
|
2 |
10 |
|
|
3 |
10 |
|
|
Средний |
10 |
Vср(HCl)
=(мл);
С(HCl).V(HCl)
= Cэ
(Na2CO3)
.V(Na2CO3);
C(HCl)
=
Т(HCl)
=
(г/мл);
Т(HCl/NaOH)
=
(г/мл).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 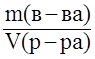
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 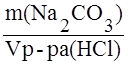
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 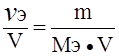
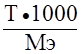
См = 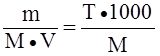
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ – e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 – 2e – ® 2H+ + O2 ® Мэ(H2O2) = М(H2O2) = 17,01 г/моль.
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) =
® Т NaAsO2/Mn = 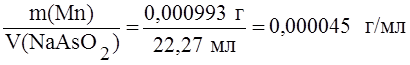
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e – ® NO + 2H2O.
Решение.
Сэ = 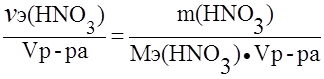
M(HNO3) = 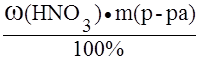
Vр-ра=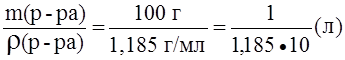
Мэ(HNO3) = М(HNO3) =
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) =