
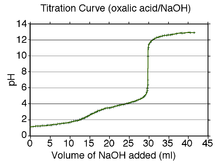
Типичный вид кривой титрования раствора 0,5 М двухосновной щавелевой кислоты 1 М раствором сильного одноосновного основания (гидроксидом натрия). Видны обе точки эквивалентности в перегибах кривой, особенно наглядные на кривой (снизу) первой производной pH по объёму добавленного титрующего раствора.
Точка эквивалентности в титриметрическом анализе — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
На графике кривой титрования присутствует одна или несколько точек перегиба, соответствующих точкам эквивалентности. Точкой окончания титрования (подобна точке эквивалентности, но не то же самое) считают момент, при котором индикатор изменяет свой цвет при колориметрическом титровании.
Методы определения точки эквивалентности[править | править код]
С помощью индикаторов[править | править код]
Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например, фенолфталеин, изменяют свой цвет в зависимости от pH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Правило выбора индикатора — при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, то есть интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
Потенциометрия[править | править код]
В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется.
С помощью pH-метров[править | править код]
pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использования ионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
Электрическая проводимость[править | править код]
Проводимость растворов электролитов зависит от концентрации и подвижности находящихся в нём ионов. В процессе титрования проводимость часто значительно изменяется (например, при кислотно-основном титровании, ионы 


Общая проводимость раствора зависит и от других присутствующих ионов (например, противоионов), которые вносят в проводимость различный вклад. Этот вклад, в свою очередь, зависит от подвижности каждого сорта ионов и от общей концентрации ионов (ионной силы). Поэтому предсказать изменение проводимости гораздо сложнее, чем измерить её.
Изменение цвета[править | править код]
При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления.
Осаждение[править | править код]
Если во время реакции образуется твердое нерастворимое вещество, то по окончании титрования образуется преципитат (осадок). Классическим примером такой реакции является образование крайне малорастворимого хлорида серебра 


Изотермическое калориметрическое титрование[править | править код]
Используется изотермический титровальный калориметр, который по количеству теплоты, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом.
Термометрическая титриметрия[править | править код]
Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности как показано на рисунке.
Спектроскопия[править | править код]
Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр поглощения продукта титрования, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах.
Амперометрия[править | править код]
Этот метод позволяет определить точку эквивалентности по величине тока, протекающего через раствор при заданном напряжении на электродах. Величина тока рабочего электрода при реакции окисления/восстановления исследуемого вещества или продукта зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галогенидов ионами серебра 
Литература[править | править код]
- Болотов В. В., Гайдукевич А. Н., Свечникова Е. Н. и др. Аналитическая химия. — Харьков: Издательство НФАУ, 2001. — 455 с. — 2500 экз. — ISBN 966-615-079-4.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
Точку
эквивалентности с помощью кривых
потенциометрического титрования находят
как точку перегиба кривой титрования
одним из двух описанных ниже способов.
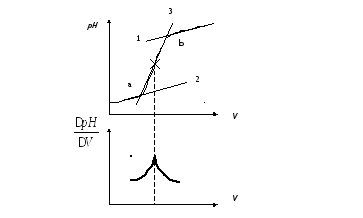
Рис.
3.11. Способы нахождения точки эквивалентности
с помощью кривых потенциометрического
титрования.
По
первому способу (рис. 3.11) проводят две
параллельные касательные 1 и 2. Затем
через вертикальный участок кривой
титрования проводят третью прямую 3:
“отрезок ав”, делят пополам.
Полученная точка отвечает точке
перегиба кривой титрования и соответственно
точке эквивалентности.
По
второму способу строят дифференциальную
кривую титрования, т.е. зависимость ![]() .
.
Для этой цели данные титрования
пересчитывают, определяя рH через
определенное значение V и находят
отношение ![]() .
.
Hа
дифференциальной кривой точку
эквивалентности находят как точку ее
максимума.
3.3.3. Практические работы
Работа
1. Потенциометрическое кислотно-основное
титрование сильных и слабых кислот
(HС1, H2SO4,
HNO3,
CH3COOH,
H2C2O4
и др.)
1. Аппаратура, материалы и реактивы
Установка
для потенциометрического титрования
рH-метр-милливольтметр
рH-121 (или другой марки)
Стеклянный
индикаторный электрод с водородной
функцией ЭСЛ-43-07 или ЭСЛ-63-07.
Хлорсеребряный
электрод сравнения типа ЭВЛ-1М3
Магнитная
мешалка с мешателем
Стаканчик
для титрования вместимостью 100 мл
Бюретка
вместимостью 25 или 50 мл
Пипетка
вместимостью 5 мл
Стандартный
раствор HС1, 0,1000 М (готовят из фиксанала)
Раствор
NaOH 0,1 М
Стандартные
буферные растворы.
2.
Выполнение работы
1)
Подготовить прибор к работе, как указано
в описании к прибору.
2)
Hастройка прибора по буферному раствору
– см. работу 1, раздел 3.2.3.
3)
Определение концентрации рабочего
раствора NaOH (титранта). В стаканчик для
титрования отобрать пипеткой 5 мл
стандартного раствора HС1, добавить в
него дистиллированную воду до уровня,
обеспечивающего погружение электродов
в раствор.
Включить
магнитную мешалку и регулятором скорости
вращения обеспечить нормальное
перемешивание раствора.
Бюретку
заполнить титрантом и приступить к
титрованию. По мере приливания титранта
измеряют рH раствора в соответствии с
инструкцией к прибору.
Сначала
проводят ориентировочное титрование
и устанавливают область скачка, добавляя
титрант через 0,5-1 мл. Затем проводят
титрование для определения конечной
точки титрования. При этом, после каждого
добавления титранта измеряют значение
рH раствора. Титрант добавляют через
0,5 мл на начальном участке кривой
титрования и через 0,1-0,2 мл в области
скачка кривой титрования. Результаты
вносят в табл. 1. Проводят не менее трех
титрований.
Таблица
1
Результаты
титрования стандартного раствора HС1
раствором
NaOH для установления точной концентрации
титранта
|
1 |
2 |
3 |
|||
|
V(NaOH), мл |
рН |
V(NaOH), мл |
рН |
V(NaOH), мл |
рН |
|
1 |
|||||
|
2 |
|||||
|
3 |
|||||
|
и |
После
скачка титрования необходимо добавлять
титрант через 0,5 мл (чтобы получить еще
5-6 точек для построения полной кривой
титрования).
По
полученным данным на миллиметровой
бумаге строят кривые титрования, по
которым устанавливают конечную точку
титрования. Берут среднее значение
объема титранта V(NaOH),
пошедшего на титрование, рассчитывают
концентрацию NaOH по формуле
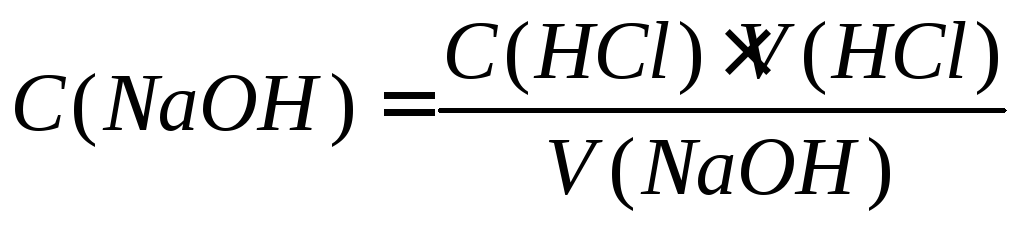
4)
Определение содержание HС1 и СH3СООH
(или другой кислоты по усмотрению
преподавателя). Полученные в мерных
колбах растворы HС1 и СH3СООH
доводят до метки дистиллированной водой
и тщательно перемешивают.
Затем
отбирают пипеткой 5 мл первого из них
(раствор HС1) и помещают в стаканчик для
титрования. Добавляют достаточное
количество дистиллированной воды для
полного покрытия электродов и проводят
титрование как описано выше.
Проводят
не менее трех титрований и по результатам
каждого из них строят кривые
потенциометрического титрования.
Конечную точку титрования находят одним
из описанных выше способов. Вычисляют
среднее значение объема титранта.
Аналогично
поступают при определении содержания
СH3СООH
в растворе.
Содержание
каждой кислоты рассчитывают по формуле
 ,
,
где
m
– навеска кислоты, г; V(NaOH)
– объем титранта, затраченный на
титрование, мл; М
– молярная масса кислоты, г/моль; Vк
– вместимость мерной колбы, мл; Vп
– вместимость пипетки, мл.
3.
Окончание работы
По
окончании работы электроды промывают
дистиллированной водой, наливают в
стаканчик дистиллированную воду и в
нее погружают электроды. Прибор выключают
из сети.
Работа
2 Потенциометрическое кислотно-основное
титрование смеси HС1 и СH3СООH
Потенциометрическое
кислотно-основное титрование может
быть использовано для определения не
только индивидуальных кислот, но и их
смесей. При этом, однако, следует иметь
ввиду, что раздельное титрование двух
кислот может быть осуществимо только
в том случае, если константы диссоциации
анализируемых кислот отличаются друг
от друга, по крайней мере, на четыре
порядка (см. раздел 3.3.1).
Кривая
титрования в данном случае имеет две
точки перегиба, причем первый перегиб
отвечает нейтрализации более сильной
кислоты. Так, например, при титровании
смеси соляной и уксусной кислот первой
будет оттитровываться соляная кислота,
как более сильная и только после этого
будет титроваться более слабая —
уксусная кислота.
Значительно
более лучшие условия для раздельного
определения кислот, находящихся в смеси,
могут быть созданы при использовании
в качестве среды для проведения реакции
титрования специальным образом
подобранного неводного, как правило,
органического или смешанного
водно-органического растворителя. В
данном случае, раздельное титрование
становится более четким и, таким образом,
может быть осуществлен анализ смеси
кислот даже с мало отличающимися
константами диссоциации.
В
качестве индикаторного электрода при
кислотно-основном титровании в неводных
и смешанных растворителях, также как и
в водных растворах, широко применяют
стеклянный электрод с водородной
функцией. Титрование проводят с
использованием шкал “+mV”
или “-mV”
или обычной шкалы “рH”
прибора. Hеобходимо, однако, обратить
внимание на тот факт, что в последнем
случае наблюдаемые величины рH
являются только относительными,
показывающими изменение этого параметра
в ходе реакции титрования. Прямой расчет
активности ионов водорода в растворе
по этим данным невозможен ввиду наличия
больших диффузионных и межфазных
потенциалов на границе электрод сравнения
– исследуемый раствор при проведении
измерений в неводных и смешанных
водно-органических растворителях.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
Что такое точка эквивалентности
Титрование представляет собой процесс постепенного добавления раствора известной концентрации к раствору, концентрацию которого требуется определить. Ключевым моментом в титровании будет фиксирование точки, в которой количество добавленных активных частиц титранта сравняется с количеством реагирующих частиц в титруемом растворе.
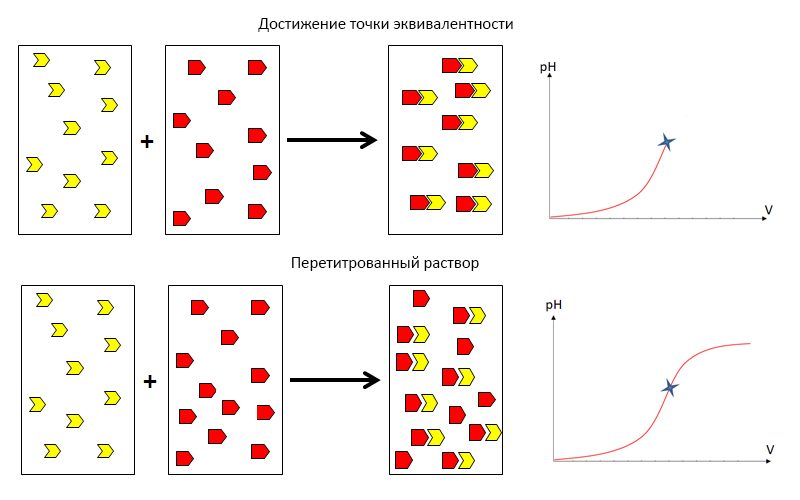
Рис.1. Стадии титрования
В этом случае количество взаимодействующих частиц в титруемом растворе будет эквивалентным, а само состояние системы в этот момент называют точкой эквивалентности (ТЭ).
Как визуально определить точку эквивалентности
При ручном титровании момент достижения точки эквивалентности определяется по изменению окраса титруемого раствора, появлению осадка, другим явно наблюдаемым признакам. Однако если исходные компоненты бесцветные и их смешение не сопровождается внешними проявлениями, то к определяемому веществу добавляют специальный реактив – индикатор титрования, который реагирует на изменения свойств раствора, меняя окраску, что позволяет обнаружить ТЭ.
Индикаторы – это вещества, способные обратимо изменять свою окраску в зависимости от текущего состояния системы. К значимым характеристикам раствора, которые можно отслеживать в присутствии индикаторов относятся: значение pH, наличие определенных катионов или анионов, способность компонентов раствора к комплексообразованию.
Обычно изменение цветности раствора при достижении точки эквивалентности происходит с некоторым опозданием. Этот момент называется точкой конца титрования (ТКТ), которая не всегда совпадает с точкой эквивалентности. Чем больше различие между ТКТ и ТЭ, тем больше ошибка метода. Поэтому выбор индикатора, который позволит зафиксировать конечную точку титрования максимально близко к точке эквивалентности, является важнейшей задачей при создании методики ручного титрования.
Чтобы понять, какие индикаторы будут оптимальны в каждом отдельном случае, нужно знать условия изменения окраса индикатора и сопоставить их с интервалом скачка титрования, в котором лежит точка эквивалентности. При разработке метода титрования строят теоретические кривые, по которым можно подобрать подходящий индикатор, оценив поведение системы: анализируемый раствор-титрант.
Так, например, при титровании раствора соляной кислоты раствором щелочи точка эквивалентности наступает в момент нейтрализации титруемого раствора, соответственно при рН=7. В кислотно-основном титровании применяется большое разнообразие индикаторов, изменяющих свой окрас в зависимости от pH среды.

Рис. 2. Шкала изменения окраса индикатора бромтимоловый синий в зависимости от pH.
Для приведенного примера лучше всего использовать индикатор бромтимоловый синий. Он начинает резко изменять свой окрас при рН 7,3 (показатель pT), а интервал перехода окраски составляет 6,0…7,6. Видно, что точка эквивалентности (рН 7,0) также находится в этом интервале. Поскольку 7,3 больше, чем 7,0, то количество добавленного титранта при достижении конечной точки титрования будет несколько больше, чем требуется для достижения ТЭ, что приведет к ошибке титрования.
Кривые титрования
В общем случае кривая титрования показывает зависимость свойств титруемого раствора от количества добавляемого к нему титранта.
В аналитической химии кривые титрования выполняют две задачи:
-
Анализ теоретических кривых титрования позволяет подобрать правильный индикатор. В расчет берут константу равновесия реакции, протекающей в ходе титрования, а также исходные концентрации взаимодействующих веществ.
-
Экспериментальные кривые титрования позволяют определить точку эквивалентности. Для построения графика измеряют какой-то показатель, который зависит от концентрации реагентов в системе, например pH или потенциал системы.
Применительно к кислотно-основному титрованию график строят в координатах pH – V и на нем будет отображаться изменение pH-раствора в процессе титрования. При построении такой интегральной кривой титрования в точке эквивалентности будет наблюдаться резкое изменение pH, которое называют скачком титрования. Наблюдаемые перегибы вблизи точки эквивалентности называются началом и концом скачка на кривой титрования.
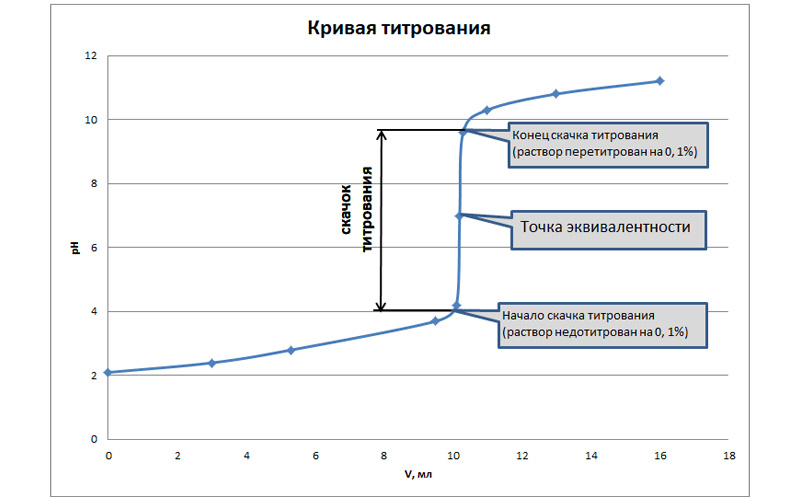
Рис. 3. График интегральной кривой кислотно-основного титрования
В зависимости от силы реагирующих кислот и оснований, вид кривой титрования будет меняться. При взаимодействии близких по силе сильных кислот и щелочей величина скачка титрования будет составлять порядка 5-6 единиц на шкале pH. Если силы определяемого раствора и титранта различаются, то размер вертикального участка будет сокращаться, а для многоосновных кислот скачков титрования на кривой будет несколько. Это необходимо учитывать при подборе индикатора. Если скачок на интегральной кривой слабо заметен, то имеет смысл построить дифференциальную кривую титрования, которая позволит определить экстремум и рассчитать точку эквивалентности более точно. Такой подход практикуется в потенциометрическом титровании, где расчет и построение кривых происходит автоматически в электронном блоке титратора.
Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
На графике кривой титрования присутствует одна или несколько точек перегиба, соответствующих точкам эквивалентности.
Точкой окончания титрования (подобна точке эквивалентности, но не то же самое) считают момент, при котором индикатор изменяет свой цвет при колориметрическом титровании.
Содержание
- 1 Методы определения точки эквивалентности
- 1.1 С помощью индикаторов
- 1.2 Потенциометрия
- 1.3 С помощью pH-метров
- 1.4 Проводимость
- 1.5 Изменение цвета
- 1.6 Осаждение
- 1.7 Изотермическое калориметрическое титрование
- 1.8 Термометрическая титриметрия
- 1.9 Спектроскопия
- 1.10 Амперометрия
- 2 Вид кривой титрования
- 3 См. также
Методы определения точки эквивалентности
С помощью индикаторов
Это вещества, изменяющие свой цвет вследствие протекания химических процессов. Кислотно-основные индикаторы, например фенолфталеин, изменяют свой цвет в зависимости от pH раствора, в котором они находятся. Редокс-индикаторы изменяют свой цвет вслед за изменением потенциала системы, используются таким образом при окислительно-восстановительном титровании. Перед началом титрования в исследуемый раствор добавляют несколько капель индикатора и начинают по каплям добавлять титрант. Как только раствор вслед за индикатором изменяет свой цвет, титрование прекращают, этот момент приблизительно и есть точка эквивалентности.
Правило выбора индикатора – при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, т.е. интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
Потенциометрия
В данном случае используют прибор для измерения электродного потенциала раствора. При достижении точки эквивалентности потенциал рабочего электрода резко изменяется.
С помощью pH-метров
pH-метр по сути своей также является потенциметром, в котором используется электрод, потенциал которого зависит от содержания в растворе ионов H+, это пример использования ионоселективного электрода. Таким образом можно следить за изменением pH в течение всего процесса титрования. При достижении точки эквивалентности pH резко изменяется. Данный способ более точный по сравнению с титрованием с использованием кислотно-основных индикаторов, и может быть легко автоматизирован.
Проводимость
Проводимость раствора электролитов зависит от находящихся в нем ионов. Во время титрования проводимость часто значительно изменяется (Например, при кислотно-основном титровании, ионы H+ и OH− взаимодействуют, образуя нейтральную молекулу H2O, что вызывает изменение проводимости раствора). Общая проводимость раствора зависит и от других присутствующих ионов (например, противоинов), которые вносят в нее различный вклад. Он, в свою очередь, зависит от подвижности каждого иона и от общей концентрации ионов (ионной силы). В связи с этим предсказать изменение проводимости гораздо сложнее, нежели измерить ее.
Изменение цвета
При протекании некоторых реакций происходит изменение цвета и без добавления индикатора. Чаще всего это наблюдается при окислительно-восстановительном титровании, когда исходные вещества и продукты реакции имеют разные цвета в разных степенях окисления.
Осаждение
Если во время реакции образуется твердое нерастворимое вещество, то по окончании титрования образуется преципитат. Классическим примером такой реакции является образование крайне нерастворимого хлористого серебра AgCl из ионов Ag+ и Cl−. Удивительно, но это не позволяет точно определить момент окончания титрования, поэтому осадительное титрование чаще всего используют в качестве обратного титрования.
Изотермическое калориметрическое титрование
Используется изотермический титровальный калориметр, который по величине тепла, которое выделила или поглотила реагирующая система, определяет точку эквивалентности. Данный способ важен в биохимическом титровании, например, для определения того, как ферментный субстрат связывается с ферментом.
Термометрическая титриметрия
Термометрическая титриметрия — чрезвычайно гибкая техника. Она отличается от калориметрической титриметрии тем, что теплота реакции, о которой свидетельствует падение или рост температуры, не используется для определения количества содержащегося в исследуемом образце раствора вещества. Напротив, точка эквивалентности определяется на основе области, в которой происходит изменение температуры. В зависимости от того, является реакция между титрантом и исследуемым веществом экзотермической или эндотермической, температура в течение процесса титрования будет, соответственно, возрастать или падать. Когда все исследуемое вещество прореагировало с титрантом, изменение области, в которой происходит рост или падение температуры, позволяет определить точку эквивалентности и изгиб на кривой температуры. Точно точку эквивалентности можно определить, взяв вторую производную кривой температуры: четкий пик будет указывать на точку эквивалентности.
Спектроскопия
Точку эквивалентности можно определить, измеряя абсорбцию света раствором во время титровании, если известен спектр продукта, титранта или исследуемого вещества. Относительное содержание продукта реакции и исследуемого вещества позволяют определить точку эквивалентности. При этом присутствие свободного титранта (указывающее на завершение реакции) можно обнаружить при очень малых величинах.
Амперометрия
Метод, позволяющий определить точку эквивалентности по величине тока при заданном потенциале. Величина тока вследствие реакции окисления/восстановления исследуемого вещества или продукта у рабочего электрода зависит от их концентрации в растворе. Точке эквивалентности соответствует изменение величины тока. Данный метод наиболее полезен, когда необходимо уменьшить расход титранта, например, при титровании галидов ионом Ag+.
Вид кривой титрования
См. также
- Методы электроаналитической химии
From Wikipedia, the free encyclopedia
The equivalence point, or stoichiometric point, of a chemical reaction is the point at which chemically equivalent quantities of reactants have been mixed. For an acid-base reaction the equivalence point is where the moles of acid and the moles of base would neutralize each other according to the chemical reaction. This does not necessarily imply a 1:1 molar ratio of acid:base, merely that the ratio is the same as in the chemical reaction. It can be found by means of an indicator, for example phenolphthalein or methyl orange.
The endpoint (related to, but not the same as the equivalence point) refers to the point at which the indicator changes color in a colorimetric titration.
Methods to determine the equivalence point[edit]
Different methods to determine the equivalence point include:
- pH indicator
- A pH indicator is a substance that changes color in response to a chemical change. An acid-base indicator (e.g., phenolphthalein) changes color depending on the pH. Redox indicators are also frequently used. A drop of indicator solution is added to the titration at the start; when the color changes the endpoint has been reached, this is an approximation of the equivalence point.
- Conductance
- The conductivity of a solution depends on the ions that are present in it. During many titrations, the conductivity changes significantly. (For instance, during an acid-base titration, the H3O+ and OH− ions react to form neutral H2O. This changes the conductivity of the solution.) The total conductance of the solution depends also on the other ions present in the solution (such as counter ions). Not all ions contribute equally to the conductivity; this also depends on the mobility of each ion and on the total concentration of ions (ionic strength). Thus, predicting the change in conductivity is harder than measuring it.
- Color change
- In some reactions, the solution changes color without any added indicator. This is often seen in redox titrations, for instance, when the different oxidation states of the product and reactant produce different colors.
- Precipitation
- If the reaction forms a solid, then a precipitate will form during the titration. A classic example is the reaction between Ag+ and Cl− to form the very insoluble salt AgCl. Surprisingly, this usually makes it difficult to determine the endpoint precisely. As a result, precipitation titrations often have to be done as back titrations.
- Isothermal titration calorimeter
- An isothermal titration calorimeter uses the heat produced or consumed by the reaction to determine the equivalence point. This is important in biochemical titrations, such as the determination of how substrates bind to enzymes.
- Thermometric titrimetry
- Thermometric titrimetry is an extraordinarily versatile technique. This is differentiated from calorimetric titrimetry by the fact that the heat of the reaction (as indicated by temperature rise or fall) is not used to determine the amount of analyte in the sample solution. Instead, the equivalence point is determined by the rate of temperature change. Because thermometric titrimetry is a relative technique, it is not necessary to conduct the titration under isothermal conditions, and titrations can be conducted in plastic or even glass vessels, although these vessels are generally enclosed to prevent stray draughts from causing “noise” and disturbing the endpoint. Because thermometric titrations can be conducted under ambient conditions, they are especially well-suited to routine process and quality control in industry. Depending on whether the reaction between the titrant and analyte is exothermic or endothermic, the temperature will either rise or fall during the titration. When all analyte has been consumed by reaction with the titrant, a change in the rate of temperature increase or decrease reveals the equivalence point and an inflection in the temperature curve can be observed. The equivalence point can be located precisely by employing the second derivative of the temperature curve. The software used in modern automated thermometric titration systems employ sophisticated digital smoothing algorithms so that “noise” resulting from the highly sensitive temperature probes does not interfere with the generation of a smooth, symmetrical second derivative “peak” which defines the endpoint. The technique is capable of very high precision, and coefficients of variance (CV’s) of less than 0.1 are common. Modern thermometric titration temperature probes consist of a thermistor which forms one arm of a Wheatstone bridge. Coupled to high resolution electronics, the best thermometric titration systems can resolve temperatures to 10−5K. Sharp equivalence points have been obtained in titrations where the temperature change during the titration has been as little as 0.001K. The technique can be applied to essentially any chemical reaction in a fluid where there is an enthalpy change, although reaction kinetics can play a role in determining the sharpness of the endpoint. Thermometric titrimetry has been successfully applied to acid-base, redox, EDTA, and precipitation titrations. Examples of successful precipitation titrations are sulfate by titration with barium ions, phosphate by titration with magnesium in ammoniacal solution, chloride by titration with silver nitrate, nickel by titration with dimethylglyoxime and fluoride by titration with aluminium (as K2NaAlF6) Because the temperature probe does not need to be electrically connected to the solution (as in potentiometric titrations), non-aqueous titrations can be carried out as easily as aqueous titrations. Solutions which are highly colored or turbid can be analyzed by thermometric without further sample treatment. The probe is essentially maintenance-free. Using modern, high precision stepper motor driven burettes, automated thermometric titrations are usually complete in a few minutes, making the technique an ideal choice where high laboratory productivity is required.
- Spectroscopy
- Spectroscopy can be used to measure the absorption of light by the solution during the titration, if the spectrum of the reactant, titrant or product is known. The relative amounts of the product and reactant can be used to determine the equivalence point. Alternatively, the presence of free titrant (indicating that the reaction is complete) can be detected at very low levels. An example of robust endpoint detectors for etching of semiconductors is EPD-6, a system probing reactions at up to six different wavelengths.[1]
- Amperometry
- Amperometry can be used as a detection technique (amperometric titration). The current due to the oxidation or reduction of either the reactants or products at a working electrode will depend on the concentration of that species in solution. The equivalence point can then be detected as a change in the current. This method is most useful when the excess titrant can be reduced, as in the titration of halides with Ag+. (This is handy also in that it ignores precipitates.)
See also[edit]
- Titration
References[edit]
- ^ “Page Title”. www.zebraoptical.com.
External links[edit]
- Equivalence points of virtual and real acid-base titrations – Software Program
- Example of robust industrial endpoint detector
- Graphical method to solve acid-base problems, including titrations
- Graphic and numerical solver for acid-base problems -Software Program for phone and tablets
