поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Связь между
молярной (Cm)
и удельной (с) теплоемкостями газа
Cm=cM,
где М
— молярная
масса газа.
Молярные
теплоемкости*
при
постоянном объеме и постоянном давлении
соответственно равны
Cv=iR/2;
Cp=(i+2)R/2
где i
— число
степеней свободы; R
— молярная
газовая постоянная.
Удельные
теплоемкости при постоянной объеме и
постоянном давлении соответственно
равны
,
.
Уравнение Майера
Cр—Сv=R.
Показатель
адиабаты
,
или
,
или.
Внутренняя
энергия идеального газа
U=N<>
или U=vCvT,
где <>—средняя
кинетическая энергия молекулы;
N—число
молекул газа;
v
— количество
вещества.
Работа, связанная
с изменением объема газа, в общем случае
вычисляется по формуле
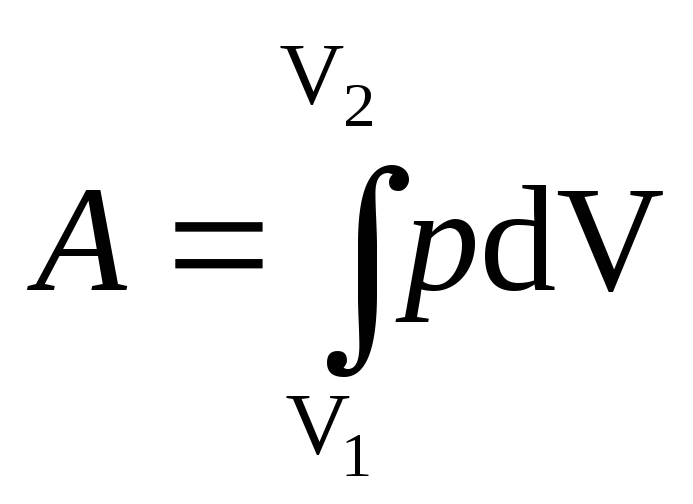
где V1
— начальный
объем газа; V2
— его
конечный объем.
Работа газа:
а) при изобарном
процессе (p=const)
A=p(V2
–
V1);
б) при изотермическом
процессе (T=const)
;
*
Здесь и далее
в целях упрощения записи в индексах
обозначений молярной теплоемкости при
постоянном давлении и постоянном объеме
букву «m»
будем опускать.
в) при адиабатном
процессе
,
или
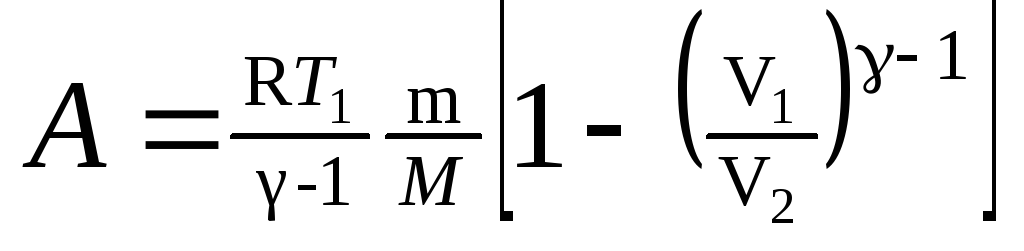
где T1
— начальная
температура газа; T2
— его
конечная температура.
Уравнение Пуассона
(уравнение газового состояния при
адиабатном процессе)
.
Связь между
начальным и конечным значениями
параметров состояний газа при адиабатном
процессе:
.
Первое начало
термодинамики в общем случае записывается
в виде
Q=U+A,
где Q
– количество теплоты, сообщённое газу;
U—изменение
его внутренней энергии; А
—
работа, совершаемая газом против внешних
сил.
Первое начало
термодинамики:
а) при изобарном
процессе
б) при изохорном
процессе (A=0)
;
в) при изотермическом
процессе (U=0)
,
г) при адиабатном
процессе (Q=0)
.
Термический
коэффициент полезного действия (КПД)
цикла
в
общем случае
,
где Q1—количество
теплоты, полученное рабочим телом
(газом) от нагревателя; Q2—количество
теплоты, переданное рабочим телом
охладителю.
КПД цикла Карно
,
или
,
где T1
— температура
нагревателя; T2
— температура
охладителя.
Изменение энтропии
где A
и B
— пределы
интегрирования, соответствующие
начальному и конечному состояниям
системы. Так как процесс равновесный,
то
интегрирование проводится по любому
пути.
Формула Больцмана
S=klnW,
где
S — энтропия
системы;
W
—
термодинамическая вероятность ее
состояния; k
—
постоянная Больцмана.
Примеры решения задач
Пример
1. Вычислить
удельные теплоемкости неона и водорода
при постоянных объеме (сv)
и давлении (cp),
принимая эти газы за идеальные.
Решение.
Удельные теплоемкости идеальных газов
выражаются формулами
; (1)
. (2)
Для неона (одноатомный
газ) i1=3,
M1=2010-з
кг/моль.
Подставив в формулы
(1) и
(2) значения
i1,
M1
и R
и произведя вычисления, найдем:
сv1=
624
Дж/(кгК);
сp1=1,04
кДж/(кгК).
Для водорода
(двухатомный газ) i2=5,
M2=210-3
кг/моль.
Вычисление по
формулам
(1) и
(2) дает
следующие значения удельных теплоемкостей
водорода:
сv2=10,4
кДж/(кгK);
сp2=14,6
кДж/(кгK).
Пример
2. Вычислить
удельные теплоемкости сv
и сp
смеси неона и водорода. Массовые доли
газов соответственно равны 1=0,8
и 2=0,2.
Значения удельных теплоемкостей газов
взять из примера
1.
Решение.
Удельную теплоемкость смеси при
постоянном объеме сv
найдем из следующих рассуждений. Теплоту,
необходимую для нагревания смеси на
T,
выразим двумя соотношениями:
Q=сv(m1+m2)T
(1)
где сv
— удельная
теплоемкость смеси; m1
— масса
неона; m2
— масса
водорода, и
Q=(сv1m1+
сv2m2)T (2)
где сv1
и сv2
— удельные
теплоемкости неона и водорода
соответственно.
Приравняв правые
части выражений
(1) и
(2) и разделив
обе части полученного равенства на
T,
найдем
сv(m1+m2)=
сv1m1+
сv2m2,
откуда
Отношения
1=m1/(m1+m2)
и 1=m2/(m1+m2)
выражают массовые доли соответственно
неона и водорода. С учетом этих обозначений
последняя формула, примет вид
сv=сv11+
сv22.
Подставив в эту
формулу числовые значения величин,
найдем
сv=2,58
кДж/(кгК).
Рассуждая
таким
же
образок, получим формулу для вычисления
удельной теплоёмкости смеси при
постоянном давлении:
cp=сp11+
сp22
Произведя вычисления
по этой формуле, найдем
cp=3,73
кДж/(кгК).
Пример
3. Определить
количество теплоты, поглощаемой
водородом массой m=0,2
кг при нагревании его от температуры
t1=0°С
до температуры t2=100
°С при постоянном давлении. Найти также
изменение внутренней энергии газа и
совершаемую им работу.
Решение.
Количество теплоты Q,
поглощаемое газом при изобарном
нагревании, определяется по формуле
Q=mcpT,
(1)
где m
— масса
нагреваемого газа; cp
— его
удельная теплоемкость при постоянном
давлении; T
— изменение температуры газа.
Как известно,
.
Подставив это выражение cp
в формулу
(1), получим
Произведя вычисления
по этой формуле, найдем
Q=291
кДж.
Внутренняя энергия
выражается формулой
,
следовательно, изменение внутренней
энергии
.
После подстановки
в эту формулу числовых значений величин
и вычислений получим U=208
кДж.
Работу расширения газа
определим по формуле, выражающей первое
начало термодинамики: Q=U+A,
откуда
A=Q – U.
Подставив значения
Q и U,
найдем
А
=83 кДж.
Пример
4. Кислород
занимает объем V1=1
м3
и находится под давлением р1=200
кПа. Газ нагрели сначала при постоянном
давлении до объема V2=3
м2,
a
затем при постоянном объеме до давления
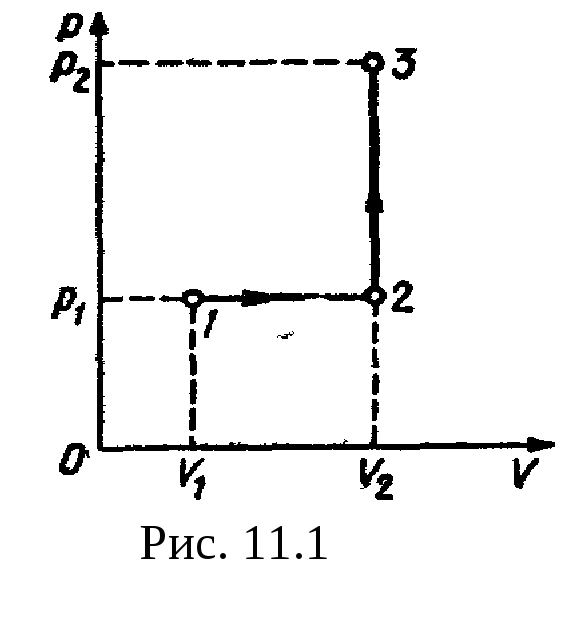
Рис
11.1 р2=500
кПа. Построить график процесса и найти:
1) изменение
U
внутренней энергии газа; 2)
совершенную им работу A;
3) количество
теплоты
Q,
переданное
газу.
Решение.
Построим график процесса (рис.
11.1). На
графике точками
1, 2, 3
обозначены состояния газа, характеризуемые
параметрами (р1,
V1,
T1),
(р1,
V2,
T2),
(р2,
V2,
T3).
1.
Изменение внутренней энергии газа при
переходе его из состояния
1 в состояние
3 выражается
формулой
U=cvmT,
где cv
— удельная
теплоемкость газа при постоянном объеме;
m
— масса
газа; T
— разность
температур, соответствующих конечному
3 и
начальному 1 состояниям, т. е. T=T3—
T1.
Так как
;
где М
— молярная
масса газа, то
.
(1)
Температуры T1
и T3
выразим из уравнения Менделеева
— Клапейрона
():
С учетом этого
равенство
(1) перепишем
в виде
U=(i/2)(p2V2–p1V1).
Подставим сюда
значения величин (учтем, что для кислорода,
как двухатомного газа, i=5)
и произведем вычисления:
U=3,25
МДж.
2.
Полная работа, совершаемая газом, равна
A=A1+A2,
где A1
— работа
на участке
1—2; A2
— работа
на участке
2—3,
На участке
1—2 давление
постоянно (p=const).
Работа в этом случае выражается формулой
A1=p1V=p1(V2—V1).
На участке 2—3
объем газа не изменяется и, следовательно,
работа газа на этом участке равна нулю
(A2=0).
Таким образом,
A=A1=p1(V2—V1).
Подставив в эту
формулу значения физических величин,
произведем вычисления:
A=0,4
МДж
3.
Согласно первому началу термодинамики,
количество теплоты Q,
переданное газу, равно сумме работы
A,
совершенной газом, и изменению U
внутренней энергии:
Q=A+U,
или
Q=3,65 МДж.
Пример
5. Идеальный
двухатомный газ, содержащий количество
вещества v=l
моль, находится под давлением p1=250кПа
и занимает объем V1==10
л. Сначала газ изохорно нагревают до
температуры T2=400
К. Далее, изотермически расширяя, доводят
его до первоначального давления.
После этого путем изобарного сжатия
возвращают газ в начальное состояние.
Определить термический КПД
цикла.
Решение.
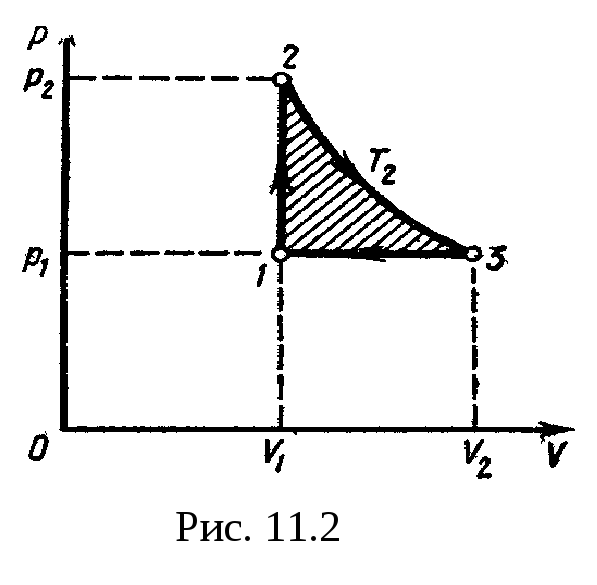
Для наглядности построим сначала график
цикла, который состоит из изохоры,
изотермы и изобары. В координатах р,
Vэтот
цикл имеет вид. представленный на рис.
11.2. Характерные
точки цикла обозначим
1, 2, 3.
Термический КПД
любого цикла определяется выражением
=(Q1
– Q2)/Q1,
или =l
– Q2/Q1,
(1) где
Q1
—
количество теплоты, полученное газом
за цикл от нагревателя; Q2
— количество теплоты, отданное газом
за цикл охладителю.
Заметим, что разность
количеств теплоты Q1
– Q2
равна работе A,
совершаемой газом за цикл.
Эта
работа на графике в координатах р,
V (рис.
11.2)
изображается площадью цикла (площадь
цикла заштрихована).
Рабочее вещество
(газ) получает количество теплоты
Q1
на двух участках: Q1-2
на участке
1—2 (изохорный
процесс) и Q2-3
на участке
2—3
(изотермический процесс). Таким образом,
Q1=Q1-2+Q2-3.
Количество теплоты,
полученное газом при изохорном процессе,
равно
Q1-2=Cvv(T2
–
T1),
где Cv
— молярная
теплоемкость газа при постоянном объеме;
v
— количестве вещества. Температуру T1
начального состояния газа найдем,
воспользовавшись уравнением Клапейрона
— Менделеева:
T1=p1V1/(vR).
Подставив числовые
значения и произведя вычисления, получим
Количество теплоты,
полученное газом при изотермическом
процессе, равно
Q2-3=vRT2ln(V2/V1),
где V2
—
объем, занимаемый газом при температуре
T2
и давлении p1
(точка
3 на графике).
На участке
3—1 газ
отдает количество теплоты Q2,
равное
Q2=Q3-1=Cpv(T2
–T1),
где Cp
— молярная
теплоемкость газа при изобарном процессе.
Подставим найденные
значения
Q1
и Q2
в формулу
(1):
В полученном
выражении заменим отношение объемов
V2/V1,
согласно закону Гей-Люссака, отношением
температур (V2/V1=T2/T1)
и выразим Cv
и Cp
через число степеней свободы молекулы
[Cv=iR/2,
Cp=(i+2)R/2].
Тогда после сокращения на
v
и R/2
получим
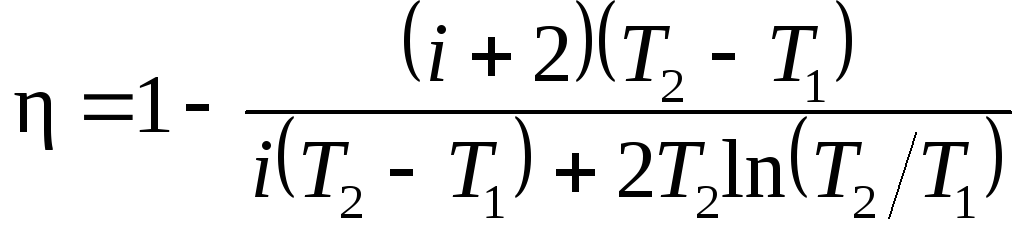
Подставив значения
i,
T1,
T2
и R
и произведя вычисления, найдем
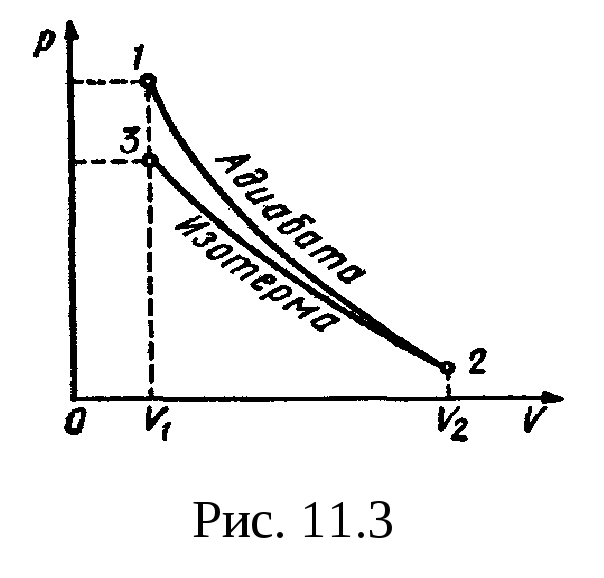
Пример 6.
В цилиндре под поршнем находится водород
массой m=0,02
кг при температуре T1=300K.
Водород начал расширяться адиабатно,
увеличив свой объем в пять раз, а затем
был сжат изотермически, причем объем
газа уменьшился в пять раз. Найти
температуру Т2,
в конце адиабатного расширения и работу
А,
совершенную газом. Изобразить процесс
графически.
Решение.
Температуры и объемы газа, совершающего
адиабатный процесс, связаны между
собой соотношением
,
где —
показатель адиабаты (для водорода как
двухатомного газа =1,4).
Отсюда получаем
выражение для конечной температуры T2:
.
Подставляя числовые
значения заданных величин, находим
.
Прологарифмируем
обе части полученного выражения:
lgT2=lg300+0,4(lgl
– lg5)=2,477+0,4( -0,699)=2,477—0,280=2,197.
Зная lgT2,
по таблицам антилогарифмов находим
искомое значение T2:
T2=157
К.
Работа A1
газа при адиабатном расширении
определяется по формуле
.
Подставив сюда
числовые значения величин, после
вычисления получим
Работа A2
газа при изотермическом сжатии выражается
формулой
A2=RT2(m/M)ln(V2/V1).
Произведя вычисления
по этой формуле, найдем
A2=
-21 кДж.
Знак минус показывает,
что при сжатии газа работа совершена
внешними силами.
Общая работа,
совершенная газом при рассмотренных
процессах, А=A1+A2=29,8кДж
+ (-21 кДж)=8,8 кДж.
График процесса
приведен на рис.
11.3.
Пример
7. Нагреватель
тепловой машины, работающей по обратимому
циклу Карно, имеет температуру
t1==200°С.
Определить температуру Т2,
охладителя, если при получении от
нагревателя количества теплоты Q1=
1 Дж машина
совершает работу A=0,4
Дж? Потери на трение и теплоотдачу не
учитывать.
Решение.Температуру охладителя найдем, использовав
выражение для термического КПД машины,
работающей по циклу Карно,=(T1—
T2)/T1.
Отсюда
T2=
T1(1-).
(1)
Термический КПД
тепловой машины выражает отношение
количества теплоты, которое превращено
в механическою работу A,
к количеству теплоты Q1,
которое получено рабочим телом тепловой
машины из внешней среды (от нагревателя),
т. е. =A/Q1.
Подставив это выражение в формулу
(1), найдем
T2=
T1(1-A/Q).
(2)
Учтя, что T1=473
К, после вычисления по формуле
(2) получим
T2=284
К.
Пример
8. Найти
изменение S
энтропии при нагревании воды массой
m=100
г от температуры t1=0°C
до температуры
t2=100
°С и последующем превращении воды в пар
той же температуры.
Решение.
Найдем отдельно изменение энтропии S’
при нагревании воды и изменение энтропии
S”
при превращении ее в пар. Полное изменение
энтропии выразится суммой S’
и S”.
Как известно,
изменение энтропии выражается общей
формулой
(1)
При бесконечно
малом изменении dT
температуры нагреваемого тела
затрачивается количество теплоты
dQ=mcdT,
где m
— масса
тела; с
— его
удельная теплоемкость. Подставив
выражение dQ
в равенство
(1), найдем
формулу для вычисления изменения
энтропии при нагревании воды:
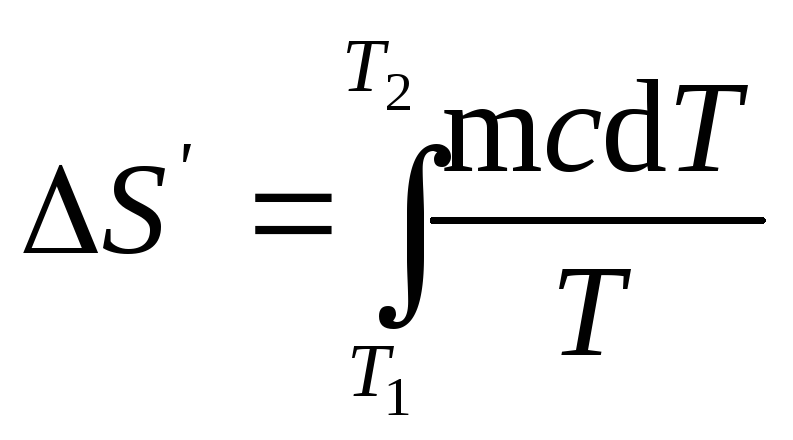
Вынесем за знак
интеграла постоянные величины и
произведем интегрирование, тогда получим
S’=mcln(T2/T1).
После вычислений
найдем S’=132
Дж/К.
При вычислении по
формуле
(1) изменения
энтропии во время превращения воды в
пар той же температуры постоянная
температуpa
T
‘выносится
за знак интеграла. Вычислив интеграл,
найдем
(2)
где Q
—
количество теплоты, переданное при
превращении нагретой воды в пар той
же температуры.
Подставив в равенство
(2) выражение
количества теплоты Q=m,
где
— удельная
теплота парообразования, получим
(3)
Произведя вычисления
по формуле
(3), найдем
S”=605
Дж/К.
Полное изменение
энтропии при нагревании воды и последующем
превращении ее в пар S=S’+S”=737
Дж/К.
Пример
9. Определить
изменение S
энтропии при изотермическом расширении
кислорода массой m=10
г от объема V1=25
л до объема V2=100
л.
Решение.
Так как процесс изотермический, то в
общем выражении энтропии
температуру выносят за знак интеграла.
Выполнив это, получим
(1)
Количество теплоты
Q, полученное
газом, найдем по первому началу
термодинамики: Q=U+A.
Для изотермического процесса U=0,
следовательно,
Q=A,
(2) а
работа А для этого процесса определяется
по формуле
A=(m/M)RT
ln(V2/V1).
(3)
С учетом
(2) и
(3) равенство
(1) примет
вид
S=(m/M)R
ln(V2/V1).
(4)
Подставив в
(4) числовые
значения и произведя вычисления, получим
S=(1010-3/(3210-3))
8,31
ln(10010-3/(2510-3))
Дж/К=3,60
Дж/К.
ГДЗ, решебники, лабораторные работы
»
ГДЗ онлайн
»
ГДЗ по физике
»
ГДЗ Волькенштейн
5.67: Найти удельную теплоемкость cp : а) хлористого водорода; б) неона; в) окиси азота; г) окиси углерода; д) паров ртути. |
| Задача из учебного пособия Волькенштейн |
|
Данная задача находится в разделе Решебник Волькенштейн на странице № 6 Смотрите также: <<< Предыдущая задача из Волькенштейн |
[12.11.2015 18:53]
Решение 13439:
Вычислить удельные теплоемкости при постоянном объеме и постоянном давлении неона и
…
Подробнее смотрите ниже
Номер задачи на нашем сайте: 13439
ГДЗ из решебника:
Тема:
2. Молекулярная физика. Термодинамика
Нашли ошибку? Сообщите в комментариях (внизу страницы)
|
Раздел: Физика Полное условие: 2 Пример 7. Вычислить удельные теплоемкости при постоянном объеме cv и при постоянном давлении cp неона и водорода, принимая эти газы за идеальные.Решение, ответ задачи 13439 из ГДЗ и решебников: Этот учебный материал представлен 1 способом:
|
||
| Счетчики: 3732 | Добавил: Admin |
| Добавить комментарий
Добавлять комментарии могут только зарегистрированные пользователи. [ Регистрация | Вход ] |
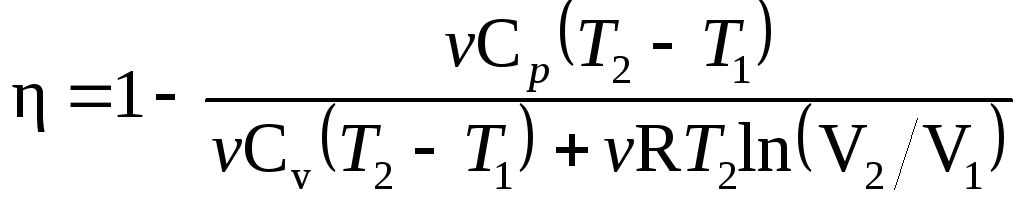


 Для просмотра в натуральную величину нажмите на картинку
Для просмотра в натуральную величину нажмите на картинку
