-
Теплоемкость смеси газов
При
расчетах тепловых установок приходится
встречаться со смесями газов, а в таблицах
приводятся значения теплоемкости только
для отдельно взятых идеальных газов,
поэтому важно уметь определять
теплоемкость газовой смеси.
Если
смесь газов задана массовыми долями,
то удельная теплоемкость смеси
определяется как сумма произведений
массовых долей и удельной теплоемкости
каждого газа:
![]() ;
;
(4.15)
![]() .
.
(4.16)
Если
смесь газов задана объемными долями,
то объемная теплоемкость смеси равна
сумме произведений объемных долей и
объемной теплоемкости каждого газа:
![]() ;
;
(4.17)
![]() .
.
(4.18)
Молярная
теплоемкость смеси газов равна
произведению объемных долей и молярных
теплоемкостей составляющих смесь газов:
![]() (4.19)
(4.19)
![]() (4.20)
(4.20)
Удельная
теплоемкость смеси газов может быть
определена, если известны плотность и
удельный объем смеси газов при нормальных
физических условиях:
![]() ;
;
(4.21)
![]() (4.22)
(4.22)
-
Основные термодинамические процессы идеальных газов.
-
Общие принципы исследования термодинамических процессов.
-
Первый
закон термодинамики устанавливает
взаимосвязь между количеством теплоты,
изменением внутренней энергии и внешней
работой газа, причем, количество теплоты,
участвующее в процессе, зависит от
характера протекания этого процесса:
![]() .
.
К
основным термодинамическим процессам,
имеющим большое как теоретическое, так
и практическое значение, относятся:
-
Изохорный,
протекающий при постоянном объеме (v=
const;
dv=0); -
Изобарный,
протекающий при постоянном давлении
(P=const;
dP=0); -
Изотермический
(изотермный), протекающий при постоянной
температуре (T=const;
dT=0); -
Адиабатный,
протекающий при отсутствии теплообмена
с внешней средой (dq=0); -
Политропный,
характеризующийся тем, что он протекает
при постоянной теплоемкости (сп=const).
Политропный
процесс может рассматриваться в качестве
обобщенного по отношению ко всем
перечисленным выше термодинамическим
процессам.
Для
всех процессов может быть применен
общий метод исследования, приведенный
в таблице 5.1.
Таблица
5.1 – Общий метод исследования политропных
процессов
|
Метод |
Формулы |
|
|
|
|
|
|
|
|
|
|
|
|
Продолжение
таблицы 5.1
|
Метод |
Формулы |
|
где |
|
|
|
|
|
|
|
|
Соседние файлы в папке Термодинамика
- #
- #
- #
- #
- #
- #
- #
- #
Теплоемкость газов
Понятие о теплоемкости
Замысловатый термин “теплоемкость” не что иное, как способность тела расходовать внешнюю тепловую энергию для повышения внутренней кинетической энергии собственных молекул, т. е. повышать температуру при подводе тепла извне.
Как мы уже знаем из предыдущих статей, повышение температуры любого вещества сопровождается увеличением кинетической энергии его частиц, скорость которых начинает возрастать. Этот процесс неизбежно сопровождается уменьшением внутренней потенциальной энергии молекул тела, поскольку они слабее взаимодействуют посредством гравитационных и электромагнитных полей (в первую очередь из-за увеличения расстояния между ними).
Различные вещества способны по-разному “впитывать” внешнюю энергию. Чтобы нагреть до определенной температуры, например, 1 кг нержавеющей стали, необходимо затратить значительно больше тепла, чем для нагрева 1 кг чугуна.
Подобный факт наталкивает на мысль о введении понятия некоторой способности материальных тел “захватывать” и “впитывать” поступающее от окружающей среды тепло. Именно этим физическим свойством материальных тел является теплоемкость.
Чтобы повысить температуру единицы количества вещества на dT, необходимо сообщить ему теплоту dq.
Отношение c = dq/dT называют удельной теплоемкостью вещества.
Удельная теплоемкость показывает, какое количество теплоты необходимо подвести к единице вещества, чтобы нагреть его на 1К (один градус Кельвина).
В зависимости от выбранной единице количества вещества различают массовую (отнесенную к 1 кг), киломольную (отнесенную к 1 кмолю) и объемную (отнесенную к 1 м3) удельные теплоемкости.

Удельная теплоемкость газа зависит от способа подвода к нему теплоты. Очевидно, что на основании определения теплоемкости и уравнения первого закона термодинамики можно записать:
c = dq/dT = (du + pdv)/dT = du/dT + pdv/dT.
Величину pdv/dT называют удельной работой. Она показывает, какую работу совершает единица количества газа при повышении его температуры на 1К.
Если при подводе теплоты к газу занимаемый им объем остается постоянным (v = const), то dv = 0 и удельная теплоемкость cv = du/dT, откуда du = cvdT.
Если же при подводе к газу теплоты его давление остается неизменным (p = const), то удельная теплоемкость будет равна:
cp = cv + pdv/dT. (1)
Следовательно, удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме на удельную работу.
Если продифференцировать уравнение состояния pv = RT при p = const, получим выражение удельной работы для идеальных газов:
dA = pdv/dT = R. (2)
Эта формула позволяет уяснить физический смысл газовой постоянной. Газовая постоянная R – это работа, совершаемая единицей количества газа при нагревании на 1К, если теплота подводилась при постоянном давлении.
Подставив в уравнение (1) значение удельной газовой постоянной из формулы (2), получим уравнение Майера:
cv – cp = R.
Для идеального газа значения cp и cv постоянны, поэтому и отношение cp/cv = k тоже является величиной постоянной.
Нагревая идеальный газ от температуры T1 до T2 при постоянном объеме, необходимо подвести количество теплоты, равное:
qv = cv(T1 – T2),
а для нагревания при постоянном давлении:
qp = cp(T1 – T2).
***
Зависимость теплоемкости от температуры
Удельная теплоемкость реальных газов в отличие от идеальных газов зависит от давления и температуры. Зависимостью удельной теплоемкости от давления в практических расчетах можно пренебречь. Но зависимость удельной теплоемкости от температуры необходимо учитывать, поскольку она очень существенна.
Исследования показывают, что удельная теплоемкость реальных газов является сложной функцией температуры:
c = f(T).
Из этого следует, что в различных температурных интервалах для нагревания единицы количества газа на 1К требуется разное количество теплоты.
Однако, если выбрать достаточно узкий температурный интервал, то для него можно принять удельную теплоемкость постоянной. Очевидно, что если этот температурный интервал стремится к нулю, удельная теплоемкость соответствует истинной удельной теплоемкости при данной температуре:
c = lim Δq/ΔT при Т стремящемся к нулю, или c = dq/dT, откуда
dq = cdT.
Чтобы определить количество теплоты, необходимое для нагревания газа от T1 до T2, необходимо проинтегрировать полученную дифференциальную зависимость.
При практическом решении теплотехнических задач пользуются понятием средней удельной теплоемкости в заданном температурном интервале.
Средняя удельная теплоемкость (cm) газа в некотором интервале температур – это количество теплоты, которое необходимо подвести к газу или отвести от него, чтобы изменить температуру на 1К в данном температурном интервале.
***
Удельная теплоемкость газовой смеси
Под удельной массовой теплоемкостью ссм газовой смеси понимают количество теплоты, необходимое для нагревания 1 кг смеси на 1К. Очевидно, что это количество теплоты можно получить путем суммирования количества теплоты, необходимое для нагревания каждого компонента, входящего в состав смеси:
ссм = Σ cimi,
где:
ci – удельная массовая теплоемкость i-го компонента смеси;
mi – массовая доля этого компонента в смеси.
Аналогично можно определить удельную объемную теплоемкость газовой смеси – как сумму удельных объемных теплоемкостей ее компонентов.
Удельная киломольная теплоемкость смеси газов определяется по формуле:
μсм ссм = Σ μiciri,
где: μi – молекулярная масса компонента смеси; ri – объемная доля компонента в составе смеси.
***
Термодинамические процессы
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине “Основы гидравлики и теплотехники”
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
- для специальности СПО “Механизация сельского хозяйства”
- для специальности СПО “Техническое обслуживание и ремонт автомобильного транспорта”
Скачать календарно-тематический план
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
- для специальности СПО “Механизация сельского хозяйства”
- для специальности СПО “Техническое обслуживание и ремонт автомобильного транспорта”
как найти удельную теплоемкость смеси газов? формула
Алена Котова
Ученик
(85),
закрыт
7 лет назад
Евгений Вороненко
Мыслитель
(7656)
7 лет назад
С = W1C1 + W2C2 + W3C3 + .+ WnCn, где W1, 2,3,n – массовая доля газа в смеси, С1, 2,3,n – удельная теплоемкость газа.
Алена КотоваУченик (85)
7 лет назад
ох.. ( а как найти массовую долю газа в смеси и удельную теплоемкость газа.?
Евгений Вороненко
Мыслитель
(7656)
W = m(газа) /m(смеси), где m – масса компонента смеси и общая масса смеси.
Удельную теплоемкость каждого газа ищется в интернете.
Уравнение Майера связывает теплоемкости идеального газа в двух изопроцессах, тогда перейдем к самому его определению.
Теплоемкость. Уравнение Майера
Переданное телу количество теплоты для его нагревания на 1 К получило название теплоемкости тела данной системы. Обозначение принимается буквой “С”:
С=δQdT (1).
Значение теплоемкости единицы молярной массы тела:
cμ=Cv (2). Выражение называется молярной теплоемкостью.
Теплоемкость не считается функцией состояния, так как является характеристикой бесконечно близких состояний системы или выражается в качестве функции бесконечно малого процесса, совершаемого в системе. В количественном выражении это означает, что из (1), применяя первое начало термодинамики, дифференциальная форма получится:
C=δQdT=dU+pdVdT (3).
Уравнение Майера для идеального газа
Определение термодинамической системы производится при помощи трех параметров p, V, T. Существующее между ними отношение получило название уравнения состояния. Для идеального газа используется уравнение Менделеева-Клапейрона. Данная связь запишется в виде:
p=p(T, V) или T=T (p,V), V=V(p, T).
При выборе независимых переменных в качестве V и T внутренняя энергия системы выражается в виде функции U=U(T, V). Получим, что значение полного дифференциала от внутренней энергии примет вид:
dU=∂U∂TVdT+∂U∂VTdV (4).
Произведем подстановку из (4) в (3), тогда
c=∂U∂TVdT+∂U∂VTdV+pdVdT=∂U∂TV+p+∂U∂VTdVdT (5).
Исходя из формулы (5), теплоемкость находится в зависимости от процесса. Если он изохорный, то
dVdT=0.
Значение теплоемкости изохорного процесса запишется как:
CV=∂U∂TV (6).
При изобарном теплоемкость выражается через формулу:
Cp=∂U∂TV+p+∂U∂VT∂V∂Tp=CV+p+∂U∂VT∂V∂Tp (7).
Перейдем к рассмотрению исследуемой системе идеального газа. Запись малого приращения энергии идеального газа:
dU=i2vRdT (8).
Отсюда следует:
dUdVT=0 (9).
Состояние идеального газа описывается при помощи уравнения Менделеева-Клапейрона:
pV=vRt (10).
Значит:
∂V∂Tp=vRp (11).
Произведем подстановку в (7) из (10) и (11):
Cp=CV+p+0vRp=CV+vR (12).
Выражение (12) называют выведенным соотношением Майера.
Или для молярных теплоемкостей:
Cμp=CμV+R (13).
Найти удельную теплоемкость смеси 16 г кислорода и 10 г гелия в процессе с постоянным давлением.
Решение
Если Q считается количеством тепла, получаемым смесью газов в процессе, то
Q=cpm∆T (1.1), где m является массой смеси, cp – удельной теплоемкостью смеси при неизменном давлении.
QO2 – это количество тепла, получаемое кислородом:
QO2=cpO2mO2∆T (1.2), mO2 выражается массой кислорода, cpO2 – теплоемкостью кислорода с постоянным давлением.
Для гелия аналогично:
QHe=cpHemHe∆T (1.3).
Кроме этого рассмотрим:
Q=cpm∆T=QO2+QHe=cpO2mO2∆T+cpHemHe∆T (1.4).
Нахождение массы смеси производится по закону сохранения массы:
m=mO2+mHe (1.5).
Произведем выражение теплоемкости cp из (1.4), учитывая (1.5). Тогда имеем:
cp=cp O2mO2+cpHemHemO2+mHe (1.6).
Существует связь между молярной теплоемкостью и удельной:
cμ=c·μ→c=cμμ (1.7).
Если cμV=i2R, то по уравнению Роберта Майера cμp=cμV+R:
cμp=i+22R (1.8);iHe=3, iO2=5.
В данном случае удельные теплоемкости запишутся как:
cpHe=52RμHe, cpO2=7R2μO2 (1.9).
Результатом будет записанная формула удельной теплоемкости смеси:
cp=7R2μO2mO2+52RμHemHemO2+mHe (1.10).
Выполним подстановку:
cp=3,5·8,31·1632+2,5·8,31·10426=14,5+51,9426=2,56 ДжгК.
Ответ: удельная теплоемкость смеси равняется 2,56 ДжгК.
При проведении опытов Джоулем было получено, что сμp-cμV=1,986 калК·моль. Значение газовой постоянной, измеренной в механических единицах R=8,314·107 эргК·моль. Определите, как соотносятся 1 кал, эрг, Дж.
Решение
Основой решения данного задания принято считать уравнение Майера, формула записывается:
сμp=cμV+R→cμp-cμV=R (2.1).
Отсюда получим, что:
cμp-cμV=1,986калК·моль=8,314·107эргК·моль→1кал=4,18·107 эрг=4,18 Дж.
Ответ: 1кал=4,18·107 эрг=4,18 Дж.

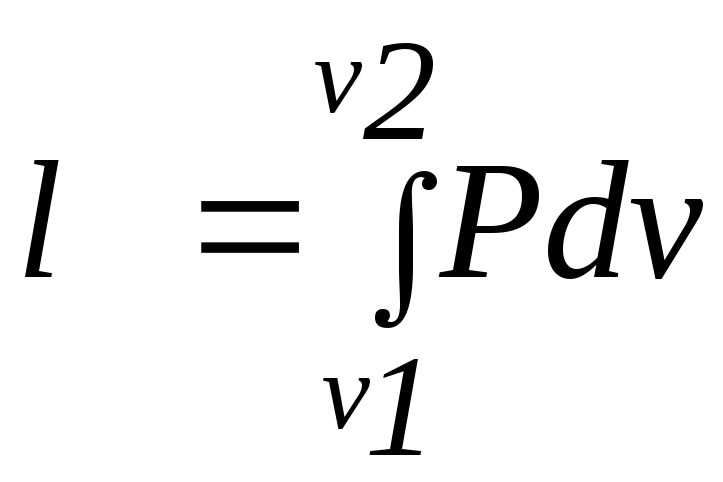

 ,
,
