Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 сентября 2021 года; проверки требуют 13 правок.
Уде́льная теплота́ парообразова́ния и конденса́ции — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар, при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Равна удельной теплоте конденсации единичной массы пара в жидкость.
Расчёт[править | править код]
Удельная теплота парообразования и конденсации обозначается буквой 
где Q — теплота, истраченная на превращение жидкости в пар или пара в жидкость, m — масса.
Наименьшее значение удельной теплоты парообразования будет при температуре кипения жидкости.
Размерность удельной теплоты парообразования в СИ — Дж/кг. Устаревшие, но иногда применяемые единицы для теплоты парообразования — ккал/кг и кал/кг.
В химии теплота парообразования обычно приводится к молю вещества. Эта величина называется молярной теплотой испарения (конденсации); единица её измерения — Дж/моль. Также используются устаревшие единицы: ккал/моль, кал/моль.
Значения для некоторых веществ[править | править код]
Удельная теплота парообразования некоторых веществ при нормальном атмосферном давлении (760 мм. рт. ст. = 101,325 кПа) и температуре, равной температуре кипения вещества[1]:
| Вещество | Температура кипения, °C |
Удельная теплота парообразования/ конденсации, кДж/кг |
|---|---|---|
| Азот | −195,8 | 199 |
| Ртуть | 357 | 282 |
| Диэтиловый эфир | 34,6 | 380 |
| Водород | −252,6 | 448 |
| Этиловый спирт | 78,4 | 837 |
| Свинец | 1 740 | 855 |
| Аммиак | −33,4 | 1 370 |
| Вода | 100 | 2300 |
| Медь | 2 600 | 4 820 |
| Железо | 3 200 | 6 120 |
| Алюминий | 2 450 | 10 900 |
| Литий | 1 340 | 21 000 |
| Графит | 4 200 | 29 700 |
| Бериллий | 2 469 | 32 500 |
| Бор | 3 865 | 45 300 |
См. также[править | править код]
- Удельная теплоёмкость
- Удельная теплота плавления
- Сублимация
Примечания[править | править код]
- ↑ Теплота испарения // БСЭ, 3 изд.
Испарение сопровождается остыванием жидкости. Чем она холоднее, тем менее интенсивно происходит образование пара. Но скорость процесса можно поддерживать, если жидкость подогревать, то есть подводить к ней тепло.
Так возникает понятие удельной теплоты парообразования. У каждого жидкости и даже твердого тела (ведь и его можно превратить в пар) эта величина своя. Рассмотрим, как найти удельную теплоту парообразования.
Содержание
- Единица измерения
- Формула для величины
- Какие данные нужны, чтобы рассчитать значение?
- Алгоритм и правила расчета
- Несколько примеров нахождения
- Таблица для ряда веществ
- Видео по теме статьи
- Заключение
Единица измерения
Удельная теплота парообразования – это величина, которая показывает, сколько теплоты необходимо сообщить веществу массой 1 кг, чтобы превратить его в пар. При этом температура вещества должна быть постоянной.
Обычно рассматриваемую величину обозначают латинскими буквами L, r или греческой λ (лямбда). Теплота в системе СИ измеряется в Джоулях (Дж), масса – в килограммах (кг). Таким образом, L измеряется в Дж/кг.
Так как теплота в джоулях принимает зачастую большие значения, может встречаться обозначения кДж (килоджоули) – Дж*1000, или МДж (мегаджоули) – Дж*1000 000.
Формула для величины
 Формула выглядит так: L = Q/m, где:
Формула выглядит так: L = Q/m, где:
- Q – теплота,
- m – масса.
Ее часто используют для расчетов энергетических затрат на выпаривание воды из растворов: Q= L* m.
L определяют в лабораториях и заносят в таблицы, составляют справочники, которыми можно пользоваться любому желающему. При этом всегда указывают температуру и давление, при которых находилось L.
С ростом температуры L уменьшается, так как жидкость расширяется, взаимодействие между ее частицами уменьшается, и ее легче превратить в пар. Когда плотность пара и жидкости сравниваются, наступает критическое состояние.
Оно характеризуется определенным давлением и температурой. Для воды — это 374 ℃ и 218,5 атм. В таком состоянии L=0.
Какие данные нужны, чтобы рассчитать значение?
Чтобы вычислить искомую величину, применяют знания о том, что теплота испарения равна теплоте конденсации со знаком «минус». Это значит, что когда пар конденсируется (превращается в воду), он охлаждается и отдает свое тепло окружающей среде. Можно применить формулу: Q= L* m.
Для расчетов необходимы следующие данные:
- Q – теплота, отданная паром, Дж,
- m – масса образовавшейся в процессе конденсации воды, кг;
- L – удельная теплота парообразования, Дж/кг – собственно то, что нужно определить.
Применяют также закон сохранения энергии и понятие теплоемкости: Qв=С*Mв*(T2-T1), где:
- С – удельная теплоемкость воды, которая нагревается под действием сконденсированного пара, Дж/(кг*К), – считается известной и берется из таблицы,
- Mв – ее масса;
- T2-T1 – изменение температуры в Кельвинах или градусах Цельсия.
Алгоритм и правила расчета
 Для решения большинства задач используют следующий алгоритм:
Для решения большинства задач используют следующий алгоритм:
- Анализируют, как проходит процесс, какое вещество отдает, а какое получает тепло.
- Переводят все единицы измерения в одну систему.
- Записывают необходимые формулы.
- Решают уравнение с одним неизвестным.
При проведении расчетов надо следить за размерностью величин. В системе СИ масса измеряется в кг, теплота в Дж, а температура в градусах Кельвина. Разность температур можно считать в градусах Цельсия.
Часто бывает нужно найти удельную теплоту парообразования при условиях кипения жидкости и нормальном атмосферном давлении (760 мм рт. ст.). В таких условиях получают чистую воду из растворов или выделяют из смеси веществ ее части.
Процесс используется в химической и пищевой промышленности и даже на бытовом уровне.
Несколько примеров нахождения
Задача №1. Сколько необходимо энергии для превращения в пар следующих кипящих веществ:
- 2 кг этилового спирта;
- 2 кг воды;
- 2 кг расплавленного свинца.
Необходимо воспользоваться формулой Q= L* m и взять значение L из таблицы. Получится:
- 0,84*МДж*2 кг = 1,68 МДж;
- 2,3 МДж*2 кг = 4,6 МДж;
- 8,6 МДж *2 кг = 17,2 МДж.
Как видно, превратить в пар воду сложнее, чем этанол, но легче, чем металл. На первый взгляд, это очевидно, но когда дело касается веществ, близких по температуре кипения, то разница становится менее заметна, ее невозможно угадать. Тем не менее, она имеет особое значение.
Задача №2. Как вычислить, сколько энергии необходимо, чтобы превратить 1 тонну воды при 20 ℃ в пар при 100 ℃?
Решение: 1 т = 1000 кг.
 Из закона сохранения следует, что общая энергия складывается из таких составляющих: Q = Q1 +Q2, где:
Из закона сохранения следует, что общая энергия складывается из таких составляющих: Q = Q1 +Q2, где:
- Q1 – тепло, ушедшее на нагревание воды с 20 до 100 градусов,
- Q2 – тепло, необходимое для образования пара (процесс происходит без изменения температуры).
Q1 = С*M* (T2-T1), С воды = 4200 Дж/(кг*К), Q2 = L*M, L воды при обычном кипении = 2,3 МДж/кг, T2-T1 = 100-20 = 80.
Подставляя известные величины, находят искомую энергию: Q = 4200*1000*80+2,3 *106*1000 = 4,2*80*106+2300*106=2636 (МДж)
Задача №3. Сколько надо затратить электроэнергии, чтобы превратить 1 л воды в пар?
Решение: Q= Lводы*m. Масса 1 литра обычной водопроводной воды равна 1 кг. Q=2260 кДж/кг *1 кг=2260 кДж=2,3 МДж.
1 кВт*ч = 3,6 МДж. Из простой пропорции следует, что надо затратить 0,64 кВт*ч. Для 2-х литров величина возрастет в 2 раза, для 3-х – в три, и так далее.
Зная тарифы на электроэнергию, несложно посчитать стоимость, во сколько рублей обойдется такое кипячение. Надо также учитывать, что частично энергия уйдет в воздух и на нагрев сосуда, частей плиты, поэтому реальный расход будет выше.
Таблица для ряда веществ
Удельная теплота парообразования при нормальном атмосферном давлении (1 атм = 760 мм рт. ст.) и температуре кипения (для каждого вещества она своя).
| Вещество | L, МДж/кг | T кипения, ℃ |
| Вода | 2,3 | 100 |
| Этиловый спирт | 0,84 | 78,4 |
| Метиловый спирт | 1,1 | 64,1 |
| Ртуть | 0,28 | 357 |
| Жидкий азот | 0,2 | -195,8 |
| Аммиак | 1,4 | -33,4 |
| Фреон 12 | 0,16 | -24,9 |
| Расплавленный алюминий | 10,9 | 2450 |
Для воды при 20 ℃ L=2,45МДж/кг.
Видео по теме статьи
Об удельной теплоте парообразования расскажет видео:
Заключение
Единица измерения удельной теплоты парообразования – Дж/кг. Она показывает, сколько при заданной температуре надо подвести тепла, чтобы преобразовать 1 кг вещества в пар. Величина определяется путем проведения экспериментов.
Для воды при 100 ℃ ее значение 2260 кДж/кг. Эта величина довольно большая в сравнении с характеристиками других веществ. С ростом температуры значение удельной теплоты образования пара уменьшается.
На этой странице вы можете рассчитать количество теплоты, необходимое для превращение жидкости в пар с помощью калькулятора онлайн. Для этого необходимо ввести массу жидкости и ее удельную теплоту парообразования (см. таблицу).
Удельная теплота парообразования – физическая величина, показывающая, какое количество теплоты потребуется для превращения жидкости массой 1кг в пар без изменения температуры. Обозначается буквой L и измеряется в Дж/кг.
Содержание:
- калькулятор количества теплоты для превращения в пар
- формула количества теплоты для превращения в пар
- таблица “Удельная теплота парообразования”
- примеры задач
Формула количества теплоты для превращения в пар

{Q = L cdot m}
Q – необходимое количество теплоты для превращения жидкости, находящейся при температуре кипения в пар
L – удельная теплота парообразования (см. таблицу)
m – масса жидкости, находящейся при температуре кипения.
Удельная теплота парообразования жидкостей и расплавленных металлов при температуре кипения и нормальном атмосферном давлении
| Жидкость | Удельная теплота парообразования, кДж/кг |
|---|---|
| Азот жидкий | 201 |
| Аллюминий | 9200 |
| Аммиак | 1370 |
| Бензин | 230 – 310 |
| Висмут | 840 |
| Вода (при 0°С) | 2500 |
| Вода (при 20°С) | 2450 |
| Вода (при 100°С) | 2260 |
| Вода (при 370°С) | 440 |
| Вода (при 374,15°С) | 0 |
| Водород жидкий | 450 |
| Воздух | 197 |
| Гелий жидкий | 23 |
| Железо | 6300 |
| Золото | 1650 |
| Керосин | 209 – 230 |
| Кислород жидкий | 214 |
| Магний | 5440 |
| Медь | 4800 |
| Никель | 6480 |
| Олово | 3010 |
| Ртуть | 293 |
| Свинец | 860 |
| Спирт этиловый | 906 |
| Эфир этиловый | 356 |
| Цинк | 1755 |
Примеры задач на нахождение количества теплоты
Задача 1
Какое количество теплоты требуется для обращения в пар воды массой 0.2 кг при температуре 100°C?
Решение
Подставим значения из условия в формулу и рассчитаем результат. Удельную теплоту парообразования для воды при температуре 100°C возьмем из таблицы: L = 2260 кДж/кг.
Q = L cdot m = 2260 cdot 0.2 = 452 Дж
Ответ: 452 Дж
Проверим ответ с помощью калькулятора .
Жидкость может переходить в парообразное состояние двумя способами – испарением и кипением. Испаряются жидкости во всем температурном диапазоне, в то время, как кипение происходит при строго определенной температуре для каждой конкретной жидкости.
Что такое кипение
Кипение – это:
- бурный переход жидкости в пар. Во всем объеме жидкости образуются пузырьки, пар в этих пузырьках насыщенный;
- эндотермический процесс, он происходит с поглощением энергии.
Образование пара во всем объеме жидкости называют кипением.
Примечание: Интересен тот факт, что перед началом кипения от чайника с водой доносится специфический шум.
Различия между испарением и кипением
Характерным проявлением кипения может служить образование пузырьков пара внутри жидкости (рис. 1):

Рис. 1. Во время испарения пар образуется только на поверхности, а во время кипения – во всем объеме жидкости
На следующем рисунке 2 представлены отличия процессов испарения и кипения подробнее:

Рис. 2. Есть два процесса образования пара – испарение и кипение, рисунок поясняет их основные отличия
Образование пара (парообразование):
- на поверхности – это испарение,
- во всем объеме – это кипение.
Испарение происходит при любой температуре с поверхности, а кипение – только при одной конкретной температуре, но во всем объеме жидкости.
Процессы кипения и конденсации на графиках
Пусть небольшое количество воды находится в просторном закупоренном сосуде.
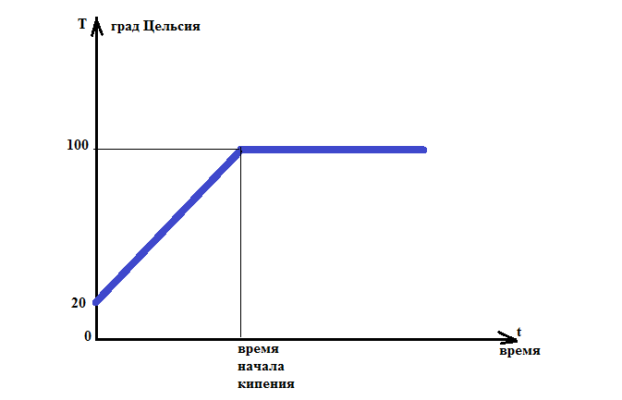
Разберем, как выглядят на температурных графиках процессы кипения и конденсации. Для начала рассмотрим график нагревания и кипения (рис. 3).
Вначале вода имела температуру +20 градусов Цельсия. Будем нагревать эту воду. Поначалу ее температура будет расти. На графике это показано наклонной синей линией, находящейся в левой части рисунка.

Рис. 3. График нагревания воды, ее кипения и нагревания полученного пара
До бесконечности температура подниматься не будет. Как только температура достигнет некоторого предела, вода закипит. Из рисунка следует, когда температура воды достигла отметки +100 градусов Цельсия и начался процесс кипения. Этот процесс на рисунке схематично обозначен горизонтальной красной линией.
Горизонтальное положение линии кипения означает, что во время кипения температура воды не изменяется. Температура будет оставаться неизменной до тех пор, пока вся вода не превратится в газообразное состояние — пар. Для компактности рисунка я укоротил эту линию, на самом деле, длину этой линии нужно увеличить.
Уже после того, как вся вода превратилась в пар, температура пара начала повышаться. Это изображено на рисунке наклонной синей линией, находящейся правее красной линии.
Будем теперь отбирать тепловую энергию у молекул. Предположим, что мы охлаждаем горячий водяной пар, находящийся в закупоренном сосуде. Процессы его охлаждения и конденсации представлены на графике (рис. 4). Этот график можно получить, зеркально отразив вокруг вертикальной оси график, связанный с нагреванием, рассмотренный ранее.

Рис. 4. График охлаждения пара, его конденсации и охлаждения полученной воды
Из графика следует:
Вначале температура пара уменьшается от +180 градусов Цельсия до +100 градусов. Это наклонная синяя линия, расположенная в левой части рисунка.
Затем, происходит конденсация пара. Молекулы пара собираются в капли жидкости. При этом, температура пара не изменяется и остается равной +100 градусам Цельсия.
Как только весь пар конденсируется, образовавшаяся жидкая вода начинает охлаждаться до конечной температуры + 20 градусов Цельсия. На графике охлаждение воды – это синяя наклонная линия, находящаяся справа от красной линии конденсации.
Температура кипения и как ее найти на графике
Чтобы жидкость закипела, ее нужно нагреть до температуры кипения.
На рисунке 5 представлен температурный график нагревания воды. Температуру кипения можно определить по горизонтальной линии, обозначающую процесс кипения. Нужно продолжить эту линию пунктиром по направлению к вертикальной оси температур. Точка, в которой пунктир упрется в ось и будет температурой кипения жидкости.

Рис. 5. Если на графике температуры найти горизонтальную линию кипения, а потом провести пунктир к оси температуры, мы найдем температуру кипения
Температура кипения – это температура, при которой пар образуется во всем объеме жидкости. Такая температура у каждой жидкости своя, ее можно найти в справочнике физики.
Температуры кипения некоторых веществ
Сравним для наглядности значения температуры кипения некоторых веществ.
Нам известно, что температура кипения питьевой воды равна 100 градусам на шкале Цельсия.
При комнатной температуре некоторые вещества пребывают в газообразном состоянии, но при более низких температурах они превращаются в жидкости. Например, кислород превращается в кипящую жидкость при минус 183 градусах Цельсия.
В противоположность этому, вещества, которые мы привыкли видеть твердыми при комнатной температуре, в кипящую жидкость превратятся при более высоких температурах. К примеру, медь станет кипящей жидкостью при 2567 град. Цельсия, а железо – при 2500 град. Цельсия
На рисунке 6 представлен список некоторых веществ и указана температура, при которой эти вещества кипят.

Рис. 6. Таблица — температура кипения некоторых веществ
Расширенный список жидкостей и их температуру кипения можно найти в справочнике физики.
Почему температура жидкости при кипении не изменяется
Тепловая энергия, которую получает жидкость во время кипения, тратится на образование пара во всем объеме жидкости. Поэтому во время кипения температура жидкости не изменяется.
Разберем подробнее, что происходит, когда мы сообщаем тепловую энергию какой-либо жидкости.
Получаемая от источника тепловая энергия передается молекулам жидкости. Скорость движения молекул увеличивается, а значит, растет их кинетическая энергия. Чем выше температура, тем быстрее будут двигаться молекулы.
Находясь в жидкости, каждая молекула притягиваются к соседним молекулам. То есть, молекулы удерживаются в жидкости силами притяжения соседних молекул. Если есть взаимодействие молекул – их взаимное притяжение, значит, есть потенциальная энергия такого взаимодействия.
По мере нагревания, энергия движения некоторых молекул увеличится настолько, что они преодолеют притяжение соседних молекул и, покинут жидкость. Чем выше температура, тем большее число молекул сможет покинуть жидкость.
Мы помним, что при испарении жидкость покидают молекулы, находящиеся только на ее поверхности. А во время кипения энергию, достаточную для того, чтобы вылететь из жидкости, получают не только молекулы на поверхности, но и молекулы, находящиеся внутри жидкости.
Примечания:
- Наблюдая за кипящей жидкостью, можно заметить, что пар образуется внутри жидкости во всем ее объеме. Пузырьки пара буду образовываться даже у дна. Они будут подниматься к поверхности, при этом расширяясь. Внутри пузырьков находятся молекулы, энергия которых достаточна для того, чтобы покинуть жидкость.
- Вместо слов «Внутри жидкости», физики говорят — «Во всем объеме жидкости».
Как давление влияет на температуру кипения
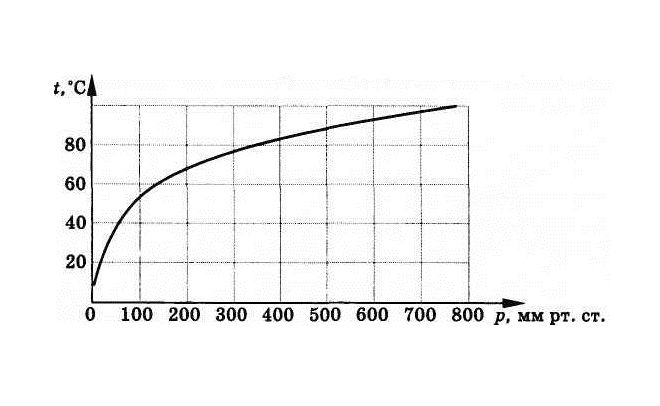
Мы можем влиять на температуру кипения жидкостей, изменяя давление. Если давление воздуха увеличить, то температура кипения, так же, возрастет. К примеру, вода при давлении 220 атмосфер (это 21,6 миллионов Паскалей) закипит только тогда, когда ее температура поднимется до 370 градусов Цельсия.
А уменьшая давление, мы наоборот, температуру кипения жидкостей понизим. Именно из-за пониженного давления, температура кипения воды в высокогорных районах ниже, чем, на равнинной местности, которая ближе к уровню мирового океана. В горах вода закипает при температуре 90 градусов Цельсия. Из-за этого, некоторые продукты высоко в горах сварить не получится.
Чем выше давление, тем выше температура кипения жидкости. Уменьшив давление, мы понизим температуру кипения.
Что такое удельная теплота парообразования
Возьмем какую-либо жидкость массой 1 кг, предварительно нагретую до температуры кипения. Будем сообщать ей тепловую энергию, чтобы испарить эту жидкость полностью.
Та энергия (теплота), которую мы затратим, чтобы испарить с помощью кипения 1 кг жидкости, называется удельной теплотой парообразования. Удельной величиной эту теплоту называют потому, что она приходится на 1 кг жидкости.
Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
(large L left( frac{text{Дж}}{text{кг}}right)) – удельная теплота парообразования (конденсации).
На рисунке 7 представлена таблица, в которой содержится удельная теплота парообразования (конденсации) при температуре кипения для некоторых жидкостей и металлов в расплавленном состоянии.

Рис. 7. Таблица – удельная теплота парообразования (конденсации) некоторых веществ при температуре кипения
Что происходит с энергией во время кипения и конденсации
Кипение: жидкость получает тепловую энергию (количество теплоты), из нее вырываются молекулы. Полученная энергия тратится на преодоление притяжения соседних молекул и на расширение образовавшегося пара.
Конденсация: молекулы пара отдают тепловую энергию в окружающее пространство, собираясь в капельки — превращаясь в жидкость.
Выполняется закон сохранения энергии. Именно поэтому теплота парообразования и теплота конденсации совпадают. Процессы кипения и конденсации протекают при одной и той же температуре. Различие кроется в том, что кипение происходит с поглощением энергии, а конденсация связана с выделением энергии.
Как удельная теплота парообразования связана с количеством теплоты — формула
Пусть жидкость предварительно нагрета до температуры кипения, и нам известны:
- ее масса (количество килограммов) и
- удельная теплота парообразования;
Мы можем посчитать общее количество теплоты, требуемое для перевода всей жидкости в пар. Расчеты нужно вести по формуле:
[large boxed{ Q = L cdot m }]
(large m left( text{кг} right) ) – масса вещества;
(large L left( frac{text{Дж}}{text{кг}} right) ) – удельная теплота парообразования (конденсации);
(large Q left( text{Дж} right) ) – количество теплоты, поглощенное жидкостью во время кипения, т. е. общая тепловая энергия для перевода всей жидкости в пар;
Формулу можно применять так же, чтобы рассчитать количество теплоты, выделяемое в окружающую среду молекулами пара при их конденсации.
Для процесса конденсации величина (large Q ) – это количество теплоты, выделенное молекулами пара в окружающую среду;
Чем удельная теплота парообразования отличается от количества теплоты
Отличия удельной теплоты парообразования от количества теплоты, приведены на рисунке 8:

Рис. 8. Если жидкость находится при температуре кипения, то удельная теплота парообразования — это энергия для перевода в пар одного кг жидкости, а количество теплоты – это энергия перевода в пар нескольких кг жидкости
В любом случае, жидкость предварительно нужно нагреть до температуры кипения.
Количество теплоты – это энергия, необходимая для конденсации или образования пара при температуре кипения для нескольких килограммов жидкости.
Удельная теплота парообразования – это энергия, необходимая для перевода в пар 1-го килограмма жидкости.
Выводы
- Жидкость может переходить в парообразное состояние двумя способами: испарением или кипением.
- Образование пара (парообразование) на поверхности – это испарение, а во всем объеме – это кипение.
- Кипение – это эндотермический процесс, который происходит с поглощением энергии. Во всем объеме жидкости образуются пузырьки, пар в этих пузырьках насыщенный;
- Чтобы жидкость начала кипеть, ее нужно нагреть до температуры кипения. Каждая жидкость кипит при строго определенной для нее температуре.
- Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
- На графике температур процессы кипения и конденсации изображаются горизонтальными линиями.
- Умножив удельную теплоту парообразования (large L ) на количество килограммов m кипящей жидкости, получим общее количество теплоты (large Q ), затраченной на перевод всей жидкости в пар во время ее кипения.
Удельная теплота парообразования


4.6
Средняя оценка: 4.6
Всего получено оценок: 198.
4.6
Средняя оценка: 4.6
Всего получено оценок: 198.
Если жидкость разогреть до температуры кипения, то начнется процесс парообразования. Молекулы жидкости, получив дополнительную энергию, отрываются от поверхности и переходят в газообразное состояние. Это явление называется парообразованием. Обратный процесс, когда молекулы пара, потеряют излишки энергии и снова перейдут в жидкое состояние, называется конденсацией.
Удельная теплота парообразования
Удельной теплотой парообразования называется физическая величина равная количеству тепла, которое необходимо потратить, чтобы превратить жидкость массой 1 кг в пар. Обозначают эту единицу латинской буквой L. Формула удельной теплоты парообразования выглядит так:
$$L={Q over m}$$
где:
Q — количество тепла израсходованное на преобразование жидкости в пар, Дж;
m — масса жидкости, кг.
Значения L для разных веществ определяют экспериментально.
Зная L, можно вычислить количество тепла Q, которое необходимо сообщить телу массой m для его полного преобразования в пар:
$$Q={L*m}$$

В каких единицах измеряется удельная теплота парообразования
Удельная теплота парообразования в СИ (Международная система ) измеряется в джоулях на килограмм, Дж/кг. Для некоторых задач применяется внесистемная единица измерения – килокалория на килограмм, ккал/кг. Напомним, что 1 ккал = 4,1868 Дж.
После достижения точки кипения (температуры кипения) температура не возрастает, хотя тепло непрерывно поступает. Это объясняется тем, что после закипания почти все тепло идет на создание пара — разрыв молекулярных связей и отрыв от поверхности жидкости.
Удельная теплота парообразования некоторых веществ
Информацию о значениях удельной теплоты парообразования для конкретного вещества можно найти в технических справочниках или в их электронных версиях на интернет-ресурсах. Обычно они приводятся в виде такой таблицы “Удельная теплота парообразования, L”
|
Вещество |
105 * Дж/кг |
ккал/кг |
Вещество |
105 * Дж/кг |
ккал/кг |
|
Аммиак |
13,6 |
327 |
Скипидар |
3 |
70 |
|
Вода |
22,6 |
5,39 |
Спирт |
8,5 |
204 |
|
Железо |
0,58 |
13,9 |
Ртуть |
3,0 |
71 |
|
Сероуглерод |
3,5 |
84 |
Эфир |
3,5 |
84 |
Температура кипения зависит от атмосферного давления. Чем ниже давление, тем меньше температура кипения. Например, температура кипения воды равна 1000С при нормальном атмосферном давлении, равном 760 мм.рт.ст. А если подняться в горы, на высоту порядка 4000 метров, то точка кипения у воды упадет до 800С.

Что мы узнали?
Мы узнали как определяется удельная теплота парообразования L. С помощью этой величины можно рассчитать количество тепла, требуемого для преобразования определенной массы жидкости в пар. Такие вычисления необходимо производить в промышленности, где в качестве теплоносителя используется пар, например на тепловых электростанциях.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 198.
А какая ваша оценка?

