16
3. В баллоне кислородного изолирующего
противогаза (КИП) ёмкостью 1 л находится
сжатый кислород. Определить удельный
объём и плотность кислорода при указанных
условиях. Какой объём займёт данная
масса кислорода при нормальных физических
условиях, если масса кислорода в баллоне
0,2 кг.
|
Дано: кислород O2 V=1л m=0,2 кг |
СИ: Нормальные
Объем 1л = Молярная Плотность кислорода O2: |
|
Найти: v -? ρ-? |
Решение.
а) Анализ данных и формул.
Задача на определение параметров
состояния газа.
Уравнение состояния идеального газа
(иногда уравнение Клапейрона или
уравнение Менделеева — Клапейрона) —
формула, устанавливающая зависимость
между давлением, молярным объёмом и
абсолютной температурой идеального
газа. Уравнение имеет вид:
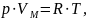
где
p – давление,
VM
– молярный объём,
R – универсальная газовая
постоянная,
T – абсолютная температура,
К.
Так как,
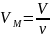
где ν – количество вещества, а
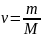
,
где m – масса, M
– молярная масса, уравнение состояния
можно записать:
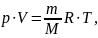
Эта форма записи носит имя уравнения
(закона) Менделеева — Клапейрона.
Из этой формулы легко выразить объем:
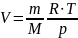
Удельный объём
тела (системы):
v
= V/m
, где V
– объём тела (системы) массой m.
Удельная масса
(плотность) тела (системы):
= m/V
или из
уравнения Клапейрона
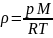
б) Вычисления.
Удельный объем газа, находящегося в
баллоне:
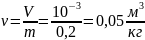
Плотность кислорода, при указанных
условиях:
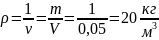
Объем кислорода, при нормальных физических
условиях::
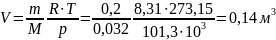
Ответ: удельный объем и плотность
кислорода, находящегося в баллоне
соответственно равны 0,05 м3/кг и
20 кг/м3; при нормальных условиях
объем кислорода той же массы: 0,14 м3
4. Кислород изотермически сжимается
до пятикратного уменьшения объёма.
Определить объём и давление кислорода
после сжатия, работу сжатия и количество
тепла, отведённого от газа, если
первоначальные объём и давление
кислорода и температура соответственно
равны
|
V, м3 |
Р, кПа |
t, °С |
|
0,6 |
120 |
30 |
|
Дано: кислород O2 T=const; V1=0,6 p1=120 |
СИ: Т1=30°С=30+273,15=303,15 p1=120 Молярная Плотность кислорода O2: |
|
Найти: V2 , p2, |
Решение.
а) Анализ данных и формул.
Изотермический процесс – термодинамический
процесс, происходящий в физической
системе при постоянной температуре.
(T = const,
m = const,
M =const).
Уравнение изотермического процесса
(закон Бойля – Мариотта):
рV = const
,
где р и V – соответственно
давление и объём газа.
Работа расширения газа:
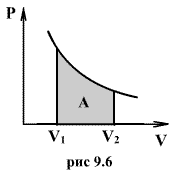
Рис.1.
Изотермический процесс.
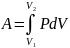
Из уравнения Менделеева-Клапейрона
выражаем давление p:

и подставим в уравнение работы:
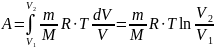
Таким образом, работа в изотермическом
процессе:
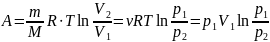
где р1, V1 и p2, V2
– соответственно начальные и конечные
значения давления и объёма газа.
Изменение внутренней энергии: U
= 0.
Первый закон термодинамики, количество
теплоты:
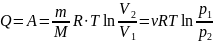
б) Вычисления.
Из закона Бойля-Мариотта следует:
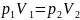
Отсюда найдем давление p2:
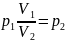
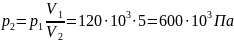
Объем после сжатия V2:
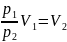

Известно, что масса газа при сжатии не
меняется:
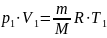
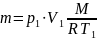
Тогда работа сжатия:
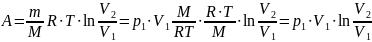
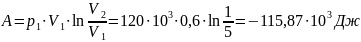
Количество теплоты:
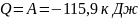
(знак минус указывает на то, что газ
сжимается)
Ответ: объём и давление кислорода
после сжатия равны соответственно 0,12
м3 и 600кПа, работа сжатия равна
количеству тепла, отведённого от газа
и равна 115,9 кДж
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Что такое – удельный объем, удельный вес, плотность? |
|---|
| Удельный объем газа, это объем единицы веса вещества. Обозначение – м3/кг. Удельный вес газа это величина, обратная удельному объему. Размерность: кг/м3. Молярным объемом газа, это удельный объем умноженный на молекулярный вес вещества. |
Методы определения удельного объема и удельного веса газов: |
| Существует несколько методов определения удельного веса веществ: взвешивания, пикнометра, ареометра и другие, в основном метод определяется агрегатным состоянием исследуемого вещества, его давления, температуры и прочих условий эксперимента. |
Плотность Кислорода:Вес 1 литра Кислорода или паров Кислорода при тетпературе 0 град.С и давлении 760 мм. = 1,43.
|
||||
| Газы | Малекулярный вес газа | Вес 1 литра газа | Удельный вес газа | Удельный вес газа в жидком состоянии |
|---|---|---|---|---|
| Кислород | 32 | 1,43 | 1,105 |
| Справочная информация |
|---|
|
Определите удельный объём кислорода и азота при нормальных условиях.
На странице вопроса Определите удельный объём кислорода и азота при нормальных условиях? из категории Физика вы найдете
ответ для уровня учащихся 10 – 11 классов. Если полученный ответ не
устраивает и нужно расшить круг поиска, используйте удобную поисковую
систему сайта. Можно также ознакомиться с похожими вопросами и ответами
других пользователей в этой же категории или создать новый вопрос. Возможно,
вам будет полезной информация, оставленная пользователями в комментариях, где
можно обсудить тему с помощью обратной связи.
![]()
8
Определите удельный объём кислорода и азота при нормальных условиях.
1 ответ:
![]()
0
0
нормальные условия
Давление P=101325 Па
Температура T= 273 К
масса m=1 кг=1000 г
µ1=32 г/моль -молярная масса молекулы кислорода О2
µ2=28 г/моль -молярная масса молекулы атома N2
R=8.31 – универсальная газовая постоянная
——————
удельный объем
V1 -?
V2 -?
формула Менделеева-Клапейрона
PV=m/µ*RT
V=1/µ * mRT/P
V1=1/32 *1000*8.31*273/101325 =0.6996=0.7 м3 – кислород
V2=1/28 *1000*8.31*273/101325 =0.7996=0.8 м3 – азот
Читайте также
![]()
Переведём милиомы в омы ,это будет 0.0012ом
Найдём падение напряж на амперметре U=I*R=6.2*0.0012=0.00744в
![]()
Дано:V=4000 cм3р=7г/см3
Найти:m=?
Решение:m=p*Vm=7 г/см3 * 4000 см3= 28000г
<span>Ответ: 28000г масса ядра</span>
![]()
Газовый разряд – это совокупность ряда физических процессов, вызываемых электрическим током в газе. Диапазон возможных значений тока чрезвычайно широк – от 10–15 А до 106 А. На участках диапазона определяющую роль играют различные физические процессы, причем характерные границы участков не являются строго определенными, а зависят от давления газа и межэлектродного расстояния, варьируемых в пределах нескольких порядков, от рода газа, материала и формы электродов.
![]()
При падении камень находится в невесомости, потому что нету опоры или подвеса
![]()
линза с большим радиусом кривизны имеет большее фокусное расстояние , чем больше фокусное , тем меньше оптическая
