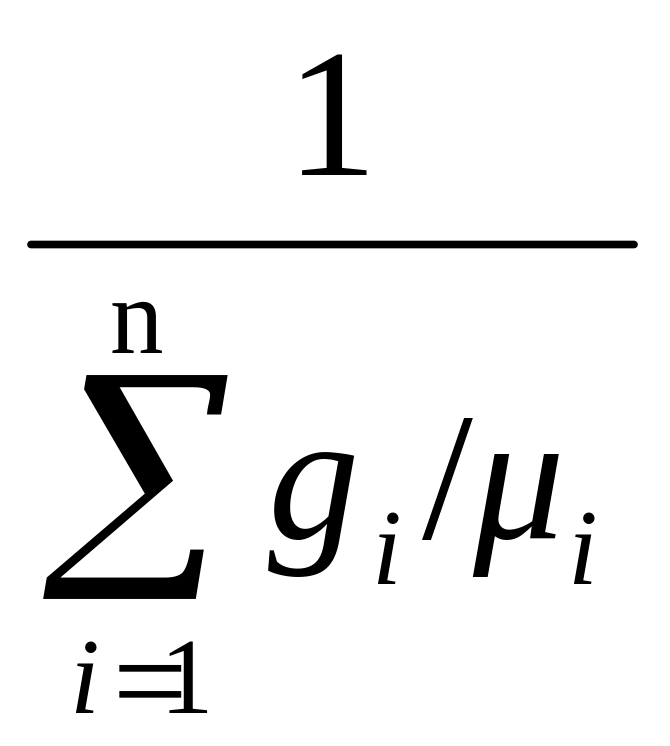Определить удельный объем воздуха
Ученик
(190),
на голосовании
7 лет назад
Голосование за лучший ответ
Viktor Rudjak
Искусственный Интеллект
(192494)
7 лет назад
Если вам надо действительно определить удельный объем воздуха при этих условиях (а не что-то другое), то тут все просто.
Используйте соотношение
Р0*V0/T0=P1*V1/T1
V0 возьмите равным 22,4 м3 и определите V1 из этого уравнения.
Поскольку молярная масса воздуха=
=29 г/моль=29 кг/киломоль=29/(22,4*1000)кг/м3=считайте сами, то получив объем воздуха при заданных условиях разделите на него молярную массу (которую посчитаете сами) и получите удельный объем воздуха м3/кг
Александр Кузнецов
Ученик
(129)
5 лет назад
.приведите объем исследуемого воздуха в рабочей зоне к нормальным условиям, если объем воздуха, взятого для манализа составил 2 литра, барометрическое давление в момент определения 720 мм. рт. ст, температура воздуха в рабочей зоне составила 18
Удельный объём υ
– объём занимаемый 1 кг рабочего тела
(газа) и определяется по формуле:
υ
= V/m,
м3/кг,
(1.6)
где V
– объём занимаемый газом м3;
m
– масса газа, кг.
Плотностью ρ
называется количество газа, заключённое
в единице объёма. Следовательно, если
m
кг занимают объём V
м3,
то плотность его определяется по формуле
ρ
= m/V,
кг/м3.
(1.7)
Из данных определений
видно, что плотность газа ρ
это величина обратная удельному объёму
υ,
т.е.
ρ·υ
= 1. (1.8)
1.4. Уравнение состояния идеального и реального газов
1.4.1. Уравнение состояния идеального газа
Основные параметры
рабочего тела независимо от его
агрегатного состояния связаны между
собой уравнением, называемым уравнением
состояния, которое может быть представлено
так:
f
(p,
υ,
T)
= 0.
(1.9)
Уравнение
(1.9) в пространстве отображает поверхность,
которая характеризует всевозможные
равновесные состояния химически
однородной термодинамической системы
(газ, жидкость). При отсутствии внешних
полей (гравитационного, электрического,
магнитного) число независимых параметров,
однозначно определяющих равновесное
состояние системы, будет равно двум из
трех (p,
υ,
T),
так как любой из этих трех параметров
является однозначной функцией двух
заданных.
Например,
если принять за независимые переменные
υ
и T,
то
p
можно выразить как функцию υ
и Т,
т.е. р
= р
(Т,
υ);
если же за независимые переменные
принять р
и Т,
то удельный объём можно выразить как
функцию р
и Т,
т.е. υ
= υ (р,
Т).
Таким
образом, уравнение состояния устанавливает
связь между давлением, температурой и
удельным объёмом однородной
термодинамической системы.
Наиболее
простой вид уравнение состояния имеет
для идеальных газов. Свойства идеальных
газов, как известно, основаны на
экспериментальных законах. (Законы
Бойля – Мариотта, Гей – Люсака и Шарля).
Эти
законы можно объединить в один, который
формируется так: для данного газа
произведение давления на объём в любом
состоянии пропорционально его массе и
абсолютной температуре.
Математическая
запись этого закона выражается уравнением
Клапейрона (1834 г.).
p·V
= m·R·T
(1.10)
Для одного кг газа
уравнение (1.10) принимает вид:
p·υ
= R·T
(1.11)
В
уравнениях (1.10), (1.11) коэффициент R
имеет размерность Дж/(кг·K)
и называется газовой постоянной, которая
зависит от молекулярной массы газа μ.
Уравнению
Клапейрона можно придать универсальную
форму, если отнести газовую постоянную
к одному киломолю газа.
Киломолем (кмоль)
или килограммолекулой называется
количество килограммов вещества,
численно равное его молекулярной массе.
Обе
части уравнения (1.11) умножим на массу
одного киломоля μ,
г/кмоль.
p·υ·μ
= R·T·μ
, (1.12)
где
υ·μ
= Vμ
,
–
объём
одного киломоля газа;
μ·R
= Rμ
, Дж/(кмоль·К) – универсальная
газовая постоянная.
Известно,
что идеальные газы подчиняются закону
Авогадро (1811 г.), который гласит, что при
одинаковых температурах и давлениях
объёмы, занимаемые одним киломолем
любого идеального газа, одинаковы.
Измерения показали, что при нормальных
атмосферных условиях (pо
= 101325 Па; То
= 273,15 К) один киломоль идеального газа
занимает Vμ
= 22,4136 м3,
отсюда можно получить, что
μ·R
= Rμ
=
Rμ
= Rун
.
Таким
образом, для одного киломоля идеального
газа уравнение состояния будет одинаковым
для всех газов:
p·Vμ
= Rμ·T
(1.13)
Это
уравнение носит название уравнение
Клапейрона – Менделеева.
С помощью формулы
R
=
(1.14)
можно
определить газовую постоянную R
для любого газа.
Масса одного
киломоля сухого воздуха находится по
уравнению:
μвозд
=
, (1.15)
где
gi
=
mi
/mсм
– массовая доля газа или отношение
массы газа к общей массе смеси;
μi
– молекулярная масса одного киломоля
i-го
газа в составе смеси, кг/кмоль.
Пользуясь
таблицей 1.1., получаем
μвозд
= 1/(0,78084/28,0134 + 0,209476/31,9968 + 0,934/39,3440 +
+
0,0314/44,0079
+ и т.д.) = 28,966 кг/кмоль.
Таким
образом, газовая постоянная сухого
воздуха равна
Rвозд
=
= 287 Дж/(кг·К).
Рассуждая
аналогичным образом можно вычислить
газовую постоянную для продуктов
сгорания для газотурбинных двигателей
(ГТД), она получается равной
Rг
= 288 Дж/(кг·К).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
| Удельный объём | |
|---|---|
 |
|
| Размерность | L3M−1 |
| Единицы измерения | |
| СИ | м³/кг |
| СГС | см³/г |
| Примечания | |
| скалярная величина |
Уде́льный объём — объём, занимаемый единицей массы вещества.
Скалярная физическая величина, обычно обозначаемая 

- где
— объём;
— масса.
В СИ имеет размерность м3/кг, в СГС — см3/г.
Связь с молярным объёмом[править | править код]
Молярный объём 
- где
— число молей вещества в объёме
Отсюда следует:
- где
— молекулярная масса вещества.
Удельный объем идеального газа[править | править код]
Удельный объем идеального газа связан с газовой постоянной 



Плотности и удельные объёмы[править | править код]
В таблице приведены плотности и удельные объёмы для некоторых веществ и объектов. Значения указаны для стандартных температуре и давлении: 0°С (273,15 К) и 1 атм (101,325 кПа или 760 мм рт. ст.).
| Название вещества | Плотность,
кг/м3 |
Удельный объём | Название вещества | Плотность,
кг/м3 |
Удельный объём | ||
|---|---|---|---|---|---|---|---|
| м3/кг | л/кг | м3/кг | л/кг | ||||
| Воздух | 1.225 | 0,816 | 816 | Двуокись углерода | 1,977 | 0,506 | 506 |
| Водяной лёд | 916,7 | 0,00109 | 1,09 | Хлор | 2,994 | 0,334 | 334 |
| Морская вода | 1030 | 0,00097 | 0,97 | Метан | 0,717 | 1,39 | 1390 |
| Ртуть | 13546 | 0,00007 | 0,07 | Азот | 1,25 | 0,799 | 799 |
| Фреон R-22* | 3,66 | 0,273 | 273 | Водяной пар* | 0,804 | 1,24 | 1240 |
| Аммиак | 0,769 | 1,30 | 1300 | Водород | 0,0899 | 11,12 | 11120 |
| Жидкая вода | 1000 | 0,001 | 1 | Человек | 940—980 (вдох)
1010—1070 (выдох) |
0,00104
0,00096 |
1,04
0,96 |
| Солнце | 1410 | 0,0007 | 0,7 | Земля | 5510 | 0,00018 | 0,18 |
| * — значения указаны для нестандартных температуры и давления |
См. также[править | править код]
- Плотность вещества (Удельная масса)
- Удельный вес
- Пикнометр
- Ареометр
Примечания[править | править код]
- ↑ Зеленцов Д. В., Техническая термодинамика, 2012, с. 4.
- ↑ Новиков И. И., Термодинамика, 2009, с. 13.
- ↑ Карминский В. Д., Техническая термодинамика и теплопередача, 2005, с. 8.
- ↑ Мурзаков В. В., Основы технической термодинамики, 1973, с. 13.
- ↑ Вукалович М. П., Новиков И. И., Термодинамика, 1972, с. 13.
Литература[править | править код]
- Вукалович М. П., Новиков И. И. Термодинамика. — М.: Машиностроение, 1972. — 671 с.
- Зеленцов Д. В. Техническая термодинамика. — Самара: Самарский гос. архитект.-строит. ун-т, 2012. — 140 с. — ISBN 978-5-9585-0456-5.
- Карминский В. Д. Техническая термодинамика и теплопередача. — М.: Маршрут, 2005. — 224 с. — ISBN 5-89035-202-4.
- Мурзаков В. В. Основы технической термодинамики. — М.: Энергия, 1973. — 304 с.
- Новиков И. И. Термодинамика. — 2-е изд., испр. — СПб.: Лань, 2009. — 590 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-0987-7.
Ссылки[править | править код]
- Объем удельный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907. Статья Коновалова Д. П.
Удельный объем – воздух
Cтраница 1
Удельный объем воздуха определим, пользуясь уравнением состояния идеального газа, которое в рассматриваемых условиях дает достаточно точные результаты.
[2]
Удельный объем воздуха в результате сжатия в компрессоре уменьшится в 0 834: 0 136 6 12 раза.
[3]
МПа; V – удельный объем воздуха; Ь – опытная постоянная, близкая по значению постоянной Ван-дер – Ваальса.
[4]
Начальная температур УЛ 450 К, удельный объем воздуха в конце процесс.
[5]
Здесь PQ и vn давление и удельный объем воздуха при нормальных физических условиях, а отношение pv / pava – так называемое число Амага.
[6]
Изотермический процесс характеризуется изменением давления р и удельного объема воздуха V при постоянной его температуре.
[7]
В табл. 26 приведены некоторые данные по удельным объемам воздуха, удаляемого от ванн бортовыми отсосами. Данные заимствованы из отечественной и иностранной практики.
[8]
Так как при переходе от каждой предыдущей ступени к последующей удельный объем воздуха меняется, то рабочие колеса должны иметь неодинаковые размеры. Уменьшение размеров осуществляется либо за счет уменьшения диаметра, либо за счет уменьшения ширины лопаток, либо тем и другим способом.
[9]
Диаметры рабочих колес уменьшаются от всасывания к нагнетанию вследствие уменьшения удельного объема воздуха в результате сжатия.
[10]
В распространенной методике теплотехнических расчетов все основные величины – состав топлива, удельные объемы воздуха и продуктов сгорания, их энтальпии, удельные тепловосприятия элементов парогенератора-относятся к 1 кг ( м3) топлива. Поскольку теплота сгорания топлива колеблется в широких пределах, то естественно, что все эти величины так же широко изменяются. В связи с этим, в нормативных материалах имеются вспомогательные расчетные таблицы объемов и энтальпий по усредненному составу для каждого отдельного сорта и месторождения топлива. Но на электростанциях в зависимости от сезона и других условий часто сжигаются разнообразные топлива, состав которых сильно отличается от усредненных составов, а также смеси различных топлив. Кроме того, при существующем положении, когда основные расчетные величины относятся к единице массы топлива, затруднены обобщения и анализ расчетных данных и результатов испытаний парогенераторов.
[11]
Следует только ввести расчетный удельный объем газа, полученный как среднее арифметическое удельных объемов воздуха входящего и уходящего.
[12]
Это обусловлено тем, что замерить давление до компрессора р и после него р2 значительно проще, чем замерить удельные объемы воздуха v и г2 в этих точках цикла.
[13]
Для ориентировочных подсчетов объема воздуха, удаляемого от ванн, а также для проверки расчетов по формулам иногда пользуются нормами удельного объема воздуха на 1 м2 зеркала.
[14]
Точка пересечения перпендикуляра, опускаемого из точки 2 на ось энтропии, с изотермой 71i 50 C является концом стадии адиабатического расширения воздуха в соплах турбины. Удельный объем воздуха в этой точке соответствует изохоре У3 0 20 м3 / кг, проходящей через найденную точку 3 диаграммы.
[15]
Страницы:
1
2
3