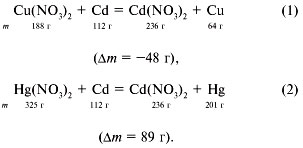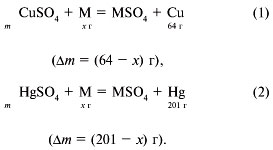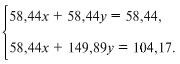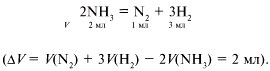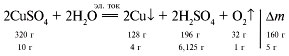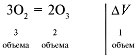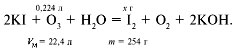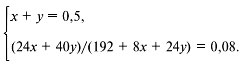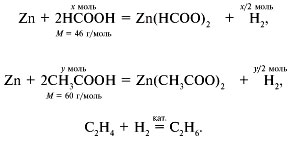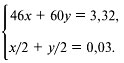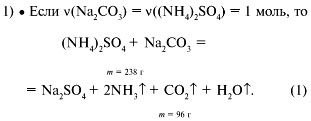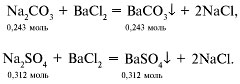В ПОМОЩЬ МОЛОДОМУ
УЧИТЕЛЮ
Решение задач
на уменьшение-увеличение
массы, объема, числа молей

Белогорском районе Республики Крым был
организован межшкольный районный факультет по
химии. Необходимость его создания виделась в том,
что он позволил бы получать более глубокие
знания по химии ученикам не только городских, но
и сельских школ, что важно для
сельскохозяйственного района.
За время работы факультета многие выпускники
стали студентами вузов Украины и России, где
профилирующим предметом является химия, а до
поступления в вузы были призерами районных,
областных и республиканских олимпиад.
К числу достоинств факультета относится то, что
рядом с учениками занимались учителя, которые
хотели углубить навыки решения сложных задач.
Занятия на факультете проводились блоками по
трем направлениям: теория, практикум, решение
задач. Продолжительность занятия – 4 ч с
обязательным домашним заданием.
Хочется надеяться, что приведенный ниже блок
принесет пользу учителям школ и руководителям
химических кружков. Этот блок предлагался
ученикам не только старших классов, но и
восьмиклассникам. Единственное отличие
заключалось в том, что для восьмиклассников на
доске записывались уравнения реакций, которые
они еще не знали, и химические формулы
неизвестных им веществ.
УСЛОВИЯ ЗАДАЧ
1. В раствор медного купороса погрузили
железную пластинку. Определите массу всей
выделившейся на ней меди, если масса пластинки
увеличилась на 1,2 г.
2. В раствор нитрата серебра погрузили
медную пластинку массой 80 г. После полного
вытеснения серебра масса пластинки увеличилась
на 7,6%. Определите массу серебра, выделившегося на
пластинке.
3. В раствор, содержащий 9,4 г нитрата меди и
9,75 г нитрата ртути, погрузили кадмиевую
пластинку массой 50 г. На сколько процентов
увеличилась масса пластинки после полного
вытеснения меди и ртути кадмием, если медь и
ртуть полностью осели на пластинке?
4. В раствор, содержащий 18,8 г нитрата меди и
32,5 г нитрата ртути, погрузили кадмиевую
пластинку массой 500 г. На сколько процентов
увеличилась масса пластинки после полного
вытеснения меди и ртути кадмием, если медь и
ртуть полностью осели на пластинке?
5. В раствор, содержащий 15,4 г
кристаллогидрата нитрата кадмия Cd(NO3)2•4Н2O,
погрузили цинковую пластинку. Через некоторое
время ее вынули из раствора, промыли, высушили и
взвесили. Масса ее увеличилась на 0,94 г. Раствор
осторожно выпарили до образования
кристаллогидратов нитратов кадмия Cd(NO3)2•4Н2O
и цинка Zn(NО3)2•6Н2О. Определите
состав остатка кристаллогидратов.
6. В раствор, содержащий 8,32 г сульфата
кадмия, погрузили цинковую пластинку. После
полного выделения кадмия из раствора масса
пластинки увеличилась на 2,35%. Определите массу
цинковой пластинки.
7. Две пластинки с одинаковой массой,
изготовленные из металла, образующего
двухзарядные ионы, погрузили: одну в раствор
сульфата меди, а вторую – в раствор сульфата
ртути. Через некоторое время масса пластинки,
погруженной в раствор сульфата меди, уменьшилась
на 3,6%, а масса второй пластинки увеличилась на
6,675%. Уменьшение молярной концентрации обоих
растворов было одинаковым. Определите
эквивалент и название металла.
8. Смесь хлорида и йодида натрия массой 104,17 г
растворили в воде, через полученный раствор
пропустили избыток хлора. Затем раствор выпарили
и остаток прокалили до постоянной массы, которая
составила 58,44 г. Вычислите массовые доли солей в
смеси.
9. К раствору, содержащему 1,6 г КВr, прибавили
5 г брома-сырца, содержащего примесь хлора. После
упаривания смеси было получено 1,155 г твердого
остатка. Определите содержание хлора в препарате
брома.
10. Определите процентное содержание
примесей в перманганате калия, если при
нагревании 40 г образца образовалось 36,8 г
твердого остатка.
11. Определите процентное содержание
дихромата аммония в образце, если при разложении
32 г его образовалось 22 г твердого остатка.
12. При разложении 25 г карбоната кальция
образовалось 16,2 г твердого остатка. Определите
степень разложения карбоната кальция.
13. При сгорании 5,4 г трехвалентного металла
образовалось 10,2 г оксида. Определите, какой
металл был взят для сожжения.
14. При прокаливании 2,42 г кристаллогидрата
азотнокислой меди масса уменьшилась на 1,62 г.
Установите формулу кристаллогидрата.
15. На чашках весов уравновешены два сосуда,
в которые налиты равные объемы раствора соляной
кислоты. В один сосуд насыпали 1 г мела. Сколько
нужно прибавить карбоната бария в другой сосуд,
чтобы равновесие весов не нарушилось?
16. При разложении аммиака объемом 100 мл
произошло увеличение объема до 150 мл. Определите
массовую долю аммиака, подвергшегося разложению.
17. Электролиз 6%-го раствора медного
купороса объемом 200 мл и плотностью 1,02 г/мл
продолжали до тех пор, пока масса раствора не
уменьшилась на 5 г. Определите массовые доли
соединений в оставшемся растворе.
18. При разложении 1 моль дихромата аммония
выделяется 503 кДж энергии. Сколько энергии
выделилось при разложении некоторой порции
дихромата аммония, если масса твердого остатка
оказалась на 25 г меньше массы исходного вещества?
19. К 50 мл смеси СО и СО2 добавили 50 мл О2
(н.у.). Смесь сожгли, после чего ее объем,
приведенный к нормальным условиям, оказался
равным 90 мл. Найдите объемные доли газов в
начальной смеси.
20. При сжигании 100 л смеси метана, оксида
углерода(II) и этилена было получено 120 л СО2.
Объемы газов измерялись в одинаковых условиях.
Сколько литров этилена содержалось в смеси?
21. После пропускания воздуха через озонатор
его объем уменьшился на 112 мл (н.у.). Какая масса
йода выделится при пропускании полученного газа
через раствор йодида калия?
22. Смесь гидридов лития и натрия
прореагировала с 193 мл воды. Масса полученного
раствора оказалась на 1 г меньше суммы масс
исходных веществ, а массовая доля щелочей в
растворе оказалась равной в сумме 8%. Определите
массы исходных гидридов.
23. При действии соляной кислоты на смесь
железных, медных и золотых опилок масса раствора
увеличилась на 2,7 г. Нерастворившуюся часть смеси
обработали горячей концентрированной серной
кислотой, при этом выделилось 1,12 л газа (н.у.).
Нерастворившийся же осадок имел массу
4,02 г. Установите массовые доли металлов в смеси.
24. К 4 л смеси метана с ацетиленом прибавили
вдвое больший объем водорода и всю смесь
пропустили над Рt-катализатором. После этого
объем газа составил 8 л. Определите объемную долю
ацетилена в исходной смеси.
25. После длительного прокаливания порошка
меди на воздухе масса его увеличилась на 1/8.
Определите состав образовавшейся смеси (в % по
массе).
26. Газ, полученный при действии избытка
металлического цинка на раствор, содержащий 3,32 г
смеси уксусной и муравьиной кислот в 21,68 мл воды,
смешали с этиленом объемом 0,112 л. После
пропускания полученной смеси над нагретым
никелевым катализатором ее объем уменьшился до
0,672 л (н.у.). Полученный газ не обесцвечивает
раствор перманганата калия. Вычислите массовые
доли кислот в растворе.
27. Тонко измельченную смесь карбоната
натрия и сульфата аммония нагревали в открытом
тигле, постепенно увеличивая температуру до
700 °С, и выдерживали при этой температуре до
постоянной массы. В результате произошло
уменьшение массы на 30%. Получившийся твердый
остаток растворили в воде. После добавления к
полученному раствору избытка раствора хлорида
бария выпал осадок. Определите (в массовых долях):
1) состав исходной смеси;
2) состав образовавшегося осадка.
РЕШЕНИЯ ЗАДАЧ
1. Записываем уравнение реакции:
Давайте попробуем себе представить, что
происходит при погружении железной пластинки в
раствор сульфата меди. Если один атом железа
переходит с пластинки в раствор, то на его место
из раствора на пластинку выделяется один атом
меди. Если в реакцию вступит 1 моль железа, то на
пластинке выделится 1 моль меди. Поскольку
атомная масса меди больше атомной массы железа и
вся медь оседает на пластинке, то в этом случае
масса пластинки увеличится на:
64 – 56 = 8 г.
Масса пластинки увеличится на 8 г – меди
выделится 64 г, масса пластинки увеличится на 1,2 г
– меди выделится х г.
Отсюда х = 9,6 г.
Ответ. m(Cu) = 9,6 г.
А могли бы вы узнать, сколько железа перешло в
раствор, а также массы сульфатов железа и меди?
2. Масса пластинки увеличилась на:
80•0,076 = 6,08 г.
Записываем уравнение реакции:
Из уравнения реакции видно, что увеличение
массы пластинки будет происходить за счет
выделения серебра на медной пластинке и перехода
в раствор меди (для 1 моль меди
m = 216 – 64 = 152 г).
При увеличении массы пластинки на 152 г серебра
выделится 216 г, при увеличении массы пластинки на
6,08 г серебра выделится х г.
Отсюда х = 8,64 г.
Ответ. m(Ag) = 8,64 г.
3. Записываем уравнения реакций:
Из уравнения реакции (1) видно, что при выделении
64 г меди на кадмиевой пластинке 112 г кадмия
перейдет в раствор и масса пластинки уменьшится
на 48 г.
Если прореагирует 188 г Сu(NO3)2 – масса
пластинки уменьшится на 48 г, если прореагирует 9,4
г Сu(NO3)2 – масса пластинки уменьшится
на х г.
Отсюда х = 2,4 г.
Из уравнения реакции (2) видно, что при выделении
на кадмиевой пластинке 201 г ртути 112 г кадмия
перейдет в раствор и масса пластинки увеличится
на 89 г.
Если вступит в реакцию 325 г Hg(NO3)2 –
масса пластинки увеличится на 89 г, если вступит в
реакцию 9,75 г Hg(NO3)2 – масса пластинки
увеличится на y г.
Отсюда y = 2,67 г.
Таким образом, масса пластинки увеличится на
0,27 г:
(2,67 – 2,4),
что составляет 0,54%.
Ответ. Масса пластинки увеличилась
на 0,54%.
Почему нельзя было определять изменение
массы сразу по двум реакциям? (Потому, что были
взяты не одинаковые, а разные количества солей.)
4. Определим число молей нитратов меди и
ртути в растворе:
количество вещества Сu(NO3)2 равно 0,1
моль,
количество вещества Hg(NO3)2 равно 0,1
моль.
Если в реакцию вступило бы по 1 моль солей, то
изменение массы составило бы:
(64 – 112) + (201 – 112) = 41 г
(см. решение задачи 3).
Если прореагирует по 1 моль солей – изменение
массы пластинки составит 41 г, если прореагирует
по 0,1 моль солей – изменение массы пластинки
составит х г.
Отсюда х = 4,1 г.
Ответ. Масса пластинки увеличилась
на 0,82%.
5. Реакция вытеснения кадмия цинком
проходит по уравнению:
При осторожном выпаривании происходит
образование кристаллогидратов.
Определим число молей кристаллогидрата нитрата
кадмия.
Поскольку M(Сd(NO3)2•4H2O) = 308
г/моль, то число молей кристаллогидрата нитрата
кадмия равно 0,05 моль.
Число молей Сd(NO3)2•4H2O равно
числу молей Сd(NO3)2.
Из уравнения реакции следует:
если в реакцию вступит 1 моль Сd(NO3)2 –
изменение массы пластинки составит 47 г, если в
реакцию вступит х моль Сd(NO3)2 –
изменение массы пластинки составит 0,94 г.
Отсюда х = 0,02 моль.
В результате реакции образовалось 0,02 моль
нитрата цинка и осталось (0,05 – 0,02) = 0,03 моль
нитрата кадмия, т.е. 0,02•297 = 5,94 г кристаллогидрата
нитрата цинка и 0,03•308 = 9,24 г кристаллогидрата
нитрата кадмия.
Ответ.
9,24 г Сd(NO3)2•4H2O,
5,94 г Zn(NO3)2•6H2O.
6. Записываем уравнение реакции:
Если в реакцию вступит 208 г CdSO4 –
изменение массы пластинки составит 47 г, если в
реакцию вступит 8,32 г CdSO4 – изменение массы
пластинки составит х г.
Отсюда х = 1,88 г.
По условию задачи этому изменению соответствует
2,35%.
Ответ. Масса цинковой пластинки
равна 80 г.
7. Анализ условия задачи показывает, что
атомная масса неизвестного металла больше, чем
атомная масса меди, но меньше, чем атомная масса
ртути. Пусть атомная масса металла х.
Записываем уравнения реакций:
Масса пластинки по реакции (1) равна:
(х – 64)•100(%)/3,6(%) г.
Масса пластинки по реакции (2) равна:
(201 – х)•100(%)/6,675(%) г.
Согласно условию задачи:
(х – 64)•100(%)/3,6(%) = (201 – х)•100(%)/6,675(%).
Решая уравнение, получим х = 112, т.е. металл –
кадмий.
Тогда
Э(Cd) = Ar/n,
где Э – эквивалент элемента, Аr –
относительная атомная масса, n – валентность
металла. Отсюда Э(Cd) = 112/2 = 56.
Ответ. Металл – кадмий, Э(Cd) = 56.
8. Первый способ. Записываем уравнение
реакции:
2NaI + Cl2 = 2NaCl + I2.
При прокаливании йод возгоняется, сухой
остаток будет состоять из хлорида натрия. Пусть в
смеси содержится х моль хлорида натрия и y
моль йодида натрия, молярная масса хлорида равна
58,44 г/моль, а йодида – 149,89 г/моль.
В соответствии с уравнением реакции y моль
йодида натрия при взаимодействии с хлором
образуют y моль хлорида натрия. Тогда масса
хлорида натрия после прокаливания составит:
58,44х + 58,44y = 58,44 г.
В то же время масса солей равна:
58,44х + 149,89y = 104,17 г.
Решаем систему уравнений:
Получаем х = 0,5, y = 0,5.
Следовательно, в смеси было 0,5 моль NаСl и 0,5 моль
NaI. Отсюда находим массовые доли:
(NaCl) =
28,1%, (NaI) = 71,9%.
Второй способ. Записываем уравнение
реакции:
После прокаливания останется только хлорид
натрия. Произошедшее уменьшение массы
обусловлено замещением в йодиде натрия атомов
йода на более легкие атомы хлора. Изменение массы
равно:
104,17 – 58,44 = 45,73 г.
Если в реакцию вступит 299,87 г NaI – изменение
массы составит 182,9 г, если в реакцию вступит х
г NaI – изменение массы составит 45,73 г.
Отсюда х = 74,94 г.
Тогда масса NаСl равна:
104,17 – 74,94 = 29,23 г.
Cледовательно, массовая доля хлорида натрия в
смеси равна 28,1%, а массовая доля йодида натрия –
71,9%.
Ответ. (NaCl) = 28,1%,
(NaI) = 71,9%.
9. Записываем уравнение реакции:
Уменьшение массы по уравнению реакции:
238 – 149 = 89 г.
Уменьшение массы по условию задачи:
1,6 – 1,155 = 0,445 г.
Если масса уменьшилась на 89 г – хлора вступило
в реакцию 71 г, если масса уменьшилась на 0,445 г –
хлора вступило в реакцию х г.
Отсюда х = 0,355 г.
Ответ. Содержание хлора в образце
брома-сырца 0,355 г, или 7,1%.
10. Записываем уравнение реакции:
Согласно уравнению реакции уменьшение массы
образца происходит за счет выделения кислорода.
Если в реакцию вступит 316 г перманганата калия, то
масса уменьшится на 32 г. По условию задачи она
уменьшилась на (40 – 36,8) = 3,2 г.
Составляем пропорцию:
316 г КМnО4 – 32 г O2,
х г КМnО4 – 3,2 г O2.
Отсюда х = 31,6 г.
Масса примесей равна:
40 – 31,6 = 8,4 г, или 21%.
Ответ. Содержание примесей – 21%.
11. Записываем уравнение реакции:
Если 252 г дихромата вступит в реакцию – масса
уменьшится на 100 г, если х г дихромата вступит
в реакцию – масса уменьшится на 10 г.
Отсюда х = 25,2 г.
Ответ. Содержание дихромата аммония
– 78,75%.
12. Записываем уравнение реакции:
СаСО3 = СаО + СО2.
Если разложилось 100 г карбоната кальция –
выделилось 44 г СО2, если разложилось х г
карбоната кальция – выделилось 8,8 г СО2.
Отсюда х = 20 г.
Ответ. Степень разложения карбоната
кальция – 80%.
13. Задача легко решается методом
эквивалентов. Можно решить эту задачу также
методом «уменьшения-увеличения массы».
Масса кислорода, вступившего в реакцию, равна:
10,2 – 5,4 = 4,8 г.
Согласно уравнению реакции:
х = 27 г. Следовательно, это алюминий.
Ответ. Металл – алюминий.
14. Записываем уравнение реакции:
Масса образовавшегося оксида меди равна:
2,42 – 1,62 = 0,8 г.
Согласно уравнению реакции х = 3.
Следовательно, кристаллогидрат нитрата меди –
Cu(NO3)2•3H2O.
Ответ. Формула кристаллогидрата –
Cu(NO3)2•3H2O.
15. Записываем уравнения реакций:
По уравнению (1):
если добавить 100 г CaCO3 – увеличение массы в
сосуде составит 56 г, если добавить 1 г CaCO3 –
увеличение массы в сосуде составит х г.
Отсюда х = 0,56 г.
По уравнению (2):
увеличение массы на 153 г – добавлено 197 г BaCO3,
увеличение массы на 0,56 г – добавлено
y г BaCO3.
Отсюда y = 0,72 г.
Ответ. Нужно прибавить 0,72 г BaCO3.
16. Записываем уравнение реакции:
Изменение объема по условию задачи:
150 – 100 = 50 мл.
Если разложится 2 мл NH3 – изменение объема
составит 2 мл, если разложится х мл NH3 –
изменение объема составит 50 мл.
Отсюда х = 50 мл.
Массовая доля разложившегося аммиака – (разл. NH3) = 0,5; в
данном случае массовая доля равна объемной.
Ответ. (разл. NH3) = 0,5.
17. Определяем массу сульфата меди:
m = 200•1,02•0,06 = 12,24 г.
Записываем уравнение реакции электролиза
раствора медного купороса:
Изменение массы раствора может быть
обусловлено как выделением меди и кислорода, так
и электролизом воды.
Если прореагирует 320 г CuSO4 – уменьшение
массы раствора составит (128 + 32) = 160 г, если
прореагирует 12,24 г CuSO4 – уменьшение массы
раствора составит х г.
Отсюда х = 6,12 г.
Согласно условию задачи прореагировал не весь
сульфат меди, электролиза воды не было.
Определим массы прореагировавшего сульфата меди
и образовавшейся серной кислоты:
Осталось (12,24 – 10) = 2,24 г CuSO4 и образовалось
6,125 г H2SO4.
Масса конечного раствора равна:
200•1,02 – 5 = 199 г.
Массовая доля сульфата меди:
(CuSO4)
= 2,24/199 = 0,01.
Массовая доля серной кислоты:
(H2SO4)
= 6,125/199 = 0,03.
Ответ. (CuSO4) = 0,01,
(H2SO4) = 0,03.
18. Записываем уравнение реакции разложения
1 моль дихромата аммония:
(NH4)2Cr2O7 = Cr2O3
+ N2 + 4H2O + 503 кДж.
Уменьшение массы за счет выделения азота и
паров воды составляет:
28 + 4•18 = 100 г.
Если масса твердого остатка уменьшится на 100 г
– выделится 503 кДж, если масса твердого остатка
уменьшится на 25 г – выделится х кДж.
Отсюда х = 127,75 кДж.
Ответ. Выделится 127,75 кДж.
19. При сжигании смеси проходит реакция:
Если в реакцию вступит два объема СО, то
изменение объема составит один объем.
Составляем пропорцию:
2 мл СО – изменение объема на 1 мл,
х мл СО – изменение объема на 10 мл.
Отсюда х = 20 мл.
Следовательно, в 50 мл смеси было 20 мл СО и 30 мл СО2.
Ответ.
Объемная доля СО равна 0,4,
объемная доля СО2 – 0,6.
20. Записываем уравнения реакций:
| СН4 + 2О2 = СО2 + 2Н2О, |
(1) |
| 2СО + О2 = 2СО2, | (2) |
| С2Н4 + 3О2 = 2СО2 + 2Н2О. |
(3) |
Первый способ. Из уравнений (1) и (2)
видно, что при сжигании одного объема метана и
оксида углерода(II) образуется один объем
углекислого газа. Следовательно, если бы в смеси
были только метан и оксид углерода(II), то из 100 л
при сжигании образовалось бы 100 л СО2.
Увеличение объема СО2 позволяет определить
содержание этилена в смеси.
Пусть было х л С2Н4 и (100 – х) л
смеси СН4 и СО.
Из (100 – х) л смеси СН4 и СО образуется (100
– х) л СО2, а из х л С2Н4
образуется 2х л СО2.
Составляем уравнение:
(100 – х) + 2х = 120.
Решив его, получим х = 20 л.
Второй способ. Из уравнений (1) и (2) видно, что
при сжигании одного объема метана и оксида
углерода(II) образуется один объем углекислого
газа. Из уравнения (3) видно, что каждый объем
этилена в смеси дает увеличение объема СО2
на один объем. Поскольку увеличение составляет
20 л СО2, то и этилена было 20 л.
Ответ. 20 л С2Н4.
21. При пропускании воздуха через озонатор
происходит уменьшение объема смеси:
Если образуется 2 л озона – изменение объема на
1 л, если образуется х л озона – изменение
объема на 0,112 л.
Отсюда х = 0,224 л.
При пропускании воздуха, содержащего озон, через
раствор йодида калия происходит реакция:
Из уравнения реакции находим х = 2,54 г.
Ответ. m(I2) = 2,54 г.
22. Записываем уравнения реакций:
Уменьшение массы раствора происходит
за счет выделения водорода. Его выделилось 1 г,
или
0,5 моль.
Из уравнений (1) и (2) видно, что при выделении 1 моль
водорода в реакцию вступает 1 моль гидрида, т.е.
суммарно в смеси было 0,5 моль гидридов.
Пусть было х моль гидрида лития и у моль
гидрида натрия. Тогда масса растворенных веществ
составит:
m = (24x + 40y) г,
а масса раствора:
m = (193 – 1 + 8x + 24y) г.
Составляем систему уравнений:
Решив эту систему, получим:
х = 0,25 моль, y = 0,25 моль.
Cледовательно, масса гидрида лития равна 2 г, а
масса гидрида натрия – 6 г.
Ответ. m(LiH) = 2 г, m(NaH) = 6 г.
23. При действии соляной кислоты на смесь
опилок в реакцию вступают только железные
опилки:
Увеличение массы раствора происходит за счет
разности между массой железа, перешедшей в
раствор, и массой выделившегося водорода.
Если в реакцию вступило 56 г железа – увеличение
массы на 54 г, если в реакцию вступило х г
железа – увеличение массы на 2,7 г.
Отсюда х = 2,8 г.
При обработке нерастворившейся части смеси
горячей концентрированной серной кислотой
происходит реакция:
Из уравнения реакции находим х = 3,18 г.
После обработки серной кислотой осталось
нерастворившимся золото массой 4,02 г.
Суммарная масса смеси равна:
2,8 + 3,18 + 4,02 = 10 г.
Следовательно массовая доля железа (Fe) = 28%,
массовая доля меди (Сu) = 31,8%,
массовая доля золота (Au) = 40,2%.
Ответ. (Fe) = 28%,
(Сu)
= 31,8%, (Au) = 40,2%.
24. Поскольку к смеси прибавили вдвое
больший объем водорода, чем объем смеси, то из
этого следует, что из ацетилена образовался этан,
т.е. происходила реакция:
Если в реакцию вступит 1 л ацетилена –
изменение объема на 2 л, если в реакцию вступит х
л ацетилена – изменение объема на 4 л.
Отсюда х = 2 л.
Следовательно, объемная доля ацетилена в
исходной смеси равна:
об(С2Н2)
= 2/4 = 0,5, или 50%.
Ответ. об(С2Н2) = 50%.
25. Пусть был 1 моль меди (64 г). Если бы она
прореагировала полностью, то масса увеличилась
бы на 16 г, т.е. на 16/64 = 1/4.
Если в реакцию вступит 64 г меди – увеличение
массы на 1/4, если в реакцию вступит х г меди –
увеличение массы на 1/8.
Отсюда х = 32 г меди, или 0,5 моль.
Следовательно, образовалось 0,5 моль CuO.
Массовая доля Сu в смеси равна 0,44, или 44%, массовая
доля CuO равна 0,56, или 56%.
Ответ. 44% Cu и 56% CuO.
26. Записываем уравнения реакций:
Газ, полученный после пропускания смеси над
нагретым никелевым катализатором, не реагирует с
водным раствором перманганата калия. Из этого
следует, что этилен прореагировал с водородом
полностью. Следовательно, в конечной смеси
содержалось 0,112 л этана и (0,672 – 0,112) = 0,560 л
водорода.
Кроме этого в реакции гидрирования было
израсходовано 0,112 л водорода, т.е. всего водорода
выделилось (0,560 + 0,112) = 0,672 л, или 0,03 моль.
Пусть в смеси было х моль муравьиной кислоты
и у моль уксусной кислоты. Составляем систему
уравнений:
Решив систему, найдем:
х = 0,02 моль, y = 0,04 моль.
Тогда массы кислот следующие:
m(HCOOH) = 46•0,02 = 0,92 г,
m(СH3COOH) = 60•0,04 = 2,40 г.
Масса раствора равна:
21,68 + 3,32 = 25,00 г.
Массовые доли:
муравьиной кислоты (HCOOH) = 3,7%,
уксусной кислоты (СH3COOH)
= 9,6%.
Ответ.
(HCOOH) = 3,7%,
(СH3COOH) = 9,6%.
27. При постепенном нагревании до 700 °С
возможны следующие процессы:
(NH4)2SO4 = NH3 + NH4HSO4,
NH4HSO4 + Na2CO3 = Na2SO4
+ NH3 + CO2 + H2O,
(NH4)2SO4 = 2NH3 + H2O + SO3,
2SO3 = 2SO2 + O2.
Потеря массы зависит от соотношения
компонентов смеси.
Потеря массы в расчете на = 1 моль исходных солей в этом случае
составляет 0,403, или 40,3%,
т.е. больше 30%.
• Если в смеси количество сульфата аммония
больше количества карбоната натрия, то за счет
полного разложения избытка сульфата аммония
потеря массы будет больше, чем 40,3%.
• Если количество карбоната натрия больше
количества сульфата аммония, то в смеси будет
присутствовать неразложившийся карбонат натрия,
и в этом случае потеря массы будет меньше, чем 40,3%.
Данный случай соответствует условию задачи.
Пусть масса исходной смеси равна 100 г. Исходя из
уравнения реакции (1), на каждые 132 г (NH4)2SO4
потеря массы составит 96 г. Из условия задачи
потеря массы составила 30 г.
132 г (NH4)2SO4 – потеря массы 96 г,
х г (NH4)2SO4 – потеря массы 30 г.
Отсюда х = 41,2 г (41,2%) сульфата аммония.
Следовательно, масса карбоната натрия равна 58,8 г
(58,8%).
Определим количества веществ сульфата аммония и
карбоната натрия:
(NH4)2SO4
= 0,312 моль,
(Na2CO3) =
0,555 моль.
(NH4)2SO4 + Na2CO3 = Na2SO4
+ 2NH3
+ CO2
+ H2O.
| По уравнению реакции |
(NH4)2SO4 1 моль |
Na2CO3 1 моль |
Na2SO4 1 моль |
| Было | 0,312 | 0,555 | – |
| Участвовало в реакции | 0,312 | 0,312 | 0,312 |
| Осталось | – | 0,243 | 0,312 |
2) При обработке полученного раствора
избытком раствора хлорида бария выпадают осадки:
Общая масса осадка:
0,243•197 + 0,312•233 = 120,6 г.
Массовая доля карбоната бария равна 39,7%, а
массовая доля сульфата бария – 60,3%.
Ответ. Состав исходной смеси:
41,2% (NH4)2SO4,
58,8% Na2CO3;
состав осадка:
39,7% BaCO3,
60,3% BaSO4.
А.П.СУГАТОВ,
учитель химии
средней школы № 26
(г. Керчь);
В.Ф.СУГАТОВА,
учитель химии
средней школы № 2
(г. Окуловка, Новгородская обл.)
В физика, то уменьшенная масса “эффективный” инертная масса появляясь в проблема двух тел из Ньютоновская механика. Это величина, которая позволяет решить проблему двух тел, как если бы она была проблема одного тела. Обратите внимание, однако, что масса, определяющая сила гравитации является нет уменьшенный. В расчете одна масса мочь заменяется уменьшенной массой, если это компенсируется заменой другой массы суммой обеих масс. Приведенная масса часто обозначается как 

Уравнение
Учитывая два тела, одно с массой м1 а другой с массой м2, эквивалентная задача одного тела, в которой положение одного тела относительно другого неизвестно, является задачей одного тела массы[1][2]
где сила, действующая на эту массу, определяется силой между двумя телами.
Характеристики
Приведенная масса всегда меньше или равна массе каждого тела:
и обладает взаимно-аддитивным свойством:
что при перестановке эквивалентно половине гармоническое среднее.
В частном случае, когда 
Если 

Вывод
Уравнение можно вывести следующим образом.
Ньютоновская механика
С помощью Второй закон Ньютона, сила, прилагаемая телом (частица 2) к другому телу (частица 1), равна:
Сила, действующая на частицу 2, равна:
Согласно с Третий закон Ньютона, сила, которую частица 2 оказывает на частицу 1, равна силе, действующей на частицу 2, и противоположна ей:
Следовательно:
Относительное ускорение аrel между двумя телами определяется выражением:
Обратите внимание, что (поскольку производная – линейный оператор), относительное ускорение 

Это упрощает описание системы до одной силы (поскольку 



Лагранжева механика
С другой стороны, лагранжевое описание проблемы двух тел дает Лагранжиан из
где 


и пусть центр масс совпадает с нашим началом в этой системе отсчета, т.е.
,
тогда
Тогда замена выше дает новый лагранжиан
где
приведенная масса. Таким образом, мы свели проблему двух тел к проблеме одного тела.
Приложения
Приведенная масса может использоваться во множестве задач двух тел, где применима классическая механика.
Момент инерции двух точечных масс на линии
Две точечные массы, вращающиеся вокруг центра масс.
В системе с двумя точечными массами 



где 

Это справедливо для вращения вокруг центра масс. момент инерции вокруг этой оси можно упростить до

Столкновения частиц
При столкновении с коэффициент реституции е, изменение кинетической энергии можно записать как
,
где vrel относительная скорость тел перед столкновение.
Для типичных приложений в ядерной физике, где масса одной частицы намного больше, чем масса другой, приведенная масса может быть аппроксимирована как меньшая масса системы. Предел формулы приведенной массы, когда одна масса стремится к бесконечности, – это меньшая масса, поэтому это приближение используется для облегчения вычислений, особенно когда точная масса большей частицы неизвестна.
Движение двух массивных тел под действием их гравитационного притяжения
В случае гравитационной потенциальной энергии
мы обнаруживаем, что положение первого тела по отношению ко второму определяется тем же дифференциальным уравнением, что и положение тела с приведенной массой, вращающегося вокруг тела с массой, равной сумме двух масс, потому что
Нерелятивистская квантовая механика
Рассмотрим электрон (масса ме) и протон (масса мп) в атом водорода.[3] Они вращаются вокруг общего центра масс – проблема двух тел. Для анализа движения электрона, задачи одного тела, приведенная масса заменяет массу электрона.
и масса протона становится суммой двух масс
Эта идея используется для настройки Уравнение Шредингера для атома водорода.
Другое использование
«Сниженная масса» может также относиться в более общем смысле к алгебраический срок формы[нужна цитата ]
что упрощает уравнение вида
Приведенная масса обычно используется как отношение между двумя элементами системы, включенными параллельно, такими как резисторы; будь то в электрической, тепловой, гидравлической или механической областях. Аналогичное выражение проявляется в поперечных колебаниях балок для модулей упругости.[4] Это соотношение определяется физическими свойствами элементов, а также уравнение неразрывности связывая их.
Смотрите также
- Рамка центра импульса
- Сохранение импульса
- Определение уравнения (физика)
- Гармонический осциллятор
- Щебетать масса, релятивистский эквивалент, используемый в постньютоновское расширение
Рекомендации
- ^ Энциклопедия физики (2-е издание), R.G. Лернер, Г.Л. Тригг, издательство VHC, 1991, (Verlagsgesellschaft) 3-527-26954-1, (VHC Inc.) 0-89573-752-3
- ^ Динамика и теория относительности, Дж. Р. Форшоу, А. Г. Смит, Wiley, 2009, ISBN 978-0-470-01460-8
- ^ Молекулярная квантовая механика, части I и II: Введение в квантовую химию (том 1), P.W. Аткинс, Oxford University Press, 1977, ISBN 0-19-855129-0
- ^ Экспериментальное исследование предсказаний теории пучка Тимошенко, А. Диас-де-Анда, Дж. Флорес, Л. Гутиеррес, Рамендес-Санчес, Г. Монсиваис и А. Моралес, Журнал звука и вибрации, том 331, выпуск 26, 17 декабря 2012, страницы 5732-5744 https://doi.org/10.1016/j.jsv.2012.07.041
внешняя ссылка
- Сниженная масса по гиперфизике
Содержание
- Измерение уменьшения массы Солнца в результате излучения
- Как Солнце теряет массу?
- Как измерить уменьшение массы Солнца?
- Какое уменьшение массы Солнца можно ожидать?
- Окончательный итог
- Найти насколько уменьшится масса солнца за год вследствие излучения
- Что такое излучение и как оно влияет на массу солнца?
- Как рассчитать потерю массы солнца вследствие излучения?
- Как это может повлиять на жизнь на Земле?
- Вывод
- Найти насколько уменьшится масса солнца за год вследствие излучения
- Что такое солнечная масса?
- Как излучение влияет на массу солнца?
- Какова скорость потери массы?
- Как найти уменьшение массы солнца за год?
- Как это влияет на солнечную систему?
- Вывод
Измерение уменьшения массы Солнца в результате излучения
Солнце — наш ближайший звездный сосед и источник жизни для всей Земли. Однако оно не вечно и со временем подвергается изменениям. Одним из таких изменений является уменьшение массы Солнца вследствие излучения. В этой статье мы рассмотрим, насколько уменьшится масса Солнца за год в результате излучения.
Как Солнце теряет массу?
Излучение — это процесс, при котором Солнце излучает энергию в виде света и тепла. Эта энергия создается в результате ядерных реакций, происходящих в ядре Солнца. В ходе этих реакций водородные ядра объединяются, образуя ядро гелия, и при этом выделяется огромное количество энергии.
Однако в результате этих ядерных реакций Солнце отдает свою массу: часть массы превращается в энергию, которая испускается в космос. Поэтому, хоть Солнце является наиболее массивным объектом в нашей солнечной системе, оно все еще теряет свою массу со временем.
Как измерить уменьшение массы Солнца?
Для измерения уменьшения массы Солнца можно использовать наблюдения, сделанные в течение нескольких лет. Большинство современных спутников используются для измерения положения, скорости и массы Солнца. Некоторые из них могут измерять истечение солнечной пыльцы и ветров, которые могут влиять на массу Солнца.
Для измерения уменьшения массы Солнца наблюдения должны вестись в течение длительного времени с большой точностью. Это может включать в себя использование специальных технологий, таких как лазерно-интерферометрические методы, для измерения расстояния между Землей и Солнцем.
Какое уменьшение массы Солнца можно ожидать?
По оценкам ученых, когда Солнце уменьшает свою массу, оно теряет примерно 4 миллионных долей своей массы в год. Это может показаться небольшой цифрой, но если учесть, что Солнце имеет массу примерно в 333 тысячи раз больше, чем Земля, это довольно впечатляющее число.
Таким образом, за 1 год Солнце может потерять примерно 1,35 x 10^20 килограммов массы. Это означает, что за 1 миллиард лет Солнце может потерять примерно 0,04% своей массы.
Окончательный итог
Измерение уменьшения массы Солнца является важной задачей для понимания того, как Солнце влияет на нашу солнечную систему и нашу планету. Измерения показывают, что Солнце потеряет некоторую массу в результате излучения, но это происходит очень медленно и в течение многих лет.
- Солнце теряет массу в результате ядерных реакций, происходящих в его ядре.
- Наблюдения и измерения позволяют установить, что Солнце потеряет примерно 4 миллионных долей своей массы в год.
- За 1 год Солнце может потерять примерно 1,35 x 10^20 килограммов массы, что составляет примерно 0,00004% ее массы.
Изучение процессов, происходящих в Солнце и их влияние на окружающие объекты, является важным направлением в научных исследованиях и позволяет углублять наши знания о том, как работает наша солнечная система и какую роль играет каждый ее элемент в создании нашего мира.
Найти насколько уменьшится масса солнца за год вследствие излучения
Солнце – это основной источник энергии в нашей солнечной системе, и наша жизнь зависит от его света и тепла. Но как долго солнце будет держать нас в жизни? Каждый год наша звезда теряет массу в результате излучения, но насколько это существенно и как это может повлиять на жизнь на Земле?
Что такое излучение и как оно влияет на массу солнца?
Излучение – это процесс, в результате которого солнце излучает энергию внутренних ядерных реакций. Каждый год солнце излучает примерно 3,828 × 10^26 Вт энергии во всех направлениях. Часть этой энергии уходит от Земли, но большая часть поглощается атмосферой.
Из-за излучения солнце постепенно теряет свою массу, и это происходит из-за известной формулы, известной как уравнение Эйнштейна (Е = mc²). Согласно этой формуле, масса и энергия взаимозависимы, и любое излучение солнца, как мало оно ни было, приводит к потере массы.
Теперь, чтобы рассчитать, насколько уменьшается масса солнца за год, мы должны знать, какую энергию звезда излучает. Следующий шаг – расчет массы, потерянной в результате излучения.
Как рассчитать потерю массы солнца вследствие излучения?
Чтобы рассчитать, насколько уменьшается масса солнца за год, мы должны знать, какую энергию звезда излучает. Согласно астрономической константе, звезда излучает в год примерно 3,828 × 10^26 Вт. Но сколько это массы?
Считается, что масса солнца равна примерно 1,989 × 10^30 кг. Используя формулу Эйнштейна, мы можем рассчитать, сколько кг потеряет солнце в результате излучения своей энергии в течение года.
Чтобы рассчитать потерю массы солнца за год, нам нужно знать, сколько энергии он излучает, и использовать формулу Эйнштейна, чтобы рассчитать, сколько массы это составляет.
С учетом этих данных мы можем рассчитать, что солнце теряет примерно 4,3 миллиона тонн массы в сутки (или примерно 1,6 миллиарда тонн массы в год).
Как это может повлиять на жизнь на Земле?
Уменьшение массы солнца за год может не показаться ощутимым, но эти потери на самом деле могут оказать довольно большое влияние на жизнь на Земле. Уменьшение массы солнца может привести к нарастанию некоторых процессов внутри звезды, таких как излучение и конвекция.
Это, в свою очередь, может спровоцировать старение Солнца и, возможно, послужить причиной глобальных изменений, связанных с климатом и внешней средой в течение многих лет. Потеря массы солнца также может привести к изменению светимости, температуры и других свойств звезды, что может повлиять на другие планеты в нашей солнечной системе.
Вывод
Хотя потеря массы солнца за год может показаться незначительной, эти потери могут оказать довольно большое влияние на жизнь на Земле. Повышенная излучательная активность может изменять климат, а уменьшение массы может привести к изменению светимости и температуры, повреждать экосистемы и изменять свойства звезды.
Насколько уменьшится масса Солнца в будущем – это тема многих исследований, и она продолжит занимать важное место в нашем понимании нашей солнечной системы и ее будущего.
Найти насколько уменьшится масса солнца за год вследствие излучения
Солнце является наиболее значимым объектом в нашей солнечной системе. Оно определяет жизненный цикл планет, вращающихся вокруг него, и играет важную роль в судьбе всей галактики. Одним из ключевых параметров солнечной системы является масса солнца. Она составляет около 99,86% общей массы нашей солнечной системы.
Что такое солнечная масса?
Солнечная масса является массой самого солнца. Она представляет собой массу всех атомов, находящихся в солнечной короне и являющихся источником света и тепла для земли и других планет солнечной системы. Солнечная масса измеряется в единицах солнечной массы (M☉), которая представляет собой массу, эквивалентную массе солнца.
Как излучение влияет на массу солнца?
Солнце излучает огромное количество энергии в виде света и тепла. Это излучение является результатом горения водорода и гелия в ядре солнца. Каждый год солнце теряет часть своей массы в результате этого излучения. Как правило, этот процесс кажется незначительным, но на самом деле он может привести к значительным изменениям в массе солнца.
Какова скорость потери массы?
Согласно научным исследованиям, в настоящее время солнце теряет примерно 4 миллиарда килограммов массы в секунду. И это может показаться незначительным, учитывая, что солнечная масса составляет более 1,98×10²⁹ килограммов (эквивалентно 333 000 M⊕, где M⊕ — масса земли). Однако, если учесть, что солнце уже существует более 4 миллиардов лет, то потери массы получаются довольно значительные.
Как найти уменьшение массы солнца за год?
Чтобы найти уменьшение массы солнца за год, мы можем использовать следующую формулу:
Масса, потерянная солнцем за год = 4×10⁹ кг/с × 31 536 000 с = 1,26×10¹⁷ кг/год
Таким образом, каждый год солнце теряет примерно 1,26×10¹⁷ килограммов массы.
Как это влияет на солнечную систему?
Солнечная масса играет важную роль в стабильности солнечной системы. Со временем потери массы могут привести к изменениям в гравитационных силах, которые удерживают планеты в их орбитах. Изменения массы могут привести к изменениям в этих силах, что может привести к катастрофическим последствиям для солнечной системы.
Вывод
Таким образом, описанный процесс уменьшения массы солнца вследствие излучения не является быстрым, но оказывает значительное влияние на всю солнечную систему. Наблюдение за этим процессом позволяет ученым лучше понять структуру и эволюцию солнечной системы и прогнозировать ее будущее.
- солнце
- солнечная масса
- излучение
- потеря массы
- гравитационные силы
- солнечная система
Удивительный вопрос, не правда ли? С виду кажется совсем странным и даже глупым. Однако, это задача из одного сборника с сёрьезными задачами по физике. И сегодня мы с вами порассуждаем над решением такой задачи.
Задача
На сколько уменьшится масса m = 10 кг воды при замерзании?
Решение:
Еще со школы нам говорят, что масса инвариант, показатель инертности тела и, вроде бы, не должна меняться вообще… Однако, в дальнейшем, при изучении физики, мы сталкиваемся с некоторыми «странными» задачами, которые ломают наши стереотипы. Например, специальная теория относительности и преобразования Лоренца. Когда в первый раз их видишь, то кажется, что они очень далеки от классической школьной механики.
Итак, мы знаем, что масса по идее не должна меняться. Но давайте немного дадим волю фантазии. Ведь не зря автор задачи просит нас четко ответить на вопрос.
Первое приближение
Когда мы измеряем массу тела, то кладем это тело на весы. Весы (внезапно) измеряют вес. А вес — это сила, действующая на опору или на подвес. То есть весы измеряют силу, а потом как бы «делят» эту силу на ускорение свободного падения и градуировка идет уже в привычных для нас килограммах. Вес тела зависит не только от силы тяжести, он еще зависит от силы, выталкивающей тело из среды, от силы инерции, если тело находит в системе отсчета, движущейся с ускорением.
Пример: Если вы возьмете напольные весы и встанете на них в лифте, то когда лифт поедет вверх, вы «потолстеете» на пару килограмм. Потому что весы измерят ваш вес, который будет зависеть от ускорения. Но на самом деле ваша масса ведь не менялась, не так ли? Или менялась? 🙂 Подумайте над этим.
Итак, мы знаем, что плотность льда меньше плотности воды (лёд всплывает в воде). Плотность воды примерно 1000 кг/м³, а плотность льда около 900кг/м³. Значит одна и та же масса воды будет иметь разный объем, в зависимости от того агрегатного состояния, в котором она находится. При замерзании или кристаллизации воды её объем увеличится, а значит на неё станет действовать большая выталкивающая сила Архимеда со стороны воздуха, которая уменьшит вес воды (уже льда) на весах. Давайте попробуем оценить на сколько масса изменится на показателях весов. Возьмем плотность воздуха за 1.29 кг/м³.
При замерзании вода расширяется, превращаясь в лед. Поэтому, если вы нальете в твердую тару (стеклянную бутылку например) воду под горлышко, плотно закроете её и положите в морозильную камеру, то бутылка лопнет от внутреннего давления.
Получается, что если мы возьмем 10. 000 000 кг воды, заморозим их и аккуратно взвесим, то получим 9. 999 857 кг. Уменьшение массы на 143 мг. Очень маленькое значение, которое трудно будет точно измерить в домашних условиях. А вообще было бы интересно, действительно ли на весах (если бы у нас были такие точные весы) мы бы увидели значение, меньшее исходного на 143 миллиграмма.
Второе приближение
Если рассмотреть формулу Эйнштейна, которая показывает эквивалентность массы покоя и полной энергии тела: E = mc², то можно записать энергию до и после кристаллизации. Здесь при кристаллизации у нас уходит энергия, соответствующая теплоте кристаллизации воды Q = λm. Попробуем произвести оценку изменения массы в таком случае:
Здесь мы получаем вообще несущественное изменение массы. И если в пером приближении масса на самом деле не менялась, а менялись только показания весов, то во втором приближении (нашей оценке через квантовую физику) масса должна измениться реально. Но встает закономерный вопрос. Как можно измерить настолько малое приращение массы?
Получается, чтобы ощутить изменение массы, нужно взять очень большое количество воды. Например, если мы возьмем 10¹¹ кг воды, то изменение уменьшение массы при кристаллизации составит Δm ~ 4 кг. К слову, масса всей воды (гидросферы) на Земле примерно 1.46 ⋅ 10²¹ кг.
Только в мире не существует приборов, чтобы сделать такой эксперимент.
А еще в голове не укладывается один момент: как же масса может уменьшиться, если количество молекул никуда не меняется, сами молекулы тоже не изменяются. H₂O в воде и во льду одно и то же ведь (не считая появление кристаллической решетки). Немного информации по связям в разных агрегатных состояниях.
Представляете ли вы себе изменение массы при охлаждении и кристаллизации тел? Из теории получается, что масса не совсем является инвариантом, а является мерой энергии тела, зависит от энергии. А энергия в некоторых процессах меняется. Тогда меняется и масса. Если конечно же принять, что скорость света является инвариантов во всех ситуациях.
Понравилась статья? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в telegram
Автор:
Peter Berry
Дата создания:
18 Июль 2021
Дата обновления:
12 Май 2023
Содержание
- Снижение массы из-за разброса продуктов
- Увеличение массы за счет включения реагентов
- Замкнутые системные химические реакции: ни увеличение, ни уменьшение массы
Наблюдая за химической реакцией, мы иногда обнаруживаем, что масса веществ уменьшается; в других случаях масса увеличивается.
Снижение массы из-за разброса продуктов
Когда мы поджигаем порцию спирта, мы видим, что через некоторое время огонь гаснет и спирт уходит. Точно так же, когда мы зажигаем свечу, через некоторое время она почти полностью выгорает под действием огня, оставляя небольшое количество воска или парафина.
Оба случая аналогичны потере массы при горении бумаги. Уменьшение массы происходит из-за того, что почти все продукты этого сгорания газообразны и рассеиваются в атмосфере. Следовательно, если бы продукты сгорания бумаги не улетучились в воздух, если бы количество кислорода (окислителя), которое прореагировало, было измерено до горения вместе с листом бумаги, после сжигания шкала будет показывать ту же массу.
Таким образом, для горения бумаги имеем следующее уравнение:
бумага + кислород → зола + газообразные продукты
Увеличение массы за счет включения реагентов
Некоторые химические реакции, кажется, создают материю, например, ржавый железный стержень; у нас создается впечатление, что ржавчина – это новое вещество, которое образовалось на стержне.
Подобно обожженной стальной вате, он имеет большую массу при ржавлении, чем без ржавчины. Как это объяснить?
Сталь – это сплав железа с небольшим количеством углерода. В присутствии кислорода железо может окисляться и образовывать оксид железа. Учитывая, что и железо, и сталь реагируют с кислородом, мы имеем следующее химическое уравнение:
железо + кислород → оксид железа
В стальной вате перед сгоранием шкала не показывала массу кислорода, которая могла бы быть включена в нее, то есть увеличение массы, указанное шкалой, связано с включением массы кислорода в железо, образуя оксид железа. .
Это также относится к железным объектам, масса которых увеличивается с образованием ржавчины, которая представляет собой химическую реакцию между кислородом воздуха и железом: определенная масса кислорода включается в железо, вызывая его ржавчину.
Замкнутые системные химические реакции: ни увеличение, ни уменьшение массы
В любой химической реакции, проводимой в замкнутой системе, не происходит уменьшения или увеличения массы задействованных веществ.
Только в конце 18 – начале 19 века ученые начали изучать это явление. После нескольких исследований они обнаружили некоторые законы, управляющие химическими реакциями.
Давайте рассмотрим два химических закона, один из которых был разработан французским химиком Антуаном Лораном Лавуазье (1743–1794), а другой – французским химиком и фармацевтом Жозефом Луи Прустом (1754–1836).