Упругость – еще одна физическая величина, свойственная водяному пару. В статье подробно описано, что такое упругость водяного пара, зависимость данной величины от различных параметров.
Дополнительно приведена таблица упругости от температуры, формула и примеры расчета данного значения.
Содержание
- Что это за параметр, в чем измеряется?
- От чего зависит?
- Дефицит
- Таблица при различных температурах
- Какова максимальная?
- Как найти значение?
- Формула и правила расчета
- Несколько примеров
- Где используют знания в жизни?
- Заключение
Что это за параметр, в чем измеряется?
Упругость водяного пара является величиной парциального давления. Иными словами, упругостью является общее количество пара в атмосфере на определенную единицу ее объема. Данная величина связана с плотностью пара, а значит с влажностью воздуха.
Единицей измерения упругости пара являются миллибар (мбар), миллиметр ртутного столба (мм.рт.ст) или гектопаскаль (гПа).
Упругость сильно зависит от температуры пара, поэтому может обозначаться как упругость насыщения среды. В формулах параметр обозначается буквой «Е». Существует также понятие фактической упругости пара или газа, не достигшего насыщения. Обозначается параметр буквой «е».
От чего зависит?
Величина упругости водяного пара имеет несколько прямых зависимостей от различных факторов:
-
 Температура. Чем выше температура пара, тем выше его упругость.
Температура. Чем выше температура пара, тем выше его упругость.
С повышением температуры возможно увеличить скорость испарения или поддерживать ее на постоянном уровне, насыщая атмосферу паром и влагой.
-
Давление. Атмосферное давление позволяет поддерживать уровень упругости пропорционально скорости парообразования.
С повышением высоты, атмосферное давление снижается, воздух становиться разряженным, большая часть пара конденсируется. При этом значение упругости снижается.
- Среда. В замкнутой среде упругость остается пропорциональной температуре. При этом уровень насыщения достигается значительно быстрее при заданном объеме и температуре. На открытой местности упругость всегда ниже, так как пар распространяется на большую площадь.
- Насыщение. Уровень насыщения молекулами воды прямо влияет на упругость пара. Чем больше влаги, тем плотность и упругость выше.
Также на данный параметр влияют различные примеси в виде газов и твердых частиц, находящиеся в атмосфере.
Дефицит
Это значение разности между полным насыщением и фактическим. Так как упругость зависит от температуры, при недостаточном уровне насыщения, при заданной температуре, прослеживается дефицит упругости пара.
На это может влиять высокий уровень примесей, резкое снижение температуры, повышение скорости ветра.
Таблица при различных температурах
| °С | 0 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 |
| -40 | 0,189 | 0,187 | 0,185 | 0,183 | 0,181 | 0,18 | 0,177 | 0,176 | 0,174 | 0,172 |
| -30 | 0,509 | 0,504 | 0,499 | 0,495 | 0,489 | 0,485 | 0,48 | 0,476 | 0,472 | 0,467 |
| -20 | 1,254 | 1,243 | 1,232 | 1,222 | 1,211 | 1,1,2 | 1,19 | 1,18 | 1,17 | 1,16 |
| -15 | 1,991 | 1,896 | 1,88 | 1,865 | 1,849 | 1,834 | 1,819 | 1,804 | 1,789 | 1,774 |
| -10 | 2,862 | 2,84 | 2,817 | 2,791 | 2,773 | 2,751 | 2,729 | 2,711 | 2,686 | 2,665 |
| -5 | 4,214 | 4,182 | 4,151 | 4,12 | 4,088 | 4,057 | 4,027 | 3,996 | 3,966 | 3,936 |
| 0 | 6,107 | 6,063 | 6,019 | 5,975 | 5,932 | 5,889 | 5,846 | 5,803 | 5,761 | 5,719 |
| 0 | 6,107 | 6,152 | 6,196 | 6,241 | 6,287 | 6,332 | 6,378 | 6,425 | 6,471 | 6,518 |
| 5 | 8,718 | 8,779 | 8,841 | 8,902 | 8,964 | 9,027 | 9,09 | 9,153 | 9,217 | 9,282 |
| 10 | 12,771 | 12,353 | 12,436 | 12,518 | 12,604 | 12,688 | 12,773 | 12,858 | 12,944 | 13,03 |
| 15 | 17,042 | 17,152 | 17,623 | 17,374 | 17,438 | 17,599 | 17,712 | 17,826 | 17,94 | 18,05 |
| 20 | 23,371 | 23,516 | 23,662 | 23,809 | 23,956 | 24,1 | 24,254 | 24,40 | 24,55 | 24,70 |
| 30 | 42,427 | 42,67 | 42,917 | 43,163 | 43,411 | 43,66 | 43,91 | 44,162 | 44,41 | 44,66 |
| 40 | 73,77 | 74,16 | 74,562 | 74,961 | 75,36 | 75,763 | 75,15 | 75,57 | 76,97 | 77,38 |
По таблице можно проследить ряд зависимостей упругости пара по температуре:
-
 При температурах от -40 до -5 градусов прослеживается слабый рост упругости (парциального давления).
При температурах от -40 до -5 градусов прослеживается слабый рост упругости (парциального давления).
Связано это с высокой степенью кристаллизации молекул воды при испарении.
-
Температура 0 градусов является переходным порогом при парообразовании. В первый момент прослеживается снижение при переходе от положительного к отрицательному температурному значению.
Повышение начинается при подводе тепла. Кристаллизация сменяется увлажнением среды.
- Рост парциального давления увеличивается с +5 градусов. Увеличивается упругость с повышением температуры. Влажность среды увеличивается, что сказывается на плотности и упругости пара.
Зависимость упругости от температуры прослеживается при отрицательных и положительных температурных значениях. Это учитывают метеорологи при вычислении уровня влажности атмосферы.
Какова максимальная?
Максимальным значением упругости является его состояние насыщения при актуальной температуре. Выше этого значения атмосфера не насыщается, так как разность влажности переходит в состояние конденсации.
Если значения упругости меньше температурного параметра, атмосфера считается не насыщенной. Проследить зависимость можно по таблице:
| Температура °С | Упругость пара гПа | Абсолютное давление г/м3 |
| -30 | 0,5 | 0,4 |
| -20 | 1,2 | 1 |
| -10 | 2,8 | 2,3 |
| -5 | 4,2 | 3,4 |
| 0 | 6,1 | 4,8 |
| +5 | 8,7 | 6,8 |
| +10 | 12,2 | 9,4 |
| +15 | 17 | 12,8 |
| +25 | 31,6 | 23 |
| +30 | 42,4 | 30,3 |
В таблице прослеживается убывание упругости и абсолютного давления при снижении температуры и рост этих значений при ее увеличении.
Как найти значение?
Рассмотрим формулу, правила расчета и несколько примеров расчета.
Формула и правила расчета
Величина упругости водяного пара является табличным значением. На основе этих данных делается расчет влажности воздуха. Для этого используется следующая формула:

Формула состоит из:
- «r» — относительная влажность;
- «e» — фактическая упругость пара;
- «E» — упругость насыщения для актуальной температуры;
- «100%» — полное насыщение.
Значение относительной влажности помогает определить состояние насыщения при заданной температуре и вычислить уровень дефицита упругости.
Несколько примеров
Задача:
- Температура воздуха 10 градусов.
- Значение упругости при этой температуре 12,2 гПа.
- Фактическая упругость 6 гПа.
- Относительная влажность неизвестна.
Решение:
- r= e/E*100%.
- r= 6/12,2*100%=49%
Ответ: относительная влажность воздуха, при температуре 10 градусов и фактической упругости пара 6 гПа, равняется 49% и находится в состоянии дефицита.
Задача:
- Температура воздуха -30 градусов.
- Значение упругости пара 0,5 гПа.
- Фактическая упругость 0,3 гПа.
- Влажность воздуха неизвестна.
Решение:
- r= e/E*100%о
- r= 0,3/0,5*100%=60%
Ответ: при температуре -30 градусов и фактической упругости пара 0,3 гПа, влажность воздуха составляет 60%.
Где используют знания в жизни?
 Упругость водяного пара — важный параметр, указывающий на процентное содержание влажности в атмосфере.
Упругость водяного пара — важный параметр, указывающий на процентное содержание влажности в атмосфере.
При помощи этих данных метеорологи вычисляют влажность воздуха, скорость парообразования и концентрацию пара в отдельных регионах и над естественными природными источниками.
Заключение
Упругость водяного пара позволяет контролировать парообразование на отдельных участках планеты. При вычислении очень важно использовать табличные значения упругости по температуре, что укажет на насыщение или дефицит влаги в атмосфере.
Чаще всего практическое использование сжиженных углеводородных газов происходит в двухфазной системе жидкость–пар (если есть свободная поверхность жидкости в замкнутом пространстве резервуара)..
При этом в общем случае происходит или конденсация пара, или испарение жидкости. В условиях равновесия нет ни конденсации, ни испарения. Давление, при котором жидкость находится в равновесном состоянии с паром, называется упругостью насыщенных паров.
Определенной температуре отвечает определенная упругость насыщенных паров, и наоборот, заданной упругости насыщенных паров отвечает определенная температура.
Если поддерживать постоянную температуру и сжимать пар, находящийся над жидкостью, то происходит его конденсация; наоборот, если увеличивать объем, занимаемый паром, то продолжается испарение жидкости.
Графическая зависимость упругости паров и температуры называется кривой испарения. Зависимости между упругостью чистых паров и температурой для углеводородов, входящих в составы сжиженных углеводородных газов, приведены на рис. 2.2. и в табл. 2.5.
Для идеальных систем жидкость-пар, у которых компоненты смеси образуют идеальный раствор в жидкой фазе, а пары компонентов подчиняются законам идеального газа, в состоянии равновесия справедливо уравнение, объединяющее законы Дальтона и Рауля:
yip = xipi или yi /xi = pi /p = ki
где ki — константа равновесия или распределения системы “жидкость пар”; pi — парциальное давление; xi — мольная концентрация компонента i в жидкой фазе; уi — то же, в паровой фазе.
Таблица 2.5. Упругость насыщенных паров, МПа, предельных парафиновых углеводородных газов (алканов). 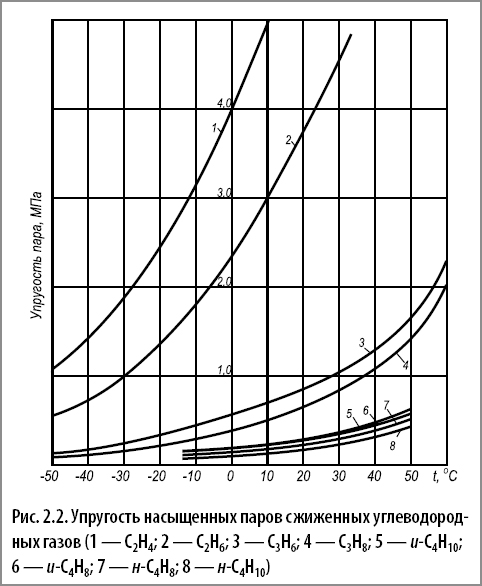
| Температура, °С | Этан | Пропан | Изобутан | н-Бутан | н-Пентан |
| -50 | 0,553 | 0,007 | – | – | – |
| -45 | 0,655 | 0,088 | – | – | – |
| -40 | 0,771 | 0,109 | – | – | – |
| -35 | 0,902 | 0,134 | – | – | – |
| -30 | 1,050 | 0,164 | – | – | – |
| -25 | 1,215 | 0,197 | – | – | – |
| -20 | 1,400 | 0,236 | – | – | – |
| -15 | 1,604 | 0,285 | 0,088 | 0,056 | – |
| -10 | 1,831 | 0,338 | 0,107 | 0,068 | – |
| -5 | 2,081 | 0,399 | 0,128 | 0,084 | – |
| 0 | 2,355 | 0,466 | 0,153 | 0,102 | 0,024 |
| 5 | 2,555 | 0,543 | 0,182 | 0,123 | 0,030 |
| 10 | 2,982 | 0,629 | 0,215 | 0,146 | 0,037 |
| 15 | 3,336 | 0,725 | 0,252 | 0,174 | 0,046 |
| 20 | 3,721 | 0,833 | 0,294 | 0,205 | 0,058 |
| 25 | 4,137 | 0,951 | 0,341 | 0,240 | 0,067 |
| 30 | 4,460 | 1,080 | 0,394 | 0,280 | 0,081 |
| 35 | 4,889 | 1,226 | 0,452 | 0,324 | 0,096 |
| 40 | – | 1,382 | 0,513 | 0,374 | 0,114 |
| 45 | – | 1,552 | 0,590 | 0,429 | 0,134 |
| 50 | – | 1,740 | 0,670 | 0,490 | 0,157 |
| 55 | – | 1,943 | 0,759 | 0,557 | 0,183 |
| 60 | – | 2,162 | 0,853 | 0,631 | 0,212 |
Упругость
насыщенных паров углеводородов
характеризует то давление, при котором
газ начинает конденсироваться и
переходить в жидкое состояние. У
индивидуальных углеводородов в чистом
виде упругость паров (Q) есть функция
только температуры: Q =ѓ (Т). Величина
упругости насыщенных паров углеводородов
повышается с ростом температуры, и она
тем выше, чем ниже плотность углеводорода.
Аналогично с ростом молекулярной массы
углеводорода, величина упругости
насыщенный паров углеводородов
уменьшается при равных температурах
(рис. 2.11).
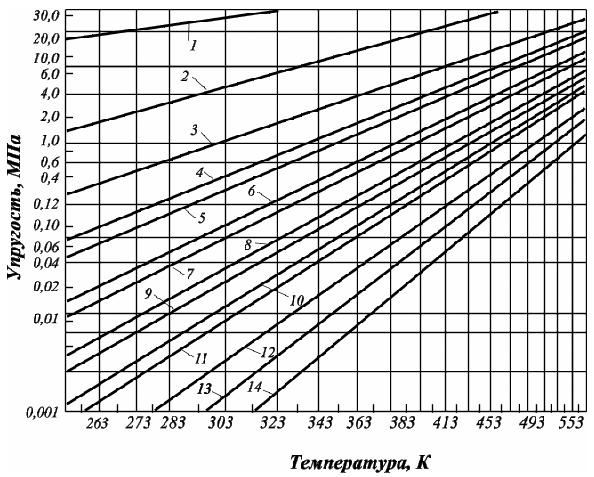
Рис. 2.11. Кривые
упругости насыщенных паров чистых
углеводородов:
1. –
метан;
2. –
этан;
3. –
пропан;
4. –
изобутан;
5. –
бутан;
6. –
изопентан;
7. –
пентан;
8. –
изогексан;
9. –
гексан;
10. –
изогептан; 11. –
гептан;
12. –
октан;
13. –
нонан;
14. –
декан
Зависимость
упругости пара от температуры: Q =ѓ (Т) –
нелинейная функция. Для ее линеаризации
шкала упругости пара принята
логарифмической, и это создает удобства
для пересчета величины упругости пара
при нужной температуре. Анализ зависимостей
представленных на рис. 2.11 свидетельствует,
что давление паров метана наибольшее.
При нормальных условиях его нельзя
превратить в жидкость (пунктирная
линия), так как его критическая температура
(Ткр.)
= –
82,4о С
(190,75 К).
На рис. 2.12, а
изображены зависимости объёма жидкого
и парообразного пропана. При сжатии от
точки М до точки А имеется перегретый
(ненасыщенный) пар, зависимость объёма
жидкости от давления при конкретной
температуре имеет гиперболическую
форму.
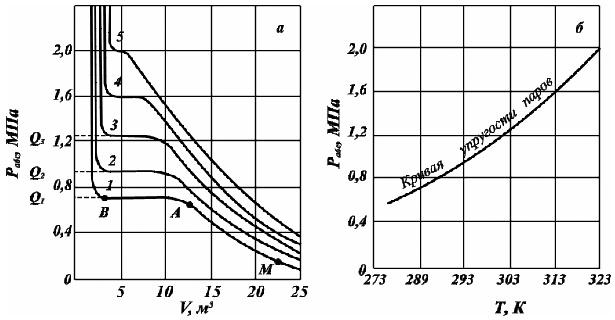
Рис.
2.10. Зависимости давления от объёма и
температуры (а) и кривая упругости
насыщенных паров (б) при температурах,
К: 1. –
283; 2. –
293; 3. –
303; 4. –
313; 5. –
323.
В точке А пар
становится насыщенным, а при дальнейшем
изменении объёма (участок АВ) он постепенно
переходит в жидкость при неизменном
давлении. В точке В заканчивается переход
пара в жидкость. При дальнейшем сжатии
пара будет резко повышаться давление
при почти неизменном объёме. Горизонтальный
участок АВ соответствует неизменности
давления в процессе конденсации паровой
фазы в жидкую фазу. Величина этого
давления и есть упругость насыщенного
пара газового компонента при данной
температуре. Чем ближе значение
температуры, при которой измеряется
упругость насыщенного пара газового
компонента к значению критической
температуре, тем короче горизонтальный
участок. На основе полученных данных
строят кривую упругости насыщенных
паров, представляющую зависимость
давления от от температуры испарения
данной жидкости (рис. 2. 12, б).
У смеси
углеводородов упругость паров является
функцией и температуры и общего давления
смеси: Q = ѓ (Т, Рсм.).
Величина её зависит от упругости паров
отдельных компонентов при данной
температуре и от их мольных концентраций.
Общее давление смеси влияет на упругость
паров каждого компонента и это влияние
учитывается по закону Рауля:
Р
= ∑
рi
и
![]() (2.39)
(2.39)
где Р –
общее давление;
рi
–
парциальное давление i-го компонента;
Qi
–
упругость паров i-го компонента;
Nxi
–
мольная доля i-го компонента в жидкости.
Упругость
паров смеси компонентов повышается с
увеличением общего давления. Это влияние
ничтожно при низких давлениях (≈
до 1 МПа), а при высоких давлениях упругость
паров резко увеличивается.
групповой и
вещественный составы нефти.
Основными
элементами
состава нефти
являются углерод (83,5-87%) и водород
(11,5-14 %). Кроме того, в нефти присутствуют:
сера в
количестве от 0,1 до 1-2 % (иногда ее
содержание может доходить до 5-7 %, во
многих нефтях серы практически нет);
азот в
количестве от 0,001 до 1 (иногда до 1,7 %);
кислород
(встречается
не в чистом виде, а в различных соединениях)
в количестве от 0,01 до 1 % и более, но не
превышает 3,6 %.
Из других элементов
в нефти присутствуют – железо, магний,
алюминий, медь, олово, натрий, кобальт,
хром, германий, ванадий, никель, ртуть,
золото и другие. Однако, содержание их
менее 1 %.
Фракционный
состав нефти
показывает содержание в ней различных
фракций, выкипающих в определенных
температурных интервалах, и отражает
содержание соединений в них.
Фракцией
называется доля нефти, выкипающая в
определенном интервале температур.
Нефти выкипают в очень широком интервале
температур, в основном, от 28 до 520-540С.
Фракционный состав нефти определяется
стандартным методом (ГОСТ 2177–82)
по результатам лабораторных испытаний
при разделении соединений по температурам
кипения методом фракционирования
(разгонки) нефти, отгона или смеси
соединений на установках АВТ
(атмосферно-вакуумная трубчатка).
Началом
кипения
фракции считают температуру падения
первой капли сконденсированных паров.
Концом
кипения
фракции считают температуру, при которой
испарение фракции прекращается.
Различают
следующие основные фракции нефти:
28-180СС
–
широкая бензиновая фракция;
140-200С
–
уайт–спирит;
180-320С
–
широкая керосиновая фракция;
150-240С
–
осветительный керосин;
180-280С
–
реактивное топливо;
140-340С
–
дизельная топливо (летнее);
180-360С
–
дизельная топливо (зимнее);
350-500С
–
широкая масляная фракция;
380-540С
–
вакуумный газойль.
Под
групповым
составом нефти
(фракции) понимают количественное
соотношение в ней отдельных групп
углеводородов, гетероатомных соединений.
Нефть
представляет собой сложную смесь
органических соединений (более 1000),
преимущественно углеводородов,
их производных и гетероатомных
соединений.
Углеводороды
представляют
собой органические соединения углерода
и водорода. В нефти в основном содержатся
следующие классы углеводородов.
Парафиновые
углеводороды
(алканы) –
насыщенные (предельные) углеводороды
с общей формулой CnH2n+2.
Содержание их в нефти составляет 30-70 %.
Различают алканы нормального строения
(н-алканы-пентан и его гомологи),
изостроения (изоалканы-изопентан и др.)
и изопреноидного строения (изопрены –
пристан, фитан и др.). В нефти присутствуют
газообразные алканы от С1
до
С4
(в виде растворённого газа), жидкие
алканы С5
–
С16,
составляют основную массу жидких фракций
нефти и твёрдые алканы состава С17
–
С53
и более, которые входят в тяжёлые нефтяные
фракции и известны как парафины.
Нафтеновые
углеводороды
(циклоалканы) –
насыщенные алициклические углеводороды.
К ним относятся моноциклические с общей
формулой CnH2n,
бициклические –
CnH2n-2,
трициклические –
CnH2n-4,
тетрациклические
–
CnH2n-6.
Содержание нафтеновых углеводородов
в нефтях может колебаться от 25 до 75 %. Из
моноциклических углеводородов в нефти
присутствуют в основном пяти- и
шестичленные нафтены. Общее содержание
нафтеновых углеводородов в нефти растёт
по мере увеличения ее молекулярной
массы.
Ароматические
углеводороды (арены)
–
соединения, в молекулах которых
присутствуют циклические углеводороды
с р–сопряжёнными
системами. Содержание их в нефти
изменяется от 10 до 50 %. К ним относятся
представители моноциклических: бензол
и его гомологи (толуол, о-, м-, п-ксилол и
др.), бициклические: нафталин и его
гомологи, трициклические: фенантрен,
антрацен и их гомологи, тетрациклические:
пирен и его гомологи и другие.
Гибридные
углеводороды (церезины) – углеводороды
смешанного строения: парафино–нафтенового,
парафино–ароматического,
нафтено–ароматического.
В основном, это твёрдые алканы с примесью
длинноцепочечных углеводородов,
содержащих циклановое или ароматическое
ядро. Они являются основной составной
частью парафиновых отложений в процессах
добычи и подготовки нефтей.
В
зависимости от преимущественного
содержания в нефти одного или нескольких
классов углеводородов она может
называться парафиновой (парафинового
основания), парафино–нафтеновой,
нафтеновой, нафтено–ароматической,
ароматической
Гетероатомные
соединения –
углеводороды, в состав молекул которых
входят кислород, сера, азот, металлы или
неметаллы. К ним относятся:
-
кислородсодержащие
–
фенолы,
эфиры, нафтеновые кислоты, жирные
кислоты и др., содержание их в нефтях
колеблется от 0,1 до 1 %, иногда в
высокосмолистых нефтях содержание
кислорода может доходить до 2-3 %;
-
серосодержащие
–
меркаптаны, сульфиды, дисульфиды,
тиофены и др., содержание их в нефтях
изменяется от 0,1 до 1-7 %, кроме того, в
нефти может присутствовать сера в
свободном состоянии или в виде
сероводорода, как составляющая природного
газа;
-
азотсодержащие
–
амины, пиридин, хинолин, пирролы, их
производные и др., содержание их
изменяется от 0,001 до 0,4-1 %;
-
порфирины
–
это азотистые соединения, в основе
структуры которых расположены четыре
пиррольных кольца координационно-соединенные
с атомами ванадия, никеля и др., содержание
их в нефтях меньше 1 %;
-
смолы и
асфальтены
–
высокомолекулярные соединения,
содержащие два и более гетероатома,
содержание их в нефтях изменяется от
1 до 35 %.
Подавляющая
часть гетероатомных соединений содержится
в наиболее высокомолекулярных фракциях
нефти, выкипающих выше 300оС.
В нефтях Западной Сибири на их долю
приходится до 15 %.
В нефти содержатся
в малых количествах минеральные вещества,
вода и механические примеси.
Состав полностью
определяет физико-химические свойства
нефтей. Вследствие изменчивости
химического состава, физико-химические
свойства нефтей различных месторождений
и даже различных пластов одного
месторождения отличаются большим
разнообразием.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Упругость насыщенных паров
 Чаще всего практическое использование сжиженных углеводородных газов происходит в двухфазной системе «жидкость-пар» (если есть свободная поверхность жидкости в замкнутом пространстве резервуара). При этом в общем случае происходит или конденсация пара, или испарение жидкости. В условиях равновесия нет ни конденсации, ни испарения. Давление, при котором жидкость находится в равновесном состоянии с паром, называется упругостью насыщенных паров. Определенной температуре отвечает определенная упругость насыщенных паров, и наоборот, заданной упругости насыщенных паров отвечает определенная температура.
Чаще всего практическое использование сжиженных углеводородных газов происходит в двухфазной системе «жидкость-пар» (если есть свободная поверхность жидкости в замкнутом пространстве резервуара). При этом в общем случае происходит или конденсация пара, или испарение жидкости. В условиях равновесия нет ни конденсации, ни испарения. Давление, при котором жидкость находится в равновесном состоянии с паром, называется упругостью насыщенных паров. Определенной температуре отвечает определенная упругость насыщенных паров, и наоборот, заданной упругости насыщенных паров отвечает определенная температура.
Если поддерживать постоянную температуру и сжимать пар, находящийся над жидкостью, то происходит его конденсация; наоборот, если увеличивать объем, занимаемый паром, то продолжается испарение жидкости. Графическая зависимость упругости паров и температуры называется кривой испарения. Зависимости между упругостью чистых паров и температурой для углеводородов, входящих в составы сжиженных углеводородных газов, приведены на рис. 2.2. и в табл. 2.5.
|
Температура, °С |
Этан |
Пропан |
Изобутан |
н-Бутан |
н-Пентан |
|
-50 |
0.553 |
0,007 |
– |
– |
– |
|
-45 |
0.655 |
0,088 |
– |
– |
– |
|
-40 |
0.771 |
0,109 |
– |
– |
– |
|
-35 |
0.902 |
0,134 |
– |
– |
– |
|
-30 |
1.050 |
0,164 |
– |
– |
– |
|
-25 |
1.215 |
0,197 |
– |
– |
– |
|
-20 |
1.400 |
0,236 |
– |
– |
– |
|
-15 |
1.604 |
0,285 |
0,088 |
0.056 |
– |
|
-10 |
1,831 |
0,338 |
0,107 |
0,068 |
– |
|
-5 |
2.081 |
0,399 |
0,128 |
0,084 |
| – | |
|
0 |
2,355 |
0,466 |
0,153 |
0.102 |
0,024 |
|
5 |
2.555 |
0,543 |
0,182 |
0,123 |
0,030 |
|
10 |
2.982 |
0,629 |
0,215 |
0.146 |
0,037 |
|
15 |
3.336 |
0,725 |
0,252 |
0,174 |
0,046 |
|
20 |
3,721 |
0,833 |
0,294 |
0.205 |
0,058 |
|
25 |
4.137 |
0,951 |
0,341 |
0.240 |
0,067 |
|
30 |
4,460 |
1,080 |
0,394 |
0.280 |
0,081 |
|
35 |
4,889 |
1,226 |
0,452 |
0.324 |
0,096 |
|
40 |
– |
1,382 |
0,513 |
0.374 |
0,114 |
|
45 |
– |
1,552 |
0,590 |
0.429 |
0,134 |
|
50 |
– |
1,740 |
0,670 |
0,490 |
0,157 |
|
55 |
– |
1,943 |
0,759 |
0.557 |
0,183 |
|
60 |
– |
2,162 |
0,853 |
0.631 |
0,212 |
Для идеальных систем «жидкость-пар», у которых компоненты смеси образуют идеальный раствор в жидкой фазе, а пары подчиняются законам идеального газа, в состоянии равновесия справедливо уравнение, объединяющее законы Дальтона и Рауля:
yiP = xiPi или yi /xi = Pi /P = ki (2.46)
где ki — константа равновесия или распределения системы «жидкость-пар»; pi — парциальное давление; xi — мольная концентрация компонента i в жидкой фазе; уi — то же, в паровой фазе.
- Главная
- Справочник
- Основные физико- химические законы и соотношения
- Упругость насыщенных паров
|
|
Макеты страниц
Представим себе вогнутую (а), выпуклую (б) и плоскую (в) поверхности жидкости, вблизи которых находится молекула пара (рис. 129).

Рис. 129
Очевидно, что молекула, находящаяся над вогнутой поверхностью, притягивается жидкостью сильнее, а молекула, находящаяся над выпуклой поверхностью, — слабее, чем молекула, находящаяся на том же расстоянии над плоской поверхностью жидкости. Это обстоятельство затрудняет испарение с вогнутой поверхности и облегчает испарение с выпуклой поверхности по сравнению с испарением с плоской поверхности. Поэтому в случае (а) динамическое равновесие жидкости с паром должно наступить при меньшей упругости пара, чем в (б). Следовательно, упругость насыщенного пара над вогнутой поверхностью жидкости меньше, а над выпуклой. — больше, чем над плоской поверхностью.
Величину изменения упругости насыщенного пара  над сферической поверхностью (по сравнению с плоской) можно определить
над сферической поверхностью (по сравнению с плоской) можно определить
исходя из следующих соображений. Пусть в жидкость, налитую  в закрытый сосуд, погружен конец полностью смачиваемой капиллярной трубки радиусом
в закрытый сосуд, погружен конец полностью смачиваемой капиллярной трубки радиусом  (рис. 130). Тогда в трубке на высоте
(рис. 130). Тогда в трубке на высоте  создается вогнутый мениск, радиус кривизны которого также равен
создается вогнутый мениск, радиус кривизны которого также равен  В сосуде находится насыщенный пар жидкости. Давление этого пара на уровне плоской поверхности обозначим
В сосуде находится насыщенный пар жидкости. Давление этого пара на уровне плоской поверхности обозначим  а на уровне
а на уровне  над мениском, — через
над мениском, — через  В связи с тем что в поле силы тяжести давление газа (и пара) уменьшается с высотой,
В связи с тем что в поле силы тяжести давление газа (и пара) уменьшается с высотой,  меньше
меньше  на величину веса столбика пара высотой
на величину веса столбика пара высотой  и площадью поперечного сечения
и площадью поперечного сечения 

где  плотность пара.
плотность пара.
Согласно формуле Борелли-Жюрена (см. § 61), в случае полного смачивания

где  плотность жидкости, а — коэффициент поверхностного натяжения. Тогда
плотность жидкости, а — коэффициент поверхностного натяжения. Тогда


Рис. 130
Аналогичный расчет для несмачиваемого капилляра покажет, что упругость насыщенного пара над выпуклой поверхностью на такую же величину больше, чем над плоской поверхностью. Поэтому

(знак плюс соответствует случаю выпуклой поверхности, знак минус — случаю вогнутой поверхности).
Зависимость упругости насыщенного пара от кривизны поверхности жидкости обусловливает целый ряд важных метеорологических явлений. Прежде всего следует подчеркнуть, что в свободной атмосфере нет тех плоских поверхностей, на которых мог бы конденсироваться водяной пар, насыщенный относительно плоской водной поверхности. Конденсация же пара на отдельных молекулах газов, входящих в состав воздуха, невозможна: крайне малому размеру (радиусу) этих молекул соответствует очень большая упругость насыщенного пара, не встречающаяся в реальной атмосфере. Между тем возникновение облаков свидетельствует о том, что конденсация водяного пара в атмосфере происходит. Дело в том, что пар конденсируется на так
называемых атмосферных ядрах конденсации: пылинках, частицах дыма, кристалликах морской соли и других мелких «посторонних» частицах, всегда взвешенных в воздухе в достаточном количестве. Адсорбируя молекулы водяного пара, эти ядра покрываются мономолекулярной пленкой воды, уподобляясь, таким образом, водяным капелькам достаточно крупного размера. Для дальнейшей конденсации пара на таких капельках уже не требуется больших пересыщений  Особенно активно действуют в этом отношении электрически заряженные ядра конденсации (атмосферные ионы) и гигроскопические растворимые в воде ядра.
Особенно активно действуют в этом отношении электрически заряженные ядра конденсации (атмосферные ионы) и гигроскопические растворимые в воде ядра.
Между прочим, сущность известного агротехнического приема защиты растений от заморозков путем «задымления» полей, огородов и садов состоит не только в том, что излучение теплоты с почвы задерживается пеленой самого дыма. Немаловажную роль здесь может играть конденсация пара на частицах дыма (как на активных ядрах конденсации), приводящая к образованию плотного приземного тумана и сопровождающаяся выделением теплоты конденсации.
Если в водяном паре находятся две капельки воды различного размера, причем пар является насыщенным относительно более крупной капельки, то наблюдается следующее интересное явление. Относительно меньшей капельки пар, согласно формуле (7), оказывается ненасыщенным и капелька начинает испаряться. Благодаря этому упругость пара увеличивается, он становится пересыщенным относительно крупной капельки и конденсируется на ней. Таким образом, крупная капелька растет за счет мелкой. Такая «перекачка» воды с мелких капелек на более крупные происходит в облаках и является одним из способов укрупнения облачных капелек до размера дождевых капель.
«Перекачку» влаги с мелких капель на крупные можно наблюдать под микроскопом, если подышать на слегка охлажденное предметное стекло, чтобы на нем образовались капли воды.
Дополнительная упругость насыщенного пара над искривленной поверхностью жидкости обусловливает так называемую капиллярную конденсацию на почве. Почвенные капилляры, как правило, смачиваются водой, поэтому почвенная вода образует в них вогнутые мениски. Пар, не насыщенный относительно плоской поверхности, может оказаться пересыщенным относительно менисков воды в почвенных капиллярах и начнет конденсироваться на них.
Если в жидкости растворено какое-нибудь нелетучее твердое вещество (например, сахар в воде), то упругость ее насыщенного пара понижается. Это можно объяснить тем, что число молекул жидкости на единице поверхности раствора меньше, чем на единице поверхности чистой жидкости (часть поверхности занята молекулами растворенного вещества). Поэтому уменьшается число испаряющихся молекул и, следовательно, понижается упругость насыщенного пара.
В 1886 г. французский химик Рауль установил, что
понижение упругости насыщенного пара над раствором пропорционально числу молекул растворенного вещества в единице объема
раствора и не зависит от их химического состава:

где  упругость насыщенного пара над чистым растворителем,
упругость насыщенного пара над чистым растворителем,  число молей вещества, растворенного в
число молей вещества, растворенного в  молях растворителя. Это утверждение называется законом Рауля, который хорошо выполняется для слабых (идеальных) растворов.
молях растворителя. Это утверждение называется законом Рауля, который хорошо выполняется для слабых (идеальных) растворов.
Из закона Рауля следует, что температура кипения у раствора выше, чем у чистого растворителя, так как раствор надо нагреть сильнее растворителя, чтобы упругость насыщенного пара над ним стала равной внешнему давлению (см. § 66).
Оглавление
- Предисловие
- Введение
- § 1. Предмет физики. Связь физики с другими науками и производством
- § 2. О единицах измерения и размерности физических величин
- § 3. О некоторых математических понятиях и символах
- 1. Физические основы механики
- § 4. Общий случай криволинейного движения материальной точки; основные характеристики движения
- § 5. Прямолинейное движение материальной точки
- § 6. Движение материальной точки по окружности
- Глава II. Основные законы динамики
- § 7. Законы Ньютона. Масса и сила
- § 8. Закон изменения количества движения (импульса)
- § 9. Закон сохранения количества движения в изолированной системе
- § 10. Силы упругости
- § 11. Силы трения
- § 12. Силы тяготения (гравитационные силы)
- § 13. Центростремительная сила
- § 14. Инерциальные и неинерциальные системы отсчета. Силы инерции
- § 15. Вес тел. Ускорение силы тяжести. Невесомость
- Глава III. Работа и энергия
- § 16. Работа и мощность
- § 17. Энергия
- § 18. Закон сохранения и превращения энергии
- § 19. О космических скоростях
- § 20. Границы применимости классической механики
- Глава IV. Вращательное движение твердого тела
- § 21. Основной закон динамики вращения
- § 22. Моменты инерции некоторых тел
- § 23. Закон сохранения момента количества движения. Кинетическая энергия вращающегося тела
- Глава V. Движение жидкости
- § 24. Основные определения. Уравнение неразрывности
- § 25. Уравнение Бернулли
- § 26. О некоторых приложениях уравнения Бернулли
- Глава VI. Колебания и волны
- § 27. Гармоническое колебание и его характеристики
- § 28. Сложение гармонических колебаний
- § 29. Динамика колебательного движения. Маятник
- § 30. О затухающих и вынужденных колебаниях
- § 31. Волновой процесс
- § 32. Уравнение волны. Интенсивность волны
- § 33. Интерференция волн. Стоячие волны
- § 34. Фронт волны. Принцип Гюйгенса-Френеля
- 2. Молекулярная физика и термодинамика
- § 35. Основные положения молекулярно-кинетической теории
- § 36. О некоторых явлениях, подтверждающих основные положения молекулярно-кинетической теории
- § 37. О теплоте и температуре
- § 38. О предмете и методах молекулярной физики
- Глава VIII. Газы
- § 39. Экспериментальные газовые законы: Бойля-Мариотта, Гей-Люссака, Дальтона, Авогадро. Абсолютная температура
- § 40. Уравнение Клапейрона — Менделеева. Универсальная газовая постоянная
- § 41. Основное уравнение кинетической теории идеального газа
- § 42. Средняя кинетическя энергия поступательного движения молекулы идеального газа
- § 43. О числе степеней свободы. Внутренняя энергия газа
- § 44. Теплоемкости газа. Физический смысл универсальной газовой постоянной
- § 45. Скорость поступательного движения молекул газа. Распределение числа молекул по скоростям
- § 46. Средняя длина свободного пробега молекул
- § 47. Явления переноса в газах. Уравнение переноса
- § 48. Диффузия
- § 49. Теплопроводность
- § 50. Внутреннее трение (вязкость)
- Глава IX. Жидкости и твердые тела
- § 51. Особенности строения жидкостей и твердых тел
- § 52. Деформация твердого тела
- § 53. Тепловое расширение твердых и жидких тел
- § 54. Теплоемкость твердых и жидких тел
- § 55. Диффузия в жидких и твердых телах
- § 56. Осмос
- § 57. Теплопроводность жидких и твердых тел
- § 58. Вязкость жидкости. Турбулентное движение жидкости
- § 59. Внутреннее давление в жидкости. Поверхностное натяжение и свободная энергия поверхности жидкости
- § 60. Дополнительное давление под искривленной поверхностью жидкости. Формула Лапласа
- § 61. Капиллярные явления; формула Жюрена
- Глава X. Изменение агрегатного состояния вещества (фазовые превращения)
- § 62. Понятие о фазовых превращениях и диаграмме состояний вещества
- § 63. Реальный газ. Уравнение Ван-дер-Ваальса
- § 64. Опыт Эндрюса. Критическая температура
- § 65. Сжижение газов. Эффект Джоуля-Томсона
- § 66. Испарение и конденсация. Кипение
- § 67. Упругость насыщенного пара над искривленной поверхностью жидкости и над раствором
- § 68. Плавление и затвердевание (кристаллизация). Возгонка
- Глава XI. Основы термодинамики
- § 69. О некоторых общих понятиях термодинамики. Первое начало термодинамики
- § 70. Работа, совершаемая при изменении объема газа. Адиабатические процессы
- § 71. Цикл Карно. Второе начало термодинамики
- § 72. Энтропия
- § 73. О статистическом смысле энтропии и второго начала термодинамики
- 3. Электричество и магнетизм
- § 74. Электризация тел. Электрический заряд
- § 75. Взаимодействие электрических зарядов в вакууме. Электрическое поле и его напряженность
- § 76 Электрический диполь. Поле диполя
- § 77. Теорема Остроградского-Гаусса и ее приложения
- § 78. Работа перемещения заряда в электрическом поле. Потенциал
- § 79. О неустойчивости статических систем электрических зарядов
- § 80. Проводники в электрическом поле. Электроемкость. Энергия заряженного проводника
- § 81. Диэлектрики в электрическом поле. Поляризация диэлектриков
- § 82. Электрическое поле в диэлектрике. Диэлектрическая проницаемость. Вектор электрической индукции
- § 83. Конденсатор. Энергия электрического поля
- Глава XIII. Постоянный электрический ток
- § 84. Электрический ток. Сила тока. Электродвижущая сила. Напряжение
- § 85. Ток в металлических проводниках. Сопротивление. Законы Ома. Работа и мощность тока
- § 86. Разветвленная электрическая цепь. Правила Кирхгофа
- § 87. Контактная разность потенциалов. Термоэлектрические явления
- § 88. Эмиссия электронов. Термоэлектронная эмиссия. Электронные лампы
- § 89. Ток в полупроводниках. Собственная и примесная проводимости полупроводников
- § 90. Запирающий слой. Полупроводниковые выпрямители, усилители и термоэлектрические батареи
- § 91. Ток в жидкостях. Электролиз. Законы Фарадея
- § 92. Ток в газах. Несамостоятельный и самостоятельный газовые разряды
- § 93. Типы самостоятельного газового разряда
- Глава XIV. Электромагнетизм
- § 94. Постоянный магнит и круговой ток. Магнитные поля магнитов и токов
- § 95. Магнитное взаимодействие токов в вакууме; закон Ампера
- § 96. Напряженность магнитного поля. Формула Ампера. Закон Био-Савара-Лапласа
- § 97. Некоторые приложения закона Био-Савара-Лапласа
- § 98. Магнитные поля соленоида и тороида
- § 99. Диамагнитные, парамагнитные и ферромагнитные вещества. Магнитная проницаемость. Магнитная индукция. Поток магнитной индукции
- § 100. Действие магнитного поля на проводник с током. Определение ампера
- § 101. Движение заряженных частиц в электрическом и магнитном полях. Определение удельного заряда и массы электрона
- § 102. О некоторых приборах и установках, основанных на движении заряженных частиц в электрическом и магнитном полях
- Глава XV. Электромагнитная индукция и переменный ток
- § 103. Электромагнитная индукция. Закон Фарадея. Правило Ленца. Токи Фуко
- § 104. Взаимная индукция и самоиндукция
- § 105. Энергия магнитного поля. Понятие об электромагнитной теории Максвелла
- § 106. Контур, вращающийся в магнитном поле. Синусоидальный переменный ток. Работа и мощность переменного тока
- § 107. Емкостное и индуктивное сопротивления
- § 108. Обобщенный закон Ома. Электрический резонанс. Коэффициент мощности электрической цепи
- § 109. Понятие о трехфазном токе
- Глава XVI. Электрические колебания и электромагнитные волны
- § 110. Электромагнитные волны
- § 111. Закрытый колебательный контур
- § 112. Вибратор Герца. Автоколебательный контур. О диапазоне частот электромагнитных волн
- § 113. Радиосвязь
- 4. Оптика и атомная физика
- § 114. Природа света
- § 115. Отражение и преломление света. Полное отражение
- § 116. Дисперсия света. Спектры
- § 117. Тонкие линзы. Микроскоп
- § 118. Глаз как оптическая система. Спектральная чувствительность глаза
- § 119. Основные фотометрические характеристики
- § 120. Поглощение света. О физиологическом действии света
- Глава XVIII. Волновые свойства света
- § 121. Интерференция света. Интерферометр
- § 122. Об интерференции света, отраженного от прозрачных пленок
- § 123. Дифракция света. Разрешающая способность оптических приборов
- § 124. Дифракция от щелей. Дифракционные спектры. Дифракционная решетка. О рассеянии света в мутной среде
- § 125. Дифракция рентгеновских лучей. Формула Вульфа-Брэггов
- § 126. О дифракции микрочастиц и волнах де-Бройля
- § 127. Поляризация света. Естественный и поляризованный свет. Поляризация света в турмалине. Поляроиды
- § 128. Двойное лучепреломление. Поляризация света в исландском шпате. Призма Николя
- 129. Вращение плоскости колебаний поляризованного света. Поляриметр
- Глава XIX. Квантовые свойства света и строение атома
- § 130. Тепловое лучеиспускание и лучепоглощение. Абсолютно черное тело. Закон Кирхгофа
- § 131. Законы излучения абсолютно черного тела. Квантовый характер излучения. Формула Планка
- § 132. Строение атома (ядерная модель). Дискретность энергетических состояний атома. Постулаты Бора
- § 133. Квантовая теория строения атома водорода (по Бору). Объяснение спектров излучения и поглощения водорода
- § 134. Понятие о строении многоэлектронных атомов и образовании оптических и рентгеновских (характеристических) спектров
- § 135. Люминесценция. Законы фотолюминесценции и некоторые ее практические применения
- § 136. Фотоэффект. Законы фотоэффекта. Фотоэлементы
- § 137. Масса и импульс фотона. Световое давление. Эффект Комптона. Флуктуации света
- Глава XX. Атомное ядро и внутриядерные процессы
- § 138. Общие сведения об атомных ядрах. Изотопы
- § 139. Естественная радиоактивность. Альфа-, бета- и гамма-лучи. Законы радиоактивного распада
- § 140. О методах наблюдения и регистрации микрочастиц
- § 141. Ядерные реакции. Искусственная радиоактивность
- § 142. Энергия связи и дефект массы атомного ядра
- § 143. Реакция деления. Цепная реакция. Ядерный реактор
- § 144. Реакция синтеза (термоядерная реакция). Энергия звезд
- § 145. Космические лучи. Элементарные частицы
- § 146. Об использовании ядерной энергии

