| Статья является частью одноименной серии. |
| Тепловые процессы |
|---|
 |
|
| См. также «Физический портал» |
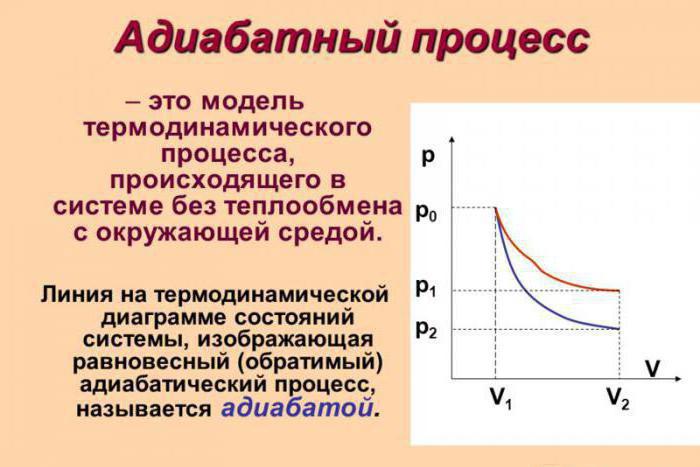
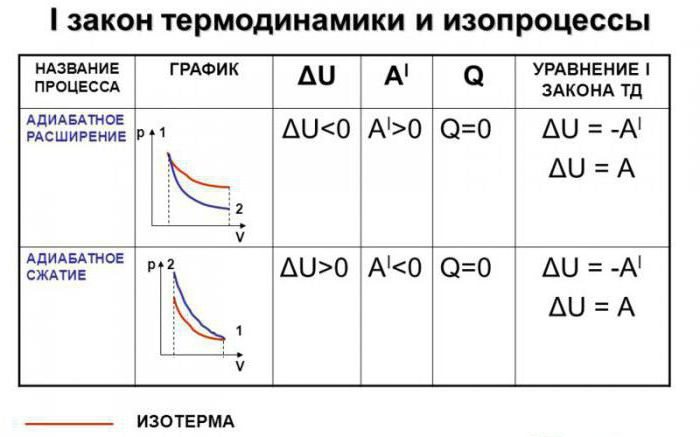
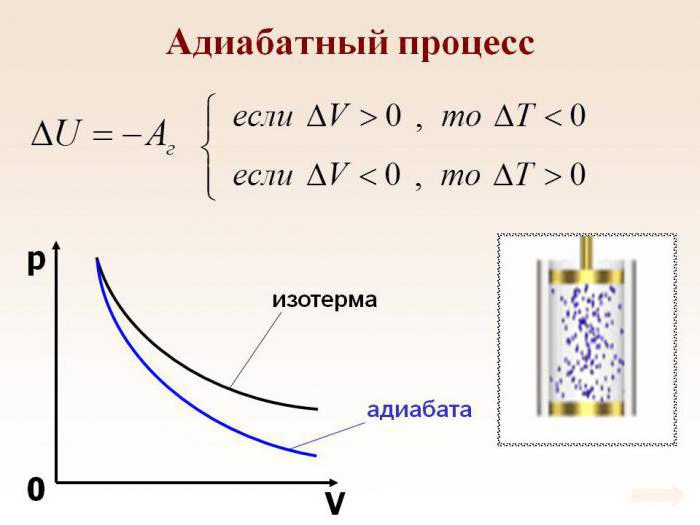
Адиабати́ческий, или адиаба́тный[1] проце́сс (от др.-греч. ἀδιάβατος «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. Серьёзное исследование адиабатических процессов началось в XVIII веке[2].
В целом термин адиабатический в разных областях науки всегда подразумевает сохранение неизменным какого-то параметра. Так в квантовой химии, электронно адибатический процесс это процесс, в котором не изменяется квантовое число электронного состояния. Например, молекула всегда остается в первом возбужденном состоянии вне зависимости от изменения положения атомных ядер. Соответственно неадиабатическим называется процесс, в котором происходит изменение какого-то важного параметра.
В термодинамике, адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[3]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Равновесный адиабатный процесс является изоэнтропным процессом[4]. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[5].
Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона. Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой. Адиабатическими можно считать процессы в целом ряде явлений природы. Также такие процессы получили ряд применений в технике.
История[править | править код]
Уравнение Пуассона позволило описать адиабатический процесс
Существование атмосферного давления было показано рядом экспериментов в XVII веке. Одним из первых доказательств гипотезы стали магдебургские полушария, сконструированные немецким инженером Герике. Из сферы, образованной полушариями, выкачивался воздух, после чего их было трудно разъединить в силу внешнего давления воздуха. Другой эксперимент в рамках исследования природы атмосферного давления поставил Роберт Бойль. Он состоял в том, что если запаять изогнутую стеклянную трубку с короткого конца, а в длинное колено постоянно подливать ртуть, она не поднимется до верха короткого колена, поскольку воздух в трубке, сжимаясь, будет уравновешивать давление ртути на него. К 1662 году данные опыты позволили прийти к формулировке закона Бойля — Мариотта[6].
В 1779 году в «Пирометрии» Ламберта был описан опыт повышения и понижения температуры в приёмнике воздушного насоса при движении поршня. Впоследствии данный эффект был подтверждён Дарвином (1788) и Пикте (1798). В 1802 году Дальтон опубликовал доклад, в котором, в числе прочего, указал, что сгущение газов сопровождается выделением тепла, а разрежение — охлаждением. Рабочий оружейного завода зажёг трут в дуле духового ружья путём сжатия воздуха, о чём сообщил в 1803 году лионский физик Моле[2].
Теоретическим обобщением накопившихся экспериментальных знаний занялся физик Пуассон. Так как при адиабатическом процессе температура непостоянна, то закон Бойля — Мариотта требует поправки, которую Пуассон обозначил как коэффициент k и выразил через соотношение теплоёмкостей. Экспериментально данный коэффициент определялся Вальтером и Гей-Люссаком (эксперимент описан в 1807 году) и затем более точно Дезормом и Клеманом в 1819 году. Практическое использование адиабатического процесса предложил С. Карно в работе «Движущая сила огня» в 1824 году[2].
Физический смысл адиабатического процесса[править | править код]
Если термодинамический процесс в общем случае представляет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии[7], то адиабатический процесс в силу отсутствия теплообмена (
где 

Изменения энтропии 
Здесь 

Работа газа[править | править код]
Совершение над газом работы на элементарном участке
dh. Совершаемая работа показана красными лампочками
Поясним понятие работы применительно к адиабатическому процессу. В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем. Если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок 
где F — сила, с которой газ действует на поршень. Перепишем уравнение:
где s — площадь поршня. Тогда работа будет равна[11][12]
где 


Основное уравнение термодинамики примет вид[13]:

|
(1) |
Это условие будет выполняться, если скорость хода поршня (протекания процесса в общем случае) будет удовлетворять определённым условиям. С одной стороны, она должна быть достаточно малой, чтобы процесс можно было считать квазистатическим. Иначе при резком изменении хода поршня давление, которое его перемещает, будет отличаться от давления в целом по газу. То есть газ должен находиться в равновесии, без турбулентностей и неоднородностей давления и температуры. Для этого достаточно передвигать поршень со скоростью, существенно меньшей, чем скорость звука в данном газе. С другой стороны, скорость должна быть достаточно большой, чтобы можно было пренебречь обменом тепла с окружающей средой и процесс оставался адиабатическим[14][15].
Однако работа может совершаться и другими путями — например, идти на преодоление межмолекулярного притяжения газов. В этом случае параллельно с изменением внутренней энергии будет происходить процессы совершения нескольких работ разной физической природы, и основное уравнение термодинамики примет вид:

|
(1a) |
где 



Внутренняя энергия идеального газа[править | править код]
Тепловое движение молекул одноатомного газа идёт в среднем тем интенсивнее, чем больше его внутренняя энергия. Скорость каждой отдельной молекулы при этом может изменяться даже при постоянстве внутренней энергии всего газа[Комм 2]
Внутренняя энергия является однозначной функцией состояния системы. Поэтому применительно к адиабатическому процессу её изменение имеет тот же физический смысл, что и в общем случае. Согласно экспериментально установленному закону Джоуля (закону Гей-Люссака — Джоуля) внутренняя энергия идеального газа не зависит от давления или объёма газа[16]. Исходя из этого факта, можно получить выражение для изменения внутренней энергии идеального газа. По определению молярной теплоёмкости при постоянном объёме, 

|
(2) |
где 
Уравнение Пуассона для идеального газа[править | править код]
Адиабата Пуассона[править | править код]
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[8][18][19]
где 



График адиабаты (жирная линия) на 


С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
где 
Поскольку 



Вывод уравнения[править | править код]
Согласно закону Менделеева — Клапейрона[8] для идеального газа справедливо соотношение
где R — универсальная газовая постоянная. Вычисляя полные дифференциалы от обеих частей уравнения, полагая независимыми термодинамическими переменными 

|
(3) |
Если в (3) подставить 

или, введя коэффициент 
Это уравнение можно переписать в виде
что после интегрирования даёт:
Потенцируя, получаем окончательно:
что и является уравнением адиабатического процесса для идеального газа.
Показатель адиабаты[править | править код]
| Показатели адиабаты для различных газов[20][21] | ||||||
|---|---|---|---|---|---|---|
| Темп. | Газ | k | Темп. | Газ | k | |
| −181 °C | H2 | 1,597 | 20 °C | He | 1,660 | |
| −76 °C | 1,453 | 20 °C | H2O | 1,330 | ||
| 20 °C | 1,410 | 100 °C | 1,324 | |||
| 100 °C | 1,404 | 200 °C | 1,310 | |||
| 400 °C | 1,387 | −180 °C | Ar | 1,760 | ||
| 1000 °C | 1,358 | 20 °C | 1,670 | |||
| 2000 °C | 1,318 |
При адиабатическом процессе показатель адиабаты равен

Для нерелятивистского невырожденного одноатомного идеального газа 




Для реальных газов показатель адиабаты отличается от показателя адиабаты для идеальных газов, особенно при низких температурах, когда большу́ю роль начинает играть межмолекулярное взаимодействие. Для его теоретического нахождения следует проводить расчёт без некоторых допущений, в частности, использованных при выводе формулы (1), и использовать формулу (1а).
Один из методов для экспериментального определения показателя был предложен в 1819 г. Клеманом и Дезормом. Стеклянный баллон вместимостью несколько литров наполняется исследуемым газом при давлении 


Энтропия и обратимость[править | править код]
В общем случае для произвольной физической системы изменение состояния при адиабатическом расширении определяется производными термодинамических параметров при постоянной энтропии. Справедливы соотношения
,
,
где Cp и Cv — теплоёмкости при постоянном давлении и объёме, которые всегда положительны по своему физическому смыслу, 



Необратимость адиабатических процессов связана с неравновесным переходом от начального состояния к конечному: система не следует адиабате Пуассона 
Примеры[править | править код]
Открытие адиабатического процесса практически сразу нашло применение в дальнейших исследованиях. Создание теоретической модели цикла Карно позволило установить пределы развития реальных тепловых машин (сам С. Карно показал, что двигатель с более высоким КПД позволил бы создать вечный двигатель[28]). Однако цикл Карно трудно осуществим для некоторых реальных процессов, так как входящие в его состав изотермы требуют определённой скорости теплообмена[29]. Поэтому были разработаны принципы циклов, частично сходных с циклом Карно (например, цикл Отто, цикл сжижения газа, цикл Ренкина), которые были бы применимы в конкретных практических задачах.
Дальнейшие исследования показали также, что некоторые процессы в природе (например, распространение звука в газе) можно с достаточной степенью приближения описывать адиабатическим процессом и выявлять их закономерности[30]. Химическая реакция внутри объёма газа в случае отсутствия теплообмена с окружающей средой также по определению будет адиабатическим процессом. Таким процессом является, например, адиабатическое горение. Для атмосферы Земли также считается адиабатическим процесс совершения газом работы на увеличение его потенциальной энергии. Исходя из этого, можно определить адиабатический градиент температуры для атмосферы Земли[31]. Теория адиабатического процесса употребляется и для других астрономических объектов с атмосферой. В частности, для Солнца наличие макроскопических конвекционных движений теоретически определяют путём сравнения адиабатического градиента и градиента лучевого равновесия[32].
Адиабатическими можно считать процессы, происходящие с применением адиабатных оболочек.
Цикл Карно[править | править код]
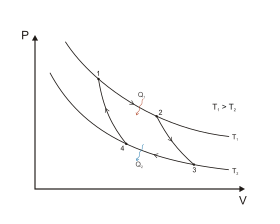
Цикл Карно в координатах P и V
Цикл Карно является идеальным термодинамическим циклом. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно[10][33].
Максимальное КПД достигается при обратимом цикле[10]. Для того, чтобы цикл был обратимым, из него должна быть исключена передача тепла при наличии разности температур. Чтобы доказать этот факт, предположим, что передача тепла при разности температур имеет место. Данная передача происходит от более горячего тела к более холодному. Если предположить процесс обратимым, то это означало бы возможность передачи тепла обратно от более холодного тела к более нагретому, что невозможно, следовательно процесс необратим[29]. Соответственно, преобразование тепла в работу может происходить только изотермически[Комм 3]. При этом обратный переход двигателя в начальную точку только путём изотермического процесса невозможен, так как в этом случае вся полученная работа будет затрачена на восстановление исходного положения. Так как выше было показано, что адиабатический процесс может быть обратимым — то этот вид адиабатического процесса подходит для использования в цикле Карно.
Всего при цикле Карно происходят два адиабатических процесса[33]:
- Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс 2→3). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
- Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс 4→1). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
Цикл Отто[править | править код]
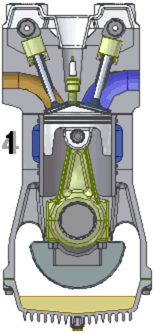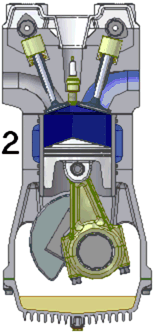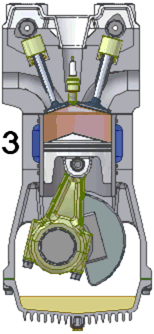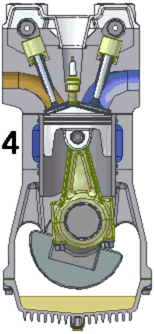
Схема работы четырёхтактного двигателя, цикл Отто
1. впуск
2. сжатие
3. рабочий ход
4. выпуск
При идеальном цикле Отто, который приближённо воспроизведён в бензиновом двигателе внутреннего сгорания, второй и третий из четырёх тактов являются адиабатическими процессами[Комм 4]. Работа, которая совершается на выходе двигателя, равна разности работы, которую произведёт газ над поршнем во время третьего такта (то есть рабочего хода), и работы, которую затрачивает поршень на сжатие газа во время второго такта. Так как в цикле Отто используется система принудительного зажигания смеси, то происходит сжатие газа в 7—12 раз[34]. Более высокая степень сжатия требует использования топлива с более высоким октановым числом (для бензиновых ДВС) во избежание детонации.
Рассчитаем пример процесса, происходящего в двигателе внутреннего сгорания при адиабатическом сжатии. Примем величину сжатия 10 и объём двигателя 10−3 м³ (1 л). Перед сжатием припишем смеси околокомнатную температуру 300 K (около 27 °C) и нормальное атмосферное давление около 100 кПа. Также примем газ смеси двухатомным и идеальным. Тогда

Рассмотрим процесс сжатия газа в десять раз — до объёма 100 мл. Константа адиабатического сжатия остаётся при этом равной 6,31. Итого получаем:

что даёт решение для P:

что составляет приблизительно 24,5 атмосферы. Однако в процессе сжатия изменилось не только давление, но и температура газа, которую можно рассчитать по закону Менделеева — Клапейрона:

Теперь, подставляя объём 100 мл и вычисленное нами ранее давление, получаем температуру:

Как видно из решения, такая температура не может привести к самоподжигу топлива[Комм 5]. Выводы из расчёта справедливы и для реальных двигателей, так как в них при данной степени сжатия самоподжига не происходит[34].
Прохождение звуковых волн в газе[править | править код]
Для небольших объёмов газа адиабатическим процессом, близким к обратимому, можно считать процессы в небольших объёмах газа при прохождении звуковой волны[8].
На основании этого можно рассчитать скорость звука в газах путём нахождения зависимости 


где 



Сжижение газов[править | править код]
Идеальный цикл сжижения газа
Пусть необходимо охладить идеальный газ путём отведения тепла в область с более высокой температурой. Тогда наименьшая затрачиваемая работа будет происходить по циклу Карно в обратном направлении 

В реальном газе при наличии большого давления и низкой температуры возможна ситуация, когда значительную роль в движении молекул начинает играть межмолекулярное притяжение. В случае адиабатического расширения газа (например в результате использования эффекта Джоуля — Томсона) из-за работы, которая тратится на преодоление межмолекулярного притяжения, температура газа резко падает, часть газа конденсируется[37]. Адиабатическое дросселирование проходит с увеличением энтропии и не сразу после изотермического сжатия[36].
Магнитное охлаждение[править | править код]
Магнитокалорический эффект. Адиабатической здесь является фаза размагничивания
С помощью адиабатического размагничивания парамагнетиков можно достичь температуры в сотые доли кельвина, а для некоторых веществ (так называемые ванфлековские или поляризационные парамагнетики) даже нанокельвинов. Метод был предложен Петером Дебаем и Уильямом Джиоком в 1926 году[38]. Парамагнитный образец для эффективного охлаждения должен иметь малую удельную теплоёмкость кристаллической решётки и большую удельную теплоёмкость магнитной подсистемы, его внутренние магнитные поля должны быть малы, а спин-решёточная связь достаточно сильной. Этим условиям удовлетворяют медь и один из интерметаллидов празеодима с никелем (празеодимпентаникель, 
При температуре порядка одного кельвина спины электронов, как правило, упорядочены, в отличие от ядерных спинов I[40]. При этом связь между ядерными спинами различных атомов практически отсутствует. При магнитном охлаждении образец вначале намагничивают в сильном магнитном поле B (до нескольких Тл), которое упорядочивает его магнитную подсистему. Далее происходит адиабатическое размагничивание, которое сохраняет постоянной энтропию системы. Энтропия одного моля меди зависит от ядерных спинов I, поля B и температуры T (в кельвинах) как
где R — газовая постоянная, b — внутреннее магнитное поле вещества, 
где g и g0 — факторы Ланде для направлений полей с напряжённостями H и H0 соответственно[42].
См. также[править | править код]
- Адиабатическое горение
- Адиабатическое приближение
- Адиабатический инвариант
- Адиабатический градиент температуры
- Система адиабатического увлажнения воздуха
Примечания[править | править код]
Комментарии[править | править код]
- ↑ Если в уравнении
считать работой внешних сил над системой, то уравнение будет иметь вид
- ↑ Что можно наглядно проследить на этом рисунке, если наблюдать за любой помеченной красным молекулой
- ↑ В соответствии с определением изотермический процесс происходит при постоянной температуре (см. например, Савельев, 2001, с 30). Если же процесс другой, то при постоянной температуре нагревателя/холодильника, очевидно в какой-то момент будет разность температур. Если же теплообмен происходит с телом переменной температуры, как в цикле Стирлинга, то это условие необязательно.
- ↑ Чтобы соответствовать циклу Отто, процесс сгорания топлива между вторым и третьим тактом должен быть быстрым по сравнению со временем такта.
- ↑ Рабочая температура для дизельных двигателей, работающих по системе самовоспламенения, составляет 820—870 K.
- ↑ Так как такой процесс будет сопровождаться передачей тепла между частями газа и, следовательно, будет необратимым (как любой процесс с передачей от более горячего тела к холодному — см. Савельев, 2001, с 106), а для обратимого адиабатического процесса dS = 0.
Источники[править | править код]
- ↑ Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин, 1984, с. 14.
- ↑ 1 2 3 Кудрявцев, 1956, с. 396—399.
- ↑ Савельев, 2001, с. 33-34.
- ↑ Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин, 1984, с. 6.
- ↑ Ландау, Лифшиц V, 1976, с. 55.
- ↑ Кудрявцев, 1956, с. 185—186.
- ↑ Савельев, 2001, с. 17.
- ↑ 1 2 3 4 Савельев, 2001, с. 30—32.
- ↑ Сивухин, 1975, с. 54.
- ↑ 1 2 3 4 Савельев, 2001, с. 109—113.
- ↑ 1 2 3 Савельев, 2001, с. 19—20.
- ↑ 1 2 Ландау Л.Д., Ахиезер А.И., 1965, с. 181—182.
- ↑ Ландау Л.Д., Ахиезер А.И., 1965, с. 196—198.
- ↑ Савельев, 2001, с. 13.
- ↑ Ландау, Лифшиц V, 1976, с. 56.
- ↑ Герасимов Я. И., 1970, с. 50—51.
- ↑ Ландау Л.Д., Ахиезер А.И., 1965, с. 185.
- ↑ Ландау Л.Д., Ахиезер А.И., 1965, с. 196-198.
- ↑ Ландау, Лифшиц V, 1976, с. 144.
- ↑ White, Frank M. Fluid Mechanics. — 4th. — McGraw-Hill, New York., 1998. — ISBN 978-0072281927.
- ↑ Lange, N. A.; Dean, J. A. Lange’s Handbook of Chemistry. — 10th. — McGraw-Hill, New York., 1967. — С. 1524.
- ↑ 1 2 Адиабата // А — Ангоб. — М. : Советская энциклопедия, 1969. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 1).
- ↑ Сивухин, 1975, с. 78—79.
- ↑ Ландау, Лифшиц V, 1976, с. 70.
- ↑ 1 2 Глаголев К. В., Морозов А. Н. Применение термодинамических потенциалов для описания эффекта Джоуля-Томсона (недоступная ссылка — история). Физическая термодинамика. МГТУ им. Н. Э. Баумана. Дата обращения: 4 января 2012. Архивировано 1 февраля 2012 года.
- ↑ K. C. Pal. Heat Power. — Orient Blackswan, 1990. — P. 85—88. — 480 p. — ISBN 9780861319596.
- ↑ David R. Gaskell. Introduction to the thermodynamics of materials. — 4th Ed. — Taylor & Francis, 2003. — P. 47. — 618 p. — ISBN 9781560329923.
- ↑ Кудрявцев, 1956, с. 400—401.
- ↑ 1 2 Савельев, 2001, с. 106.
- ↑ 1 2 3 Савельев Т.4, 2001, с. 32—36.
- ↑
Paul E. Lyndorph. Weather and Climate. — 3-е изд. — New Jersey: Rowman & Allanheld Publishers, 1985. — С. 95—97. - ↑
Соболев В. В. Курс теоретической астрофизики. — 3-е изд. — М.: Наука, 1985. — С. 170—172. — 504 с. - ↑ 1 2 Ландау Л.Д., Ахиезер А.И., 1965, с. 209.
- ↑ 1 2 Кириллин, 2008.
- ↑ Сивухин, 1975, с. 98—99.
- ↑ 1 2 3 Сжижение газов / А. Б. Фрадков // Сафлор — Соан. — М. : Советская энциклопедия, 1976. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 23).
- ↑ Адиабатный процесс // А — Ангоб. — М. : Советская энциклопедия, 1969. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 1).
- ↑ 1 2 Магнитное охлаждение — статья из Физической энциклопедии
- ↑ Anthony Kent. Experimental low temperature physics. — Springer, 1993. — P. 141. — 212 p. — (Macmillan physical science). — ISBN 9781563960307.
- ↑ Luke C. L., Wu Yan, Chien-Shieng. Part B // Nuclear Physics. — Academic Press, 1963. — Vol. 5. — P. 187. — 886 p. — (Methods in Experimental Physics). — ISBN 9780124759459.
- ↑ Магнитное охлаждение / А. Б. Фрадков // Ломбард — Мезитол. — М. : Советская энциклопедия, 1974. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 15).
- ↑ Luke C. L., Wu Yan, Chien-Shieng. Part B // Nuclear Physics. — Academic Press, 1963. — Vol. 5. — P. 189. — 886 p. — (Methods in Experimental Physics). — ISBN 9780124759459.
Литература[править | править код]
- Савельев И. В. Курс общей физики: Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
- Савельев И. В. Курс общей физики: Волны. Оптика. — М.: Астрель, 2001. — Т. 4. — 256 с. — 7000 экз. — ISBN 5-17-004586-7.
- Ландау Л. Д., Ахиезер А. И., Лифшиц Е. М. Курс общей физики: Механика. Молекулярная физика. — М.: Наука, 1965.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1 // Теоретическая физика. — М.: Наука, 1976. — Т. V. — 584 с. — 45 000 экз.
- Сивухин Д. В. Общий курс физики. — М.: МФТИ, 2005. — Т. I. Механика. — 560 с.
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- Кудрявцев П. С. История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- Кириллин В. А., Сычёв В. В., Шейндлин А. Е. Техническая термодинамика: учебник для вузов. — М.: Издательство МЭИ, 2008. — 496 с. Архивная копия от 24 ноября 2011 на Wayback Machine
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд. — М.: Химия, 1970. — Т. I. — 592 с.
- Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
В
любой термодинамической системе (простой
или сложной) могут протекать три процесса:
изотермический
(Т = const),
адиабатический
(Q = 0)
и политропный
(С = const,
где C – теплоемкость).
В простой
системе, в которой внешним параметром
является объем V,
а сопряженной ему обобщенной силой –
давление Р,
возможны еще два процесса: изохорный
(V = const)
и изобарный
(Р = const).
Эти пять
процессов
(изотермический, адиабатический,
политропный, изохорный, изобарный)
считаются
основными в термодинамике,
причем адиабатический
процесс является частным случаем
политропного.
Уравнения
изохорного, изобарного, изотермического
процессов для идеального газа получаются
из уравнения состояния PV = RT:
РV = const
– уравнение
изотермы;
Р = аТ,
где а
= R/V
= const
– уравнение
изохоры;
V
= a1T,
a1
= R/P
= const
– уравнение
изобары.
Получим уравнение
адиабатического расширения (сжатия)
идеального газа. Примем, что система
совершает только работу расширения и
процесс является обратимым (равновесным).
Тогда
Для
идеального газа
,
следовательно
.
Поскольку процесс
адиабатический, то δQ = 0
и, с учетом того, что
,
,
получаем
.
Разделим левую и
правую часть на (СV·Т):
,
, (2.47)
где
– адиабатический коэффициент ( > 1
для любых систем).
Уравнение (2.47)
является дифференциальным уравнением
адиабаты в переменных Т
и V.
Проинтегрировав уравнение (2.47) с учетом
того, что теплоемкости СV
и Сp
(а значит, и адиабатический коэффициент)
идеального газа не зависят от температуры
и объема, получим:
,
,
(2.48)
Уравнение (2.48) есть
уравнение адиабаты идеального газа в
переменных Т
и V.
В переменных P
и V
уравнение адиабаты принимает вид
, (2.49)
так
как
,
.
И, наконец, уравнение
адиабаты в переменных Р
и Т
имеет вид
, (2.50)
поскольку
,
.
Уравнения адиабаты
(2.48) – (2.50) называются уравнениями
Пуассона.
Теплоемкости
одноатомных и двухатомных идеальных
газов постоянны и равны:
|
Идеальный |
Сp |
CV |
|
|
одноатомный |
|
|
|
|
двухатомный |
|
|
|
Величину γ для
реальных газов можно определить, измеряя
скорость звука в газе:
,
где
М
– молярная масса газа.
Далее, зная величину
,
можно, используя в первом приближении
уравнение Майера, рассчитать изохорную
и изобарную теплоемкость газообразного
вещества:
,
,
,
,
.
При адиабатическом
расширении (сжатии) газа Q = 0
и
,
то есть положительная
работа совершается за счет убыли
внутренней энергии. Следовательно, если
идеальный газ адиабатически расширяется
(W
> 0), то U
< 0 и температура газа уменьшается:
только если
.
При адиабатическом
сжатии температура газа увеличивается.
На практике
адиабатическим условиям отвечает
быстрое (мгновенное) проведение процессов,
когда сравнительно медленно протекающий
теплообмен мало влияет на изменение
внутренней энергии и температуры. Так,
при адиабатическом сжатии газа ударной
волной газ не успевает отдать выделившуюся
теплоту и сильно нагревается.
Используя
уравнения адиабат идеального газа,
можно получить несколько уравнений
для работы равновесного адиабатического
процесса.
Так как для адиабатического процесса
и
,
то
.
Поэтому
работа расширения одного моля идеального
газа равна
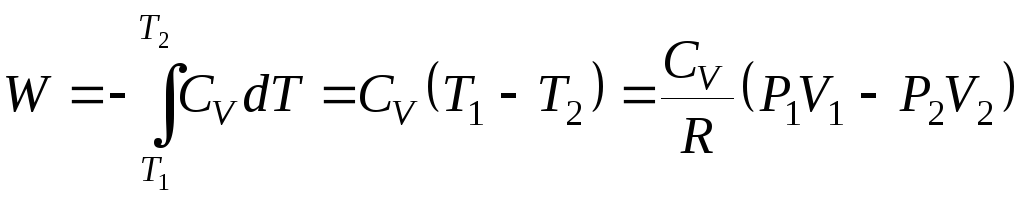
а
так как
и
,
то
. (2.52)
Следует отметить,
что для
необратимого адиабатического расширения
(сжатия) газа уравнения Пуассона
неприменимы.
Однако по-прежнему справедливо соотношение
,
а работа необратимого
расширения газа против постоянного
внешнего давления равна

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание
- 1 Адиабатический процесс. Уравнение адиабаты для идеального газа
- 2 Другой вывод данного уравнения (Сивухин)
- 3 Уравнение адиабаты для газа Ван-дер-Ваальса
- 4 Другой вывод
Адиабатический процесс. Уравнение адиабаты для идеального газа
Адиабатическим называется процесс, происходящий в теплоизолированной системе, когда дельта Q_внеш = 0. Для случая квазистатического процесса дифференциальное уравнение адиабаты записывается в виде
dU + PdV = 0.
В частности, для идеального газа, у которого С_V = const, имеем C_V dT + vRT/V dV = 0 => TV^(гамма – 1) = const, гамма = 1 + vR/C_V = C_P/C_V (адиабата Пуассона). Величина гамма = Ср/Сv называется показателем адиабаты. Для идеального одноатомного газа гамма = 5/3.
Уравнению адиабаты можно придать иной вид, воспользовавшись уравнением состояния идеального газа:
PV^г = const, P^(1-г)T^г = const.
Другой вывод данного уравнения (Сивухин)
dU + PdV= 0
dU = C_v dT
dT = dPV/R = (PdV + VdP)/(C_p – C_v) (ур-е. Клапейрона + соотношение Роберта_ Майера)
dU + Pdv = ( Pdv + VdP )/(гамма – 1) + PdV = 0
VdP + гамма*PdV = 0
что есть полный дифференциал d(PV^гамма) = 0 => PV^гамма = const
Уравнение адиабаты для газа Ван-дер-Ваальса
P(V,T) = RT/(V-b)-a/V^2, U(V,T) = C_V T – a/V;
дельта Q = C dT
дельта Q = dU + PdV
dU = C_V dT + a/V^2 dV
C_V dT + a/V^2 dV + RT/(V-b) dV – a/V^2 dV = 0;
dT/T + (г-1)/(V-b) dV = 0, где R/Cv = г-1;
T(V-b)^(г-1) = const
(P + a/V^2)(V – b)^(C_p/C_v) = const – уравнение адиабаты для газа Ван-дер-Ваальса.
Другой вывод
Из данного нам свыше должно быть известно
dS = (C_vdT)/T + (RdV)/(V-b)
S(T,V) = C_v lnT + R ln(V-b) + S0
S(T,V) = const => C_v lnT + R ln(V-b) = const => T(V-b)^(R/Cv) = const
Алгебраические преобразования с дельтами, финты ушами – запихиваем уравнение адиабаты в рамки школьной программы.
Здравствуйте, уважаемые читатели! Адиабатный процесс считается самым сложным среди всех изопроцессов над идеальными газами, которые проходят в школе. В учебнике нет вывода уравнения этого процесса. Можно, конечно, просто сказать “выучите уравнение адиабаты”, но мне это как-то неинтересно. В университетском курсе это уравнение легко выводится через интегралы, из первого закона термодинамики, но как быть школьникам 10 класса, которые интегралов ещё не проходили?
В этой статье выведу уравнение адиабаты путём алгебраических преобразований, без применения интегралов. Вывод непростой, но может быть понятен старшеклассникам, изучающим физику углублённо, студентам, учителям.
Напомню, адиабатный процесс – это процесс без теплообмена с окружающей средой. На рисунке – графики процесса и соответствующие уравнения в разных координатах. Школьники должны запомнить, что адиабата в координатах pV идет круче изотермы.
Итак, приступим к выводу уравнения адиабатного процесса в координатах pV. Начнем с первого закона термодинамики, определения работы идеального газа и изменения внутренней энергии.
Будем рассматривать очень малые изменения объема ΔV, при которых давление можно примерно считать постоянным, при этом мы можем записать стандартную формулу для работы газа.
Распишем приращение Δ(pV). Здесь мы воспользуемся малостью дельт-приращений – пренебрежем произведением ΔVΔp.
Подставим эту запись, а также выражение для работы, в первый закон термодинамики.
Раскроем скобки, приведем подобные слагаемые, сделаем алгебраические преобразования:
Теперь будет немного шаманства и финтов ушами. Поскольку интегралов мы брать не можем, будем работать с этими дельтами. Мы хотим получить эти приращения как разность некоторых функций давления и объёма.
Промежуточные вычисления. Вспомним формулу бинома Ньютона и воспользуемся малостью ΔV – пренебрежем всеми степенями ΔV, кроме первой.
Цель этого преобразования – выписать второе слагаемое из формулы (*) через разность двух состояний. Как видите, это получилось. Подставим (2) в (*)
Теперь будем шаманить с первым слагаемым. Воспользуемся формулой (1), а затем пренебрежем слагаемым, содержащим ΔpΔV
Теперь подставляем первое слагаемое в формулу (3). Это позволит нам объединить первые два слагаемых и представить нашу формулу (3) как разность значений одной и той же функции при малом приращении переменных:
Так как при изменении объема и давления приращение функции равно нуля, то значит, сама эта функция не меняется:
Это и есть искомое уравнение адиабаты. Как видите, всё сошлось!
Ход решения может казаться искусственным, так и есть. Я действительно подгоняла под известный ответ. С интегралом, конечно, этот вывод проще и естественней, но в таком виде это хорошо как алгебраическое упражнение для продвинутых старшеклассников.
Спасибо, что дочитали до конца! Надеюсь, эта статья будет кому-нибудь полезна. А если не полезна, то хотя бы любопытна.
Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R – газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс – это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV – изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV – малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP – изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ – это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
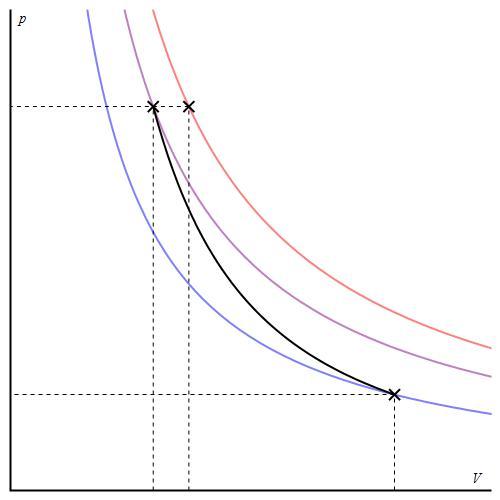
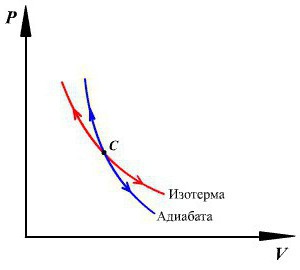
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая – это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
2.4. Адиабатный процесс
Адиабатный процесс — это процесс, при котором не происходит теплообмена с внешней средой.
Физически это означает, что процесс протекает достаточно быстро и система не успевает обменяться теплотой с внешними телами. Однако коль скоро мы имеем дело с равновесными процессами, скорость адиабатного процесса не должна быть слишком уж велика. Примером таких процессов может служить распространение звуковых колебаний в упругой среде.
Выведем уравнение, описывающее адиабатный процесс. Ранее мы имели дело с самыми простыми уравнениями процессов
— для изотермического процесса;
— для изобарного процесса;
— для изохорного процесса.
Поскольку в адиабатном процессе dQ = 0, из первого начала термодинамики следует, что
C другой стороны,
Приравнивая эти выражения, находим
Умножая уравнение (2.28) на V g –1 , получаем в левой части полный дифференциал
В результате интегрирования (2.29) приходим к уравнению адиабатного процесса
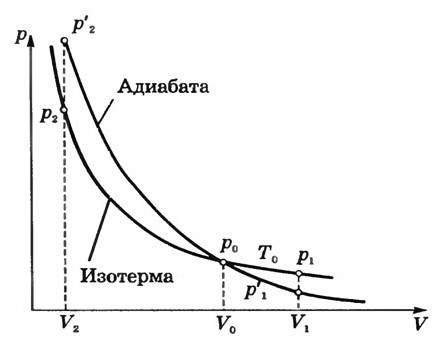
Графически адиабатный процесс описывается на (р,V) — диаграмме кривыми, похожими на изотермы (рис. 2.12), но идущими круче, так как g > 1, поскольку Сp > СV.
Рис. 2.12. Адиабатный процесс в идеальном газе: 1 — адиабата, 2 — изотерма
Это и понятно, так как при адиабатном расширении газ совершает работу за счет внутренней энергии, и его температура падает, что еще больше уменьшает давление по сравнению с изотермическим расширением.
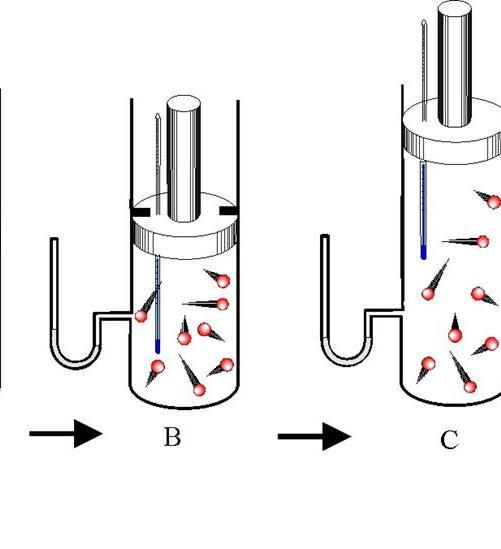
Экспериментальное исследование адиабатного процесса в идеальном газе можно выполнить с помощью установки, представленной на рис. 2.13.
Рис. 2.13. Экспериментальное изучение адиабатного процесса в идеальном газе
Учитывая, что из уравнения состояния идеального газа следует пропорциональность
уравнение адиабатного процесса можно также представить в виде
Первый закон термодинамики в применении к адиабатному процессу позволяет вычислить работу газа при адиабатном расширении:
Выражения для работы при адиабатном процессе с учетом уравнения Клапейрона — Менделеева можно выразить также через температуры в начале и конце процесса
Для бесконечно малых изменений параметров уравнения (2.32), (2.33) переходят в соотношения
Пример. Горючая смесь в двигателе Дизеля (см. рисунок выше) воспламеняется при температуре Т2 = 1 100 К. Начальная температура смеси Т1 = 350 К. Определим, во сколько раз нужно уменьшить объем смеси при сжатии, чтобы она воспламенилась. Сжатие будем считать адиабатным. Показатель адиабаты для смеси g = 1,4.
Для решения удобнее воспользоваться уравнением адиабатного процесса в форме (2.31):
Отсюда сразу следует выражение для степени сжатия горючей смеси:
Адиабатный процесс, его суть и и формулы
Адиабатный процесс (в некоторых источниках упоминается как адиабатический) – это термодинамический процесс, который происходит при отсутствии теплообмена с окружающей средой. Есть несколько факторов, которые характеризуют этот класс. Например, адиабатный процесс происходит динамично и укладывается в короткий срок времени. Происходят процессы данного класса, как правило, мгновенно.
Связь с первым началом термодинамики
Адиабатный процесс (адиабатический) можно напрямую связать с первым законом термодинамики. Его формулировка “по умолчанию” звучит следующим образом: изменение количества теплоты в системе при протекании в ней термодинамического процесса будет численно равно сумме изменения внутренней энергии идеального газа и работы, совершаемой этим газом.
Если мы попытаемся записать первое начало термодинамики в его стандартном виде, то получим следующее выражение: dQ = dU + dA. А теперь постараемся видоизменить эту формулу применительно к адиабатическому процессу. Как было сказано ранее, подобные процессы протекают при условии отсутствия теплообмена с окружающей (внешней, как ее называют некоторые литературные источники) средой.
В таком случае формула, описывающая первое начало термодинамики, примет следующий вид: dA = -dU. Теперь несколько подробнее о видоизменении. Если мы говорим о том, что теплообмена в системе не происходит, изменение количества теплоты (обозначенное в формуле первого закона термодинамики через dQ) будет равно нулю. Следовательно, мы можем перенести одно из слагаемых из правой части в левую, после чего получим формулу, приведенную к описанному ранее виду.
Следствие из первого начала термодинамики для адиабатического процесса
Допустим, что в системе произошел адиабатный процесс. В этом случае можно, не вдаваясь в мельчайшие детали, говорить о том, что газ при расширении совершает работу, но при этом он теряет свою внутреннюю энергию. Иными словами, работа, совершаемая при адиабатном расширении газа, будет осуществляться за счет убыли внутренней энергии. Следовательно, в качестве исхода этого процесса мы будем рассматривать понижение температуры самого вещества.
Абсолютно логично можно предположить, что если газ будет адиабатически сжат, его температура вырастет. Несложно заметить, что в ходе процесса будут изменяться все главные характеристики идеального газа. Речь идет о его давлении, объеме и температуре. Следовательно, грубой ошибкой стало название адиабатического процесса изопроцессом.
Адиабатный процесс. Формулы
Ранее была записана формула, выведенная из первого начала термодинамики. Используя ее, мы без особого труда можем вычислить работу в общем виде, которую будет выполнять газ при течении адиабатного процесса. Как вы уже могли догадаться, делать это мы будет при помощи интегрирования.
Итак, чтобы получить общую формулу работы для x молей газа, проинтегрируем выражение первого закона термодинамики для адиабатного процесса. Выглядеть все это будет следующим образом: A = – (интеграл) от dU. Раскроем это выражение, получим: A = – xCv (интеграл в пределах от T1 до T2) dT.
Теперь, когда мы привели интеграл к конечному виду, мы можем его упростить. На выходе получим формулу следующего вида: A = – xCv (T2 – T1). Ну и последним шагом станет небольшое упрощение. Избавимся от минуса перед формулой. Для этого сделаем в скобках небольшую перестановку, поменяв конечную температуру с начальной местами. В итоге получим: A = xCv (T1 – T2).
Уравнение адиабаты
Используя первое начало термодинамики для адиабатного процесса, мы можем найти уравнение адиабаты. При этом оно будет записано для произвольного числа молей идеального газа. Итак, запишем первоначальную формулу. Она имеет такой вид: dA + dU = 0. Но ведь мы прекрасно знаем, что работа идеального газа представляет численно собой не что иное, как произведение давления на изменение объема.
В то же время изменение внутренней энергии будет равно работе, взятой с обратным знаком. А ее-то мы уже нашли при помощи интегрирования. Значит, первое начало термодинамики для адиабатического процесса может принять следующий вид: pdV + xCvdT = 0. Из этого уравнения нам нужно исключить один показатель, а именно, температуру. Вернее, ее изменения. Чтобы сделать это, мы обратимся к достаточно часто используемому в молекулярной физики уравнению. А именно к уравнению Менделеева-Клапейрона.
Первичное выражение
Его нам нужно продифференцировать, чем мы и займемся. Итак, в общем виде уравнение выглядит следующим образом: PV = XRT. Вследствие дифференцирования оно будет приведено к такой форме: pdV + Vdp = xRdT. Отсюда мы можем выразить изменение энергии. Оно будет равно левой части, деленной на произведение количества вещества на универсальную газовую постоянную. Иными словами, формула будет такой: (pdV + Vdp)/xR. Остается только упростить ее. В итоге получим следующее выражение: dT = (pdV + Vdp)/x(Cp – Cv)
По сути дела, первая часть задачи выполнена. Остается только довести все до ума.
Вторичное выражение. Подстановка значения
Возьмем полученную в результате дифференцирования формулу Менделеева-Клапейрона и подставим ее в выражение, выведенное нами ранее для первого закона термодинамики по отношению к адиабатному процессу. Итак, что мы получим? Все это громоздкое выражение примет следующий вид: pdV + xCv ((pdV + Vdp)/x(Cp-Cv)) = 0.
Чтобы упростить все это, мы должны принять во внимание пару фактов. Во-первых, упростить выражение можно за счет приведения к общему знаменателю. Когда мы получим одну дробь, мы можем воспользоваться старым добрым правилом, которое гласит, что дробь равна нулю, когда ее числитель равен нулю, а знаменатель от нуля отличен. В результате совокупности всех этих действий мы получим следующее выражение: pCpdV – pCvdV + pCvdV + VCvdp = 0.
Теперь следующим шагом мы можем разделить данное выражение на pVCv. Получим сумму двух частей, дающих в итоге ноль. Это будет Cp/Cv * dV/V + dp/p = 0. Эту формулу необходимо проинтегрировать. Тогда мы получим следующее выражение: y (интеграл) dV/V + (интеграл) dp/p = (интеграл) 0.
Ну а дальше все достаточно просто. Воспользовавшись формулами интегрирования (можно использовать табличные интегралы, чтобы все было проще), получим в итоге следующую запись: y ln V + ln p = ln (const). Получается, что p(V)y = const. Данное выражение называется в молекулярной физике уравнением Пуассона. Многие литературные источники научной направленности также называют эту формулу уравнением адиабаты. В то же время величина y, которая имеет место в данной записи, называется показателем адиабаты. Она равна (i+2)/i. Нужно отметить, что показатель адиабаты всегда больше единицы, что, в принципе, логично.
Примеры адиабатных процессов
Вскоре после того, как был открыт адиабатический процесс, стартовало огромное количество различных исследований. Так, была создана первая теоретическая модель, имеющая отношение к циклу Карно. Именно она позволила установить условные пределы, ограничивавшие развитие тепловых машин. Но в случае некоторых реальных процессов осуществлять цикл Карно достаточно трудно. Все дело в том, что в его состав входят изотермы. А они, в свою очередь, требуют задания определенной скорости термодинамических процессов.
Заключение
С целью обойти подобные проблемы был придуман цикл Отто, а также цикл сжижения газа. Они стали широко применяться при решении конкретных задач на практике. Стартовавшие исследования показали возможность описания некоторых природных процессов в адиабатическом плане, что позволило выявлять общие закономерности соответствующих процессов. Примером адиабатического процесса можно смело назвать химическую реакцию, которая происходит внутри некоторого объема газа, если система является замкнутой, а обмен с внешней средой теплом отсутствует.
[spoiler title=”источники:”]
http://online.mephi.ru/courses/physics/molecular_physics/data/course/2/2.4.1.html
http://www.syl.ru/article/206205/mod_adiabatnyiy-protsess-ego-sut-i-i-formulyi
[/spoiler]